Se ha sugerido que una degradación disminuida de histamina puede contribuir en la patogénesis de migraña y alergia. Este trabajo investiga una posible asociación entre 2 polimorfismos de un solo nucleótido (SNP) de 2 enzimas que degradan histamina, C314T para la histamina N-metil-transferasa (HNMT) y C2029G para diaminoxidasa (DAO), con la presencia, discapacidad y severidad de la migraña.
Material y métodosSe reclutó a 162 madres de niños alérgicos (80 con migraña y 82 sin migraña) determinando las variantes alélicas por PRC tiempo real usando un modelo de casos y controles. Mediante regresión logística se determinaron las OR para los genotipos y haplotipos.
ResultadosEl alelo mutado G para DAO fue significativamente más frecuente en el grupo de mujeres migrañosas que en los controles (OR=1,6; IC del 95%=1,1-2,1). No encontramos diferencias significativas para el alelo mutado T de la HNMT. Ambos alelos mutados estuvieron asociados a la discapacidad causada por la migraña. La coexistencia de ambas mutaciones (haplotipos) mostró una fuerte asociación con migraña. Los haplotipos que tenían ambos alelos mutados (ya sea como homocigotos o heterocigotos) estuvieron fuertemente asociados a la discapacidad por migraña grado iv (OR=45,0, IC del 95%=5,2-358). Esto sugiere que los alelos mutados T para HNMT y G para DAO pueden interactuar incrementando el riesgo y el impacto de la migraña.
ConclusionesSe sugiere una asociación sinérgica de polimorfismos de HNMT y DAO con migraña el cual debe ser confirmado en futuros estudios. La interpretación debe tomar en cuenta las características étnicas de la población estudiada.
Low histamine metabolism has been suggested to play a role in the pathogenesis of allergy and migraine. We investigated the possible association between 2 single-nucleotide polymorphisms (SNP), C314T HNMT and C2029G DAO, and the presence and severity of migraine and migraine-related disability.
Materials and methodsWe studied the frequency of C314T HNMT and C2029G DAO allelic variants in 162 mothers of children with allergies (80 with migraine and 82 without) using a TaqMan-based qPCR Assay and a case-control model. We conducted a logistic regression analysis to examine the association between migraine and the allelic and haplotype variants.
ResultsMutant C2029G DAO SNP was found significantly more frequently in the group of women with migraine than in controls (OR, 1.6; 95% CI, 1.1–2.1). No significant differences were found in frequencies of genotypes or alleles in the case of C314T HNMT SNP. Both mutated alleles were associated with migraine-related disability. Coexistence of alleles for both SNPs (haplotypes) showed a strong association with migraine. Haplotypes containing both mutated alleles (either heterozygous or homozygous) were very strongly associated with MIDAS grade iv migraine (OR, 45.0; 95% CI, 5.2-358). This suggests that mutant alleles of C314T for HNMT and C2029G for DAO polymorphisms may interact in a way that increases the risk and impact of migraine.
ConclusionsWe suggest a synergistic association between HNMT and DAO functional polymorphisms and migraine; this hypothesis must be further confirmed by larger studies. However, the characteristics and ethnic differences between analysed populations should be considered when interpreting the results
La migraña es una cefalea neurovascular recurrente que tiene diferentes fenotipos clínicos1,2. Las formas más comunes, la migraña con aura (MA) y la migraña sin aura (MSA), se caracterizan por la presencia de cefalea recurrente que dura de 4 a 72h, cursan con náuseas, fotofobia, fonofobia, se incrementan con la actividad física y se acompañan de síntomas neurológicos3. La prevalencia de migraña es del 4% antes de la pubertad e incrementa a un 25% en mujeres en edad reproductiva y tiene repercusiones personales, sociales y económicas importantes4. Los mecanismos y las causas exactas de la migraña no están bien determinados aún2.
Varios estudios han mostrado que algunas formas raras y comunes de migraña tienen bases genéticas5,6. Por ejemplo, se han identificado genes involucrados en la migraña familiar hemipléjica (MFH)5. En contraste, las formas más prevalentes de migraña, MA y MSA son poligénicas y la contribución genética es difícil de determinar7. La mitad de las familias con MFH tienen mutaciones en el gen de canal de calcio CACNA1A, localizado en el cromosoma 195. En la otra mitad, ha sido mapeado un locus en el cromosoma15; el papel de estos loci en la migraña típica es aún desconocido. Los enfoques genéticos en las migrañas comunes (MA y MSA) incluyen métodos tales como los análisis de ligamiento y los llamados Genome-Wide Association Studies5,6,8. Loci de susceptibilidad para migraña han sido identificados por estos métodos en los cromosomas 19, 4 y X5.
Algunos neurotransmisores han sido implicados en la migraña, los más estudiados son serotonina y dopamina9-11. Tres genes relacionados con el sistema serotoninérgico han sido asociados con la MA y MSA: el del receptor HTR2By el de la MAO A, que se asociaron a susceptibilidad para MSA, y el de la Dopa-descarboxilasa, que se asoció a susceptibilidad para MA10. Hay además evidencia del papel de varios polimorfismos de un solo nucleótido (SNP), de genes del sistema dopaminérgico, en la patogénesis de migraña. Tres SNP fueron asociados a MA: el rs2097629 en el gen de la dopamina beta hydroxilasa, el rs7131056 en el gen del receptor DRD2 y el rs40184 en el gen del transportador SLC6A311.
La histamina es un neurotransmisor y neromodulador que además parece desempeñar un papel importante en la migraña12,13. Ataques de migraña pueden ser desencadenados por alimentos que contienen histamina14 y la cefalea es una característica común de la histaminosis15. La cefalea puede ser inducida de manera dependiente de la dosis por histamina en pacientes con migraña16,17. La histamina es degradada por 2 enzimas: la histamina N-metiltransferasa (HNMT, EC. 2.1.1.8) y la diaminoxidasa (DAO) o proteína unida a amilorida 1 (ABP1, EC 1.4.3.6). La HNMT está involucrada en la degradación de la histamina intracelular18 y la DAO es secretada y desempeña un papel en la degradación de la histamina extracelular18,19.
Los genes que codifican para HNMT y DAO son polimórficos. El gen de la HNMT está localizado en el cromosoma 2q22.1, tiene 8 SNP pero solo uno es no sinónimo, el cual está localizado en el exón 4 y causa una sustitución de Thr105Ile (rs11558538)20. Este gen está relacionado con la disminución de la actividad de la enzima21. Tres SNP no sinónimos han sido mapeados para el gen de DAO, localizado en el cromosoma 7q34-36. El SNP rs1049793ha mostrado que altera la forma de la proteína sustituyendo un aminoácido His645Asp y disminuyendo su actividad22. Por lo anterior, nos enfocamos a estos 2 SNP, Thr105Ile para HNMT y His645Asp para DAO, los cuales nombraremos C314T y C2029G, respectivamente (por la sustitución de nucleótidos).
Estos SNP se han investigado en algunas patologías que implican la participación de histamina, principalmente en enfermedades alérgicas. La asociación de asma con el polimorfismo para HNMT, Thr105Ile, fue inicialmente reportada23; sin embargo, posteriores estudios no han encontrado la misma asociación24,25. Por otro lado, no se ha encontrado asociación entre este SNP y otras patologías relacionadas con histamina como colitis ulcerativa (CU)26o úlcera gástrica27. Sin embargo, recientemente se ha reportado una asociación positiva de este polimorfismo con asma28,29. Por otro lado, el polimorfismo para DAO, C2029G, no ha sido asociado a un mayor riesgo de enfermedades relacionadas con histamina, pero sí con la severidad de los síntomas en la CU26 y con manifestaciones clínicas de asma y rinitis30. Solo 2 trabajos han estudiado la asociación entre estos 2 polimorfismos y migraña, y no encontraron asociación significativa31,32. En el presente estudio se investigó la asociación entre los SNP C314T para HNMT y C2029G para DAO, con la presencia, la severidad y la discapacidad de migraña en un grupo de madres mexicanas de niños alérgicos.
Material y métodosSe calculó un tamaño de la muestra para un estudio de casos y controles con análisis de regresión logística. Se estudió a 162 mujeres adultas no relacionadas, de edades de 20 a 55 años, con una media ± desviación estándar (DE) de 34,2±7,1 años de edad. Todas ellas eran madres de niños alérgicos atendidos en el Servicio de Alergia Pediátrica de la Secretaría de Salud en Torreón, Coahuila, México, entre marzo del 2013 y mayo del 2014. Ochenta cumplieron criterios de diagnóstico para migraña y no para otro tipo de dolor de cabeza (casos). El diagnóstico de migraña se realizó por un médico calificado asesorado por un neurólogo empleando un cuestionario validado de acuerdo con la International Headache Society3. Ochenta y 2 no reportaron cefalea para al menos el año previo al estudio (controles).
Los casos reportaron episodios de dolor desde hacía 7,3±4,7 años; el 20,9% tenía antecedentes familiares de migraña y un 58,3% tenía MA. Estos fueron evaluados con la Escala de Evaluación de la Discapacidad por Migraña (MIDAS) para determinar la severidad y el grado de discapacidad de la migraña33. Ninguno de los casos ingería medicamentos preventivos para migraña, sino únicamente analgésicos en el momento de la cefalea. Los controles fueron mujeres mexicanas no relacionadas, sanas, sin migraña u otros tipos de dolor de cabeza.
Las madres seleccionadas fueron invitadas a participar y aceptaron firmar la carta de consentimiento informado. Este estudio se realizó de acuerdo con los principios de la Declaración de Helsinki. El protocolo fue aprobado por el Comité de Ética de la Escuela de Medicina de la Universidad Autónoma de Coahuila, México. Estas madres y sus hijos participaron en otro estudio de asociación genética realizado por nuestro grupo con relación a la alergia.
El ADN se obtuvo de sangre periférica (5ml) por el método de SaltingOut34. Los polimorfismos se analizaron por reacción en cadena de la polimerasa en tiempo real (RT-PCR). La genotipificación se realizó usando TaqMan (AppliedBiosystem®) para detectar los SNP siguientes: para DAO, rs1049793 (C_7599774_10) una variante no sinónima que causa la sustitución de aminoácido His664Asp, y para HNMT rs11558538 (C_11650812_20) una variante no sinónima que causa la sustitución de aminoácidos Thr105Ile.
Los polimorfismos se analizaron por RT-PCR en un equipo de RT-PCR (modelo 7300 de AppliedBiosystem®). Se utilizó una concentración de 8ng de ADN. Las condiciones de amplificación fueron: después de un tiempo de desnaturalización de 10 min a 95°C, se realizaron 40 ciclos de 15 s a 95°C seguidos de 60°C por 90 s. De 324 muestras analizadas (162 para HNMT y 162 para DAO), 320 se genotipificaron con éxito para los 2 SNP analizados (160 para HNMT y 160 para DAO).
Se estimaron las proporciones de los SNP para HNMT y DAO. La diferencia de proporciones se analizó con la χ2 o la prueba exacta de Fisher, según el caso. La magnitud de la asociación entre las mutaciones de la HNMT y DAO, y la presencia de migraña se estimó mediante odds ratio (OR) con un intervalo de confianza del 95% (IC del 95%).
Para evaluar si los SNP de HNMT y DAO tenían influencia sinérgica sobre la severidad o discapacidad de la migraña, los sujetos fueron clasificados como portadores y no portadores de los SNP considerando varios haplotipos. Se realizó un análisis de regresión logística para evaluar si estos haplotipos se correlacionaban con la discapacidad y severidad de la migraña. La asociación se expresó como OR con un IC del 95%. Se consideró como significativo un valor de p de 2 colas igual o inferior a 0,05. El análisis estadístico se realizó utilizando el software STATA 11.1®. El equilibrio de Hardy-Weinberg fue confirmado por el software Arlequin ver.2.000 (CMPGZoological Instituto de la Universidad de Berna, Berna, Suiza).
ResultadosFueron estudiadas un total de 162 mujeres (madres de niños alérgicos) de 34±7,1 (media±DE) años de edad, de las cuales 80 tenían migraña (de acuerdo con la clasificación de la International Headache Society) y 82 sin migraña (grupo control). Las principales características clínicas se muestran en la tabla 1. La presencia de antecedentes familiares de alergia y migraña fue significativamente mayor en los casos que en el grupo control (p<0,05).
Características de la población
| Características | Total n=162 | Migraña (casos, n=80) | No Migraña (controles, n = 82) | p |
|---|---|---|---|---|
| Edad (media±DE, años) | 34,0±7,1 | 33,8±7,1 | 34,3±8,1 | 0,718 |
| Enfermedades alérgicas (%) | 58 (35,8) | 34 (42,5) | 24 (29,3) | 0,079 |
| Antecedentes familiares de migraña (%) | 34 (20,9) | 22 (27,5) | 12 (17,6) | 0,044 |
| Antecedentes familiares de enfermedades alérgicas (%) | 44 (27,2) | 28 (35,0) | 16 (19,5) | 0,026 |
Todos los individuos fueron madres de niños alérgicos. La historia familiar de alergia y migraña fue reportada por los participantes en todos los casos. Todos los individuos fueron consecutivos y sin relación. Las comparaciones fueron realizadas por prueba de la χ2.
Las distribuciones genotípicas de los SNP de los genes estudiados estuvieron en concordancia con la ley de Hardy-Weinberg en los controles. En los casos, la distribución de los genotipos del SNP de la HNMT también estuvo en concordancia con la ley de Hardy-Weinberg, pero la distribución de genotipos para el polimorfismo de la DAO estuvo en discordancia con ella. Hubo una diferencia significativa (p=0,001) en la distribución del genotipo de este SNP en las madres con migraña comparado con una población hispana sana35.
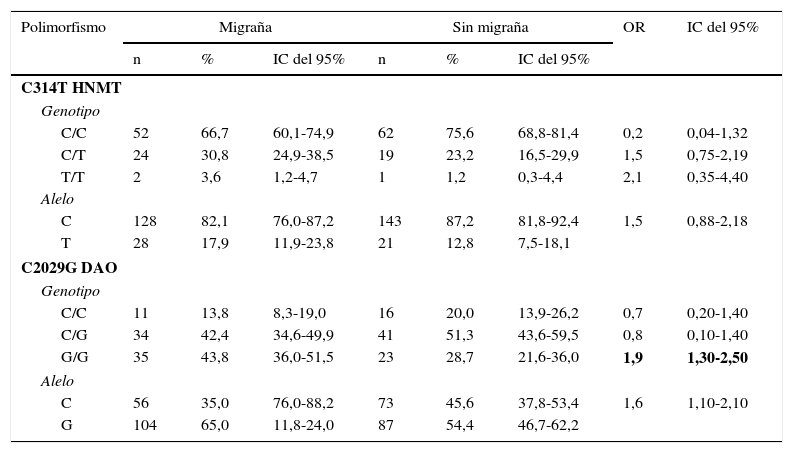
La tabla 2 muestra las distribuciones genotípicas y frecuencias de los alelos de HNMT y DAO de los casos contra el grupo control. La comparación de las frecuencias de los alelos de HNMT reveló que el alelo mutado T del polimorfismo C314T no fue significativamente más frecuente en el grupo de casos en comparación con el grupo control (p=0,189) (tabla 2).
Distribución de genotipos y frecuencias alélicas de los polimorfismos C314T HNMT y C2029G DAO en casos y controles
| Polimorfismo | Migraña | Sin migraña | OR | IC del 95% | ||||
|---|---|---|---|---|---|---|---|---|
| n | % | IC del 95% | n | % | IC del 95% | |||
| C314T HNMT | ||||||||
| Genotipo | ||||||||
| C/C | 52 | 66,7 | 60,1-74,9 | 62 | 75,6 | 68,8-81,4 | 0,2 | 0,04-1,32 |
| C/T | 24 | 30,8 | 24,9-38,5 | 19 | 23,2 | 16,5-29,9 | 1,5 | 0,75-2,19 |
| T/T | 2 | 3,6 | 1,2-4,7 | 1 | 1,2 | 0,3-4,4 | 2,1 | 0,35-4,40 |
| Alelo | ||||||||
| C | 128 | 82,1 | 76,0-87,2 | 143 | 87,2 | 81,8-92,4 | 1,5 | 0,88-2,18 |
| T | 28 | 17,9 | 11,9-23,8 | 21 | 12,8 | 7,5-18,1 | ||
| C2029G DAO | ||||||||
| Genotipo | ||||||||
| C/C | 11 | 13,8 | 8,3-19,0 | 16 | 20,0 | 13,9-26,2 | 0,7 | 0,20-1,40 |
| C/G | 34 | 42,4 | 34,6-49,9 | 41 | 51,3 | 43,6-59,5 | 0,8 | 0,10-1,40 |
| G/G | 35 | 43,8 | 36,0-51,5 | 23 | 28,7 | 21,6-36,0 | 1,9 | 1,30-2,50 |
| Alelo | ||||||||
| C | 56 | 35,0 | 76,0-88,2 | 73 | 45,6 | 37,8-53,4 | 1,6 | 1,10-2,10 |
| G | 104 | 65,0 | 11,8-24,0 | 87 | 54,4 | 46,7-62,2 | ||
Las OR fueron obtenidas por regresión logística.
Por otro lado, el alelo mutado G del polimorfismo C2029G de la DAO fue significativamente más frecuente (p=0,044) en el grupo con migraña que en los controles. El OR para migraña en los portadores del alelo mutado G de la DAO fue 1,6 (IC del 95%, 1,1-2,1) en comparación con los homocigotos silvestres. De la misma manera, los individuos homocigotos G tuvieron más riesgo de migraña que los homocigotos silvestres (OR 1,9, IC del 95%, 1,3-2,5) (tabla 2).
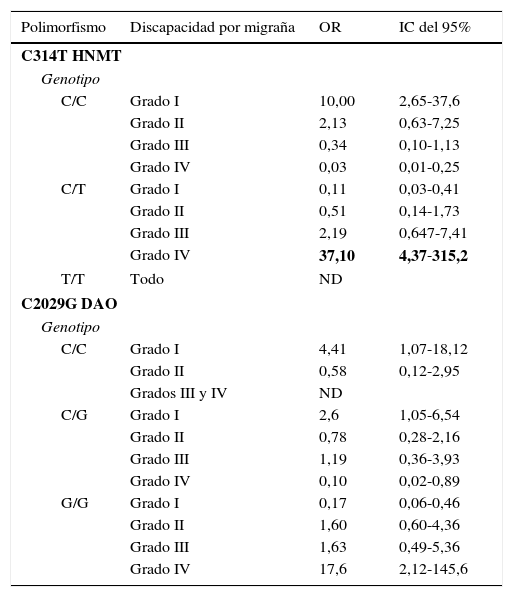
Para obtener más información sobre el efecto de ambos polimorfismos sobre las características fenotípicas y clínicas de la población estudiada, estos se agruparon como portadores y no portadores de las mutaciones correspondientes, ya sea como homocigotos o heterocigotos. Los polimorfismos de la HNMT y DAO se distribuyeron de manera similar cuando la población se subdividió de acuerdo con la presencia de aura y la duración media de la migraña. Sin embargo, ambos polimorfismos se asociaron positivamente a la puntuación MIDAS relacionada con la discapacidad causada por la migraña. La presencia del alelo C del polimorfismo HNMT se asoció a un menor grado de discapacidad por migraña (OR = 10,0, IC del 95%, 2,65-37,6). Por el contrario, la presencia del alelo T (en individuos heterocigotos) se asoció a un mayor grado de discapacidad por migraña (OR=37,1, IC del 95%, 4,37-315,2) (tabla 3). No hubo suficientes individuos homocigotos mutados a fin de analizar su asociación con la discapacidad por migraña.
Asociación de la discapacidad por migraña y los genotipos de los polimorfismos C314T HNMTy C2029G DAO
| Polimorfismo | Discapacidad por migraña | OR | IC del 95% |
|---|---|---|---|
| C314T HNMT | |||
| Genotipo | |||
| C/C | Grado I | 10,00 | 2,65-37,6 |
| Grado II | 2,13 | 0,63-7,25 | |
| Grado III | 0,34 | 0,10-1,13 | |
| Grado IV | 0,03 | 0,01-0,25 | |
| C/T | Grado I | 0,11 | 0,03-0,41 |
| Grado II | 0,51 | 0,14-1,73 | |
| Grado III | 2,19 | 0,647-7,41 | |
| Grado IV | 37,10 | 4,37-315,2 | |
| T/T | Todo | ND | |
| C2029G DAO | |||
| Genotipo | |||
| C/C | Grado I | 4,41 | 1,07-18,12 |
| Grado II | 0,58 | 0,12-2,95 | |
| Grados III y IV | ND | ||
| C/G | Grado I | 2,6 | 1,05-6,54 |
| Grado II | 0,78 | 0,28-2,16 | |
| Grado III | 1,19 | 0,36-3,93 | |
| Grado IV | 0,10 | 0,02-0,89 | |
| G/G | Grado I | 0,17 | 0,06-0,46 |
| Grado II | 1,60 | 0,60-4,36 | |
| Grado III | 1,63 | 0,49-5,36 | |
| Grado IV | 17,6 | 2,12-145,6 | |
Las OR fueron obtenidas por regresión logística.
ND: no determinado/analizado por insuficiencia de individuos en esta categoría.
Por otro lado, el alelo C del polimorfismo DAO se asoció a la discapacidad más leve por migraña (OR=4,41, IC del 95%, 1,07-18,12). Así mismo se observó que los homocigotos C tuvieron una menor discapacidad (OR=2,6, IC del 95%, 1,05-6,54). Por el contrario, el alelo G fue un factor de riesgo para discapacidad alta. Los individuos homocigotos G tuvieron mayor riesgo de discapacidad alta (OR=17,6, IC del 95%, 2,12-145,6) (tabla 3).
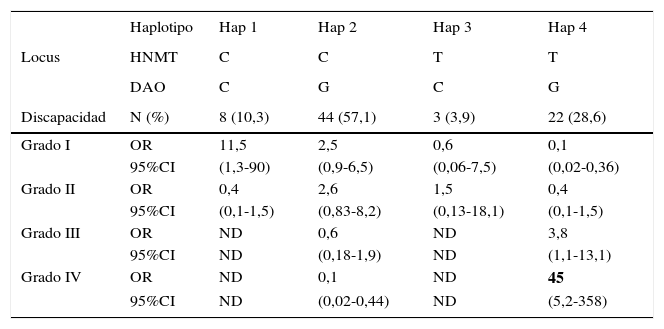
El análisis de regresión logística de los haplotipos reveló una asociación más fuerte de estos polimorfismos con migraña. Consideramos 4 haplotipos (tabla 4): Cuando solo había alelos silvestres para los 2 loci se consideró haplotipo 1; cuando había solo un alelo mutado en el locus DAO, haplotipo 2; solo un alelo mutado en el locus HNMT, haplotipo 3, y alelos mutados en ambos loci (ya sean como homocigotos o como heterocigotos), haplotipo 4. Se encontró una diferencia significativa en la frecuencia de haplotipos entre las mujeres con migraña y sin migraña (p=0,038). Asimismo, en las mujeres con migraña, se encontró una fuerte asociación del haplotipo 1 con discapacidad grado i (OR=11,5, IC del 95%, 1,3-90) y una muy fuerte asociación del haplotipo 4 con la discapacidad grado iv (OR=45,0, IC del 95%, 5,2-558). No pudimos estimar los valores de OR de los haplotipos 1 y 3 con los grados iii y iv de discapacidad por migraña, porque no hubo individuos en esta categoría (tabla 4).
Asociación de haplotipos con la discapacidad por migraña
| Haplotipo | Hap 1 | Hap 2 | Hap 3 | Hap 4 | |
|---|---|---|---|---|---|
| Locus | HNMT | C | C | T | T |
| DAO | C | G | C | G | |
| Discapacidad | N (%) | 8 (10,3) | 44 (57,1) | 3 (3,9) | 22 (28,6) |
| Grado I | OR | 11,5 | 2,5 | 0,6 | 0,1 |
| 95%CI | (1,3-90) | (0,9-6,5) | (0,06-7,5) | (0,02-0,36) | |
| Grado II | OR | 0,4 | 2,6 | 1,5 | 0,4 |
| 95%CI | (0,1-1,5) | (0,83-8,2) | (0,13-18,1) | (0,1-1,5) | |
| Grado III | OR | ND | 0,6 | ND | 3,8 |
| 95%CI | ND | (0,18-1,9) | ND | (1,1-13,1) | |
| Grado IV | OR | ND | 0,1 | ND | 45 |
| 95%CI | ND | (0,02-0,44) | ND | (5,2-358) |
Para la HNMT, el alelo silvestre es C y el mutado es T. Para la DAO, el silvestre es C y el mutado G. El haplotipo 1 tiene solo alelos silvestres para ambos locus, el haplotipo 2 tiene un alelo mutado en el locus de la DAO, el haplotipo 3 tiene el alelo mutado en el locus de la HNMT, y el haplotipo 4 contiene alelos mutados en ambos locus (cualquiera de los individuos homocigotos o heterocigotos). La discapacidad de la migraña fue calculada con la puntuación MIDAS. Las OR fueron obtenidas con regresión logística.
ND: no determinado (debido a que no hubo individuos en estas categorías).
Este estudio se realizó en madres de niños alérgicos, por tanto, la prevalencia de alergia en estas mujeres (35,8%) fue mayor a la de la población general, indicando un factor genético. La frecuencia de migraña en este grupo de mujeres (49,4%) fue mayor que la observada en la población femenina de otros estudios4, indicando una asociación entre alergia y migraña36,37. En apoyo de esto, encontramos una mayor prevalencia de enfermedades alérgicas en las mujeres con migraña (42,9%) que en los controles (29,3%) (tabla 1). También se encontró una diferencia significativa (p=0,026) en la historia familiar de alergia entre el grupo con migraña (35%) y sin migraña (19,5%), apoyando una influencia genética y la asociación de migraña con enfermedad alérgica, como ya se ha sugerido1,38.
Se ha sugerido que la histamina podría desempeñar un papel en la patogénesis de la migraña porque la frecuencia es mayor en pacientes con enfermedades alérgicas36,37 y los niveles de histamina en plasma son significativamente más elevados en pacientes con migraña39,40. Algunos estudios han mostrado un incremento de la liberación espontánea de histamina por los leucocitos de pacientes con migraña en comparación con controles39,41 y se ha sugerido, en modelos experimentales, que la activación de los mastocitos de la duramadre podría desempeñar un papel en la patogénesis de la migraña42.
En estas mujeres encontramos una prevalencia muy alta del alelo G mutado del polimorfismo C2029G de la DAO (59,4%). Sin embargo, la prevalencia de este alelo también se ha reportado alta en la población hispana (43,2%)34. La mayor prevalencia del alelo G aquí reportada puede explicarse por un posible sesgo de selección, pues todas las mujeres eran madres de niños alérgicos, pudiendo ser portadoras de un alelo relacionado también con enfermedad alérgica. En apoyo a esto, se encontró una diferencia significativa en la prevalencia del alelo G entre las mujeres con y sin enfermedad alérgica (datos no mostrados). La distribución genotípica del polimorfismo de la DAO estuvo en desequilibrio, según la ley de Hardy-Weinbwerg, en las mujeres con migraña pero en equilibrio en las mujeres sin migraña, indicando que son poblaciones diferentes.
La frecuencia del alelo T mutado de la HNMT fue del 15,3%, mientras que esta se ha reportado en un 10,4% para la población hispana sana43. No se encontró discordancia con la ley de Hardy-Weinberg en la distribución genotípica de los grupos con y sin migraña. Además, no hubo diferencias significativas entre controles y mujeres con migraña con relación a la distribución genotípica; si bien, el tamaño de la muestra y la baja frecuencia del alelo mutado pudieron contribuir a no detectar diferencia. Eso no se modificó cuando ajustamos por edad, tiempo de enfermedad, presencia de aura o consumo de alimentos. Sin embargo, cuando analizamos la presencia del alelo T mutado con la discapacidad por migraña por regresión logística, se encontró una asociación positiva. El genotipo homocigoto silvestre C/C se asoció con grado i de discapacidad por migraña (OR=10,0, IC del 95%, 2,65-37,6) y fue altamente protector contra la discapacidad grado iv (OR=0,03, IC del 95%, 0,01-0,25). De igual manera, la presencia del alelo T en heterocigotos fue un factor de riesgo para la discapacidad grado iv (OR=37,1, IC del 95%, 4,37-315,2).
En cuanto al polimorfismo DAO, la frecuencia del alelo G mutado fue significativamente mayor (p=0,044) en el grupo con migraña (65%) que en los controles (54,4%) (tabla 2). La regresión logística para genotipos de DAO vs. discapacidad por migraña reveló que el genotipo C/C se asoció con el grado i de discapacidad (OR=4,4, 1,07-18,12), y que los homocigotos mutados G/G tenían 17,6 más riesgo para discapacidad grado iv (p=0,008). La asociación entre estos SNP y la gravedad de los síntomas ya se ha indicado para otras patologías que implican a la histamina26,30. Aunque la severidad de la migraña, en una escala de 0 a 10 (parte B del reactivo 6 del MIDAS), se correlacionó en forma moderada (r=0,426) con la puntuación de discapacidad por migraña (primeros 5 reactivos del MIDAS), no pudimos encontrar una asociación entre alelos o genotipos y la severidad de la migraña. Menon et al.44 recientemente encontraron una asociación entre el polimorfismo A118G del receptor μ opioide y la severidad de la migraña utilizando solo la parte B del reactivo 6 del MIDAS, nosotros solo logramos encontrar una asociación entre los polimorfismos estudiados y el grado de discapacidad por migraña.
La coexistencia de los alelos para ambos polimorfismos (haplotipos) mostró una asociación más fuerte con la presencia de la migraña. La distribución de los haplotipos mostró una diferencia significativa en las mujeres con migraña y sin migraña. Al analizar la asociación entre los haplotipos y la discapacidad por la migraña, se encontró que el haplotipo 1 (homocigotos silvestres para ambas enzimas) se asoció fuertemente al grado i de discapacidad (OR=11,5; IC del 95%, 1,3-90), mientras que el haplotipo 4 (que contiene ambos alelos mutados) se asoció fuertemente a la discapacidad grado iv (OR=45,0, IC del 95%, 5,2-358). Esto sugiere que los alelos mutados de C314T para HNMT y C2029G para DAO pueden interactuar aumentando la discapacidad causada por la migraña.
La principal limitación de este estudio fue el pequeño tamaño de la muestra; sin embargo, creemos que hay pruebas suficientes que apoyen una asociación sinérgica de ambos polimorfismos con migraña, por lo menos en las madres de los niños alérgicos. Lo anterior porque con un bajo tamaño de muestra existe más posibilidad de cometer un error tipo ii que uno tipo i. Un posible sesgo de selección también debe de hacer tomar con precaución estos resultados. Sin embargo, este sesgo llevaría a concentrar los posibles alelos de riesgo en los controles, pero a pesar de esto se encontraron diferencias significativas en la distribución de genotipos entre los casos y los controles.
En conclusión, se presenta aquí una asociación sinérgica de los polimorfismos C314T para HNMT y C2029G para DAO con la presencia y la discapacidad por migraña, que debe ser confirmada en un grupo más amplio de estudios. Sin embargo, la interpretación debe de tomar en cuenta las características y las diferencias étnicas entre las poblaciones analizadas. Por otra parte, las interacciones con otros polimorfismos de estas enzimas y otros SNP asociados con el metabolismo de la histamina (histidina descarboxilasa, receptores de histamina, etc.) pueden influir en el riesgo de desarrollo de la migraña, como se ha indicado recientemente en la asociación del polimorfismo del gen rs3816527 PTX3 con la susceptibilidad a la migraña, aunque solo en sujetos masculinos45.
Conflicto de interesesLos autores declaran no tener conflictos de interés.