En los últimos años se han producido importantes cambios en la prevención y tratamiento del ictus isquémico agudo en el adulto. Sin embargo, la baja incidencia en edades pediátricas hace más difícil desarrollar protocolos y guías de asistencia específicas. Este trabajo busca conocer la situación de estos niños en nuestra región, con el objetivo de establecer un protocolo autonómico que mejore la atención a estos pacientes.
MétodosEstudio de incidencia de base hospitalaria del ictus infantil (≤15 años de edad) en Aragón (1.308.728 habitantes, 15% ≤15 años), desde 2008 a 2019. Los datos se extrajeron de los episodios de alta hospitalaria, incluidas las defunciones, del Servicio Aragonés de Salud, de acuerdo a los códigos de la Codificación Internacional de Enfermedades (CIE) definidos para enfermedad cerebrovascular. Se analizaron aspectos demográficos, clínicos, diagnóstico-terapéuticos y de pronóstico.
ResultadosSe recogieron un total de 21 eventos, ocho isquémicos (38,1%) y 13 hemorrágicos (61,9%). La media de edad fue 9,3 años (desviación típica 1,0). Hubo 12 hombres y nueve mujeres. No se encontraron diferencias estadísticamente significativitas entre ictus isquémicos y hemorrágicos, salvo por el síntoma guía (déficit motor o del lenguaje en isquémicos, y cefalea en hemorrágicos). Ninguno de los eventos isquémicos recibió terapias de reperfusión. Incluyendo los tres pacientes que fallecieron durante el ingreso, ocho (42,1%) tenían una puntuación en la escala modificada de Rankin (mRS) > 2 a los 12 meses. El déficit motor fue la secuela más común (n = 9).
ConclusionesEl ictus infantil, aunque infrecuente, supone una importante limitación funcional. En España, Madrid fue pionera en adaptar las redes de asistencia existentes del Código Ictus en el adulto. En el caso de Aragón, esta revisión nos ha permitido trabajar de cerca con los diferentes actores implicados, para poder ofrecer un plan autonómico de atención al ictus isquémico infantil. Sin embargo, registros nacionales prospectivos ayudarían a avanzar en la atención a estos niños.
Recent years have seen considerable changes in the prevention and treatment of acute ischaemic stroke in adult patients. However, the low incidence of paediatric stroke makes the development of specific guidelines more challenging. This study aims to clarify the situation of these children in our region in order to establish a regional protocol to improve the care provided to these patients.
MethodsWe performed a regional incidence study of pediatric stroke (≤ 15 years of age) in Aragon, Spain (1 308 728 population, 15% aged ≤ 15 years) between 2008 and 2019. Data were obtained from hospital discharge records, including deaths, from the regional health service of Aragón, according to ICD codes for cerebrovascular disease. We analysed demographic, clinical, diagnostic/therapeutic, and prognostic variables.
ResultsA total of 21 events were recorded: 8 ischaemic (38.1%) and 13 haemorrhagic strokes (61.9%). The mean age (SD) was 9.3 years (1.0). The sample included 12 boys and nine girls. No statistically significant differences were found between ischaemic and haemorrhagic strokes, except in the chief complaint (language and motor impairment in ischaemic stroke and headache in haemorrhagic stroke). None of the patients with ischaemic stroke received reperfusion therapies. Including the 3 patients who died during hospitalisation, eight patients (42.1%) had modified Rankin Scale scores > 2 at 12 months. Motor deficits were the most common sequela (n = 9).
ConclusionThough infrequent, paediatric stroke has an important functional impact. In Spain, Madrid was the first region to adapt the existing code stroke care networks for adult patients. In Aragon, this review has enabled us to work closely with the different stakeholders to offer a care plan for acute paediatric ischaemic stroke. Nevertheless, prospective national registries would be valuable to continue improving the care provided to these patients.
En el último decenio, los cambios y avances producidos en la prevención y tratamiento agudo del ictus han permitido mejorar de forma significativa el pronóstico de los pacientes adultos1–7. En el caso de Aragón, el establecimiento de una estrategia autonómica en el año 2009 ha conseguido homogeneizar el abordaje del ictus isquémico del adulto en toda la comunidad, objetivándose un descenso de la mortalidad del 33% en varones y del 38% en mujeres8.
En la edad pediátrica, la baja incidencia de la enfermedad cerebrovascular (ECV) y sus diferentes etiologías dificultan la implantación de guías de actuación y la aplicación de tratamientos de reperfusión que ayuden a disminuir, de forma similar a lo ocurrido en el adulto, la morbimortalidad de estos pacientes9–12.
De forma global, se estima una incidencia de ictus pediátrico de unos dos a tres casos por cada 100.000 habitantes por año entre los cero y 15 años de edad, con una mayor incidencia en neonatos (25-40 por cada 100.000), especialmente prematuros10,13–16. En el caso de España, para una población de 47 millones de habitantes, los casos representarían unos 140-270 niños por año. En Aragón, con 1.308.728 habitantes en 2020, y una población infantil ≤ 15 años del 15% (196.379 niños, 51,41% hombres); supondrían unos dos a tres casos de ictus por año.
De acuerdo con las series publicadas, los factores de riesgo difieren a los presentados en la edad adulta. Se observa un predominio en varones, y su forma de presentación está marcada por la edad del paciente9,13–17. Más del 50% de los niños presentan secuelas que repercutirán en su calidad de vida18.
En la actualidad, el neurointervencionismo se presenta como el tratamiento con mayor probabilidad de lograr un resultado favorable para el ictus isquémico en esta edad19. La fibrinólisis endovenosa no ha conseguido establecer su efectividad real por falta de reclutamiento en los estudios, y sus recomendaciones se basan en los resultados observados en adultos9,10,20–23. Por otra parte, son escasos los estudios que describen las características de los niños que presentan un ictus isquémico, lo que dificulta conocer el perfil de aquellos susceptibles de recibir un tratamiento reperfusor.
Ante la necesidad desde el Departamento de Sanidad aragonés de establecer un plan para la atención del ictus pediátrico, con la implantación del Código Ictus y sus circuitos, se decide revisar los casos sucedidos en Aragón en la última década. La hipótesis establecida es que un mayor conocimiento de las características de los pacientes y de la población diana susceptible es un aspecto esencial que permitiría definir los circuitos de atención, y así evitar desplazamientos y realización de pruebas innecesarias.
El objetivo de este estudio descriptivo es conocer la incidencia y características epidemiológicas del ictus en edad infantil en Aragón, de cara a establecer un protocolo autonómico que permita una mejora en la atención a estos pacientes.
Material y métodosEstudio regional retrospectivo del ictus infantil en Aragón, obtenido del sistema de información de la estrategia de ictus del Servicio Aragonés de Salud (SALUD).
Aragón es una Comunidad Autónoma ubicada en el noreste de España, con una baja densidad poblacional (28 habitantes por km2) distribuida de forma desigual. El 74% de las personas ≤ 15 años se concentra en una de sus tres provincias, Zaragoza (con una densidad de 55,8 habitantes por km2). En la capital de esta provincia se encuentra el único centro de referencia para patología neurovascular pediátrica, el Hospital Materno Infantil-Hospital Universitario Miguel Servet (HUMS).
Los datos se extrajeron de los episodios de alta hospitalaria, incluidas las defunciones, de los diversos centros hospitalarios adscritos al SALUD. Para ello, se consultó el registro integrado en su historia clínica electrónica (GUHARA), con los códigos de la Codificación Internacional de Enfermedades (CIE) definidos para ECV, tanto isquémica como hemorrágica. CIE-9 (430 a 437) hasta el año 2015 y CIE-10 (I60 a I67 y G45) a partir del 2016, fecha de implantación de la CIE-10 en el Sistema Nacional de Salud español (SNS) para registro de morbilidad. No se incluyen, por tanto, los ictus que han podido ser atendidos exclusivamente en atención primaria o en centros privados.
Se consultaron los datos disponibles en la última década (2008-2019) de ictus infantil, considerado como aquel que se presenta a partir de los 28 días de vida. Por sus características específicas, se excluyeron los episodios de ictus perinatal, definido como aquel que sucede entre la semana 28 de gestación y el día 28 tras el nacimiento11, salvo para los cálculos de incidencia poblacional; así como los niños con una edad mayor de 15 años, al considerarse este el límite de edad pediátrica en el SNS a nivel hospitalario.
Se recogieron las características basales del paciente, incluyendo la edad, el sexo, el lugar de residencia, los factores de riesgo cerebrovascular o comorbilidades asociadas y la situación funcional previa. En cuanto a las características del evento, se documentó la clínica de presentación, el tiempo desde el inicio de los síntomas hasta la llegada al primer centro sanitario y al centro de referencia para patología neurovascular infantil, el tipo de neuroimagen realizada de forma urgente o durante el ingreso hospitalario, la localización del ictus, el tratamiento recibido en fase aguda, la necesidad de cuidados intensivos, la causa del evento y la duración total del ingreso. La escala de valoración clínica utilizada fue la Pediatric National Institutes of Health Stroke Scale (PedNIHSS), de forma retrospectiva, ya que su desarrollo e implantación se realizó tras su validación en 201224. Su uso retrospectivo tiene un alto grado de validez y reproductibilidad y mejora la calidad de los estudios observacionales25. En el caso de los eventos isquémicos, se infirió el Alberta Stroke Program Early CT Score (ASPECTS) de la neuroimagen basal, así como la existencia o no de transformación hemorrágica, y una clasificación etiológica del ictus mediante los criterios Childhood AIS Standardized Classification and Diagnostic Evaluation (CASCADE). En cuanto a las hemorragias cerebrales, se valoró, de forma retrospectiva, la puntuación en la escala modificada de hemorragia intracerebral pediátrica (mPICH) como herramienta de estratificación pronóstica en la fase aguda26. Como variables de resultados en salud, seleccionamos la mortalidad hospitalaria, los tipos de secuelas al alta y la necesidad de rehabilitación ambulatoria, la existencia de epilepsia estructural remota secundaria y la puntuación en la escala modificada de Rankin (mRS) a 12 meses a través de los registros de seguimiento.
Realizamos un análisis estadístico descriptivo utilizando el paquete informático IBM SPSS Statistics para Macintosh (versión 25.0. Armonk, NY: IBM Corp). Las variables cualitativas se recogen en forma de números totales y porcentajes, mientras que las variables cuantitativas continuas se muestran con sus medias aritméticas y desviaciones típicas, o medianas y rangos intercuartílicos, cuando procede.
El estudio ha sido aprobado por el Comité de Ética de la Investigación de la Comunidad Autónoma de Aragón (CEICA) y cuenta con la autorización del Servicio de Estrategias en Salud de la Dirección General de Sanidad del Gobierno de Aragón.
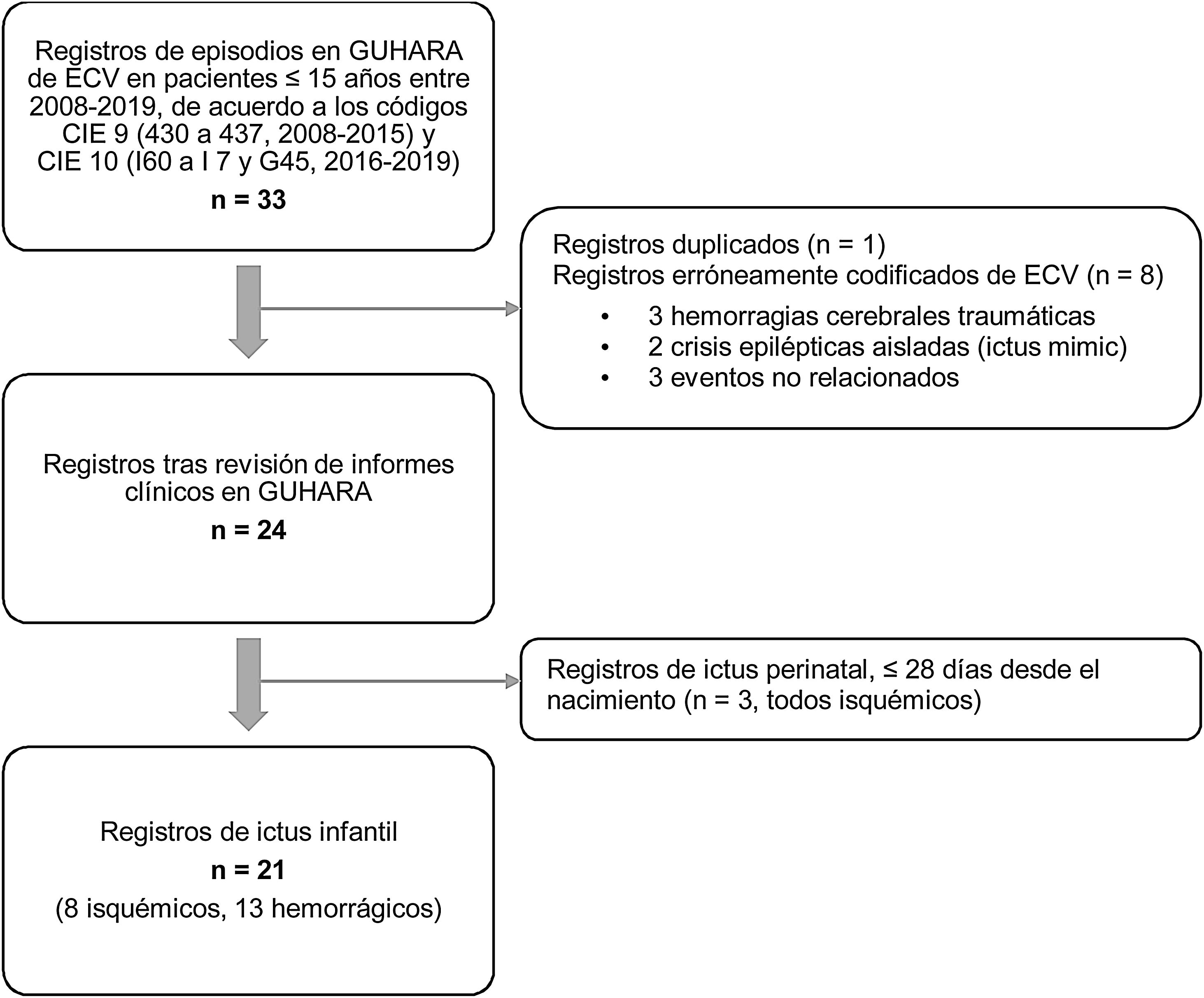
ResultadosDe un registro inicial de 33 episodios de hospitalización codificados como ECV, 21 cumplían todos los criterios de inclusión y ninguno de los de exclusión para ictus infantil. La figura 1 muestra el esquema de selección de pacientes, de acuerdo a los criterios indicados. De los 21, ocho fueron ictus isquémicos (38,1%) y 13 hemorrágicos (61,9%). No se registró ningún accidente isquémico transitorio, ninguna trombosis venosa cerebral, ni ninguna hemorragia subaracnoidea espontánea aislada.
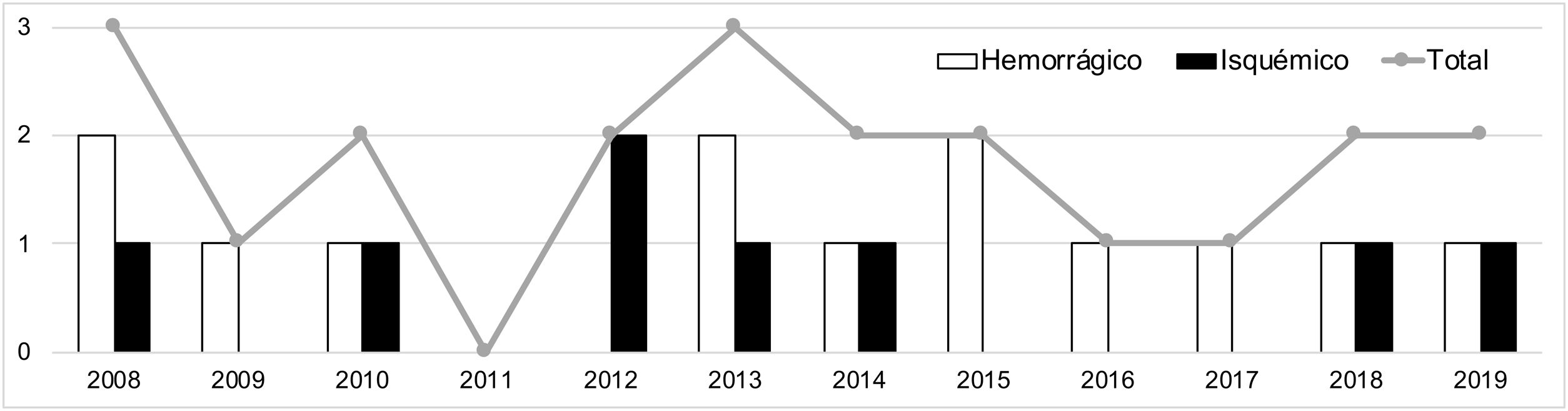
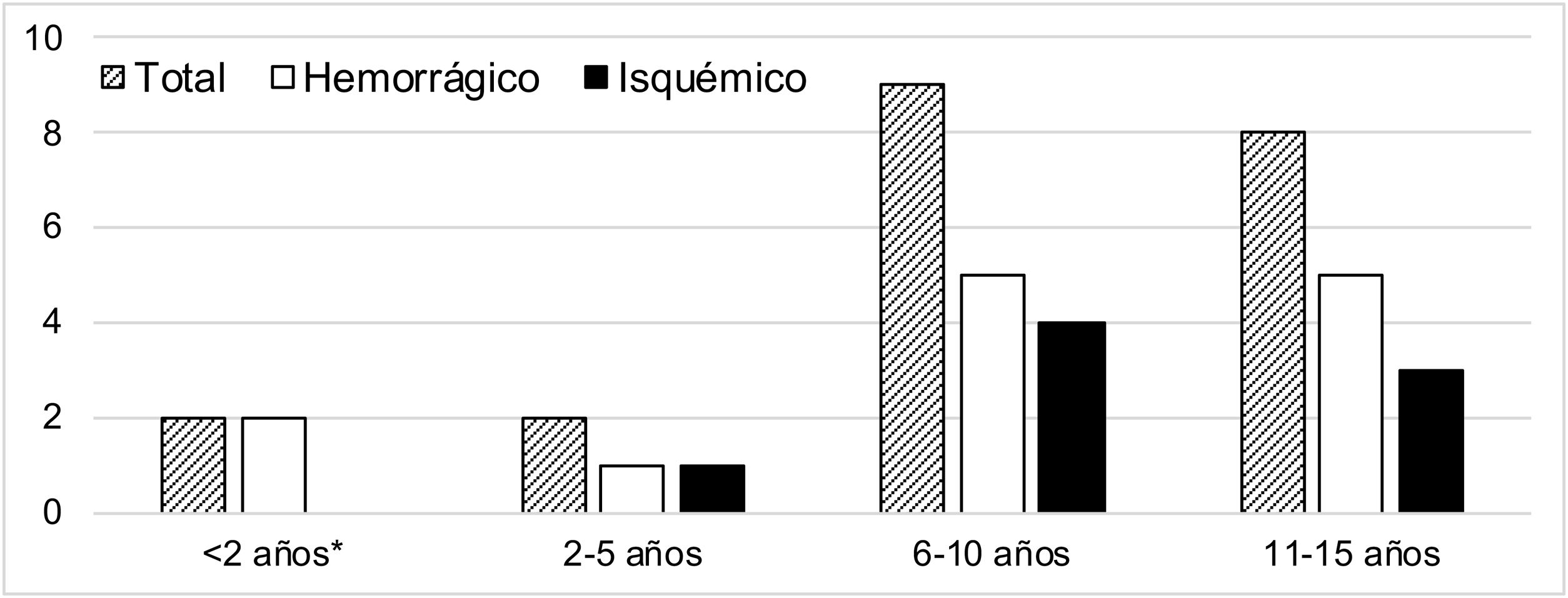
La mediana de casos anuales en el periodo analizado fue de dos casos por año (rango intercuatílico [IQR] 0-3). La figura 2 muestra su distribución a lo largo de todo el periodo. La media de edad del conjunto de casos fue de 9,3 años (desviación típica 1,0), con una distribución por sexos de 12 hombres (57,1%) y nueve mujeres (42,9%). En la figura 3 se recoge la distribución por grupos etarios, con tres eventos isquémicos en menores de ocho años. Como situación funcional de partida, todos los pacientes tenían una autonomía esperable para su edad (mRS 0), salvo dos niños con ictus isquémico, en los que se estimó un mRS de 2 (cardiopatía congénita con ventrículo único que limitaba actividades físicas) y 3 (síndrome de Down y West, que condicionaba una dependencia parcial).
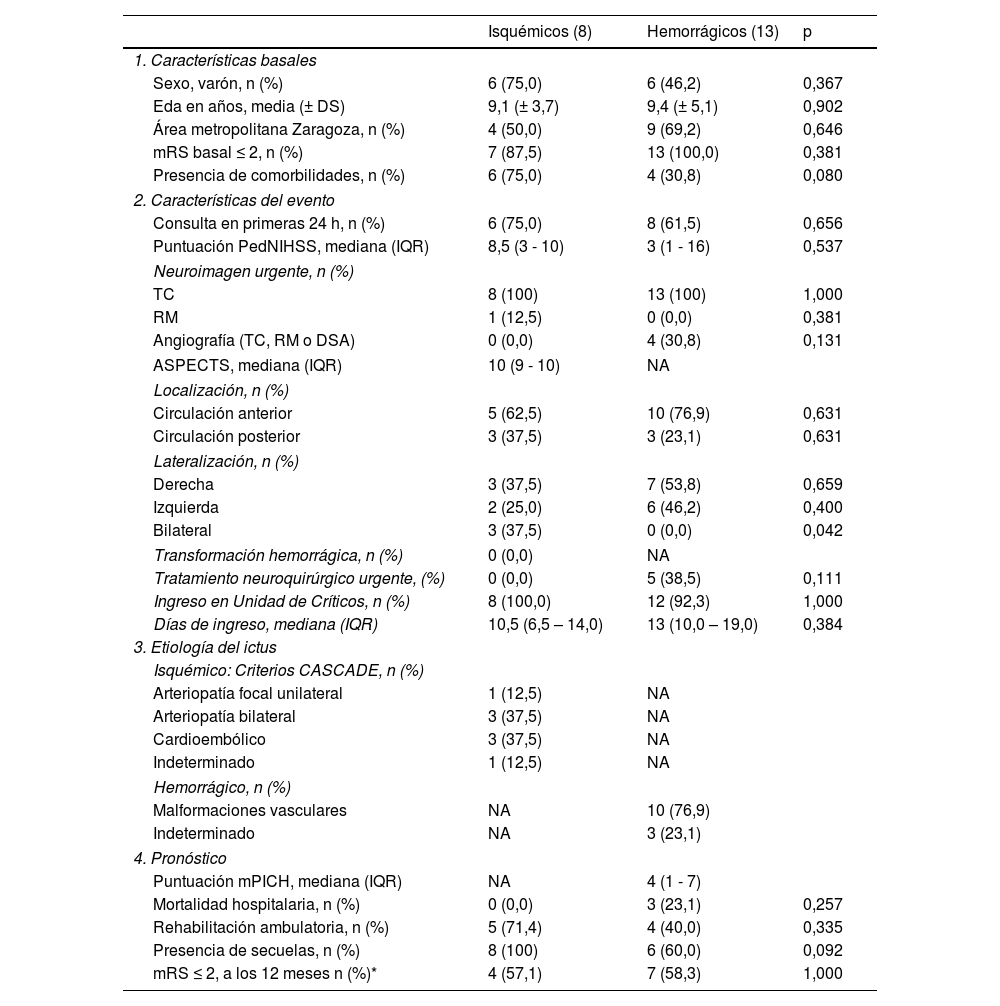
En las tablas 1 y 2 se muestran el conjunto de características demográficas, clínicas y pronósticas agrupadas por tipo de episodio, isquémico o hemorrágico. No encontramos diferencias estadísticamente significativas para las variables analizadas entre ambos grupos, salvo en el motivo clínico de consulta identificado: en los eventos isquémicos hubo un 37,5% (n = 3) de alteraciones del lenguaje vs. 0,0% (p = 0,042) y un 62,5% (n = 5) de déficit motor vs. 0,0% (p = 0,003), mientras que, en los hemorrágicos, la cefalea fue el motivo de consulta en el 69,2% (n = 9) vs. 0,0% (p = 0,002). Se encuentra una relación, que no llega a ser estadísticamente significativa, entre la mayor presencia de comorbilidades (75,0 vs. 30,8%, p = 0,080) y a su vez mayor presencia de secuelas al alta (100 vs. 60%, p = 0,092) en pacientes que sufren un evento isquémico, frente a los hemorrágicos.
Características de los pacientes pediátricos hospitalizados por ictus agudo (isquémico o hemorrágico) en Aragón, entre 2008 y 2019 (n = 21)
| Isquémicos (8) | Hemorrágicos (13) | p | |
|---|---|---|---|
| 1. Características basales | |||
| Sexo, varón, n (%) | 6 (75,0) | 6 (46,2) | 0,367 |
| Eda en años, media (± DS) | 9,1 (± 3,7) | 9,4 (± 5,1) | 0,902 |
| Área metropolitana Zaragoza, n (%) | 4 (50,0) | 9 (69,2) | 0,646 |
| mRS basal ≤ 2, n (%) | 7 (87,5) | 13 (100,0) | 0,381 |
| Presencia de comorbilidades, n (%) | 6 (75,0) | 4 (30,8) | 0,080 |
| 2. Características del evento | |||
| Consulta en primeras 24 h, n (%) | 6 (75,0) | 8 (61,5) | 0,656 |
| Puntuación PedNIHSS, mediana (IQR) | 8,5 (3 - 10) | 3 (1 - 16) | 0,537 |
| Neuroimagen urgente, n (%) | |||
| TC | 8 (100) | 13 (100) | 1,000 |
| RM | 1 (12,5) | 0 (0,0) | 0,381 |
| Angiografía (TC, RM o DSA) | 0 (0,0) | 4 (30,8) | 0,131 |
| ASPECTS, mediana (IQR) | 10 (9 - 10) | NA | |
| Localización, n (%) | |||
| Circulación anterior | 5 (62,5) | 10 (76,9) | 0,631 |
| Circulación posterior | 3 (37,5) | 3 (23,1) | 0,631 |
| Lateralización, n (%) | |||
| Derecha | 3 (37,5) | 7 (53,8) | 0,659 |
| Izquierda | 2 (25,0) | 6 (46,2) | 0,400 |
| Bilateral | 3 (37,5) | 0 (0,0) | 0,042 |
| Transformación hemorrágica, n (%) | 0 (0,0) | NA | |
| Tratamiento neuroquirúrgico urgente, (%) | 0 (0,0) | 5 (38,5) | 0,111 |
| Ingreso en Unidad de Críticos, n (%) | 8 (100,0) | 12 (92,3) | 1,000 |
| Días de ingreso, mediana (IQR) | 10,5 (6,5 – 14,0) | 13 (10,0 – 19,0) | 0,384 |
| 3. Etiología del ictus | |||
| Isquémico: Criterios CASCADE, n (%) | |||
| Arteriopatía focal unilateral | 1 (12,5) | NA | |
| Arteriopatía bilateral | 3 (37,5) | NA | |
| Cardioembólico | 3 (37,5) | NA | |
| Indeterminado | 1 (12,5) | NA | |
| Hemorrágico, n (%) | |||
| Malformaciones vasculares | NA | 10 (76,9) | |
| Indeterminado | NA | 3 (23,1) | |
| 4. Pronóstico | |||
| Puntuación mPICH, mediana (IQR) | NA | 4 (1 - 7) | |
| Mortalidad hospitalaria, n (%) | 0 (0,0) | 3 (23,1) | 0,257 |
| Rehabilitación ambulatoria, n (%) | 5 (71,4) | 4 (40,0) | 0,335 |
| Presencia de secuelas, n (%) | 8 (100) | 6 (60,0) | 0,092 |
| mRS ≤ 2, a los 12 meses n (%)* | 4 (57,1) | 7 (58,3) | 1,000 |
ASPECTS: Alberta Stroke Program Early Computed Tomography Score; CASCADE: Childhood AIS Standardized Classification and Diagnostic Evaluation; DS: desviación típica; DSA: angiografía por sustracción digital; IQR: rango intercuartílico; mPICH: modified Pediatric Intracraneal Cerebral Hemorrhage; mRS: modified Rankin Scale; NA: no aplica; PedNIHSS: Pediatric National Institutes of Health Stroke Scale; TC: tomografía computarizada; RM: resonancia magnética.
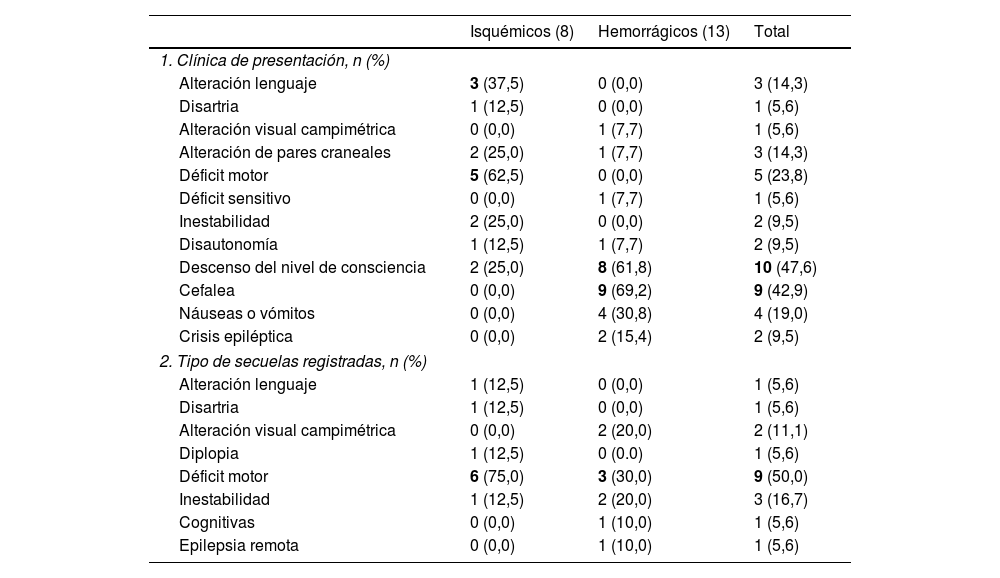
Clínica de presentación registrada como motivo de consulta y secuelas al alta hospitalaria de los pacientes con ictus agudo pediátrico en Aragón (2008 - 2019), de forma global y por tipo de evento (isquémico o hemorrágico)
| Isquémicos (8) | Hemorrágicos (13) | Total | |
|---|---|---|---|
| 1. Clínica de presentación, n (%) | |||
| Alteración lenguaje | 3 (37,5) | 0 (0,0) | 3 (14,3) |
| Disartria | 1 (12,5) | 0 (0,0) | 1 (5,6) |
| Alteración visual campimétrica | 0 (0,0) | 1 (7,7) | 1 (5,6) |
| Alteración de pares craneales | 2 (25,0) | 1 (7,7) | 3 (14,3) |
| Déficit motor | 5 (62,5) | 0 (0,0) | 5 (23,8) |
| Déficit sensitivo | 0 (0,0) | 1 (7,7) | 1 (5,6) |
| Inestabilidad | 2 (25,0) | 0 (0,0) | 2 (9,5) |
| Disautonomía | 1 (12,5) | 1 (7,7) | 2 (9,5) |
| Descenso del nivel de consciencia | 2 (25,0) | 8 (61,8) | 10 (47,6) |
| Cefalea | 0 (0,0) | 9 (69,2) | 9 (42,9) |
| Náuseas o vómitos | 0 (0,0) | 4 (30,8) | 4 (19,0) |
| Crisis epiléptica | 0 (0,0) | 2 (15,4) | 2 (9,5) |
| 2. Tipo de secuelas registradas, n (%) | |||
| Alteración lenguaje | 1 (12,5) | 0 (0,0) | 1 (5,6) |
| Disartria | 1 (12,5) | 0 (0,0) | 1 (5,6) |
| Alteración visual campimétrica | 0 (0,0) | 2 (20,0) | 2 (11,1) |
| Diplopia | 1 (12,5) | 0 (0.0) | 1 (5,6) |
| Déficit motor | 6 (75,0) | 3 (30,0) | 9 (50,0) |
| Inestabilidad | 1 (12,5) | 2 (20,0) | 3 (16,7) |
| Cognitivas | 0 (0,0) | 1 (10,0) | 1 (5,6) |
| Epilepsia remota | 0 (0,0) | 1 (10,0) | 1 (5,6) |
Se muestra en negrita los síntomas más frecuentes de consulta en cada grupo. Alcanzaron una diferencia estadísticamente significativa la alteración del lenguaje (p = 0,042), el déficit motor (p = 0,003) y la cefalea (p = 0,002).
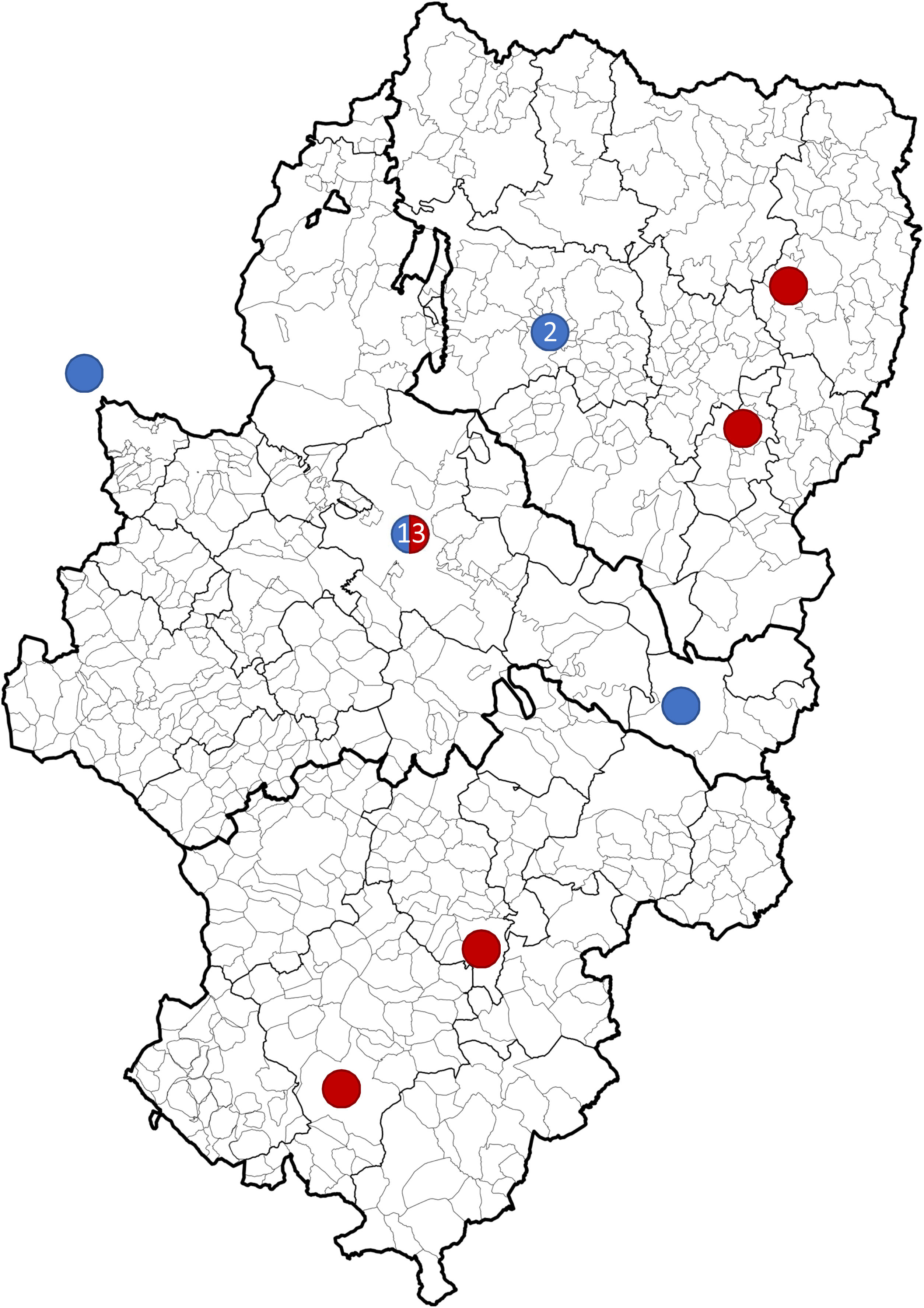
De forma global, el 61,9% (n = 13) de los episodios tuvieron lugar en Zaragoza o su área metropolitana (fig. 4). El 95,8% (n = 20) acabó siendo atendido en el HUMS. Ingresaron en Unidades de Críticos el 95,8% (n = 20), 18 en la Unidad de Cuidados Intensivos Pediátricos (UCIP) y dos en Unidades de Ictus de adultos. Un 33,3% (n = 7) no consultaron en las primeras 24 horas de inicio de los síntomas. El paciente que ingresó directamente en planta de hospitalización llevaba al menos 72 horas de inicio de clínica, sin presentar empeoramiento. La mediana de tiempo de ingreso fue de 12 días (IQR 8-17).
Distribución de los eventos entre 2008 y 2019 en Aragón. Ictus isquémicos (azul) en Huesca (2008, 2012), Zaragoza (2010, 2012, 2018, 2019), Caspe (2013) y La Rioja (2014). Ictus hemorrágicos (rojo) en Zaragoza (2008, 2013 x 2, 2014, 2015 x 2, 2017, 2018, 2019), Graus (2008), Aliaga (2009), Monzón (2010) y Teruel (2016). La Rioja tenía antiguamente el Hospital Materno Infantil - Hospital Universitario Miguel Servet como el centro de referencia para patología neurovascular pediátrica urgente.
En cuanto al manejo realizado en la fase aguda, ningún paciente con ictus isquémico recibió fibrinólisis intravenosa ni se valoró la trombectomía mecánica. La neuroimagen basal se realizó en el primer centro hospitalario en 19 casos (90,5%). En cuatro pacientes (17,4%) se efectuó un estudio arterial urgente, todos ellos hemorrágicos. Durante el ingreso, se realizó una resonancia magnética (RM) cerebral en las primeras 24 horas en el 50% (n = 4) de los ictus isquémicos y se completó con un estudio angiográfico cerebral y de troncos supra-aórticos en todos ellos, con alguna de las siguientes modalidades: Angio-RM (cinco), angiografía por sustracción digital (dos), neurosonología (dos) o Angio-TC (uno). En el caso de los eventos hemorrágicos, solo en dos (15,4%) no se efectuó un estudio arterial durante el ingreso, en ambos casos por una situación clínica que llevó al fallecimiento en los primeros días.
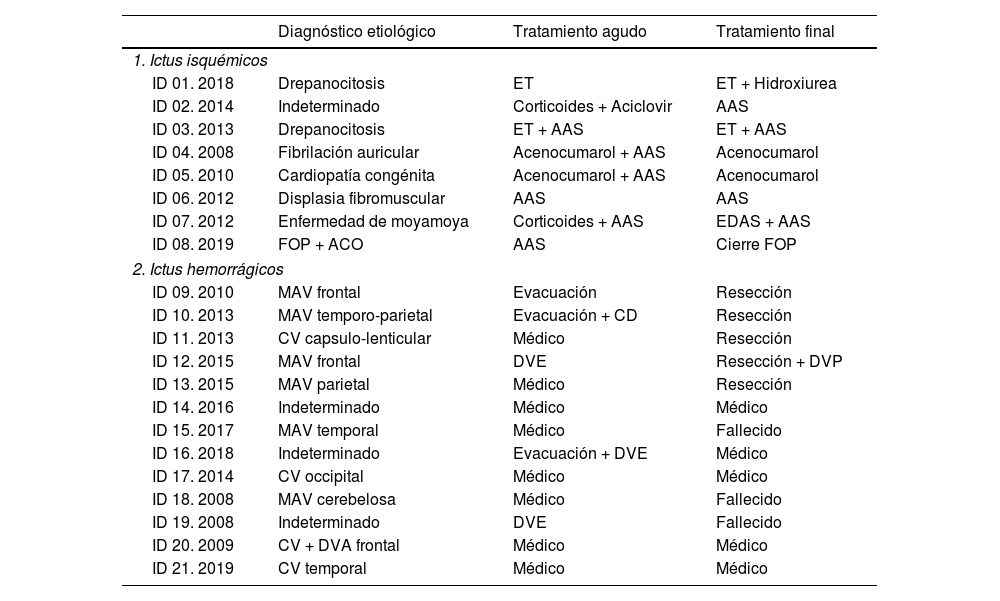
La tabla 3 muestra el diagnóstico etiológico y los tratamientos recibidos en relación con la causa del evento, tanto en fase aguda como para el abordaje de la patología que motivó el ictus. No se determinó la causa en 4 casos (17.4%, 1 isquémico y 3 hemorrágicos).
Diagnóstico etiológico y manejo terapéutico de cada uno de los casos de ictus infantil, isquémicos y hemorrágicos
| Diagnóstico etiológico | Tratamiento agudo | Tratamiento final | |
|---|---|---|---|
| 1. Ictus isquémicos | |||
| ID 01. 2018 | Drepanocitosis | ET | ET + Hidroxiurea |
| ID 02. 2014 | Indeterminado | Corticoides + Aciclovir | AAS |
| ID 03. 2013 | Drepanocitosis | ET + AAS | ET + AAS |
| ID 04. 2008 | Fibrilación auricular | Acenocumarol + AAS | Acenocumarol |
| ID 05. 2010 | Cardiopatía congénita | Acenocumarol + AAS | Acenocumarol |
| ID 06. 2012 | Displasia fibromuscular | AAS | AAS |
| ID 07. 2012 | Enfermedad de moyamoya | Corticoides + AAS | EDAS + AAS |
| ID 08. 2019 | FOP + ACO | AAS | Cierre FOP |
| 2. Ictus hemorrágicos | |||
| ID 09. 2010 | MAV frontal | Evacuación | Resección |
| ID 10. 2013 | MAV temporo-parietal | Evacuación + CD | Resección |
| ID 11. 2013 | CV capsulo-lenticular | Médico | Resección |
| ID 12. 2015 | MAV frontal | DVE | Resección + DVP |
| ID 13. 2015 | MAV parietal | Médico | Resección |
| ID 14. 2016 | Indeterminado | Médico | Médico |
| ID 15. 2017 | MAV temporal | Médico | Fallecido |
| ID 16. 2018 | Indeterminado | Evacuación + DVE | Médico |
| ID 17. 2014 | CV occipital | Médico | Médico |
| ID 18. 2008 | MAV cerebelosa | Médico | Fallecido |
| ID 19. 2008 | Indeterminado | DVE | Fallecido |
| ID 20. 2009 | CV + DVA frontal | Médico | Médico |
| ID 21. 2019 | CV temporal | Médico | Médico |
AAS: ácido acetilsalicílico 100 mg; ACO: anticoagulación oral; CD: craniectomía descompresiva; CV: cavernoma; DVA: drenaje venoso anómalo; DVE: drenaje ventricular externo; CVP: drenaje ventrículo-peritoneal; EDAS: encefaloduroarteriosinangiosis; ET: exanguinotransfusión; HIV: hemorragia intraventricular; HSA: hemorragia subaracnoidea; ID: n.° de identificación del paciente y año del evento; FOP: foramen oval permeable; MAV: malformación arteriovenosa.
NOTAS: En los ictus hemorrágicos, los ID 12, 15 y 21 asociaron HIV, los ID 10, 14, 16, 18 y 19 un componente de HSA y el ID 10 un hematoma subdural.
Se entiende por tratamiento médico en la hemorragia intraparenquimatosa a los cuidados estandarizados de control clínico y hemodinámico que no requiera tratamiento intervencionista.
De la resección de malformaciones vasculares, 3 de las 4 MAV se aseguraron previamente mediante embolización endovascular y una de ellas recibió radioterapia posterior. El cavernoma resecado se realizó mediante radiocirugía.
En relación con el pronóstico de los pacientes, tres (14%) fallecieron durante la fase aguda, todos ellos ictus hemorrágicos. Dos de ellos en el contexto de hipertensión intracraneal por hematoma de fosa posterior (mujer de 1,8 años y varón de 10,2 años, mPICH 9 en ambos casos) y el otro por estatus epiléptico refractario secundario a hematoma temporal derecho con vertido ventricular (varón de 8,5 años, mPICH 1). No se encontraron diferencias significativas en cuanto al pronóstico funcional y la localización de la hemorragia o puntuación en la escala mPICH.
Las secuelas al alta de los 18 supervivientes se recogen en la tabla 2, programándose rehabilitación ambulatoria en el 55,6% (n = 10). Los déficits motores fueron los más frecuentes (50%, n = 9). Seis pacientes presentaron crisis epilépticas secundarias al ictus, todos ellos hemorrágicos. De ellos, cinco fueron crisis sintomáticas agudas durante el ingreso y solo uno presentó epilepsia remota (varón de 12,8 años, con antecedente de crisis febriles complejas en la infancia).
En cuanto al seguimiento, se pudo trazar a 16 niños (88,9%), no disponiendo de registros posteriores en los otros dos por trasladarse fuera de Aragón. No ha habido recurrencias en el seguimiento de cada uno de los pacientes y, en la revisión tras los primeros 12 meses, no hubo nuevos fallecidos, teniendo cinco (31,3%) un mRS > 2 (incluyendo el paciente que partía con un mRS de 3). Considerando los tres pacientes fallecidos durante el ingreso, el 42,1% (n = 8) ha tenido un mal pronóstico funcional a medio-largo plazo (mRS > 2).
DiscusiónLa baja incidencia del ictus pediátrico hace disponer de pocas series que estudien el perfil de estos pacientes15,27,28. Si comparamos estos registros con nuestra muestra, observamos que la incidencia del ictus infantil es menor a la esperada para la población de nuestro territorio, recogiendo 0,89 casos al año por cada 100.000 niños ≤ 15 años de edad, con una predominancia de eventos hemorrágicos (61,9%) frente a isquémicos (38,1%) en los 12 años de registro. En el ictus isquémico es más patente esta menor incidencia, con 0,47 por cada 100.000, incluyendo, en este caso, neonatos (vs. 1,7-2,7 de series recientes)15,27,28; y con un bajo número de casos en el grupo donde suele registrarse una mayor prevalencia, los niños < 2 años. Las razones pueden ser varias, como una dificultad en la identificación en el momento agudo, pero también a la hora de codificar los episodios. Por sexos, sí que observamos, al igual que otros registros, una predominancia del sexo masculino en los eventos isquémicos (75%)15,27.
Respecto a la evolución de la incidencia en Aragón, se observa que el ictus pediátrico se ha mantenido estable durante los últimos 12 años, a diferencia del descenso ocurrido en el adulto. Este hecho se plasma en otra serie poblacional28, en la que también existe una mayor incidencia del ictus isquémico (2,7/100.000) respecto al hemorrágico (1,7/100.000). La estabilidad de la incidencia en las series puede deberse a que no se han producido cambios sustanciales en la prevención del ictus infantil en los últimos años, a excepción del manejo de la anemia de células falciformes29.
Como en la mayoría de las series, nuestros pacientes con ictus isquémico presentaban algún factor de riesgo conocido de ECV (el 75%, seis de los ocho casos). De ellos, podemos destacar: el paciente con distrofia muscular de Emery-Dreifuss, que presentó una fibrilación auricular denovo como causa del ictus, siendo una de las cardiopatías más frecuentes asociadas a este tipo de distrofia30; y los dos pacientes afectos de drepanocitosis, ambos de raza negra, lo que incrementa su riesgo de ictus por la enfermedad en hasta más de 200 veces respecto al resto de la población infantil31. En el caso de nuestro paciente con síndrome de Down, fue diagnosticado de enfermedad de moyamoya. Esta arteriopatía tiene una mayor prevalencia en este tipo de trisomía y es la responsable del 6-10% de todos los accidentes isquémicos transitorios (AIT) e ictus pediátricos32,33.
La existencia de comorbilidades o factores de riesgo conocidos antes del evento isquémico remarca la importancia de un seguimiento estrecho de este tipo de pacientes para evitar que la ECV ocurra. Dado el limitado número de etiologías del ictus isquémico infantil, habría que aumentar los esfuerzos en prevención primaria en pacientes seleccionados (como aquellos con cardiopatías o vasculopatías), al igual que se ha hecho con la drepanocitosis (consiguiendo una drástica reducción de estos eventos). Si esto no es posible y el evento acaba sucediendo, se hace esencial la existencia de una red articulada para una pronta identificación y posible tratamiento.
En el caso de las hemorragias, nuestra serie se comporta como las descritas en la literatura. El 77% se deben a una lesión estructural (10 de 13 pacientes), siendo en la mayor parte de los casos una malformación arteriovenosa o un cavernoma. Observamos también que en tres de ellas (23%) el diagnóstico etiológico fue indeterminado, describiéndose en un 10% de los pacientes de otras series34.
En cuanto a la forma de presentación de la ECV, esta se asocia a la edad. En el ictus perinatal, son frecuentes los síntomas difusos, que suelen relacionarse con ictus hemorrágicos, o las crisis epilépticas en todos los tipos de ictus15. En el ictus infantil, los síntomas son similares a los observados en el adulto. Sin embargo, algunas series describen que hasta un tercio de los casos en fase aguda podrían catalogarse como ictus mimic11, frente al 15-25% de los adultos35, lo que ejemplifica la dificultad que existe en edades tempranas para una correcta identificación del cuadro clínico. En nuestra serie, es difícil valorar la categoría de ictus mimic en la fase aguda, al partir de los diagnósticos realizados al alta hospitalaria, cuando ya se han descartado la mayoría de imitadores.
De forma global, en nuestros pacientes con ictus infantil, la cefalea y el descenso de nivel de consciencia fueron los motivos de consulta más identificados en los ictus hemorrágicos (69,2 y 61,8% respectivamente). En los isquémicos, la clínica focal fue la de mayor frecuencia, de forma similar a lo recogido en otras series11,15. De ellos, destacan los déficits motores unilaterales (62,5%), presentes en los grupos de mayor edad (cuatro de los cinco casos en niños de seis a 15 años), seguidos de las alteraciones del lenguaje (37,5%). Respecto a la presentación como crisis epilépticas, solo se produjo en dos de los 21 ictus confirmados (9,5%), cifra menor a la descrita en la literatura (15-25%)11, ambos con ictus hemorrágicos y una edad dispar, 1,8 y 10,8 años. Las crisis en la edad infantil se producen con mayor frecuencia en menores de seis años y se asocian con la etiología. La edad media de nuestra muestra era de 9,3 años y solo tres presentaron un ictus cardioembólico, una de las etiologías que más se asocian en los niños a esta forma de presentación (crisis en más del 40% de los casos)11.
Llama la atención que un 33% de los niños de nuestra serie acude a consulta pasadas las 24 horas de inicio de los síntomas. Se ha observado que, aunque la mayoría de los niños son atendidos en las primeras horas, la mediana de tiempo que transcurre desde el inicio de los síntomas hasta la demanda de atención médica por los padres es muy variable, desde 1,7 hasta 21 horas36,37. Un estudio realizado para conocer el comportamiento de los padres ante un ictus, mostró que un 24% no percibieron la gravedad del cuadro, ya que, ante los síntomas, la actitud fue «esperar y ver»37,38. Este hecho pone de manifiesto que los síntomas en los niños no siempre son reconocidos por los padres como un cuadro de gravedad que requiere una atención inmediata. La concienciación, al igual que sucedió en población adulta, se hace algo fundamental.
Respecto al uso de recursos de estos pacientes, el 95,8% fue atendido en una unidad de críticos. A diferencia de los adultos (donde es extendido el uso de unidades de semicríticos como son las Unidades de Ictus), estos niños ingresaron predominantemente en la Unidad de Cuidados Intensivos Pediátricos del HUMS, con el coste que ello supone (en Aragón no se disponen, a día de hoy, de unidades de cuidados intermedios infantiles para este tipo de patologías). Los pacientes requirieron entre 10,5 a 13 días de estancia hospitalaria, con una tendencia a un mayor número de días en los ictus hemorrágicos, no significativa, pero probablemente limitada por el pequeño tamaño muestral. Por otra parte, no se realizó un tratamiento de reperfusión a ninguno de los niños atendidos con un ictus isquémico. La baja incidencia de estos procesos hace más difícil que sean elegibles para estas terapias, además de que el neurointervencionismo (que se presenta como opción más eficaz en la edad pediátrica), no estaba incluído en la Cartera de Servicios de la Comunidad, ni se había implantado el Código Ictus pediátrico, aprobado en octubre del 2020. En los niños con un ictus hemorrágico, el escaso uso de estudios arteriales urgentes puede ser debido a la falta de un protocolo establecido (solo en cuatro de los 13 pacientes se realizaron estas pruebas, a pesar de que el diagnóstico final de 10 de ellos fue de malformación vascular). De estas hemorragias, se efectuó una actuación neuroquirúrgica urgente en el 38,5% de los pacientes, y el 46,8% requirió un tratamiento quirúrgico posterior de la causa que motivó el sangrado.
Por último, los resultados en salud observados en nuestra serie constatan el elevado porcentaje de dependencia funcional posictus que se describe en los niños. En nuestra serie, el 42,1% (ocho de 19 pacientes) presentó una dependencia funcional, muerte o falta de autonomía (mRS > 2 a los 12 meses). Estos resultados guardan consonancia con otras series, como el registro canadiense (Canadian Pediatric Ischemic Stroke Registry [CPISR] 1992-2001), en el que solo la mitad de los niños con ictus isquémico presentaron un pronóstico favorable15. No obstante, el uso de escalas funcionales como la mRS, diseñadas para población adulta, puede tener sus limitaciones para una correcta valoración de secuelas en niños, por lo que cada vez son más frecuentes los instrumentos específicos como la Pediatric Stroke Outcome Measure (PSOM)39.
Esta dependencia funcional hace necesario disponer de tratamientos efectivos para la fase aguda. Sin embargo, la reducida incidencia de ictus pediátrico supone un lento reclutamiento en ensayos clínicos aleatorizados23, limitando la evidencia disponible en cuanto a los tratamientos indicados en esta franja etaria.
Para superar estas limitaciones y mejorar los resultados, se han propuesto en los últimos años documentos de consenso como el de la American Heart Association de 201911, en el que a los estudios específicos disponibles como el Thrombolysis In Pediatric Stroke (TIPS)23, se añade la experiencia disponible en el ictus isquémico del adulto para implementar terapias de reperfusión.
En España, la región de Madrid fue pionera en adaptar las redes de asistencia del Código Ictus para la atención del paciente infantil. En el caso de Aragón, esta revisión ha permitido acercar posturas de los diferentes actores implicados y ofrecer un plan de atención al ictus isquémico pediátrico en nuestra Comunidad Autónoma, que se acabó aprobando a finales de 202040. Nuestro plan busca ofertar el mejor tratamiento disponible, utilizando todos los recursos y redes ya existentes para el adulto, fomentando la formación y el reconocimiento precoz de los síntomas. Para ello, se hacen fundamentales los equipos multidisciplinares en los que participen, entre otros, médicos con especial dedicación a la neurología infantil. La experiencia obtenida del Código Ictus en el adulto puede ayudar a dicha formación, e incrementar las competencias de otros profesionales, como pediatras, en el uso de herramientas objetivas que permitan monitorizar las actividades de cara a una mejora continua de resultados.
Por último, el hecho de tratarse de una patología infrecuente con una significativa repercusión en la calidad de vida, puede hacer interesante la documentación de pacientes en registros nacionales que permitan conocer las características de estos, para luego adaptar la atención de estos niños a un sistema sanitario concreto.
LimitacionesLa principal limitación de este trabajo es su carácter retrospectivo y observacional. Los errores de codificación han podido suponer, a su vez, algún caso perdido. Aunque menos probable dada la organización asistencial pediátrica en Aragón, con el HUMS como único centro con disponibilidad de UCIP, otro riesgo de infradiagnóstico pudieran ser casos leves que hayan acudido exclusivamente a atención primaria o a centros sanitarios privados. Por otro lado, dada la baja incidencia y el pequeño tamaño de la muestra, el análisis comparativo es limitado y los resultados pueden no ser generalizables a otras regiones.
Se evidencia, además, una falta de uso de escalas clínicas (mRS, PedNIHSS) o radiológicas (ASPECTS, mPICH) semi-cuantitativas en la valoración inicial y el seguimiento de estos pacientes, así como de unos criterios de clasificación etiológica del ictus isquémico, de forma similar a como sucede en el adulto. Por ello, ha sido necesario realizar, para este trabajo, una estimación retrospectiva de este tipo de variables, sirviendo a su vez como oportunidad para formar en esta clase de valoraciones a los profesionales que se encargarán de la asistencia del paciente pediátrico en un futuro.
ConclusiónEl ictus infantil, aunque infrecuente, supone una importante limitación funcional para al menos la mitad de aquellos que lo sufren, con una mayor carga de discapacidad. Los avances que hemos observado en los últimos años en el ictus isquémico agudo en edad adulta han propiciado la creación de nuevas guías de actuación y consensos18. En nuestro caso, nos ha permitido aprobar el Plan de Atención autonómico al Código Ictus pediátrico, con el objetivo de detectar pacientes en riesgo y ofrecer los mejores tratamientos en caso de sucederse el evento40. Animamos a otras comunidades a seguir este camino y a crear registros colaborativos que nos permitan avanzar juntos en el cuidado de estos niños.
FinanciaciónNo se ha recibido financiación para la realización de este trabajo.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.