El interferón beta (IFNß) se utiliza para el tratamiento de la esclerosis múltiple remitente-recurrente (EMRR) y se considera un fármaco seguro. No obstante, la toxicidad hepática debida a IFNß no es rara1,2.
El aloe vera (AV) también se ha asociado a daño hepático3,4. Algunos pacientes con EMRR usan el AV para el alivio del estreñimiento.
Hepatitis en pacientes que toman IFNß y AV no ha sido descrita previamente en la literatura. Presentamos el caso de una paciente con EMRR, que desarrolla una hepatitis tóxica tras el tratamiento a largo plazo con ambos fármacos.
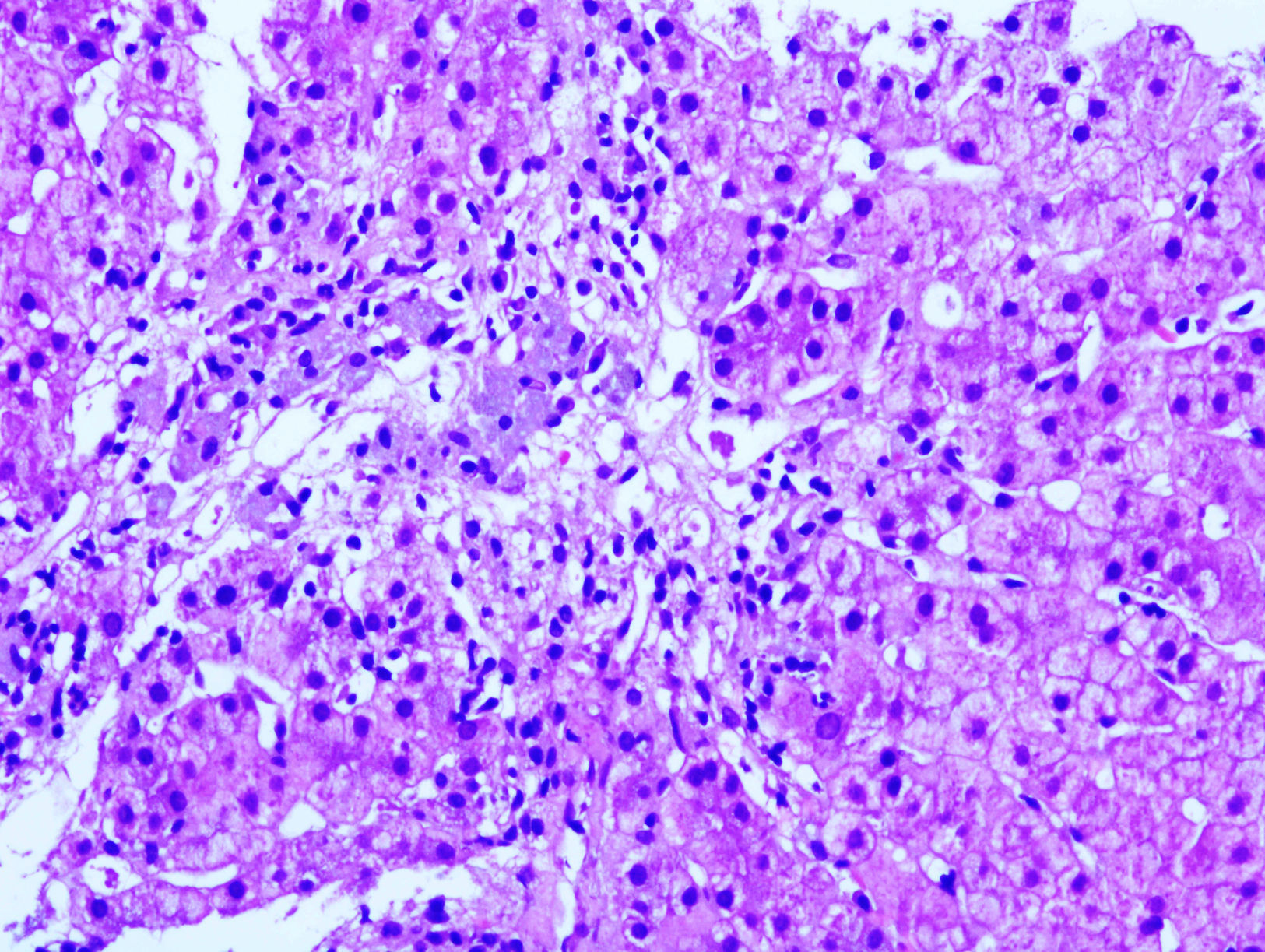
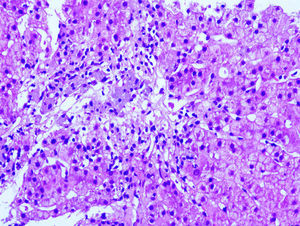
Mujer de 61 años con EMRR en tratamiento con IFNß-1a intramuscular (IFNß-IM) 30μg/semanal durante 10 años (Avonex®) y LX_Trem® (182mg de AV) durante 3 años para el tratamiento del estreñimiento. Acude a urgencias por cuadro de astenia y dolor abdominal. La exploración mostró ictericia cutáneo-mucosa y dolor a la palpación en hipocondrio derecho. La analítica reveló AST 1.236U/l, ALT 824U/l, GGT 169U/l, FA 121U/l, actividad de protrombina 73%. Serologías víricas (hepatitis A, B y C) y estudio de autoinmunidad (ANA, AMA, LKM y ASMA) negativos. La ecografía hepática y el TC toraco-abdominal detectaron esteatosis hepática sin hepatomegalia ni lesiones ocupantes de espacio, y la biopsia hepática (fig. 1) fue compatible con hepatitis tóxica. Debido a la sospecha clínica, tanto el IFNß-IM como el AV fueron retirados. Tres semanas después, la analítica mostró una mejoría de la función hepática, que se normalizó a los 6 meses.
La escala Roussel Uclaf Causality Assessment Method (RUCAM) para este paciente se calificó como probable (7 puntos)5. La reacción farmacológica se comunicó al Centro de Farmacovigilancia de Cataluña.
La alteración hepática más frecuente debida a IFNß es la elevación asintomática de las transaminasas; normalmente es leve y transitoria, y suele ser innecesaria la retirada o el ajuste de dosis del fármaco1. Francis et al. comunicaron que solo un 0,4% de los pacientes que tomaban IFNß lo suspendieron por toxicidad, siendo la tasa de hepatotoxicidad grave de un caso por cada 2.300 pacientes1. La hepatotoxicidad grave y tardía por IFNß, como en nuestro caso es excepcional6,7, y suele ocurrir durante el primer año, siendo infrecuente tras los 6 primeros meses de tratamiento1. Con respecto al tipo de IFNß, la toxicidad es mayor con dosis altas y con mayor frecuencia de administración, siendo rara con la administración semanal2.
La toxicidad hepática por AV es común durante los primeros meses. Solo hemos encontrado un caso de aparición tardía, tras más de 5 años desde el inicio del tratamiento3.
La fisiopatología del daño hepático por IFNß y AV no es conocida. Se cree que el IFNß podría producir hepatotoxicidad por daño directo a los hepatocitos, o por inducción de autoinmunidad frente al hígado1,8; debido a sus propiedades inmunomoduladoras podría desencadenar alteraciones inmunológicas como la hepatitis autoinmune. La toxicidad hepática por AV puede ser debida por toxicidad directa o por hipersensibilidad.
Con relación al sexo, la hepatotoxicidad es más frecuente en varones, pero suele ser más grave en las mujeres. La razón de esta diferencia no es bien conocida, pero se piensa que un menor índice de masa corporal y un mayor grado de adherencia al tratamiento, pueden ser factores predisponentes6.
En nuestro caso, la paciente presentó una hepatitis tóxica tras varios años de tratamiento concomitante con IFNß y AV, la cual se resolvió tras la retirada de ambos fármacos. Debido a que, de forma individual, los 2 pueden provocar toxicidad hepática tardía, y a que el cuadro mejoró tras la retirada de ambos, ninguno puede descartarse como causa. Respecto a la fisiopatología, el estudio de autoinmunidad fue negativo, lo que descarta la hepatitis autoinmune, siendo la etiología tóxica la más probable.
En conclusión, el riesgo de toxicidad hepática por IFNß es mayor cuando se combina con otros fármacos o productos herbales9. Los facultativos que tratan con IFNß a pacientes con EMRR deberían vigilar el uso de terapias concomitantes. Aunque el riesgo es mayor al inicio del tratamiento, la toxicidad hepática también puede aparecer de forma tardía.
FinanciaciónLos autores declaran no haber recibido financiación para la realización de este trabajo.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.