La hemorragia subaracnoidea de la convexidad cerebral (HSAc) consiste en la presencia de un sangrado espontáneo, no aneurismático ni traumático, localizado en los surcos de la convexidad cerebral, cuya etiología es muy variada. Presentamos una serie de 3 casos de HSAc con probable angiopatía amiloidea cerebral (AAC) con clínica sensitiva recurrente que respondió al tratamiento con corticoides.
PacientesCaso 1: varón de 67 años que presenta episodios paroxísticos sensitivos en el hemicuerpo derecho con progresión jacksoniana, episodios sensitivos queiroorales con disfasia motora. Caso 2: varón de 79 años, con trastorno paroxístico sensitivo-motor queirooral izquierdo y disartria. Caso 3: mujer de 71 años, con trastorno paroxístico sensitivo-motor queirooral izquierdo y disartria. Ningún paciente tuvo cefalea ni deterioro cognitivo. Se descartó la presencia de malformaciones aneurismáticas con una angio-RM cerebral.
ResultadosLa tomografía computarizada craneal mostró una hiperdensidad aislada en un surco de la convexidad frontal y la RM encefálica en la secuencia de eco-gradiente mostró depósitos de hemosiderina en dichos surcos y lesiones sugestivas de microsangrados. La RM no mostró atrofia de hipocampos ni temporal medial. En el líquido cefalorraquídeo todos los pacientes tuvieron un descenso del péptido beta-amiloide, valores bajos del índice de Hulstaert y aumento de la proteína tau fosforilada. Todos los pacientes se trataron inicialmente con prednisona y levetiracetam pero los síntomas recurrieron en dos pacientes tras la suspensión de la prednisona.
ConclusionesPresentamos a 3 pacientes con HSAc asociada a AAC, caracterizados por una clínica estereotipada, con ausencia de cefalea y de demencia clínica, con buena respuesta al tratamiento corticoideo.
Convexity subarachnoid haemorrhage (cSAH) is a rare type of spontaneous, non-traumatic, and nonaneurysmal SAH characterised by blood collections in one or more cortical sulci in the convexity of the brain; the aetiology varies. We report a clinical case series of 3 patients with cSAH associated with probable cerebral amyloid angiopathy (CAA) who presented with focal sensory seizures and responded well to corticosteroid treatment.
PatientsCase 1 was a 67-year-old man reporting right-sided paroxysmal sensory episodes with Jacksonian progression, cheiro-oral symptoms, and motor dysphasia. Case 2 was a 79-year-old man reporting left-sided paroxysmal episodes with cheiro-oral signs and dysarthria. Case 3 was a 71-year-old woman also reporting recurrent left cheiro-oral signs and dysarthria. None of the patients had headache or clinical dementia. Aneurysms were ruled out using MR angiography.
ResultsBrain CT scan detected an isolated hyperintensity in a sulcus of the frontal convexity; brain gradient echo T2-weighted MRI sequences showed meningeal haemosiderosis and microbleeds. However, no atrophy was identified in medial temporal lobes including the hippocampal formation. All patients had low levels of beta-amyloid in CSF, low values on the Hulstaert index and high levels of phosphorylated tau protein. Patients were initially treated with prednisone and levetiracetam, but symptoms recurred in 2 patients after prednisone was discontinued.
ConclusionsWe present a series of 3 patients with cSAH associated with CAA, characterised by a stereotypical syndrome responding well to corticoid treatment; there were no cases of headache or clinical dementia.
La denominada hemorragia subaracnoidea de la convexidad (HSAc) cerebral se refiere a la presencia de sangrado subaracnoideo localizado en un surco (o unos pocos adyacentes) de la convexidad cerebral, sin que exista contaminación de las cisuras interhemisféricas, las cisternas de la base o de los ventrículos cerebrales1-5. La etiología es variada, pero varios autores han señalado una diferencia etiológica en relación con la edad de presentación de la hemorragia, de forma que en menores de 60 años predominan los síndromes de vasoconstricción cerebral, y en los mayores de 60 años la causa principal del sangrado es la angiopatía amiloidea cerebral (AAC)1-5. La presentación clínica también está condicionada por la etiología, ya que los pacientes con vasoespasmo cerebral suelen presentar cefalea en trueno y los pacientes con AAC asocian episodios transitorios focales de disfunción neurológica tipo AIT-like o aura-like1-6.
Presentamos una serie de 3 pacientes con HSAc asociada con una probable AAC, valorando la posible implicación de las vías patogénicas del péptido beta-amiloide y de la proteína tau a través de su análisis en el líquido cefalorraquídeo (LCR), caracterizándose la muestra por una clínica neurológica estereotipada, la cual presenta una respuesta inicial excelente al tratamiento corticoideo, pero el pronóstico final es poco favorable por la tendencia a la recurrencia del sangrado intracraneal.
PacientesCaso 1: paciente de 67 años, con antecedentes de hipercolesterolemia, diagnosticado en el año 2005 de AIT y manteniéndose antiagregación con clopidogrel; consulta en noviembre del 2013 por presentar varios episodios de disfunción neurológica consistentes en parestesias hormigueantes peribucales derechas afectando a la hemilengua derecha, saltando a los pulpejos de los dedos de la mano derecha y desde ahí hasta alcanzar al antebrazo u hombro, acompañándose de dificultad para emitir el lenguaje, con una duración de 10 a 15 min y frecuencia de hasta 8 episodios al día. En alguna ocasión la clínica sensitiva progresó al muslo derecho a través del costado. No se acompaña de cefalea ni alteración del nivel de consciencia ni signos meníngeos en la exploración neurológica. Se realizó una TAC craneal que muestra una hiperdensidad en un surco del lóbulo frontal izquierdo y con datos de hemosiderosis superficial en la RM con ecogradiente. La etiología isquémica aguda se descartó con la RM encefálica con secuencias en difusión y la patología aneurismática con una angiografía por RM. Se realizó un electroencefalograma que no demostró actividad epileptiforme. Se inició tratamiento con levetiracetam y dexametasona por vía endovenosa, con cese de los episodios paroxísticos en 24-48 h. La retirada de la dexametasona se acompañó de recurrencia de la clínica, que se mantuvo a pesar de asociar oxcarbacepina y zonisamida al tratamiento, y no se controló hasta introducir el tratamiento con prednisona, lo que permitió la retirada de los fármacos antiepilépticos. A los 4 meses de seguimiento, presentó síntomas sensitivos faciales y en el antebrazo izquierdos en relación con una nueva HSAc localizada en un surco del lóbulo frontal derecho.
Caso 2: varón de 79 años, con antecedentes de dislipidemia y clínica indicativa de AIT (disartria y trastorno sensitivo en las extremidades derechas) el año anterior pero sin recibir tratamiento antiagregante en el momento del ingreso, que consulta en junio del 2014 por episodios paroxísticos de parestesias en la mano izquierda y, posteriormente, en periorales izquierdas afectando la hemilengua izquierda, con dificultad para articular las palabras, con una frecuencia de 3 diarios y una duración entre 2-3 min, sin cefalea asociada ni rigidez de nuca. Se le realiza una TAC craneal que muestra una hiperintensidad en un surco frontal derecho indicativa de HSA y en la secuencia de ecogradiente se aprecia hemosiderosis en surcos frontales de forma bilateral. La etiología isquémica aguda se descartó con la RM encefálica con secuencias en difusión y la patología aneurismática con una angiografía por RM. Se decide iniciar tratamiento con levetiracetam y dexametasona, con cese de los episodios clínicos transitorios. Sin embargo, a las 48 h de la retirada del tratamiento corticoideo, y a pesar de estar bajo tratamiento con levetiracetam, se inicia nuevamente la clínica sensitiva paroxística, que vuelve a responder al tratamiento con prednisona por vía oral.
Caso 3: mujer de 71 años, con antecedentes familiares de una hermana con demencia, un hermano fallecido de hemorragia cerebral y el padre con patología psiquiátrica no especificada, que consulta por presentar desde hacía 2 semanas episodios repetidos de parestesias en facies y mano-antebrazo derechos, con dificultad para agarrar los objetos, y con disartria. No tuvo cefalea, alteración del nivel de consciencia ni signos meníngeos en la exploración. La TAC craneal mostró un foco hiperdenso en un surco frontal izquierdo con importante leucoaraiosis y en la secuencia de ecogradiente se aprecia hemosiderosis en surcos de los lóbulos frontal y parietal izquierdos, y también frontal derecho. También se descartó la posibilidad de una etiología isquémica aguda de pequeño vaso con la RM encefálica con secuencias ponderadas en difusión y la patología aneurismática con una angiografía por RM. Al igual que los casos anteriormente descritos, respondieron al tratamiento con levetiracetam y dexametasona, decidiéndose tratamiento ambulatorio con prednisona 30mg/día durante 2 meses, tras los cuales se repitió la RM encefálica, sin apreciar cambios en las lesiones de la sustancia blanca. A los 6 meses ingresa con una hemorragia frontotemporal izquierda y durante el ingreso presenta una nueva hemorragia parietal derecha, ocurriendo el fallecimiento de la paciente.
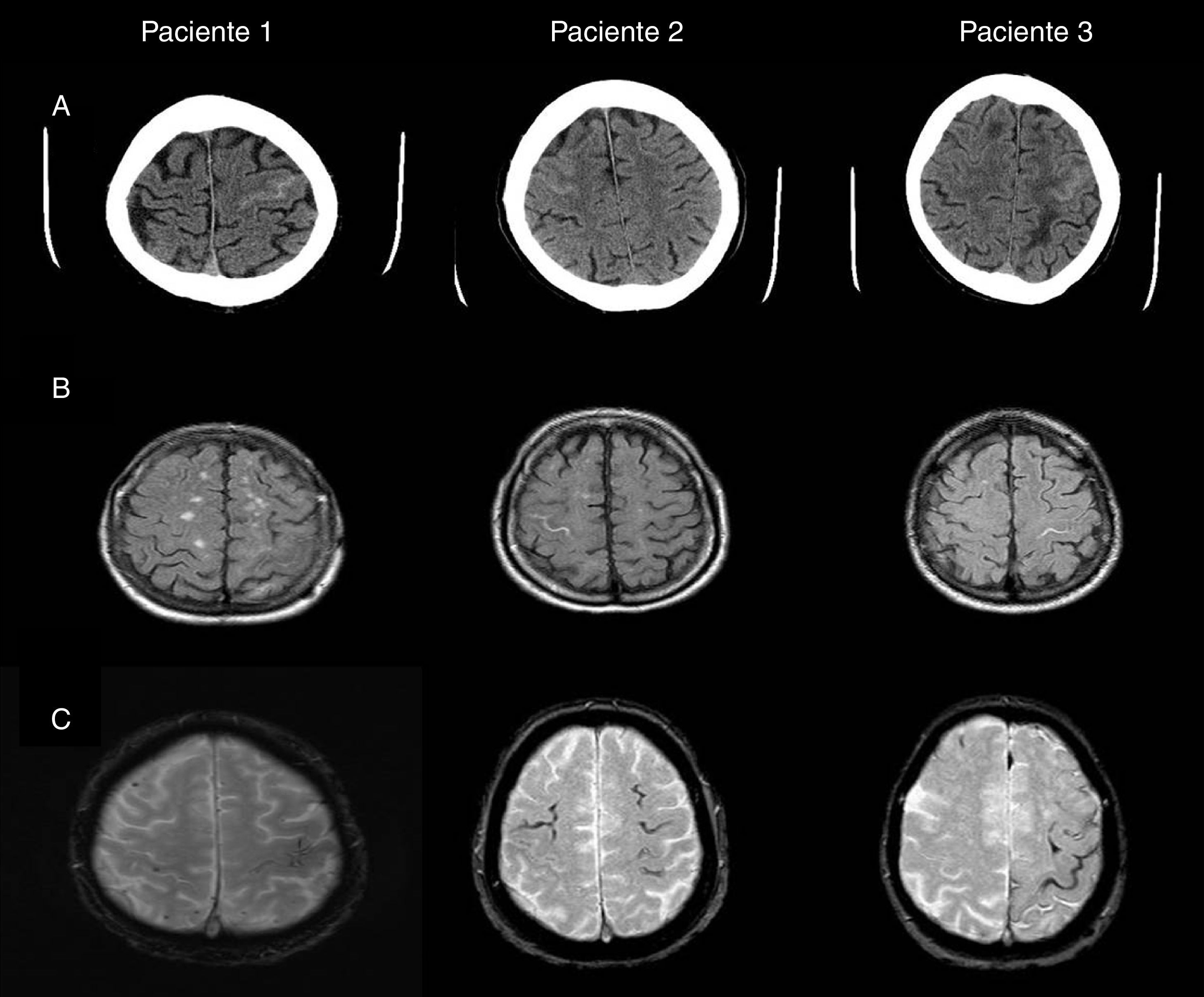
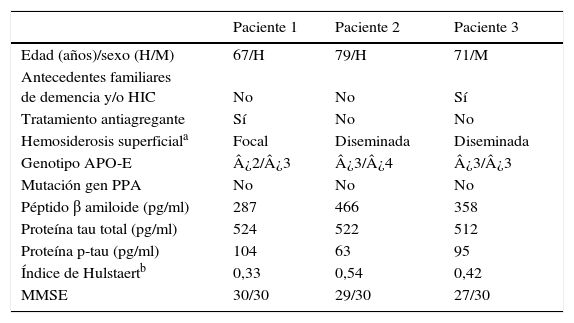
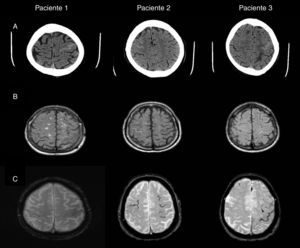
En la figura 1 adjunta se pueden visualizar las imágenes de la TAC craneal y las imágenes de RM encefálica en secuencias FLAIR y eco de gradiente (T2*). En la tabla 1 se resumen los principales datos de las exploraciones complementarias: LCR, genotipo de la apolipoproteína E (APO-E), mutaciones en el gen del péptido precursor del amiloide (PPA) y la presencia de deterioro cognitivo empleando las puntuaciones del Mini Mental State Examination.
A) Imagen de TAC craneal: hiperintensidad en surco de la convexidad frontal correspondiente al sangrado subaracnoideo, frontal izquierdo en el paciente 1 y frontales derechos en los pacientes 2 y 3. B) Imagen de RM en secuencia FLAIR: hiperintensidad intrasurco a nivel del sangrado subaracnoideo visualizado en la TAC. C) Imagen de RM en secuencia ecogradiente: identifica la presencia de microbleeds y de la hemosiderosis superficial.
Variables clínicas y analíticas de los pacientes
| Paciente 1 | Paciente 2 | Paciente 3 | |
|---|---|---|---|
| Edad (años)/sexo (H/M) | 67/H | 79/H | 71/M |
| Antecedentes familiares de demencia y/o HIC | No | No | Sí |
| Tratamiento antiagregante | Sí | No | No |
| Hemosiderosis superficiala | Focal | Diseminada | Diseminada |
| Genotipo APO-E | ¿2/¿3 | ¿3/¿4 | ¿3/¿3 |
| Mutación gen PPA | No | No | No |
| Péptido β amiloide (pg/ml) | 287 | 466 | 358 |
| Proteína tau total (pg/ml) | 524 | 522 | 512 |
| Proteína p-tau (pg/ml) | 104 | 63 | 95 |
| Índice de Hulstaertb | 0,33 | 0,54 | 0,42 |
| MMSE | 30/30 | 29/30 | 27/30 |
La HSAc es una presentación infrecuente de la hemorragia intracraneal pero sus implicaciones pronósticas pueden ser graves, pues aunque se ha reconocido inicialmente un mejor pronóstico que para la HSA aneurismática1, otros estudios recientes no confirman esta hipótesis3,4, y así en nuestros pacientes uno presentó recurrencia de la HSAc en el lóbulo frontal contralateral (con síntomas sensitivos contralaterales) y otro presentó 2 nuevos focos de hemorragia intraparenquimatosa que condicionaron el fallecimiento del mismo. También se ha indicado como evidencia de un mal pronóstico a largo plazo que los ictus isquémicos cerebrales son más frecuentes en los pacientes con AAC4.
A nivel etiológico parece demostrado que las causas son diferentes en función de la edad del paciente, de forma que los menores de 60 años las etiologías implicadas son variadas pero en las que predomina el síndrome de vasoconstricción cerebral reversible2 y también se ha asociado a la presencia de estenosis carotidea bilateral7, y en mayores de 60 años la etiología más frecuentemente implicada es la AAC2-4. A nivel clínico, la presencia de cefalea (cefalea en trueno) se relaciona y orienta la etiología de la HSAc, de forma que su presencia es altamente frecuente en el vasoespasmo cerebral y su ausencia orienta hacia la AAC como causa etiológica5. Dentro de las enfermedades cerebrovasculares, la HSAc debida a AAC es una causa infrecuente, de forma que en un extenso registro etiológico de la enfermedad cerebrovascular aguda en España esta entidad no fue registrada entre las diversas etiologías8.
La presentación clínica de los pacientes fue estereotipada con síntomas predominantemente sensitivos y con una distribución queiroral, paroxísticos, lo que inicialmente sugirió la presencia de AIT de repetición, auras migrañosas o de crisis focales, y en este sentido un paciente presentó un trastorno sensitivo en el hemicuerpo izquierdo con una evidente progresión jacksoniana. Un diagnóstico diferencial obligado es con el síndrome sensitivo puro por lesión vascular isquémica de pequeño vaso y en este sentido los 3 pacientes no mostraron restricción en las secuencias de RM encefálica ponderadas en difusión que indicasen una lesión lacunar capsular o talámica9. Varios autores implican en la presencia de estos síntomas neurológicos focales transitorios a un mecanismo de depresión cortical propagada como ocurre en el aura de la migraña2,4,6. Uno de nuestros pacientes realizó un electroencefalograma pero no se hallaron paroxismos epileptiformes, lo que es también referido por otros autores2,3. Inicialmente nuestros pacientes fueron tratados con levetiracetam y dexametasona, cediendo la clínica paroxística rápidamente, pero en 2 pacientes estos síntomas focales recurrieron tras la retirada del corticoide, aunque nuevamente cedieron tras la reintroducción del mismo. Esto nos hace pensar que estos episodios paroxísticos se tratan de un fenómeno irritativo-inflamatorio que se origina en la corteza cerebral en contacto con el sangrado subaracnoideo y no de AIT ni de verdaderas crisis epilépticas focales. Por otra parte, se ha sugerido que en los pacientes con AAC estos episodios focales recurrentes son un marcador de alto riesgo para la aparición de una hemorragia intracraneal y, por tanto, su presencia en un paciente sin factores de riesgo cardiovascular debe indicar al clínico la posibilidad de una AAC subyacente y realizar un estudio de RM encefálica con secuencias de ecogradiente (T2*) para identificar la presencia de hemosiderosis superficial y de microbleeds característicos de la AAC, y de esta forma evitar el uso de fármacos con efecto antiagregante plaquetario que pueden facilitar el sangrado intracraneal6.
El diagnóstico de hemorragia intracraneal asociada a AAC se basa en los criterios de Boston10, cuya sensibilidad mejora si se añade a los mismos la presencia de hemosiderosis superficial11. La prevalencia de hemosiderosis superficial se detecta en el 60,5% de los pacientes con AAC y la de microsangrados (microbleeds) en el 47,4%9, estando estos relacionados tanto con la localización como con el riesgo de presentar una hemorragia intraparenquimatosa12. Por los criterios de Boston modificados, nuestros pacientes pueden clasificarse como probable HSA debida a AAC. Además, el estudio de los biomarcadores en el LCR apoya el diagnóstico de probabilidad de AAC, ya que es habitual demostrar un descenso en el nivel del péptido beta-amiloide12,13. Nuestros pacientes presentaron conjuntamente un descenso en el nivel del péptido beta-amiloide con un aumento de la proteína tau, es decir, un perfil bioquímico superponible a la enfermedad de Alzheimer, pero ningún paciente cumplía criterios de demencia clínica en el momento de la presentación de la HSAc, aunque este hallazgo nos obliga a realizar un seguimiento clínico buscando el inicio de un posible deterioro cognitivo dada la especificidad de estos biomarcadores para el diagnóstico de la enfermedad de Alzheimer, sobre todo si se asocia con un alelo ¿4 del gen APO-E.
La presencia de un alelo ¿2 o ¿4 del genotipo APO-E confiere un riesgo elevado de sangrado intracraneal lobar14-16, siendo más elevado con las combinaciones ¿4/¿4, ¿2/¿4 y ¿2/¿2, un riesgo intermedio con las combinaciones ¿3/¿4 y ¿2/¿3 y un riesgo bajo con la homocigosis ¿314. A nivel patogénico, el alelo ¿4 se relacionaría con un incremento en la cantidad de amiloide vascular en una forma dependiente de la dosis, incrementando la agregación de beta-amiloide y alterando su aclaramiento, y el alelo ¿2 aceleraría el daño a la pared vascular que daría lugar al sangrando12. Nuestro paciente con el alelo ¿2 presentó recurrencia de la HSAc pero fue la paciente con homocigosis ¿3 y, por tanto, con un aparente menor riesgo, la que presentó las nuevas hemorragias lobares que le ocasionaron la muerte. Un reciente estudio con casos anatomopatológicos de AAC comparando aquellos con hemorragia cerebral y sin ella mostró que la presencia de la misma no se relacionaba con la presencia de enfermedad de pequeño vaso ni con los microbleeds, ni tampoco se obtuvo una significación estadística para la presencia del alelo ¿4 del gen APO-E —que incluso se mostró como protector—, y lo único verdaderamente significativo fue la presencia de hemosiderosis superficial diseminada que se correlacionaba con la presencia de un alelo ¿216. Otro aspecto importante de este trabajo es que los pacientes con AAC sin hemorragia intracraneal presentaban en la anatomía patológica, además de la placas seniles, mayor número de ovillos neurofibrilares y el alelo ¿4 se expresaba en el 87% de los casos, lo que podría implicar un mecanismo patofisiológico diferente en este grupo. Sin embargo nuestros pacientes presentaron tanto descenso del péptido beta-amiloide como un aumento de la proteína tau fosforilada, lo que indica que en ellos ambas vías fisiológicas están implicadas en la patogenia de la AAC.
La forma más común de AAC es la esporádica, con las raras formas familiares, estando asociadas a mutaciones puntuales en el gen PPA localizado en el cromosoma 21. Sin embargo, para las formas esporádicas no se han encontrado mutaciones en dicho gen y no se recomienda el cribado sistemático, excepto si existe una historia familiar de hemorragia intracraneal o de demencia17,18. En este sentido, nuestros pacientes no mostraron mutaciones en el gen del PPA, incluida la paciente 3, con historia familiar de demencia y hemorragia cerebral.
Dado lo pequeño de la serie, no se pueden generalizar conclusiones, pero sí se puede avanzar que la HSAc asociada a AAC no se caracteriza por presentar cefalea ni deterioro cognitivo en grado demencia, la presentación clínica tiende a ser estereotipada con episodios sensitivos y/o motores paroxísticos que responden al tratamiento corticoideo, y el pronóstico a largo plazo no es favorable al poder presentar recurrencias la HSAc o bien presentar una hemorragia intraparenquimatosa amenazante para la vida del paciente.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.