El aumento de homocisteína en sangre constituye un conocido factor de riesgo cardiovascular. Los pacientes epilépticos en tratamiento crónico con fármacos antiepilépticos pueden presentar niveles más elevados de homocisteína y, en consecuencia, un potencial aumento del riesgo cardiovascular.
Material y métodosEstudio observacional de casos y controles para la comparación de los niveles plasmáticos de homocisteína, ácido fólico y vitamina B12.
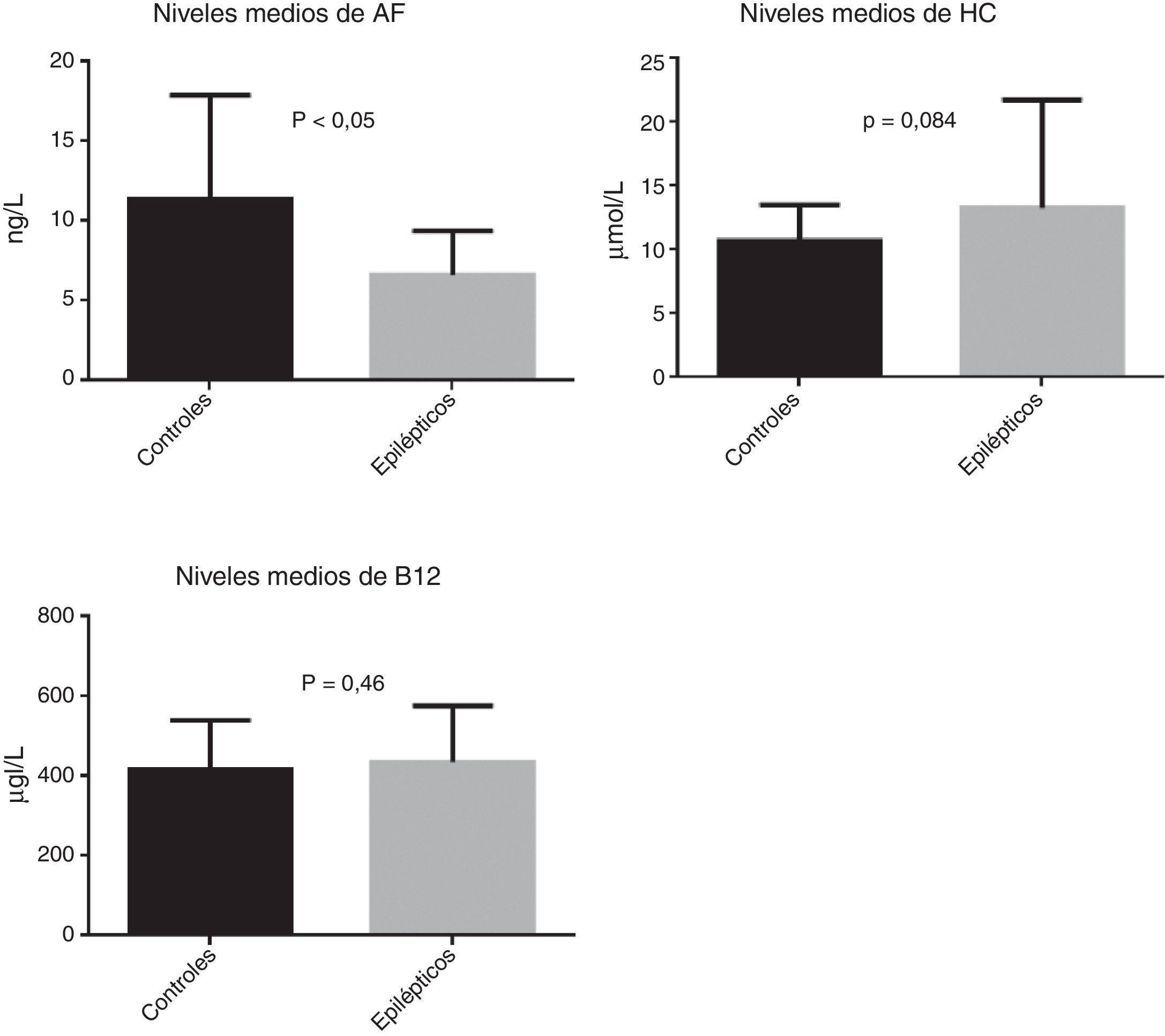
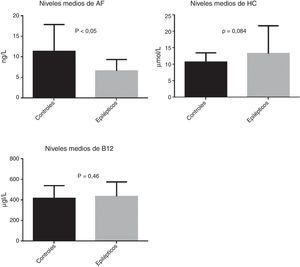
ResultadosSe reclutó a un total de 88 sujetos, 52 de ellos epilépticos y 36 controles. Se observó una tendencia a niveles de homocisteína más elevados (p=0,084) en los pacientes epilépticos y unos valores de ácido fólico más bajos (p<0,05).
ConclusionesPor su potencial efecto como factor de riesgo cardiovascular, es importante prestar atención a los niveles de homocisteína en los pacientes epilépticos en tratamiento crónico con fármacos antiepilépticos y en caso de encontrar niveles elevados sugerimos la instauración de tratamiento específico.
Increased blood homocysteine levels are a known cardiovascular risk factor. Epileptic patients on long-term treatment with antiepileptic drugs may present higher homocysteine levels and, consequently, a potential increase in cardiovascular risk.
Material and methodsWe conducted an observational case-control study to compare plasma levels of homocysteine, folic acid, and vitamin B12.
ResultsOur study included a total of 88 subjects: 52 patients with epilepsy and 36 controls. Epileptic patients showed higher homocysteine levels (P=.084) and lower levels of folic acid (P<.05).
ConclusionHomocysteine levels should be monitored in epileptic patients on long-term treatment with antiepileptic drugs. We suggest starting specific treatment in patients with high homocysteine levels.
La epilepsia supone una de las enfermedades neurológicas crónicas más prevalentes. Se estima que en España existen en torno a 5-10 casos por 1.000 habitantes1. Su tratamiento principalmente se fundamenta en el empleo crónico de fármacos antiepilépticos (FAE), lográndose el control de la enfermedad (ausencia de crisis epilépticas) en un 70% de los casos. Sin embargo, hasta en hasta un 30% de los pacientes no se logra el control de las crisis y constituyen el grupo de la denominada epilepsia farmacorresistente2. Las causas exactas que llevan a esta resistencia a los FAE siguen aún a día de hoy sin conocerse, constituyendo un importante reto para los neurólogos3.
Respecto al tratamiento crónico con FAE, es importante señalar que existen estudios que muestran que los pacientes epilépticos en tratamiento crónico con FAE presentan un riesgo cardiovascular incrementado, en forma de infarto de miocardio, ictus o muerte de origen cardiovascular4, principalmente. Así, distintas líneas de investigación han encontrado elevaciones plasmáticas de diferentes marcadores de riesgo cardiovascular en estos pacientes, tales como la homocisteína.
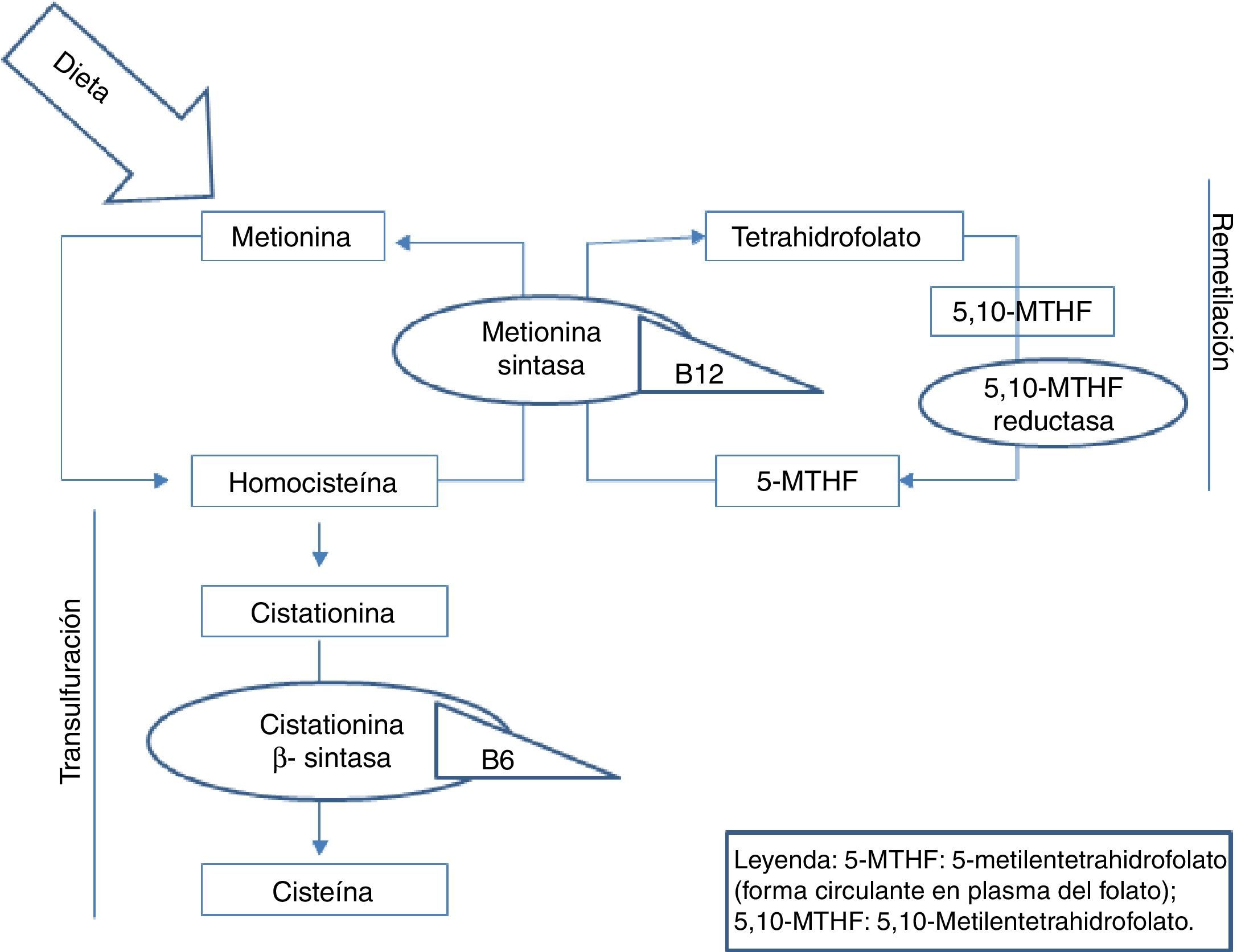
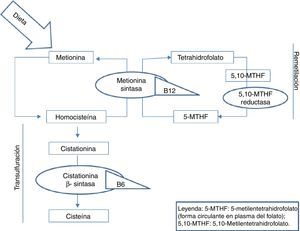
La homocisteína es un aminoácido azufrado, no presente en las proteínas de la dieta, y que se sintetiza exclusivamente en el organismo a partir del metabolismo de la metionina. Este es un aminoácido esencial cuya única fuente es la dieta, principalmente a partir de proteínas animales. La metionina cumple importantes funciones en el mantenimiento del ADN, siendo participante vital en los procesos de metilación del mismo. Una vez ingerida en la dieta, la metionina se metaboliza en el hígado a homocisteína. A partir de este punto, puede seguir 2 vías: la remetilación o la transulfuración5. En ambas vías, como puede verse en la figura 1, resultan importantes para el correcto metabolismo de la homocisteína, las vitaminas del grupo B y el ácido fólico.
La elevación plasmática de los niveles de homocisteína se ha asociado a un incremento del riesgo cardiovascular6. Numerosos estudios epidemiológicos de casos y controles han demostrado que la hiperhomocisteinemia se relaciona con un mayor riesgo de padecer enfermedad vascular cerebral, coronaria y periférica7,8. De manera que la hiperhomocisteinemia constituye un factor de riesgo cardiovascular independiente y además con efecto multiplicativo con otros factores de riesgo, tales como la hipertensión arterial o el tabaquismo. Respecto a los valores a partir de los cuales considerarlos patológicos, aunque existe controversia, actualmente se reconoce que el riesgo aterotrombótico de la homocisteína se ve incrementado a partir de 10μmol/L9,10.
Otro aspecto interesante relacionado con el aumento de la homocisteína plasmática, si bien menos estudiado, es su posible implicación en la epilepsia farmacorresistente. Esta posible asociación ha surgido a partir de estudios de experimentación animal que han demostrado el potencial proconvulsivo de la homocisteína11,12. En el estudio del grupo de Baldelli et al.12, realizado en ratas a las que se les inducia crisis epilépticas, observaban mayor resistencia al tratamiento de las crisis en ratas con niveles elevados de homocisteína. Por otro lado, también encontraban que estas ratas presentaban mayor grado de atrofia cortical. Como conclusión de su estudio, sugería que algo similar podría ocurrir en pacientes epilépticos.
Respecto a las causas que llevan al aumento de la homocisteína en los pacientes epilépticos en tratamiento crónico con FAE, no son del todo conocidas. Se ha postulado que se debe a alteraciones en los niveles de ácido fólico y vitamina B12, ambos constituyentes esenciales del metabolismo de la homocisteína, como señalábamos con anterioridad. Se cree que los FAE interfieren con la absorción intestinal de folato, con el metabolismo de las coenzimas del folato y con el metabolismo de la vitamina B12, alteraciones que llevarían al aumento de la homocisteína13,14. Esta hipótesis se ha visto apoyada por el hecho de que los niveles de homocisteína disminuyen cuando los pacientes epilépticos en tratamiento con FAE reciben suplementos de vitamina B12 y ácido fólico15,16.
Sin embargo, los estudios que han determinado los niveles de ácido fólico y vitamina B12 en pacientes epilépticos en tratamiento crónico con FAE no muestran resultados homogéneos. Trabajos como el del grupo de Linnebank et al.17 encuentran niveles bajos de folatos y vitamina B12. No obstante, otros trabajos, como el publicado por Mintzer et al.18 no encuentran alteraciones en estos parámetros.
Respecto a qué FAE puede provocar este aumento en la homocisteína, se sabe que los FAE clásicos, como la fenitoína, el fenobarbital, el ácido valproico, la primidona y la carbamacepina, son los que mayor susceptibilidad presentan19,20. Sin embargo, en trabajos recientes se ha demostrado que el aumento de la homocisteína también puede verse en pacientes tratados con FAE de nueva generación, tales como oxcarbacepina o topiramato21, entre otros.
Por tanto, son la existencia de estos datos contradictorios acerca de la influencia de los FAE en los niveles de homocisteína, vitamina B12 y ácido fólico, y la posible implicación de estas alteraciones bioquímicas en la farmacorresistencia los principales motivos que nos llevan a investigar qué ocurre en nuestra muestra.
Pacientes y métodosDiseñamos un estudio observacional, de casos y controles, que fueron reclutados en el servicio de neurología del Complejo Hospitalario de Navarra, perteneciente al Instituto de investigación Sanitaria de Navarra (IdiSNA) durante un total de 12 meses.
Los casos eran pacientes mayores de 18 años con diagnóstico de epilepsia en tratamiento crónico, de un mínimo de 2 años, con fármacos antiepilépticos. Los controles eran sujetos mayores de 18 años sin diagnóstico de epilepsia y que no tomaran fármacos antiepilépticos.
Se consideraron criterios de exclusión en ambos grupos la toma de suplementos vitamínicos que contuvieran vitaminas del grupo B o de ácido fólico, así como el diagnóstico de enfermedad o defecto genético del metabolismo del ácido fólico.
El estudio fue aprobado por el Comité de Ética para la Investigación clínica del Complejo Hospitalario de Navarra y todos los pacientes fueron informados del estudio y firmaron el debido consentimiento informado. Posteriormente a la obtención del consentimiento informado, se procedió a la extracción de sangre y a la recogida de la información clínica.
Las variables clínicas se obtuvieron mediante entrevista directa con los participantes en el estudio. Se recogieron en todos los casos variables demográficas, antecedentes patológicos, existencia de factores de riesgo cardiovasculares (hipertensión arterial, diabetes mellitus, dislipidemia y hábito tabáquico) y medicaciones actuales. En el caso de los pacientes epilépticos, se recogieron además cuestiones relacionadas con la evolución de la enfermedad, tales como evolución de la enfermedad, frecuencia de crisis y número de FAE en el momento del estudio. La determinación de las variables bioquímicas se realizó en los laboratorios centrales del Complejo Hospitalario de Navarra, llevándose a cabo las determinaciones de vitamina B12, homocisteína y folato mediante inmunoanálisis quimioluminiscente.
Para el análisis estadístico se empleó el paquete estadístico IBM SPSS Statistic 21. En primer lugar, se realizó un análisis descriptivo de la muestra de estudio y, en segundo lugar, se procedió a la comparación de medias. Para la misma, tras comprobar la normalidad de las variables comparadas mediante el test de Kolgomorov-Smirnov para una muestra, se empleó la prueba de la t de Student para la comparación de medias de variables cuantitativas y la χ2 para la comparación de medias de variables cualitativas. Se consideró estadísticamente significativo un p valor inferior a 0,05.
ResultadosSe reclutó a un total de 88 sujetos, 52 de ellos epilépticos (26 varones y 26 mujeres) y 36 controles (11 varones y 25 mujeres). Las características clínicas de la muestra se recogen en la tabla 1. Respecto a las variables bioquímicas estudiadas, se observaron valores medios más elevados de homocisteína y de vitamina B12 en el grupo de pacientes epilépticos. Al realizar la comparación de medias mediante la prueba de la t de Student, las diferencias en los valores de homocisteína y vitamina B12 no resultaron estadísticamente significativas, aunque en el caso de la homocisteína se observó una tendencia a estar más elevada en pacientes epilépticos (p=0,084). Por otra parte, observamos valores medios descendidos de ácido fólico en el grupo de pacientes epilépticos comparado con los controles (6,6ng/L vs. 11,4ng/L) y esta diferencia resultó estadísticamente significativa al aplicar la prueba t de Student (p < 0,05) (fig. 2).
Dentro del grupo de pacientes epilépticos (tabla 2), analizamos si existían diferencias en los valores medios de las variables bioquímicas recogidas en función de si la epilepsia estaba bien controlada o si eran pacientes farmacorresistentes. A la hora de realizar esta comparación se tuvo en cuenta si entre ambos grupos existían diferencias en cuanto a la distribución de factores de riesgo cardiovascular y en cuanto a la toma de FAE clásicos, sin que se obtuvieran diferencias en la distribución de estos factores entre los 2 grupos de estudio. Obtuvimos valores medios más elevados de homocisteína y más bajos de ácido fólico y vitamina B12 en el grupo farmacorresistente frente al grupo de buen control. No obstante, estas diferencias no fueron estadísticamente significativas (tabla 3).
Características del grupo de pacientes
| n = 52 (26 mujeres/26 varones) |
| Edad media ± DE (años), 41,67 ± 14,28 |
| Control de las crisis |
| 56% buen control |
| 44%: farmacorresistencia |
| N.° de FAE |
| Monoterapia: 43,1% |
| Biterapia: 29,4% |
| Triterapia: 19,6%% |
| Tetraterapia: 7,8% |
| Frecuencia de crisis/mes |
| Ninguna: 58,8% |
| 1-4: 23,5% |
| 5-9: 7,8% |
| Más de 10: 9,8% |
Valores medios variables bioquímicas en función del control de la epilepsia
| Buen control (n=29) | Farmacorresistencia (n=23) | t de Student | |
|---|---|---|---|
| Homocisteína, μmol/L | 11,98±3,31 | 15±12,3 | p=0,21 |
| Ácido fólico, ng/L | 6,85±2,24 | 6,35±3,31 | p=0,52 |
| Vitamina B12, μg/L | 459±152,4 | 405,1±121,5 | p=0,17 |
Los datos se presentan como media ± desviación estándar.
Por último, centrándonos también en el grupo de pacientes epilépticos, estudiamos si existían diferencias en los niveles medios de homocisteína, ácido fólico o vitamina B12 en función de si los pacientes se encontraban en tratamiento con FAE clásicos, bien en monoterapia o en terapia combinada, en comparación con aquellos que no recibían tratamiento con estos fármacos. Nuevamente, sin llegar a encontrar diferencias estadísticamente significativas en los valores medios de ninguno de los parámetros bioquímicos entre ambos grupos, sí que se observaron valores medios más elevados de homocisteína y valores más bajos de ácido fólico y vitamina B12 en los pacientes que reciben FAE clásicos (tabla 4).
Valores medios variables bioquímicas en función de FAE
| FAE 1.° clásicos (n=17) | No FAE 1.° clásicos (n=35) | t de Student | |
|---|---|---|---|
| Homocisteína, μmol/L | 15,08±13,64 | 12,46±4,73 | p=0,31 |
| Ácido fólico, ng/L | 5,34±2,57 | 7,22±2,63 | p=0,21 |
| Vitamina B12, μg/L | 407±150,3 | 449±137,16 | p=0,32 |
Los datos se presentan como media ± desviación estándar
En el presente estudio hemos observado niveles medios de ácido fólico significativamente más bajos en pacientes epilépticos en tratamiento crónico con FAE en comparación con sujetos control. Además, hemos encontrado que los pacientes en tratamiento crónico con FAE presentan niveles medios de homocisteína más elevados, aunque la diferencia no llega a ser estadísticamente significativa (p=0,084).
El nivel de homocisteína más elevado en los pacientes epilépticos que toman FAE está en concordancia con la literatura previa, aunque en alguno de los estudios publicados esta diferencia sí llega a alcanzar significación estadística. Consideramos que la falta de significación en nuestro estudio puede deberse a nuestro menor tamaño muestral, a diferencia de los tamaños de otros estudios similares. Sirvan de ejemplo el presentado por el grupo de Linnebank et al.17, realizado en un total de 2.730 pacientes, o el del grupo de Belcastro et al.21, con una muestra total de 480 pacientes.
Por otra parte, hemos encontrado diferencias estadísticas significativas en los niveles de ácido fólico, siendo más bajos en los pacientes en tratamiento crónico con FAE. Esto se encuentra en concordancia con la hipótesis de que el aumento de homocisteína que se observa en estos pacientes sea consecuencia de la interferencia de los FAE con el metabolismo de la homocisteína, para lo cual resulta fundamental el ácido fólico.
El valor descendido de ácido fólico en pacientes epilépticos en tratamiento crónico con FAE se ha descrito en varios trabajos22,23. Algunos de estos trabajos abogan por su corrección con suplementos de ácido fólico como manera que corregir los niveles de homocisteína. Basan esta decisión en la inocuidad del tratamiento con ácido fólico junto con el potencial riesgo cardiovascular que la hiperhomocisteinemia confiere24,25.
Sin embargo, no está demostrado hasta qué punto esta medida disminuye el riesgo cardiovascular. Se necesitan nuevos estudios con diseño prospectivo que aporten más datos al respecto; no obstante, en espera de los mismos, no se considera una mala práctica el administrar suplementos cuando se detecten valores bajos de ácido fólico en estos pacientes.
Por último, en cuanto a la comparación dentro del grupo de epilépticos, no hemos encontrado trabajos en la bibliografía dirigidos directamente a investigar esta comparación. En nuestro estudio, sin llegar a la significación estadística, se observaron niveles medios mayores de homocisteína en los pacientes en tratamiento con FAE clásicos y también en pacientes con epilepsia farmacorresistente. A pesar de no obtener la significación estadística, consideramos de importancia el hallazgo de esta mayor tendencia a niveles mayores de homocisteína en estos 2 subgrupos.
Por un lado, en el caso de mayores niveles de homocisteína en pacientes tomadores de FAE clásicos, sobre la base de la tendencia encontrada en nuestro trabajo, en caso de confirmarse nuestros resultados en un estudio futuro con mayor tamaño muestral, podría sugerirse evitar estos FAE en aquellos pacientes epilépticos que además presenten otros factores de riesgo cardiovascular.
De este modo, al menos de manera teórica, evitaríamos un aumento del riesgo de presentar enfermedad cardiovascular.
Respecto a la tendencia a mayores niveles de homocisteína en pacientes con epilepsia farmacorresistente, los hallazgos nos resultan interesantes, puesto que en una reciente publicación del grupo de Bochynska et al.16, se comenta la posible relación entre homocisteína elevada y peor evolución de la epilepsia. Es cierto que únicamente es una idea vertida sin realizar en su trabajo más investigaciones en ese sentido y que justifican por el conocido, a partir de trabajos de experimentación animal, potencial proconvulsivo de las altas concentraciones de homocisteína, pero que resalta esta posible relación.
Los datos de nuestro estudio tampoco permiten realizar más afirmaciones en este sentido, pero se presentan como una buena línea de investigación, especialmente teniendo en cuenta que el aporte de suplementos de ácido fólico ayuda, prácticamente sin efectos secundarios, a disminuir los niveles de homocisteína.
En conclusión, a pesar de la debilidad de nuestro pequeño tamaño muestral, los resultados obtenidos en el estudio nos alertan a prestar atención a los niveles de homocisteína y ácido fólico en los pacientes epilépticos que tratemos, especialmente en aquellos pacientes con riesgo cardiovascular elevado y con epilepsia farmacorresistente. De manera que deberemos poner todo nuestro interés por evitar factores que favorezcan este aumento y, en caso necesario, instaurar las medidas terapéuticas necesarias para aminorar los potenciales efectos nocivos de la hiperhomocisteinemia.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Trabajo presentado parcialmente como póster en la sección epilepsia, en la LXVII Reunión anual de la SEN (noviembre del 2015).