El virus del herpes simple tipo I (VHS-I) es la causa más frecuente de encefalitis en el mundo1. Su curso es habitualmente monofásico, pero el 12-27% desarrollan recurrencia clínica tras el episodio inicial pese a tratamiento antimicrobiano adecuado2,3. En algunos casos el empeoramiento es debido a reactivación viral, pero en la mayoría la PCR de herpesvirus en líquido cefalorraquídeo (LCR) es negativa y el tratamiento con aciclovir resulta ineficaz2,4. En los últimos años se ha demostrado la relación entre encefalitis herpética (EH) y el posterior desarrollo de una encefalitis inmunomediada (EI) que podría condicionar la recurrencia clínica5,6. Presentamos un caso de EI tras EH.
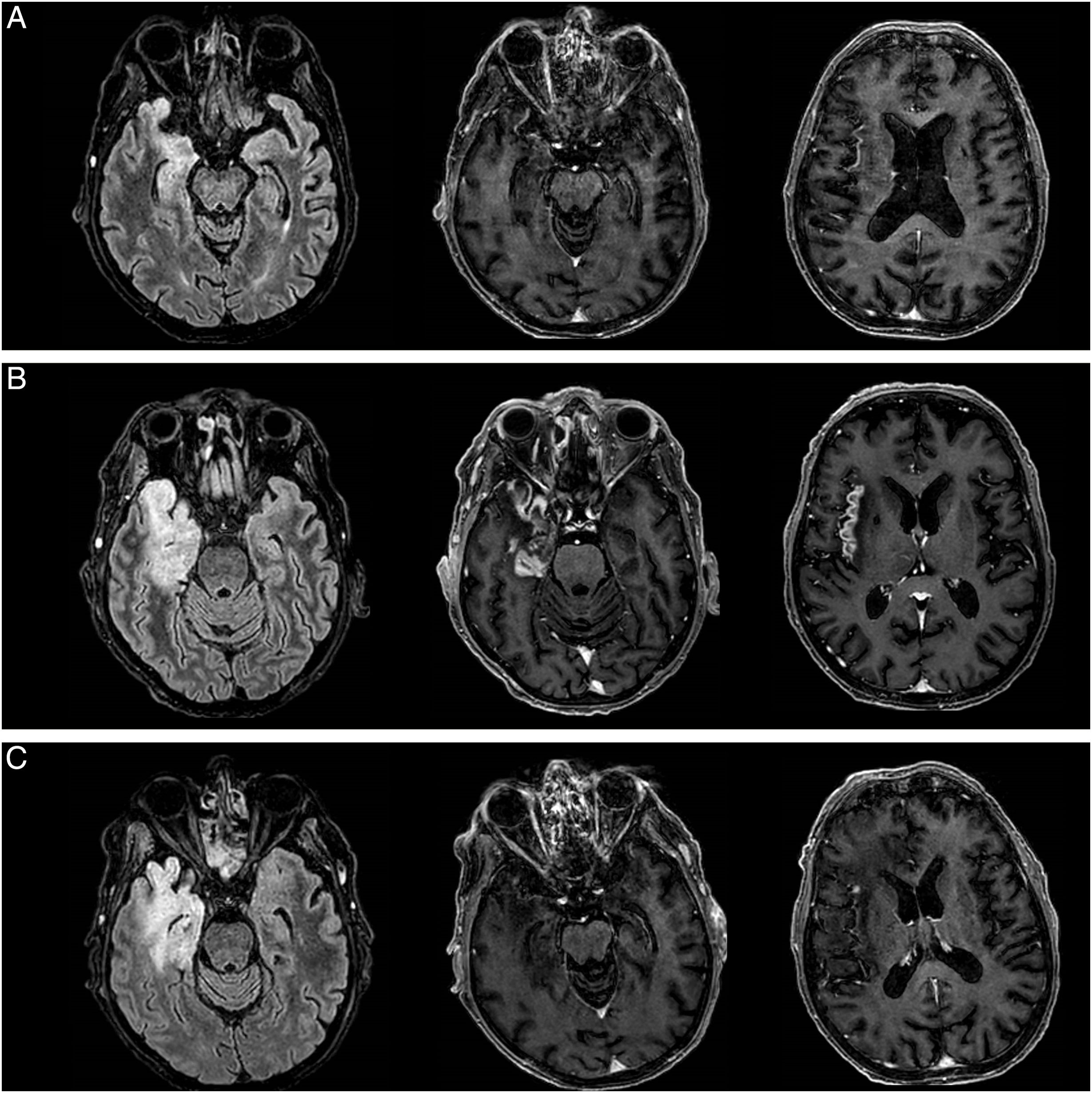
Varón de 59 años con carcinoma epidermoide hipofaríngeo tratado con radioterapia. Ingresa por fiebre, confusión y crisis epilépticas. El análisis de sangre fue normal. La resonancia magnética (RM) encefálica evidenció una hiperintensidad témporo-insular derecha con leve captación de contraste (fig. 1A). La citobioquímica de LCR fue normal y el estudio microbiológico detectó una PCR positiva para VHS-I. Con diagnóstico de EH, se trató con aciclovir intravenoso durante 21días y levetiracetam, alcanzándose recuperación completa. Cuatro semanas después ingresó en la unidad de cuidados intensivos por crisis epilépticas refractarias a cinco fármacos antiepilépticos (FAE). Se reinició aciclovir intravenoso sin objetivarse mejoría, y se indujo coma barbitúrico por empeoramiento de las crisis comiciales. El electroencefalograma (EEG) fue compatible con estado epiléptico y un nuevo análisis de LCR mostró leve pleocitosis linfocítica y una PCR para herpesvirus negativa. La determinación de anticuerpos de encefalitis autoinmune en LCR y suero resultó negativa. Se realizó una nueva RM encefálica (fig. 1B), que demostró aumento del edema y de la captación de contraste témporo-insular derecho. Con sospecha de EI tras EH, se instauró tratamiento inmunomodulador con megadosis de metilprednisonola intravenosa. Ante una discreta mejoría, se intensificó el tratamiento con plasmaféresis durante 7sesiones. El EEG tras la inmunoterapia fue normal y la RM encefálica de control (fig. 1C) evidenció disminución del edema y la captación de contraste. La evolución clínica fue favorable, sin nuevas crisis y con recuperación de la situación cognitiva previa.
Comparación de los hallazgos en resonancia magnética durante la encefalitis herpética (A), la recidiva por encefalitis autoinmune (B) y tras el tratamiento inmunomodulador (C). Evolución del edema en lóbulo temporal derecho —secuencia FLAIR— (izquierda) y de la captación de contraste leptomeníngeo en lóbulo temporal (centro) e ínsula (derecha).
Ante una recurrencia clínica tras EH se recomienda repetir la PCR de VHS-I en LCR. Una vez descartada la reactivación viral es preciso valorar la etiología inmunomediada4,7. La EI aparece habitualmente en los dos meses siguientes a la EH, aunque se han reportado casos de aparición tardía3,6. Clínicamente es superponible a la EH, y la afectación más frecuente es el bajo nivel de consciencia, los cambios neuroconductuales y las crisis comiciales, en ocasiones, refractarias3. Ante la sospecha de esta entidad, se recomienda la determinación de anticuerpos antineuronales en LCR y suero. Los que se detectan con mayor frecuencia son los dirigidos contra el receptor de N-metil-D-aspartato (NMDA), presentes hasta en el 64% de los casos3. Otros autoanticuerpos, como anti-GABABR, AMPAR y dopamina-2R también aparecen de forma infrecuente8. En la mayoría de los laboratorios clínicos las pruebas de detección de anticuerpos antineuronales se realizan rutinariamente a través de kits comerciales basados en inmunofluorescencia indirecta en células transfectadas que expresan los antígenos de superficie celular más comunes. Estos kits han mostrado una baja sensibilidad en la detección de autoanticuerpos, con tasas de falsos negativos entre el 12 y el 18%9-11. En la EI tras EH, hasta en el 36% de los casos el resultado de los kits es negativo7,8. Una causa frecuente de falsos negativos es la omisión de antígenos infrecuentes o recientemente descubiertos10-12. Sin embargo, hasta en el 50% de falsos negativos se detectan anticuerpos habitualmente incluidos en los kits tras reevaluación de las muestras en laboratorios especializados mediante técnicas de inmuhistoquímica en tejido murino (IHC) y confirmación posterior con ensayos basados en células (CBAs) y Western-Blot9-11,13. Estos errores son más frecuentes en LCR que en suero y se han relacionado principalmente con anticuerpos contra LGI1, GABABR y AMPAR10-12,14. Por tanto, los resultados negativos en los kits comerciales no excluyen el diagnóstico, y ante una alta sospecha clínica, se recomienda realizar estudios de IHC y CBAs en laboratorios especializados7-13. Los hallazgos de neuroimagen también pueden ayudar al diagnóstico. La RM encefálica durante la recurrencia inmunomediada muestra aumento de edema y captación de contraste leptomeníngeo en la mayoría de los casos, que disminuye o desaparece tras inmunoterapia3,6. Estos hallazgos radiológicos se han sugerido como potenciales biomarcadores de recidiva autoinmune6, y podrían ayudar al diagnóstico, en especial en casos seronegativos.
FinanciaciónLa presente investigación no ha recibido ayudas específicas provenientes de agencias del sector público, sector comercial o entidades sin ánimo de lucro.
Conflicto de interesesNo hay conflictos de intereses.