La diana habitual empleada para el tratamiento quirúrgico del temblor es el núcleo ventralis intermedius (Vim) del tálamo. Su localización es compleja, ya que no se puede visualizar con métodos de imagen convencionales, por lo que para el procedimiento quirúrgico se toman clásicamente medidas indirectas y se correlacionan con la clínica y neurofisiología intraoperatorias. Sin embargo, procedimientos ablativos actuales como la talamotomía por gamma-knife o por ultrasonidos (MRgFUS) hacen que sea preciso buscar otras alternativas para su localización. El objetivo del presente trabajo es comparar la localización indirecta del Vim mediante técnica esterotáctica con la realizada directamente por tractografía para el tratamiento del temblor.
DiscusiónLa definición citoarquitectónica más empleada del Vim es la del atlas de Schaltenbrand-Wahren. Existe un límite claro entre el tálamo motor y el sensitivo; las neuronas del Vim responden a movimientos pasivos articulares y su actividad es sincrónica con el temblor periférico. Las coordenadas estereotácticas del Vim más frecuentemente utilizadas se basan en mediciones indirectas respecto a la línea intercomisural y el III ventrículo, las cuales dependen de variaciones interindividuales. Estudios recientes han propuesto el haz dentatorrubrotalámico como una diana óptima para el control del temblor, postulando que se asocia a una mejoría clínica; sin embargo, esto no ha sido corroborado por otros autores.
ConclusionesLa visualización de la vía cerebelorrubrotalámica por tractografía puede ayudar a definir la localización del Vim. Esta técnica tiene limitaciones inherentes y sería necesaria una estandarización del método para lograr resultados más precisos. La posible mayor utilidad de la diana por tractografía, directa, sobre la indirecta queda por demostrar a largo plazo en pacientes con temblor.
The ventralis intermedius (Vim) nucleus of the thalamus is the usual surgical target for tremor. However, locating the structure may be difficult as it is not visible with conventional imaging methods; therefore, surgical procedures typically use indirect calculations correlated with clinical and intraoperative neurophysiological findings. Current ablative surgical procedures such as Gamma-Knife thalamotomy and magnetic resonance-guided focused ultrasound require new alternatives for locating the Vim nucleus. In this review, we compare Vim nucleus location for the treatment of tremor using stereotactic procedures versus direct location by means of tractography.
DiscussionThe most widely used cytoarchitectonic definition of the Vim nucleus is that established by Schaltenbrand and Wahren. There is a well-defined limit between the motor and the sensory thalamus; Vim neurons respond to passive joint movements and are synchronous with peripheral tremor. The most frequently used stereotactic coordinates for the Vim nucleus are based on indirect calculations referencing the mid-commissural line and third ventricle, which vary between patients. Recent studies suggest that the dentato-rubro-thalamic tract is an optimal target for controlling tremor, citing a clinical improvement; however, this has not yet been corroborated.
ConclusionsVisualisation of the cerebello-rubro-thalamic pathway by tractography may help in locating the Vim nucleus. The technique has several limitations, and the method requires standardisation to obtain more precise results. The utility of direct targeting by tractography over indirect targeting for patients with tremor remains to be demonstrated in the long-term.
El ventralis intermedius (Vim) del tálamo es el núcleo escogido habitualmente para el tratamiento quirúrgico del temblor, ya que tanto el temblor esencial como el parkinsoniano, así como otros tipos de temblor, mejoran de forma significativa abordando esta diana tanto con técnicas lesivas (como la talamotomía por radiofrecuencia) como con estimulación cerebral profunda (ECP). El Vim es una diana compleja, ya que en el tálamo hay muchos núcleos que no se pueden visualizar con las técnicas de imagen convencionales como la resonancia magnética (RM) de alto campo. La localización de la diana por procedimientos indirectos (como la clásica medición de la línea intercomisural) puede ser imprecisa en las nuevas técnicas no invasivas en cirugía funcional para el temblor refractario —como el gamma-knife o el MRgFUS (magnetic resonance guided focused ultrasound), debido a variaciones individuales. Hoy día, con la mejora de las técnicas de imagen, la posibilidad de localizar los tractos de sustancia blanca permite que la tractografía ayude a definir la diana talámica.
En la actualidad se desconoce si esta nueva tecnología es lo suficientemente exacta para localizar la diana elegida y si es la misma que tras un registro fisiológico. En el artículo se describe la localización del Vim por el procedimiento indirecto clásico (mediante la línea intercomisural) y por el método directo de tractografía. También se discute brevemente la diferencia entre ambos procedimientos.
DiscusiónTálamo motorEl tálamo motor se define como el territorio que recibe proyecciones subcorticales de los ganglios basales (nigrales y palidales) así como cerebelosas y las proyecta sobre el área motora primaria, área suplementaria y el córtex premotor. Está limitado medialmente por la lámina medular interna, posteriormente por aferencias somatosensitivas y lateralmente por la cápsula interna1.
El tálamo motor está situado en el tercio lateral y ventral, mientras que la porción dorsal y lateral recibe fibras de asociación intratalámicas y no recibe otras aferencias que no sean del propio tálamo; por tanto, son núcleos considerados como de integración.
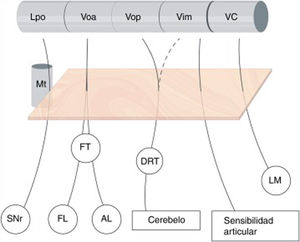
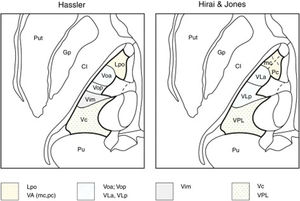
La subdivisión del tálamo motor humano siempre ha sido compleja, ya que desde el punto de vista citoarquitectónico puede variar. Esto ha hecho que la nomenclatura de los diferentes núcleos y las aferencias no sea uniforme. El atlas más utilizado en cirugía es el de Schaltenbrand-Wahren2 que sigue la nomenclatura de Hassler a partir de tinciones de mielina. De rostral a caudal para Hassler los núcleos más importantes del tálamo motor serían el lateropolaris (Lpo), que recibe aferencias nigrales; el ventralis oralis anterior (Voa), que recibe aferencias palidales (globo pálido interno); el ventralis oralis posterior (Vop), que recibe aferencias cerebelosas; el Vim, que recibe aferencias profundas de las articulaciones y, por último, el ventro caudalis (VC), que recibe aferencias del lemnisco medial y trigeminal, así como haces espinotalámicos3 (fig. 1).
Subdivisión del tálamo motor y sus aferencias. Se ilustran las conexiones aferentes al tálamo ventral. Nótese que dichas proyecciones atraviesan el área subtalámica posterior – recuadro naranja-, y están íntimamente relacionadas con el haz mamilotalámico en su parte más anterior. No existe una clara división de las aferencias cerebelosas que llegan a través del tracto dentato-rubro-talámico hacia Vop y Vim, mientras que la frontera entre tálamo motor y sensitivo (VC) está bien delimitada. AL: Ansa Lenticularis; DRT: Tracto Dentato-rubro-talámico; FL:Fasciculus Lenticularis; FT: Fasciculus Thalamicus; LM: Lemnisco Medial; Lpo: Lateropolaris; Mt: Haz mamilo-talámico; SNr: Sustancia nigra pars reticulata; VC: Ventro Caudalis; Vim: Nucleus Ventralis intermedius; Voa: Ventralis oralis anterior; Vop: Ventralis oralis posterior.
El Vim es la diana del temblor empleada habitualmente para pacientes refractarios a tratamientos médicos desde la era prelevodopa hasta la actualidad. Tiene una forma de estrecho paralelogramo, con una altura de 8-9 mm y una anchura de 3-3,5mm rostrocaudal en su parte más lateral y de 2mm en la porción medial. Presenta una clara somatotopía, con la cara y lengua en una localización medial, la extremidad superior más lateral y la inferior en el extremo lateral, próxima a la cápsula interna4,5.
Para otros anatomistas como Hirai y Jones, basándose en tinciones histoquímicas de acetilcolinesterasa, el tálamo ventral estaría subdividido en ventral anterior, ventral lateral y ventral posterior. El ventral anterior se subdivide a su vez en porción magnocelular (aferencias nigrales) y parvocelular (palidales). El ventral lateral, a su vez, se subdivide en ventral lateral anterior, que recibe aferencias palidales desde el fascículo talámico y en ventral lateral posterior, que recibe proyecciones cerebelosas. La parte anterior del ventral posterior lateral recibe proyecciones lemniscales de la sensibilidad profunda y, la parte posterior, sensibilidad superficial de las fibras lemniscales6,7 (tabla 1).
Nomenclatura del tálamo ventrolateral humano, según Hassler y Hirai y Jones
| Hassler | Hirai y Jones | Aferencias |
|---|---|---|
| Lpo | VA mc pca | SNr |
| Voa | VLa | GPia |
| Vop | VLp | Cerebelo |
| Vim | - | Sensibilidad de articulaciones |
| VC | VPLa VPLp | Lemnisco medial (sensibilidad profunda)Lemnisco medial (sensibilidad táctil) |
GPi: globus pallidus internus; Lpo: lateropolaris; mc: pars magnocelularis; pc: pars parvocelularis; SNr: sustancia nigra pars reticulata; VA: ventral anterior; VC: ventro caudalis; Vim: ventralis intermedius; VLa: ventral lateral anterior; VLp: ventral posterior; VOA: ventralis oralis anterior; Vop: ventralis oralis posterior; VPLa: ventral posterior lateral, parte anterior; VPLp: ventral posterior lateral, parte posterior.
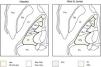
Macchi y Jones relacionaron las diferentes nomenclaturas que existen entre los distintos autores y sus discrepancias. Así, para Jones, el Voa y el Vop de Hassler no serían núcleos independientes, ya que ambos recibirían aferencias palidales y cerebelosas sin una clara individualización, por lo que sendos núcleos formarían parte de uno único: el ventral lateral anterior. El Vim de Hassler, que incluye neuronas con respuesta a movimientos pasivos articulares contralaterales, sería parte del ventral lateral posterior de Hirai y Jones, que recibiría aferencias cerebelosas y no la información sensitiva de las articulaciones (spindle afferents), mientras que para Hassler las aferencias cerebelosas proyectan sobre el Vop7. También existirían diferencias entre ambos autores respecto a las terminaciones lemniscales con aferencias kinestésicas o sensibilidad profunda, ya que las primeras proyectarían sobre la parte anterior del ventral posterior lateral (aferencias lemnisco medial profundas) y la parte posterior del ventral posterior lateral recibiría inputs táctiles, mientras que para Hassler todo estaría incluido en el VC (tabla 1, fig. 2).
Representación de las nomenclaturas del tálamo motor. Se ilustra la nomenclatura según Hassler (izquierda) y Hirai & Jones (derecha) en el plano axial. Nótese cómo difiere la denominación de los núcleos dentro de una misma región anatómica: Lpo y VA (punteado); Voa, Vop, VLa y VLp (rayas); Vim (gris); Vc y VPL (cruces). Gp: Globus pallidus; Lpo: Lateropolaris;VA: Ventral anterior (mc: pars magnocelularis; pc: pars parvocelularis);VC: Ventro Caudalis; Vim: Ventralis intermedius; VLa: Ventral Lateral anterior; VLp: Ventral Lateral posterior; Voa: Ventralis oralis anterior; Vop: Ventralis oralis posterior; VPL: Ventral Posterior Lateral.
Como se ha comentado, el grado de overlapping entre las aferencias es controvertido, ya que no existiría ninguno entre cerebelo y el lemnisco medial, pero entre aferencias palidales y cerebelosas puede existir cierta interdigitación, como ocurre en el ventral lateral anterior8.
Por lo expuesto, es difícil concluir la localización del Vim en el humano. Invariablemente estaría localizado anterior a la región que recibe la sensibilidad táctil, pero en este contexto se puede contemplar como una estructura del VC, ya que recibiría sensibilidad profunda de las articulaciones y, por tanto, podría ser un núcleo sensitivo. O bien podría relacionarse como la aferencia más caudal del Vop, en donde se recibe esta sensibilidad de las articulaciones contralaterales, que estaría localizada en la porción posterior de la aferencia cerebelosa7,9,10.
El borde entre el Vim y el VC es una referencia capital entre el tálamo motor y sensitivo en la cirugía talámica y únicamente se diferencia con registro neurofisiológico.
Dianas para el temblor en cirugía funcionalLa palidotomía era la cirugía de elección para pacientes con enfermedad de Parkinson durante los años 50 del siglo pasado, tanto tremóricos como rigidoacinéticos11. Hassler fue el primer autor que realizó una talamotomía sobre las aferencias palidales en el tálamo, desplazando la diana desde el globo pálido interno, pero los pacientes no mejoraron significativamente12. La mayoría de los neurocirujanos realizaron lesiones localizadas más caudales en el tálamo, ya que los resultados eran mejores respecto al temblor y, sobre todo, desde que en los años 60 se comenzó con el registro fisiológico13,14. Se comprobó que las neuronas tremóricas (neuronas que descargan con la misma frecuencia que el temblor de las extremidades contralaterales) se encontraban donde llegaban las proyecciones cerebelosas, Vop y Vim. Desde entonces, el Vim ha sido considerado como la mejor diana para tratamiento del temblor de distintas enfermedades15,16. En el Vim se inició también la estimulación cerebral profunda (ECP) para pacientes con temblor tanto por enfermedad de Parkinson como temblor esencial17. Los resultados de los estudios mostraron un gran beneficio clínico en las escalas de evaluación del temblor, así como una reducción de efectos adversos con las técnicas de estimulación sobre las de lesión18.
Otros autores, como alternativa a la diana del Vim, seleccionaron la zona incerta y el área subtalámica posterior, realizando lesiones que se conocieron como campotomías19,20, aunque el riesgo de inducir una disquinesia era más alto que con la cirugía talámica. Recientemente la zona incerta y el área subtalámica posterior se han propuesto como dianas para ECP, como una alternativa al Vim del tálamo, con buenos resultados clínicos tanto para temblor esencial como parkinsoniano. La diana del área subtalámica posterior se puede visualizar en la RM en T2; no así el Vim, que obliga a registrar la actividad para conocer la diana específica21-24. Las principales proyecciones o fascículos que atraviesan el área subtalámica posterior son la zona incerta, las radiaciones prelemniscales (fibras desde la formación reticular que proyectan al tálamo y el haz cerebelorrubrotalámico, que va desde el núcleo dentado hasta el Vop), el fascículo lenticular y el fascículo talámico, con proyecciones desde el globo pálido interno hasta el Voa, pasando mediales y dorsales al núcleo subtalámico y anteriores al núcleo rojo3,24-26.
Recientemente un estudio clínico ha comparado pacientes tratados con estimulación en ambas dianas, Vim o el área subtalámica posterior, con un seguimiento de 4 años. Los resultados mostraron beneficios para ambos grupos de pacientes (p <0,05). Las mejorías en el temblor en ambas dianas entre los 6 meses y los 2 años eran estadísticamente similares, pero a los 3-4 años post-ECP, el seguimiento mostró mejorías para el grupo de pacientes tratados con el Vim (p <0,01)27.
Definición electrofisiológica del núcleo ventralis intermediusDesde el punto de vista anatómico, el Vim no se define bien en la RM porque no se llega a visualizar28-30, pero mediante la neurofisiología su localización es más clara. Las neuronas que responden principalmente a movimientos voluntarios o activos de las articulaciones contralaterales corresponderían al Vop, mientras que las neuronas del Vim están localizadas más posteriores, responden a movimientos pasivos (realizados por el explorador) y están localizadas a unos 2mm anteriores a las neuronas sensitivas táctiles5,31-35. Estas neuronas tienen una actividad espontánea de gran amplitud con descargas tónicas o fásicas en respuesta a los movimientos de las articulaciones, así como a la presión sobre los músculos contralaterales, sin respuesta a estímulos táctiles. Las neuronas que reciben las aferencias de las articulaciones se conocen como neuronas kinestésicas y están probablemente localizadas en el Vim, aunque esto nunca se ha comprobado en humanos. Para algunos autores existiría un overlapping entre las neuronas que responden a movimientos voluntarios y las que lo hacen a los pasivos (neuronas kinestésicas) sobre todo en el Vop/Vim36, pero no así entre las kinestésicas y las táctiles, que muestran 2territorios muy compartimentalizados: el motor y el sensitivo bien definidos. En el Vim existe también una somatotopía con las neuronas de la cara medial y de las extremidades lateralmente, aunque según Tasker la somatotopía sería menos exquisita que en la zona sensitiva táctil correspondiente al VC 37.
En pacientes con temblor, las neuronas kinestésicas se disparan sincrónicamente al mismo ritmo del temblor periférico contralateral y se conocen como neuronas tremóricas. Estas neuronas se registran en el Vim, aunque también pueden registrarse en menor grado en el Vop y en el VC. Podría tratarse de las mismas unidades, ya que, al hacer un movimiento voluntario, la actividad tremórica desaparece y el temblor, también5,32. Esta localización fisiológica es anterior a las neuronas cutáneas con respuesta, nos indica la localización del Vim y predice una buena respuesta en la supresión del temblor, tanto por técnicas ablativas como por estimulación33.
La incidencia del registro de neuronas tremóricas es variable con relación a la fisiopatología de temblor. Así, en pacientes con temblor de reposo en la enfermedad de Parkinson, el número de neuronas tremóricas registradas es 3veces mayor que en pacientes con temblor esencial y 5veces más que en pacientes con temblor en el contexto de una esclerosis múltiple o de temblores de tipo cerebeloso. Sin embargo, la localización anatómica de las neuronas es en la misma región fisiológica, entre 1-2mm anterior al borde táctil38. Para Lenz et al. las neuronas tremóricas estarían como un clúster, rostrales a la sensibilidad táctil y a unos 3,5mm por encima de la línea intercomisural39. Esto no ha sido ratificado por otros autores, que encontraron con registro de potencial de campo (local field potential) grupos tremóricos específicos y diferentes topográficamente para pacientes con Parkinson o con temblor esencial en el Vop40.
Coordenadas estereotácticas del núcleo ventralis intermediusClásicamente la localización del Vim se realiza por métodos indirectos mediante el cálculo de sus coordenadas esterotácticas. La dificultad para visualizar el Vim con las técnicas de imagen convencionales puede deberse a la falta de láminas entre los distintos núcleos del tálamo41, lo cual puede llevar a una falta de precisión en su localización. Los núcleos del tálamo están muy relacionados con las estructuras mediales, como el III ventrículo y la línea intercomisural, aunque la longitud de la línea o bien la anchura del III ventrículo pueden hacer variar su posición42.
Las coordenadas más frecuentemente utilizadas y que podemos considerar como indirectas serían: la coordenada medio-lateral (X) a 14-15mm desde la línea media o bien a 11-11,5mm desde la pared del III ventrículo; la coordenada anteroposterior (Y), que varía entre 3 y 7mm anterior a la comisura posterior (CP) o bien 3-4mm posterior al MCP (punto medio de la línea intercomisural), y la coordenada dorso-ventral (Z), generalmente en la línea intercomisural. Una medición frecuente es la derivada de las ventriculografías por Guiot et al., quienes dividieron la línea intercomisural (AC-PC) en 12 partes y consideran el Vim localizado 3/12 anterior a la CP43,44. Esta localización anatómica del Vim sigue vigente en neurocirugía funcional para la mayoría de los autores (tabla 2).
Coordenadas para la localización indirecta del Vim según diferentes autores
| Autor | Coordenada X | Coordenada Y | Coordenada Z | Procedimiento |
|---|---|---|---|---|
| Benabid | 15 mm | ¼ AC-PC anterior a PC | 0 | ECP |
| Ohye | 2mm al borde de CI | 7-8mm anterior a PC | 3-4 sobre AC-PC | GK |
| Brodkey | 15/11 mm | 3-5mm anterior a PC | 0 | ECP |
| Koller | 11, 5+½ IIIV | AC-PC/12×2,5 desde PC | 0 | ECP |
| Pilitsis | 11-12+½ IIIV | 4mm anterior a PC | 0 | ECP |
| Witjas | 11mm | 7, 3mm anterior a PC | 2,5 sobre AC-PC | GK |
| Krauss | 12-14 mm | 3-4 posterior a MCP | 1,0 sobre AC-PC | ECP |
| Hyam | 13 mm | 4 posterior a MCP | 0 | ECP |
| Kondziolka | 25% IIIV+11 mm | 25% AC-PC+1mm anterior a PC | 2,5 sobre AC-PC | GK |
| King | 4mm medial al borde talámico | Fx-PC: ⅓ anterior a PC | 0 | ECP |
AC-PC: línea intercomisural; AC: comisura anterior; CI: cápsula interna; Coordenada X: coordenada mediolateral; Coordenada Y: coordenada anteroposterior; Coordenada Z: coordenada dorsoventral; ECP: estimulación cerebral profunda; GK: gamma knife; IIIV: tercer ventrículo; MCP: midcommisural point (punto medio intercomisural); PC: comisura posterior.
Diferentes autores eligen otras coordenadas45-52 basados en variaciones individuales y en su experiencia personal (tabla 2). El registro fisiológico, como hemos visto previamente, puede ayudar en la localización del Vim, pero en técnicas como el gamma-knife o bien MRgFUS, que actúan exclusivamente por imagen, esto implica una mayor dificultad, ya que la variedad anatómica de los sujetos hace que la diana elegida por imagen en el tálamo pueda ser insuficiente. Existe una correlación entre la anchura del III ventrículo y la posición de la cápsula interna; así en pacientes con un III ventrículo menor de 5mm de anchura, el borde medial de la cápsula interna estaría situado entre 16 y 20mm desde la línea media, mientras que pacientes con una anchura superior a 6mm, el borde lateral del tálamo estaría localizado entre 19 y 23mm de la línea53.
Por último, otros autores, comparando la diana clásica (medición indirecta) con la determinada por el atlas deformable individualmente en la RM (valorando la longitud AC-PC y el III ventrículo de cada paciente) encontraron discrepancias de, por lo menos, 2mm, fundamentalmente en la lateralidad, por lo que la coordenada medio-lateral (X) podría estar sobrestimada54. Recientemente, King et al. han reportado una nueva determinación indirecta del Vim por imagen basándose en la ubicación del fórnix52.
Tractografía del haz dentatorrubrotalámicoEstudios recientes seleccionan la diana talámica con base en el haz dentatorrubrotalámico (DRT), que proyecta sobre el tálamo en la línea intercomisural. El tracto parte del núcleo dentado, globoso y emboliforme del cerebelo, ascendiendo hacia el pedúnculo cerebeloso superior. Se decusa en gran porcentaje contralateralmente en el colículo inferior, proyectando sobre el núcleo rojo o bien bordeándolo, y asciende verticalmente hacia el Vim y Vop contralaterales55,56. Existe también un haz ipsilateral que no decusa. Desde el tálamo proyecta sobre el área motora primaria56 y, en menor medida, sobre el área motora suplementaria. El tracto DRT tiene relación con el control del movimiento, por lo que lesiones en él pueden inducir ataxia, temblor o distonía57.
La imagen del tensor de difusión o tractografía es una técnica no invasiva que permite visualizar vías de sustancia blanca en el cerebro mediante la identificación de la principal dirección de las fibras en cada vóxel de la imagen del tensor de difusión de la RM58. Yamada et al. delimitaron el tracto cerebelorrubrotalámico con esta técnica, seleccionando regiones de interés (ROI) en el núcleo rojo y la corteza motora primaria ipsilaterales y considerando el Vim como el punto de intersección entre dicho haz y el tálamo en la línea intercomisural59. Otros autores han localizado dianas para ECP con tractografía probabilística parcelando el tálamo, con base en estudios de conectividad, predefiniendo regiones del córtex que proyectan sobre el tálamo60 (fig. 3).
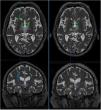
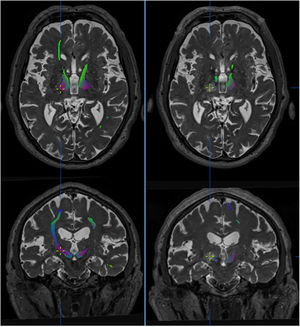
Efecto de la talamotomía por ultrasonidos (MRgFUS) sobre el haz dentato-rubro-talámico (DRT). Imágenes de la tractografía del haz DRT procedentes de secuencias DTI en resonancia magnética de alto campo (Skyra,3T,Siemens) pre-tratamiento (izquierda) y post-tratamiento (derecha). El haz DRT se observa en el tálamo a nivel del plano intercomisural. En los cortes axiales y coronales se aprecia la práctica desaparición del haz en las secuencias post-tratamiento, persistiendo el haz contralateral. La cruz indica la localización de la lesión. Imágenes extraídas de software de planificación Iplannet de Brainlab.
La primera vez que esta técnica se realizó para delimitar el tracto DRT fue en 41 voluntarios, según Kwon et al. con tractografía probabilística y, como ROI, se tomaron el dentado del cerebelo, el pedúnculo cerebeloso contralaterales y el núcleo rojo ipsilateral. De esta manera se identificó y se pudo localizar el haz DRT que terminaba en el ventral lateral del tálamo61.
La primera cirugía en pacientes con temblor planificando la diana con tractografía fue publicada por Coenen (2011)62. La colocación del electrodo con base en esta nueva técnica, definiendo el tracto DRT de manera determinística y localizando el contacto más eficaz del electrodo directamente dentro del tracto, fue descrita en un paciente con temblor esencial, al que se le suprimió el temblor. Para los autores la exactitud de la técnica es de unos 3mm62,63.
Anthofer et al. encontraron discrepancias entre la localización de la diana tomada por métodos convencionales indirectos y la tomada mediante tractografía. Los autores describieron una importante diversidad, ya que la diana tomada por métodos indirectos estaba dentro del haz DRT en un 64% de los casos, en un 11% estaba medial al tracto y en un 23,5% lateral a él64 en el eje de coordenadas medio-lateral (X). El mismo grupo, colocando electrodos basados en la vía DRT como diana en 5 pacientes con temblor esencial, concluyó que no había evidencia suficiente para definir el tracto como diana del temblor, ya que los resultados de la estimulación no fueron convincentes65.
Sammartino et al. propusieron en 2016 un método novedoso basado en la tractografía determinística para la localización del Vim, partiendo de las relaciones anatómicas de este núcleo respecto a la cápsula interna y el lemnisco medial. Situaron el ROI para la definición del DRT dentro del área delimitada lateralmente por el tracto piramidal y posteriormente por el lemnisco medial, dejando un margen de seguridad de 3mm respecto a dichas estructuras elocuentes. El haz DRT obtenido estaba situado 1mm lateral y 1,8mm más anterior que la diana convencional indirecta (tomado clásicamente como ¼ anterior a la PC en el plano intercomisural). Los autores también encontraron una gran correspondencia entre la localización de los tractos por imagen y su localización intraoperatoria mediante la evaluación de efectos clínicos y neurofisiológicos66. El mismo grupo ha encontrado que, en el registro de pacientes con temblor, tanto las neuronas kinestésicas como las tremóricas en el Vim se correspondían con la diana definida previamente por tractografía67. Resultados similares han sido referidos por otros autores que han correlacionado la tractografía con la supresión del temblor68.
Además, se ha publicado un estudio que correlaciona tractografía con talamotomía por ultrasonidos guiados por RM (MRgFUS) y refiere que la distancia final entre la localización de la lesión por ultrasonidos y la diana tomada por imagen directa mostraba una discrepancia de 2,5mm69. Esta variación puede atribuirse a la idiosincrasia del procedimiento, lo que resulta en modificaciones de la energía de los ultrasonidos y, por tanto, en diferente respuesta del parénquima a la lesión (fig. 3).
Finalmente, Fenoy y Schiess compararon la diferencia en el control del temblor entre 2 cohortes de pacientes al año de la cirugía. Encontraron que la diana directa tomada con la tractografía controla el temblor de manera similar a la diana indirecta del Vim del tálamo en 20 pacientes por grupo. En ambas cohortes de pacientes los parámetros de estimulación fueron similares70.
ConclusionesTras la revisión de la literatura podemos concluir que la definición del tracto DRT puede ayudar a localizar de manera directa el Vim. Por otro lado, habría que preguntarse si la metodología de la tractografía determinística es válida y reproducible y si es superior a la localización anatómica indirecta clásica62,66. Existen limitaciones en la técnica, con relación al software empleado, a la longitud de las fibras, fracción de anisotropía, a las regiones de interés (ROI) o al número de direcciones seleccionado, y esto hace que no todos los autores obtengan los mismos resultados y con la misma fiabilidad. En este sentido, debería ser necesaria una estandarización del método en la RM. La posible mayor utilidad del método directo de localización de la diana por tractografía sobre el indirecto mediante coordenadas estereotácticas queda pendiente de demostración a largo plazo en pacientes con temblor.
FinanciaciónLa presente investigación no ha recibido ayudas específicas provenientes de agencias del sector público, sector comercial ni entidades sin ánimo de lucro.
Conflictos de interesesNinguno.