Comparar la efectividad y seguridad de los esquemas corto de 6 meses y largo de 12 meses en el tratamiento de la meningoencefalitis tuberculosa de pacientes VIH negativos de dos hospitales de Lima-Perú.
MétodosEstudio comparativo, retrospectivo y observacional. Los pacientes recibieron uno de los siguientes esquemas de tratamiento: grupo 1, curso largo de 12 meses de tratamiento con isoniazida, rifampicina, pirazinamida y etambutol los primeros 2 meses; luego isoniazida y rifampicina durante 10 meses. Grupo 2, curso corto de 6 meses con isoniazida, rifampicina, pirazinamida y etambutol los primeros 2 meses; luego isoniazida y rifampicina durante 4 meses. Se revisó las historias clínicas y se evaluó en ambos grupos la efectividad, recaídas, fracaso terapéutico, reacciones adversas a fármacos antituberculosos, mortalidad y secuelas luego de concluir tratamiento.
ResultadosSe presentaron 26 pacientes con meningoencefalitis grado I, de los cuales 10 recibieron el esquema de tratamiento largo y 16 el esquema corto; 51 con meningoencefalitis grado II, 27 recibieron el esquema largo y 24 el esquema corto; y 31 con meningoencefalitis grado III, recibiendo 18 el esquema largo y 13 el esquema corto. Al evaluarse la efectividad de los esquemas corto y largo no se encontró diferencia estadísticamente significativa en los grados I, II y III; tampoco existió diferencia estadísticamente significativa en la frecuencia de recaídas, fracaso terapéutico, reacciones adversas a fármacos antituberculosos, en la mortalidad y secuelas.
ConclusionesLos esquemas largo de 12 meses y corto de 6 meses tendrían similar efectividad y seguridad en el tratamiento de la meningoencefalitis tuberculosa de pacientes VIH negativos.
To compare the effectiveness and safety of short term 6 month-treatment and long term 12 month-treatment schedules for meningoencephalitis due to tuberculosis in two hospitals from Lima-Peru.
MethodsComparative, retrospective and observational study. The patients were divided in two groups: Group 1: long term 12 month-treatment with isoniazid, rifampin, pyrazinamide, and ethambutol for the first 2 months; then isoniazid and rifampin for 10 months. Group 2: short term 6 month-treatment with isoniazid and rifampin, pyrazinamide and ethambutol for the first 2 months; then isoniazid and rifampin for 4 months. Clinical records, effectiveness, treatment failure, treatment side effects, mortality and late consequences after treatment were reviewed.
ResultsTwenty-six patients with meningoencephalitis level I were included, 10 received the long term schedule and 16 the short term schedule treatment. From 51 patients with meningoencephalitis level II, 27 received the long term schedule and 24 the short term schedule treatment and of 31 patients with meningoencephalitis level III, 18 received the long term schedule treatment and 13 the short term schedule treatment. There was no statistically significant differences among levels I, II and III when effectiveness of short and long term schedule was evaluated. Moreover, there was no statistically significant difference in the frequency of treatment failure, treatment side effects, mortality and late consequences among groups.
ConclusionsLong term 12 month-treatment and short term 6 month-treatment had similar effectiveness and safety in the treatment of meningoenchephalitis due to tuberculosis in HIV negative patients.
La tuberculosis (TBC) constituye un serio problema de salud pública en el mundo. Para el año 2007 se estima que hubo 9,27 millones de nuevos casos (139/100.000 hab) y que 1,7 millones de personas fallecieron incluyéndose los casos de coinfección con el VIH (456.000)1.
La meningoencefalitis tuberculosa constituye la forma más grave de TBC extrapulmonar. Clínicamente se presenta con un periodo de 2-8 semanas de síntomas inespecíficos (malestar general, hiporexia, fiebre, mialgias, pérdida de peso), seguidos por cefalea, meningismo, náuseas, vómitos, convulsiones, compromiso del sensorio, de oculomotores, hemiparesia, etc.2-4. Se estadifica en tres grados de acuerdo a la escala de severidad modificada por el British Medical Research Council3,5:
- -
Grado I: alerta y orientado sin déficit neurológico focal.
- -
Grado II: escala de Glasgow 14-10, con o sin déficit neurológico focal; escala de Glasgow 15 con déficit neurológico focal.
- -
Grado III: escala de Glasgow menos de 10, con o sin déficit neurológico focal.
La mortalidad es variable, siendo menor del 10, 20-30 y 60-70% en los grados I, II y III respectivamente3,5. El factor más importante para la prevención de secuelas y mortalidad es el inicio temprano del tratamiento2,3. En el pronóstico se describe recuperación completa o secuela neurológica mínima en el estadio I y secuelas neurológicas severas en el estadio III. Las principales secuelas neurológicas descritas son disfunción cognitiva, alteración en oculomotores, hemiplejías, disfasias, convulsiones, ataxia y deterioro visual con atrofia óptica4.
Las recomendaciones internacionales para el tratamiento de la TBC pulmonar refieren que los dos primeros meses debe realizarse con 4 fármacos: isoniazida, rifampicina, pirazinamida y estreptomicina, etambutol o etionamida2,6-12. En la actualidad existen escasas evidencias para el tratamiento de la TBC extrapulmonar, particularmente la neurológica en la que se recomienda un tratamiento de 9-12 meses. Aunque se acepta el tratamiento con 4 fármacos, hay autoridades que aceptan 3 en zonas de no resistencia a la isoniazida. Existen algunos estudios y revisiones sistemáticas que muestran que, a pesar de no contarse con estudios comparativos del tratamiento de 6 meses con los de mayor duración en la meningoencefalitis tuberculosa, los esquemas cortos podrían ser suficientes siempre que las cepas de Mycobacterium tuberculosis sean susceptibles a los fármacos administrados13,14.
En Perú, de acuerdo con la norma nacional el tratamiento de las formas extrapulmonares como la meningoencefalitis se realiza con el esquema I15 que incluye 4 fármacos que son: rifampicina, isoniazida, pirazinamida, etambutol; sin embargo, se observan diferencias en su duración que en algunos hospitales es corto (6 meses) y en otros largo (9-12 meses). La duración del tratamiento prescrito para la meningoencefalitis se basa en las preferencias y/o experiencia de los especialistas.
De acuerdo con lo anteriormente expuesto, no existe consenso en el tiempo de duración para el tratamiento de la meningoencefalitis tuberculosa, y es por esta razón que planteamos el presente estudio que tiene como objetivo comparar la efectividad de los esquemas largo de 12 meses y corto de 6 meses en el tratamiento de la meningoencefalitis tuberculosa en dos hospitales de Lima-Perú.
Material y métodosSe trata de un estudio comparativo, retrospectivo y observacional. Se incluyó a mayores de 15 años de edad, de cualquier género, con meningoencefalitis tuberculosa en los que se verificó cuadro clínico y hallazgos de laboratorio compatible diagnosticados en el Hospital Nacional Dos de Mayo e Instituto Nacional de Ciencias Neurológicas Óscar Trelles Montes (Lima-Perú) durante el período 2000-2003.
Se excluyó a los pacientes con infección por VIH, con otras formas de TBC del sistema nervioso central como forma inicial de presentación (granuloma, vasculitis, absceso cerebral y mal de Pott), TBC de otros órganos diferentes al sistema nervioso central, enfermedades descompensadas (insuficiencia cardiaca, insuficiencia renal, cirrosis hepática, etc.), tratamiento previo, abandono del tratamiento por causa no médica, historia clínica incompleta o ausente.
Los pacientes clasificados de acuerdo a estadiaje (grados I, II y III) recibieron uno de los siguientes tratamientos:
- 1)
Esquema largo: indicación de 12 meses de tratamiento con isoniazida, rifampicina, pirazinamida y etambutol los primeros 2 meses; luego isoniazida y rifampicina durante 10 meses.
- 2)
Esquema corto: indicación de 6 meses de tratamiento con isoniazida, rifampicina, pirazinamida y etambutol los primeros 2 meses; luego isoniazida y rifampicina durante 4 meses.
Se revisó las historias clínicas de los pacientes por grupos de estudio y se evaluó la efectividad y seguridad de los esquemas antituberculosos largo y corto; así como variables clínicas, epidemiológicas, exámenes de laboratorio, reacciones adversas a fármacos antituberculosos (RAFA), recaída, fracaso terapéutico, mortalidad. Para el análisis de las secuelas se realizó una visita domiciliaria luego de concluir tratamiento completo dos años como mínimo. Se documentó también el tratamiento con corticosteroides en ambos grupos de investigación. Los datos fueron registrados en un instrumento de recolección de datos.
Se realizó estadística univariada basada en la obtención de frecuencias, porcentajes, medidas de tendencia central y de dispersión relativa; mientras que el análisis bivariado se realizó con la prueba exacta de Fisher y la de la t de Student para muestras independientes. El análisis de la efectividad y la seguridad de los esquemas de tratamiento antituberculoso se llevó a cabo usando un modelo de regresión logística multinomial con ajuste de variables potencialmente confusoras como edad, sexo, estadiaje, alcoholismo, drogadicción y tratamiento con corticosteroides. Los cálculos se realizaron con un nivel de confianza del 95%.
La medida de la efectividad de una intervención pretende conocer el resultado alcanzado por la misma en condiciones habituales de uso en las que no se garantiza condiciones ideales16. De este modo, el presente estudio pretende evaluar la efectividad de dos esquemas de tratamiento antituberculoso en el marco de su administración en dos hospitales de Lima-Perú, empleándose como parámetro de efectividad la frecuencia de pacientes curados, fracasos y recaídas. La seguridad será evaluada según la frecuencia de RAFA. Para los fines del estudio se emplearon las siguientes definiciones operacionales:
- 1)
Cura: ausencia de manifestaciones clínicas de meningoencefalitis tuberculosa al culminar el tratamiento antituberculoso y luego de 2 años de seguimiento.
- 2)
Fracaso: evolución clínica desfavorable con necesidad de cambio de medicación antituberculosa por sospecha de resistencia a los fármacos.
- 3)
Recaída: nuevo episodio de meningitis tuberculosa en los siguientes 2 años tras terminar el tratamiento antituberculoso.
- 4)
RAFA: respuesta nociva no intencionada a cualquier fármaco antituberculoso que se produce a la dosis utilizada normalmente en el hombre.
El estudio fue aprobado por el Comité de Ética en Investigación Biomédica del Hospital Nacional Dos de Mayo el cual se encuentra registrado en “The Office for Human Research Protection” (Washington DC, USA). Se garantizó la confidencialidad de la información recolectada, la cual fue usada sólo con fines del estudio.
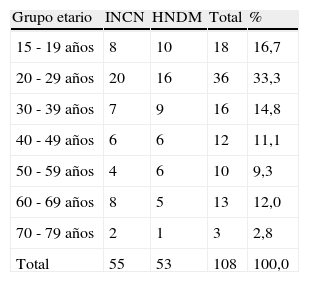
ResultadosSe registró en los archivos del Programa de Control de Tuberculosis del Hospital Nacional Dos de Mayo (HNDM) y del Instituto Nacional de Ciencias Neurológicas Óscar Trelles Montes (INCN) 205 casos de meningoencefalitis tuberculosa, de los cuales se ubicaron 145 historias clínicas. De las historias ubicadas se excluyó 37 por estar incompletas para realizar un diagnóstico certero de meningoencefalitis tuberculosa, por lo que quedaron disponibles para el análisis 108; 24,1% correspondieron al grado I (26 pacientes); 47,2% al grado II (51 pacientes) y 28,7% al grado III (31 pacientes). La enfermedad predominó en adolescentes y adultos jóvenes de sexo masculino (tablas 1 y 2).
Distribución por grupo etario de pacientes con meningoencefalitis tuberculosa del INCN y HNDM
| Grupo etario | INCN | HNDM | Total | % |
| 15 - 19 años | 8 | 10 | 18 | 16,7 |
| 20 - 29 años | 20 | 16 | 36 | 33,3 |
| 30 - 39 años | 7 | 9 | 16 | 14,8 |
| 40 - 49 años | 6 | 6 | 12 | 11,1 |
| 50 - 59 años | 4 | 6 | 10 | 9,3 |
| 60 - 69 años | 8 | 5 | 13 | 12,0 |
| 70 - 79 años | 2 | 1 | 3 | 2,8 |
| Total | 55 | 53 | 108 | 100,0 |
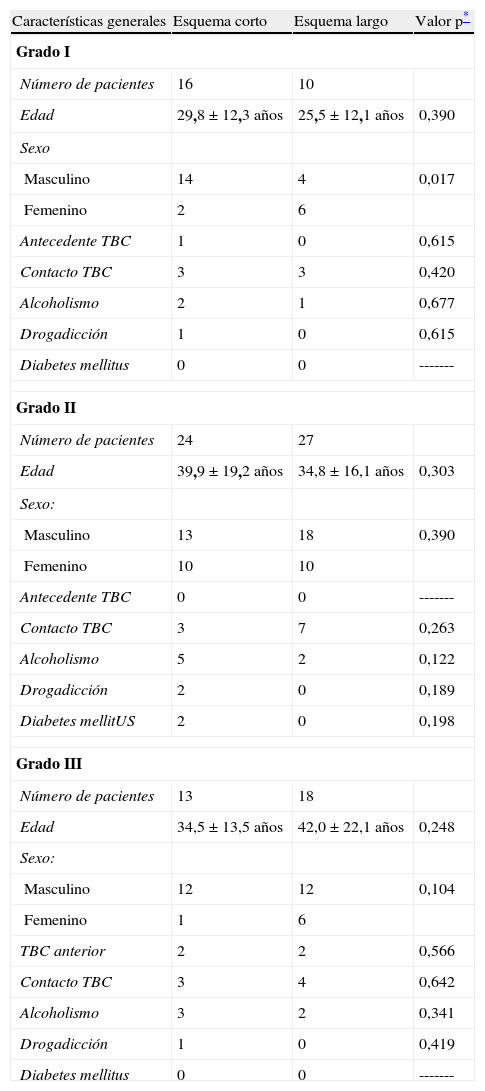
Características generales de los grupos que recibieron tratamiento antituberculoso con los esquemas corto y largo para meningoencefalitis tuberculosa
| Características generales | Esquema corto | Esquema largo | Valor p* |
| Grado I | |||
| Número de pacientes | 16 | 10 | |
| Edad | 29,8±12,3 años | 25,5±12,1 años | 0,390 |
| Sexo | |||
| Masculino | 14 | 4 | 0,017 |
| Femenino | 2 | 6 | |
| Antecedente TBC | 1 | 0 | 0,615 |
| Contacto TBC | 3 | 3 | 0,420 |
| Alcoholismo | 2 | 1 | 0,677 |
| Drogadicción | 1 | 0 | 0,615 |
| Diabetes mellitus | 0 | 0 | ------- |
| Grado II | |||
| Número de pacientes | 24 | 27 | |
| Edad | 39,9±19,2 años | 34,8±16,1 años | 0,303 |
| Sexo: | |||
| Masculino | 13 | 18 | 0,390 |
| Femenino | 10 | 10 | |
| Antecedente TBC | 0 | 0 | ------- |
| Contacto TBC | 3 | 7 | 0,263 |
| Alcoholismo | 5 | 2 | 0,122 |
| Drogadicción | 2 | 0 | 0,189 |
| Diabetes mellitUS | 2 | 0 | 0,198 |
| Grado III | |||
| Número de pacientes | 13 | 18 | |
| Edad | 34,5±13,5 años | 42,0±22,1 años | 0,248 |
| Sexo: | |||
| Masculino | 12 | 12 | 0,104 |
| Femenino | 1 | 6 | |
| TBC anterior | 2 | 2 | 0,566 |
| Contacto TBC | 3 | 4 | 0,642 |
| Alcoholismo | 3 | 2 | 0,341 |
| Drogadicción | 1 | 0 | 0,419 |
| Diabetes mellitus | 0 | 0 | ------- |
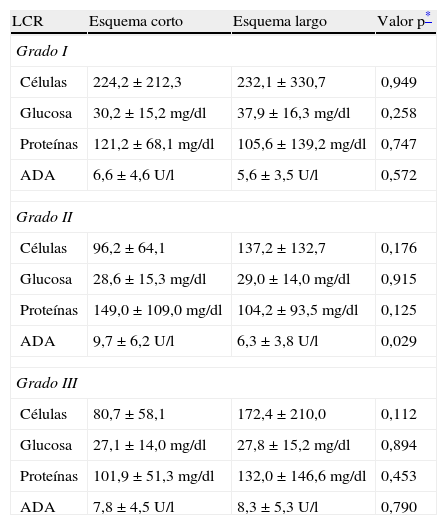
Se incluyó a 26 pacientes, de los cuales 10 habían recibido el esquema de tratamiento largo y 16 el esquema corto. Las características generales y las del estudio citoquímico del líquido cefalorraquídeo (LCR) de ambos grupos fueron similares, encontrándose diferencia estadísticamente significativa sólo en el sexo de los pacientes (tablas 2 y 3).
Características del líquido cefalorraquídeo (LCR) de los pacientes de ambos grupos
| LCR | Esquema corto | Esquema largo | Valor p* |
| Grado I | |||
| Células | 224,2±212,3 | 232,1±330,7 | 0,949 |
| Glucosa | 30,2±15,2mg/dl | 37,9±16,3mg/dl | 0,258 |
| Proteínas | 121,2±68,1mg/dl | 105,6±139,2mg/dl | 0,747 |
| ADA | 6,6±4,6 U/l | 5,6±3,5 U/l | 0,572 |
| Grado II | |||
| Células | 96,2±64,1 | 137,2±132,7 | 0,176 |
| Glucosa | 28,6±15,3mg/dl | 29,0±14,0mg/dl | 0,915 |
| Proteínas | 149,0±109,0mg/dl | 104,2±93,5mg/dl | 0,125 |
| ADA | 9,7±6,2 U/l | 6,3±3,8 U/l | 0,029 |
| Grado III | |||
| Células | 80,7±58,1 | 172,4±210,0 | 0,112 |
| Glucosa | 27,1±14,0mg/dl | 27,8±15,2mg/dl | 0,894 |
| Proteínas | 101,9±51,3mg/dl | 132,0±146,6mg/dl | 0,453 |
| ADA | 7,8±4,5 U/l | 8,3±5,3 U/l | 0,790 |
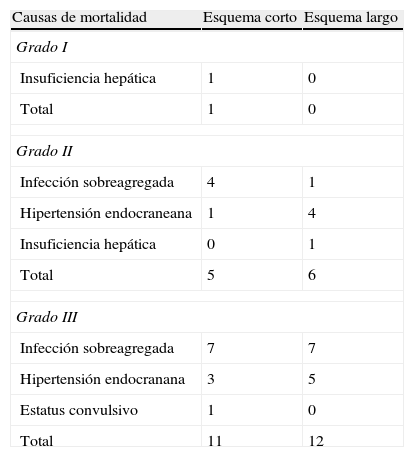
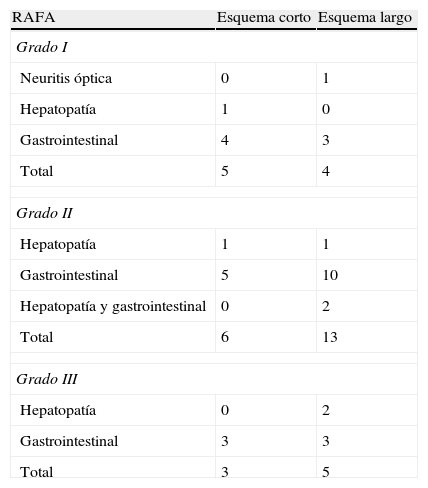
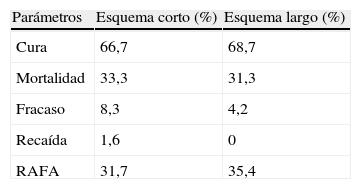
El 93,7% de los que recibieron el esquema corto evolucionaron favorablemente alcanzando la curación, la cual fue del 100% en el esquema largo. La mortalidad en los grupos que recibieron los esquemas antituberculosos corto y largo fue similar, con 1 fallecido (6,3%) en el grupo del esquema corto por insuficiencia hepática y ninguno en el grupo del esquema largo (tabla 4). Se presentó fracaso en el 6,3% de los tratados con el esquema corto y en 10% de los tratados con el esquema largo; no se produjo recaídas en pacientes de ninguno de los dos esquemas. Las RAFA presentadas en ambos grupos tampoco mostraron diferencias importantes, siendo las principales las gastrointestinales (tabla 5).
Causas de mortalidad en pacientes con meningoencefalitis tuberculosa que recibieron tratamiento con los esquemas corto y largo
| Causas de mortalidad | Esquema corto | Esquema largo |
| Grado I | ||
| Insuficiencia hepática | 1 | 0 |
| Total | 1 | 0 |
| Grado II | ||
| Infección sobreagregada | 4 | 1 |
| Hipertensión endocraneana | 1 | 4 |
| Insuficiencia hepática | 0 | 1 |
| Total | 5 | 6 |
| Grado III | ||
| Infección sobreagregada | 7 | 7 |
| Hipertensión endocranana | 3 | 5 |
| Estatus convulsivo | 1 | 0 |
| Total | 11 | 12 |
Reacciones adversas a fármacos antituberculosos (RAFA) con los esquemas corto y largo
| RAFA | Esquema corto | Esquema largo |
| Grado I | ||
| Neuritis óptica | 0 | 1 |
| Hepatopatía | 1 | 0 |
| Gastrointestinal | 4 | 3 |
| Total | 5 | 4 |
| Grado II | ||
| Hepatopatía | 1 | 1 |
| Gastrointestinal | 5 | 10 |
| Hepatopatía y gastrointestinal | 0 | 2 |
| Total | 6 | 13 |
| Grado III | ||
| Hepatopatía | 0 | 2 |
| Gastrointestinal | 3 | 3 |
| Total | 3 | 5 |
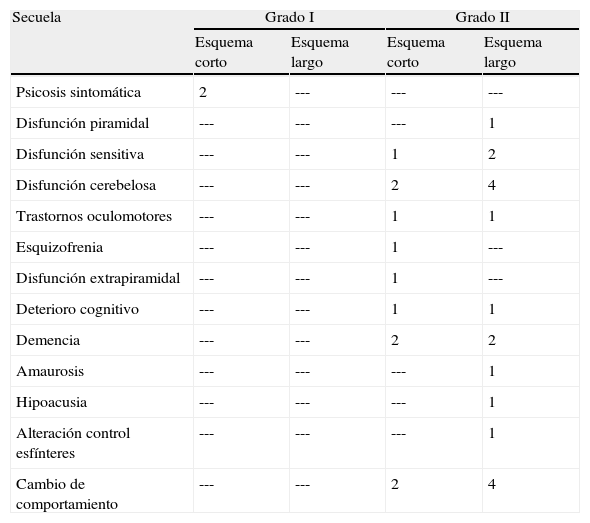
Para analizar la presencia de secuelas y discapacidad se realizó una visita domiciliaria de los pacientes ubicándose a 5 asignados al esquema corto y 5 al esquema largo. Se presentaron secuelas en 2/5 pacientes que recibieron el esquema corto y en ninguno de los que recibieron el esquema largo (tabla 6).
Frecuencia de secuelas en los grupos que recibieron tratamiento con los esquemas corto y largo
| Secuela | Grado I | Grado II | ||
| Esquema corto | Esquema largo | Esquema corto | Esquema largo | |
| Psicosis sintomática | 2 | --- | --- | --- |
| Disfunción piramidal | --- | --- | --- | 1 |
| Disfunción sensitiva | --- | --- | 1 | 2 |
| Disfunción cerebelosa | --- | --- | 2 | 4 |
| Trastornos oculomotores | --- | --- | 1 | 1 |
| Esquizofrenia | --- | --- | 1 | --- |
| Disfunción extrapiramidal | --- | --- | 1 | --- |
| Deterioro cognitivo | --- | --- | 1 | 1 |
| Demencia | --- | --- | 2 | 2 |
| Amaurosis | --- | --- | --- | 1 |
| Hipoacusia | --- | --- | --- | 1 |
| Alteración control esfínteres | --- | --- | --- | 1 |
| Cambio de comportamiento | --- | --- | 2 | 4 |
Se incluyó a 51 pacientes, de los cuales 27 recibieron el esquema de tratamiento largo y 24 el corto. Las características generales así como las del estudio citoquímico del LCR de ambos grupos fueron similares (tablas 2 y 3).
Comparación de esquemas antituberculososLa mortalidad en los grupos que recibieron los esquemas antituberculosos corto y largo fue similar, con 5 fallecidos (21,7%) en el grupo del esquema corto y 6 (21,4%) en el grupo del esquema largo; los pacientes restantes evolucionaron a la curación. Se presentó fracaso en el 12,9% de los tratados con el esquema corto y en 5% de los tratados con el esquema largo, la única recaída se produjo en un paciente que recibió el esquema corto (3,2%). Las principales causas de mortalidad en ambos grupos fueron las infecciones sobreagregadas y la hipertensión endocraneana (tabla 4). Las RAFA de ambos grupos no mostraron diferencias importantes, siendo las principales las gastrointestinales (tabla 5).
Para analizar la presencia de secuelas y discapacidad se realizó una visita domiciliaria de los pacientes, ubicándose a 22 del esquema corto y 24 del esquema largo. Se presentaron secuelas en 14/22 pacientes que recibieron el esquema corto y en 14/24 de los que recibieron el esquema largo. El uso del esquema corto en comparación con el esquema largo no se asoció significativamente a mayor frecuencia de secuelas (p=0,473).
La secuelas detectadas con mayor frecuencia fueron disfunción piramidal (hemiparesia, asimetría de reflejos, signo de Babinski, espasticidad), disfunción cerebelosa (ataxia para la marcha y de extremidades) y cambios en el comportamiento (menor tolerancia, mayor irritabilidad); estos últimos se asociaron a alguna disfunción perceptible para el paciente (piramidal, cerebelosa, control de esfínteres). Esto se muestra en la tabla 6.
Se encontró sólo una recaída en un paciente que fue tratado con el esquema corto; posteriormente curó al recibir el esquema para pacientes previamente tratados, quedando con demencia.
Meningoencefalitis tuberdulosa grado IIICaracterísticas generalesSe incluyó a 31 pacientes, de los cuales 13 recibieron el esquema de tratamiento corto y 18 el esquema largo. Las características generales de los pacientes así como las del estudio citoquímico del LCR de ambos grupos fueron similares, no encontrándose diferencias estadísticamente significativas (tablas 2 y 3).
Comparación de esquemas antituberculososAl compararse la mortalidad en los grupos que recibieron los esquemas antituberculosos se observó que fue levemente mayor en el grupo del esquema corto en comparación con los que recibieron el esquema largo (84,6% vs 66,7%); los pacientes restantes evolucionaron a la curación. Las causas de mortalidad pueden observarse en la tabla 4.
No se presentó ningún caso de recaída ni de fracaso. Las RAFA más frecuentes para ambos grupos fueron las gastrointestinales (tabla 5). La alta mortalidad en este estadio así como el cambio de residencia de los pacientes no permitió su ubicación, visita domiciliaria y análisis de secuelas.
Análisis multivariadoEl análisis multivariado con ajuste de las variables edad, sexo, estadiaje, alcoholismo, drogadicción y tratamiento con corticosteroides mostró que no existió diferencia significativa para la curación (p=0,537) y fracaso (p=0,092) entre los esquemas antituberculosos corto y largo; mientras que, la presencia de un solo paciente con recaída no hizo necesario el análisis multivariado. Con relación a la seguridad, no existió diferencia significativa entre las RAFA de ambos tratamientos (p=0,242).
DiscusiónLa meningoencefalitis tuberculosa es una infección grave del sistema nervioso que afecta principalmente a personas de países en vías de desarrollo; la inespecificidad de sus síntomas y lentitud en el diagnóstico se asocian a una alta mortalidad y secuelas neurológicas2,4,17,18. Los primeros intentos por establecer un esquema corto de tratamiento19 se remontan a 1980; a partir de allí, se ha realizado varios estudios en adultos que han mostrado resultados contradictorios en cuanto a eficacia y efectividad13,14,20,21 y una alta tasa de reacciones adversas graves como hepatitis en cursos cortos con isoniazida, rifampicina y pirazinamida22.
La presente investigación muestra que no existiría diferencia significativa en la efectividad de los esquemas terapéuticos antituberculosos corto de 6 meses y largo de 12 meses para el tratamiento de la meningoencefalitis tuberculosa (tabla 7). El análisis de la seguridad mostró con frecuencia la presencia de RAFA; sin embargo, no se encontró diferencia estadísticamente significativa en ambos grupos de investigación. Las más frecuentes fueron la hepatopatía y las gastrointestinales.
Esto demuestra que es factible el tratamiento de la meningoencefalitis tuberculosa con el esquema corto, lo cual disminuiría el costo del tratamiento y optimizaría recursos con una efectividad y seguridad similar al esquema largo. Cabe resaltar que estos hallazgos se han presentado para los grados I, II y III de la enfermedad con la diferencia de que el pronóstico y la sobrevida se empobrecen de acuerdo al grado de la patología. Los resultados del presente estudio concuerdan con los obtenidos por Alarcón (1990) y van Loenhout-Rooyackers (2001)13,14.
Se encontró sólo una recaída durante el seguimiento de los pacientes con meningoencefalitis grado II (no hubo recaídas para los grados I y III) en el grupo tratado con el esquema corto. No existió diferencia comparando las recaídas de los dos grupos, hallazgo similar al único metanálisis que comparó ambos tipos de tratamiento14.
En los pacientes curados, la presencia de secuelas y discapacidades fueron similares en los tratados con ambos esquemas. Las principales secuelas diagnosticadas fueron el cambio de comportamiento, disfunción piramidal, disfunción cerebelosa, deterioro cognitivo y demencia, lo cual concuerda con las estadísticas reportadas a nivel internacional para esta patología. Se detectó mayor frecuencia de secuelas en el estadio II, con relación a lo encontrado en algunos reportes3.
Una limitación del estudio es su carácter retrospectivo; sin embargo, la selección de los pacientes de acuerdo a criterios de inclusión y exclusión; así como el uso de análisis multivariado para el control de confusores como la edad, sexo, estadiaje, alcoholismo, drogadicción y tratamiento con corticosteroides ha permitido a nuestro parecer realizar un análisis adecuado de la efectividad y seguridad. Asimismo, son escasos los ensayos clínicos para el tratamiento de la meningoencefalitis tuberculosa principalmente por cuestiones éticas, por lo que los estudios retrospectivos constituyen una alternativa23. Consideramos que los resultados de esta investigación son fiables debido a que los grupos establecidos no difieren significativamente en sus características, por lo que son estadísticamente comparables. Por otro lado, era también necesario comparar por separado los grados I, II y III debido a que cada grupo tiene diferencias en términos de secuelas y mortalidad.
En conclusión, los esquemas largo de 12 meses y corto de 6 meses tendrían similar efectividad y seguridad en el tratamiento de la meningoencefalitis tuberculosa de pacientes VIH negativos.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Al Dr. César Munayco Escate, responsable del Grupo Temático de Tuberculosis y Lepra de la Dirección General de Epidemiología (Ministerio de Salud, Lima-Perú) por la revisión crítica de este artículo y por sus valiosos aportes.