Estudios recientes han demostrado una relación entre el desarrollo del deterioro cognitivo y la demencia con factores de riesgo relacionados con el estilo de vida, muchos de ellos potencialmente modificables, lo que significa que la prevención de la demencia es posible mediante un enfoque de salud pública que incluya la implementación de intervenciones clave que retrasan o ralentizan el deterioro cognitivo o la demencia.
El documento de consenso actual ha sido elaborado por un grupo de expertos en patología cognitiva y por el Grupo de Estudio de Neurogeriatría de la Sociedad Española de Neurología.
Este documento se ha elaborado a partir de una revisión de la bibliografía existente y su principal objetivo es servir de guía a aquellos profesionales de la salud con interés en el deterioro cognitivo y la demencia. Se enumeran los diferentes factores de riesgo modificables y se analizan aspectos relacionados con estos factores de riesgo relacionados con el deterioro cognitivo y la demencia, así como una serie de recomendaciones básicas.
Este documento pretende ser una herramienta útil en la práctica clínica de los profesionales dedicados al deterioro cognitivo y a la demencia.
Recent studies have demonstrated a relationship between the development of cognitive impairment and dementia with lifestyle-related risk factors, many of them potentially modifiable, meaning that dementia prevention is possible through a public health approach that includes the implementation of key interventions that delay or slow cognitive decline or dementia.
The current Consensus Document has been prepared by a group of experts in cognitive pathology and by the Neurogeriatrics Study Group of the Spanish Society of Neurology.
This document has been prepared from a review of the existing literature and its main objective is to serve as a guide for health professionals. with interest in cognitive impairment and dementia. The different modifiable risk factors are listed and aspects related to these risk factors related to cognitive decline and dementia are analyzed, as well as a series of basic recommendations.
This document aims to be a useful tool in the clinical practice of professionals dedicated to cognitive impairment and dementia.
La demencia, un síndrome clínico que se caracteriza por un déficit cognitivo que representa una pérdida respecto a un nivel previo, y que interfiere actividades de la vida diaria y el funcionamiento social, supone uno de los mayores desafíos globales para la salud y la atención social en el siglo XXI.
Debido al rápido envejecimiento de la población, la demencia plantea uno de los mayores retos de salud pública siendo una causa importante de discapacidad y dependencia, y tiene un impacto significativo no solo en los pacientes sino también en los cuidadores, las familias, las comunidades y la sociedad.
Durante mucho tiempo se ha considerado que la demencia no se puede prevenir ni tratar, pero se han logrado progresos esperanzadores. Muchas de sus manifestaciones son manejables y, aunque la enfermedad subyacente no es curable, el curso podría modificarse con un manejo adecuado de la misma. Las intervenciones y la atención disponibles pueden mejorar la trayectoria de los síntomas y la capacidad de la familia para hacerles frente y, así, poder modificar parcialmente el curso de la enfermedad.
Existe una relación directa entre el desarrollo del deterioro cognitivo y la demencia con factores de riesgo, en concreto 12, relacionados con los estilos de vida, como la inactividad física, el consumo de tabaco, las dietas poco saludables y el uso nocivo del alcohol. Ciertas condiciones médicas están asociadas con un mayor riesgo de desarrollar demencia, como son la hipertensión arterial, diabetes, el colesterol alto, la obesidad y la depresión. Otros factores de riesgo potencialmente modificables son el aislamiento social, la hipoacusia, la contaminación ambiental y la escasa estimulación cognitiva. Todos ellos suponen un 40% del total de factores relacionados con el desarrollo de deterioro cognitivo/demencia.
Actuar en la prevención e intervención en la demencia mejorará enormemente la atención de las personas afectadas y sus familias y, por lo tanto, de la sociedad.
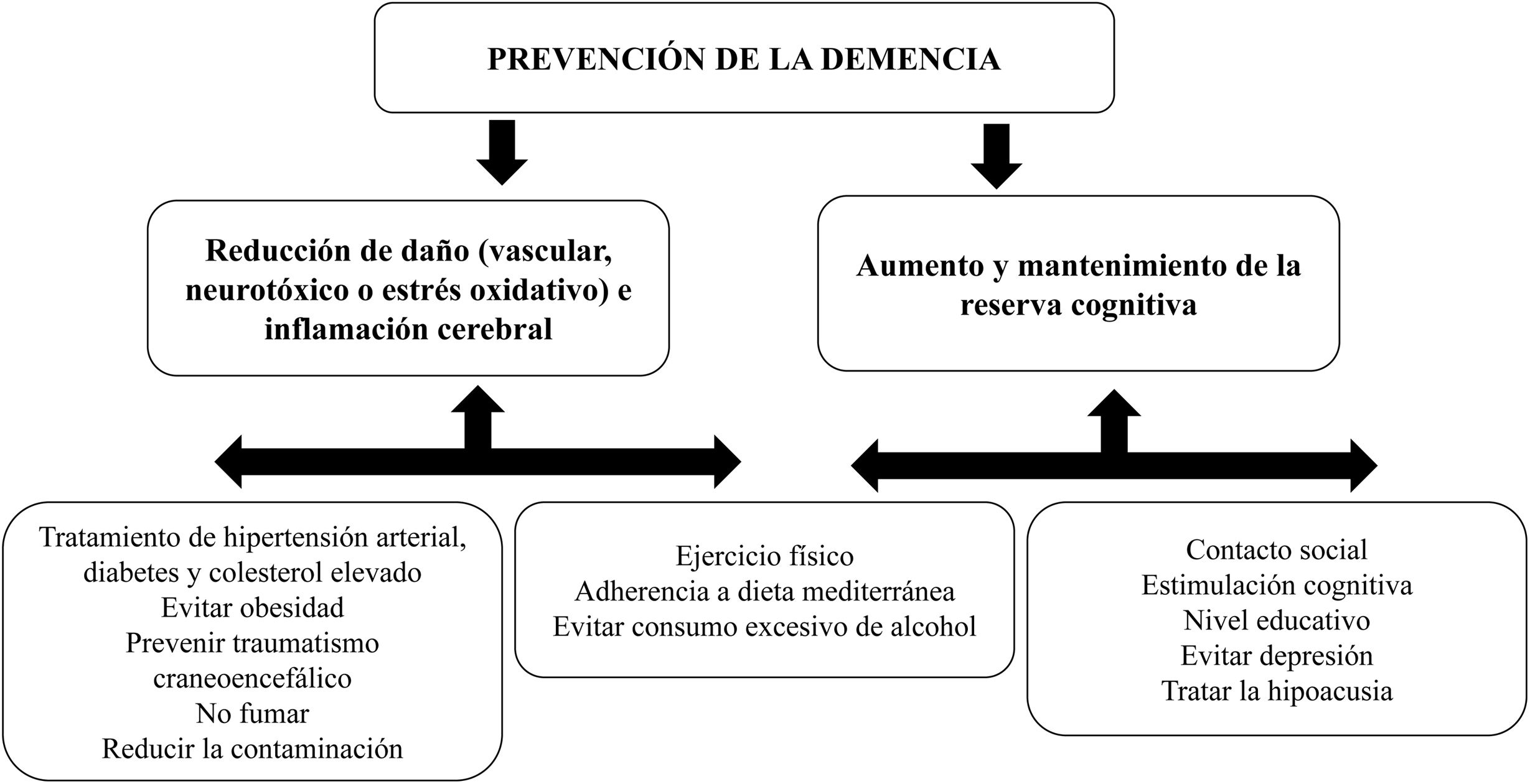
Prevención de la demenciaHan sido descritos varios posibles mecanismos cerebrales para mejorar o mantener la reserva cognitiva y reducir factores de riesgo potencialmente modificables en la demencia1. Por un lado, la prevención de la demencia se basa en reducir el daño neuropatológico mediado por afección ß-amiloide o tau, el daño vascular e inflamatorio y el estrés oxidativo. En este grupo se englobarían factores de riesgo vascular y reducir el consumo de tóxicos, entre otros. Por otro, existiría una serie de mecanismos que mejorarían y mantendrían la reserva cognitiva, como tratar la pérdida de audición y la depresión, favorecer el contacto social y una estimulación cognitiva adecuada (fig. 1).
Factores de riesgo potencialmente modificablesLos factores de riesgo son aquellas situaciones o condiciones que aumentan la probabilidad de desarrollar la enfermedad. Clásicamente se consideran marcadores de riesgo aquellos factores de riesgo no modificables, y factores de riesgo como tal los que sí son modificables2 (fig. 2).
Los factores de riesgo no modificables para la demencia son: edad, género, raza, polimorfismos genéticos e historia familiar:
- •
Edad: es el primer y más importante marcador de riesgo. La incidencia y prevalencia de la demencia aumenta progresivamente y de forma directa con el envejecimiento.
- •
Sexo: la incidencia es ligeramente mayor en mujeres, y la prevalencia, muy dependiente de la mayor mortalidad global en varones, es 3 veces mayor.
- •
Genética: en el caso de la enfermedad de Alzheimer (EA) hereditaria (<1%), el patrón de herencia es autosómico dominante y está relacionada con formas de inicio en edad temprana y vinculadas a 3 genes: proteína precursora de amiloide (APP), presenilina 1 (PSEN1) y presenilina 2 (PSEN2). La asociación entre el gen APOE y la EA está también claramente establecida, siendo el alelo ɛ4 un marcador de aumento de riesgo.
Se han descrito 12 factores de riesgo modificables que pueden aparecer en diferentes etapas de la vida3: bajo nivel educativo en infancia, presencia de hipertensión arterial (HTA), obesidad, pérdida de audición, traumatismo craneoencefálico y abuso de alcohol en edades medias de la vida, y tabaquismo, depresión, inactividad física, aislamiento social, diabetes y contaminación del aire en edades avanzadas. Todos estos factores pueden contribuir a aumentar el riesgo de demencia.
Factores de riesgo vascularLa asociación entre factores de riesgo vascular y desarrollo de deterioro cognitivo y demencia es bien conocida desde hace años. En concreto, destacan como factores de riesgo la HTA, la diabetes mellitus, la dislipemia y el sobrepeso4.
La presencia de HTA se ha relacionado de distintas formas con el desarrollo de deterioro cognitivo y demencia en función de la edad de la persona. El aumento de la presión arterial en la edad adulta, seguido de una disminución posterior en etapas más avanzadas de la vida ha sido descrito como un perfil de riesgo de desarrollo de demencia5,6.
La presencia de diabetes en etapas tardías de la vida se ha asociado también a un aumento del riesgo de padecer demencia ya sea de forma directa o de forma indirecta, a través de complicaciones secundarias como nefropatía, retinopatía, dificultades de audición y enfermedad cardiovascular7. Aunque los mecanismos por los cuales podrían relacionarse ambos eventos son múltiples, el pobre control de la glucosa se ha relacionado con un peor rendimiento cognitivo y un mayor declive cognitivo8.
Diversos estudios epidemiológicos han señalado la estrecha relación entre dislipemia con la EA y el riesgo de demencia9. Introducir cambios en el estilo de vida (pérdida de peso y restricción de grasas saturadas de origen animal) y el tratamiento farmacológico son las principales formas de abordar los altos niveles de colesterol.
El riesgo a padecer demencia se asocia con la presencia de obesidad en la vida adulta10. Tanto el sobrepeso como la obesidad suponen un factor de riesgo para la salud de forma directa e indirecta a través de diversas complicaciones médicas asociadas y factores cardiovasculares.
Actividad físicaLa actividad física (AF) ha demostrado efectos beneficiosos sobre la salud cerebral, contribuyendo a la creación de la reserva cognitiva, concepto recientemente renovado por Hachinski11: capacidad acumulada, dinámica, interactiva, desarrollada a lo largo de la vida, para resistir daños físicos, emocionales o sociales.
Los mecanismos por los cuales la AF puede ejercer un efecto beneficioso en el cerebro son12,13:
- •
Efecto indirecto: mejora la condición física cardiorrespiratoria, factores de riesgo vascular (HTA, obesidad, control lipídico y glucémico). La AF favorece la plasticidad mitocondrial, su biogénesis y respiración, así como la capacidad antioxidante, la afinidad mitocondrial por el oxígeno y el rendimiento aeróbico.
- •
Efecto directo: favorece la angiogénesis, sinaptogénesis, el crecimiento y la supervivencia neuronal, incrementando la plasticidad e integridad de la barrera hematoencefálica (BHE).
El sedentarismo es un factor de riesgo de demencia: las personas con hábitos de vida insuficientemente activos presentan un riesgo un 30% mayor de demencia14. La evidencia proporcionada por los estudios apoya la AF como factor protector de la demencia, disminuyendo el riesgo de demencia en, aproximadamente, un 20% en los estudios más rigurosos o un retraso de hasta 12 años en el desarrollo de demencia12,13.
NutriciónSe recomienda la adherencia a una dieta saludable tipo mediterránea, MIND o DASH (del inglés, Mediterranean-DASH Intervention for Neurodegenerative Delay). que combina aspectos nutricionales de dietas utilizadas en el Mediterráneo y para el control de la HTA15.
Las evidencias actuales son insuficientes para recomendar desde un punto de vista médico el consumo de suplementos nutricionales con mono u oligocomponentes con el objetivo de realizar una prevención primaria o secundaria de la EA. En concreto, una suplementación puntual con ácidos grasos poliinsaturados o vitaminas liposolubles (A, D, E) o del grupo B no han mostrado evidencias suficientes para su recomendación en la prevención del deterioro cognitivo.
Se puede recomendar el uso de alimentos de uso médico (AUMEs) en pacientes con EA biológicamente confirmada en fase de deterioro cognitivo inicial. En nuestro país, Souvenaid (Fortasyn Connect®) es el único AUME indicado en el deterioro cognitivo asociado a la EA inicial16. El objetivo de su prescripción es la mejora de la memoria durante esta fase. No hay una evidencia de disminución de la incidencia de la demencia, aunque hay datos de modificaciones estructurales encefálicas con usos prolongados durante 3 años17.
El extracto EGb761 de las hojas del Gingko biloba es un medicamento comercializado en algunos países para diversas enfermedades neurodegenerativas. En nuestro país su venta es sin receta médica y está indicado en el tratamiento sintomático de alteraciones en la microcirculación cerebral síntomas asociados a insuficiencia circulatoria en las extremidades o mejoría del deterioro cognitivo asociado a la edad18.
Trastornos de la sensopercepciónDurante el envejecimiento se produce un deterioro tanto de la cognición como de la percepción.
Roberts et al.19 presentan una revisión sobre las teorías que se pueden aplicar, de modo no excluyente, para analizar la relación entre la percepción y la cognición:
- •
El efecto del envejecimiento influye en la percepción y en la cognición.
- •
El deterioro cognitivo afecta las capacidades perceptivas.
- •
Una mala señal perceptiva afecta los recursos cognitivos.
- •
Un deterioro sensorial lleva a una pérdida cognitiva.
- •
La cognición puede compensar los efectos de una pérdida sensorial.
De forma unánime la impresión global es que las personas con déficit sensoriales tienen más deterioro cognitivo20,21, y que cuanto más déficit, peor21, aunque el tipo de relación entre ambos no está resuelto22.
A pesar de esto, parece justificado el cribado de los déficits sensoriales en la consulta de neurología, por el impacto que tienen en la vida diaria del paciente y en su estado emocional.
Trastornos psiquiátricos y del sueñoLos trastornos psiquiátricos, como la depresión, la ansiedad, el trastorno por estrés postraumático y las alteraciones del sueño se han asociado con riesgo de demencia. También se ha comunicado una asociación positiva entre otros trastornos psiquiátricos, como el trastorno bipolar y el trastorno psicótico de inicio muy tardío y la demencia23.
El comienzo de los síntomas psiquiátricos en la edad senil, particularmente en los pacientes sin antecedentes previos, puede ser la primera manifestación de un proceso neurodegenerativo subclínico y debe vigilarse más estrechamente la aparición de síntomas cognitivos o de deterioro funcional en estos casos.
La depresión se ha asociado con el riesgo de demencia de cualquier causa, la demencia vascular y la EA24. La ansiedad se asocia a peor rendimiento cognitivo y a la progresión a demencia en individuos con deterioro cognitivo leve.
Los trastornos del sueño pueden formar parte de la fase prodrómica de la enfermedad con cuerpos de Lewy difusos o de la EA, y también ser un factor asociado al riesgo de demencia25. Se ha comunicado que el tiempo de sueño presenta una asociación no lineal, en «U», con la demencia, de forma que tanto la falta como el exceso de horas de sueño se asociarían con un mayor riesgo:
La apnea del sueño obstructiva es otro trastorno consistentemente asociado al deterioro cognitivo y a la demencia.
Contaminación y tóxicosVarios estudios han investigado los efectos de estos compuestos en el deterioro cognitivo, y se ha observado una asociación significativa entre la exposición a contaminantes y tóxicos y la aparición de problemas cognitivos, fundamentalmente el consumo de alcohol y el tabaco.
El consumo excesivo de alcohol se ha asociado clásicamente con cambios cerebrales, deterioro cognitivo y demencia3,26. Reducir el consumo excesivo de alcohol podría ser una estrategia efectiva para la prevención de la demencia, sobre todo en los casos de consumo excesivo o en personas con trastorno por consumo de alcohol27.
La mayoría de los estudios muestran una asociación entre el consumo de tabaco y la aparición de demencia o deterioro cognitivo. No obstante, el tabaco también se asocia a un mayor riesgo de muerte prematura antes de la edad en la que se podría haber desarrollado demencia, lo cual introduciría cierto sesgo en la asociación entre fumar y el riesgo de demencia3,28. Cualquier tipo de intervención dirigida a dejar de fumar tabaco es probable que sea beneficiosa para reducir el riesgo de demencia, además de aportar otros beneficios para la salud.
La calidad del aire y algunas partículas contaminantes se han asociado con problemas de salud y se está prestando atención a su posible efecto sobre la cognición y el cerebro. Modelos animales sugieren que los contaminantes particulados transportados por el aire podrían acelerar los procesos neurodegenerativos, favoreciendo el depósito de ß-amiloide o alterando el procesamiento de la proteína precursora del amiloide3,29, fundamentalmente concentraciones elevadas de dióxido de nitrógeno (NO2) y partículas finas (PM) 2,5 provenientes del escape del tráfico y de la quema residencial de madera.
Aunque las evidencias acerca de la contaminación ambiental sobre la incidencia de demencias son cuestionables, la mejora de la calidad del aire tiene claramente beneficios en la salud global de las personas.
Traumatismo craneoencefálico (TCE)Uno de los factores de riesgo modificables para el desarrollo de la demencia es la lesión traumática cerebral. La comnoción o lesión traumática cerebral leve se define como un síndrome neurológico de aparición abrupta, transitorio, secundario a un daño biomecánico craneal (directo o indirecto, contusivo y sin traducción en el escáner craneal), que puede asociar alteración del nivel de consciencia o no, y puede presentarse con síntomas como la cefalea, la alteración visual, conductual o cognitiva, entre otros.
La encefalopatía traumática crónica (ETC) es una enfermedad neurodegenerativa definida por determinados hallazgos neuropatológicos, que agrupa síntomas cognitivos, neuropsiquiátricos y motores, descrita en sujetos expuestos a TCE repetidos o incluso en sujetos que han presentado un único TCE moderado o severo30.
Se han descrito múltiples factores de riesgo para su desarrollo, si bien el más importante es la repetición de los traumatismos y el intervalo de tiempo que existe entre ellos. Se trata de una enfermedad neurodegenerativa tipo taupatía31, si bien otros procesos, como el daño de la unidad neurovascular, la activación microglial o el daño axonal, son esenciales para su desarrollo. El 70% de los casos presentan los síntomas cardinales, que son cognitivos, neuropsiquiátricos y motores; no obstante, actualmente, el diagnóstico de la ETC sigue siendo exclusivamente anatomopatológico.
La prevención de los traumatismos craneales de repetición y de la lesión cerebral traumática es esencial.
Cognición y actividad socialLa creciente evidencia apunta a una asociación significativa entre la pérdida de actividades sociales y el aislamiento social con angustia emocional y el desarrollo de numerosas enfermedades físicas y trastornos psiquiátricos, así como un mayor riesgo de mortalidad32.
Una menor participación social, el contacto social infrecuente y la soledad se asocian a una mayor incidencia de la demencia33. La fracción atribuible ponderada del riesgo de demencia debido al aislamiento social es del 2,3%, similar a la HTA y a la inactividad física34.
Deprescripción de fármacos y prevención de la demenciaEl paciente con deterioro cognitivo, sobre todo en estadio de demencia, tiene mayor prevalencia de comorbilidad con respecto al paciente sin deterioro cognitivo, siendo las más frecuentes: enfermedad cerebrovascular, HTA, diabetes, enfermedad vascular periférica, depresión y epilepsia35. Estas comorbilidades constituyen por sí mismas un aumento del riesgo de evolución a demencia y suponen uno de los factores de riesgo para la polifarmacia y prescripción potencialmente inadecuada.
La polifarmacia se encuentra asociada con la evolución del estadio del deterioro cognitivo a demencia con una correlación positiva con respecto al número de fármacos. Tomando los criterios de la OMS, el tratamiento crónico con más de 3 grupos farmacológicos se considera polifarmacia35,36. La prescripción potencialmente inadecuada, tanto en indicación como en dosis, es más frecuente en los pacientes con deterioro cognitivo37.
El uso de algunos grupos farmacológicos conlleva el deterioro de las capacidades cognitivas y, por lo tanto, modifica la evolución natural de las enfermedades neurodegenerativas, acelerando la evolución a demencia. Es de gran importancia conocer esta evidencia, identificar los grupos farmacológicos implicados en la polifarmacia fútil y/o de mayor riesgo y realizar acciones que ayuden a reducir la velocidad en la evolución36.
Determinados grupos farmacológicos de amplio uso que empeoran la evolución del deterioro cognitivo38. El uso de estos grupos farmacológicos en el paciente con deterioro cognitivo aumenta las interacciones medicamentosas, las hospitalizaciones, la progresión del deterioro cognitivo y la mortalidad. Los fármacos con efecto anticolinérgico y los utilizados para el tratamiento de los síntomas psicoconductuales, fundamentalmente antipsicóticos y benzodiazepinas, son de gran relevancia como aceleradores de progresión del deterioro cognitivo. Los fármacos para el control de factores de riesgo cardiovascular también han de ser valorados, ajustando las expectativas terapéuticas
Estudios de intervención basados en prevención en demencias. Evidencia proporcionada por los estudiosEn los últimos años han surgido diferentes iniciativas centradas en el ejercicio físico y el control de los factores de riesgo cardiovascular, destacando la base de datos International Database on Aging and Dementia (IDAD) y las estrategias European Dementia Prevention Initiative (EDPI), The Australian Imaging, Biomarker & Lifestyle (AIBL) Flagship Study of Aging, PREVENT-AD (Douglas Institute, Montreal, Canadá) y Promotion of the Mind Through Exercise (PROMoTE), University of British Columbia, Canadá).
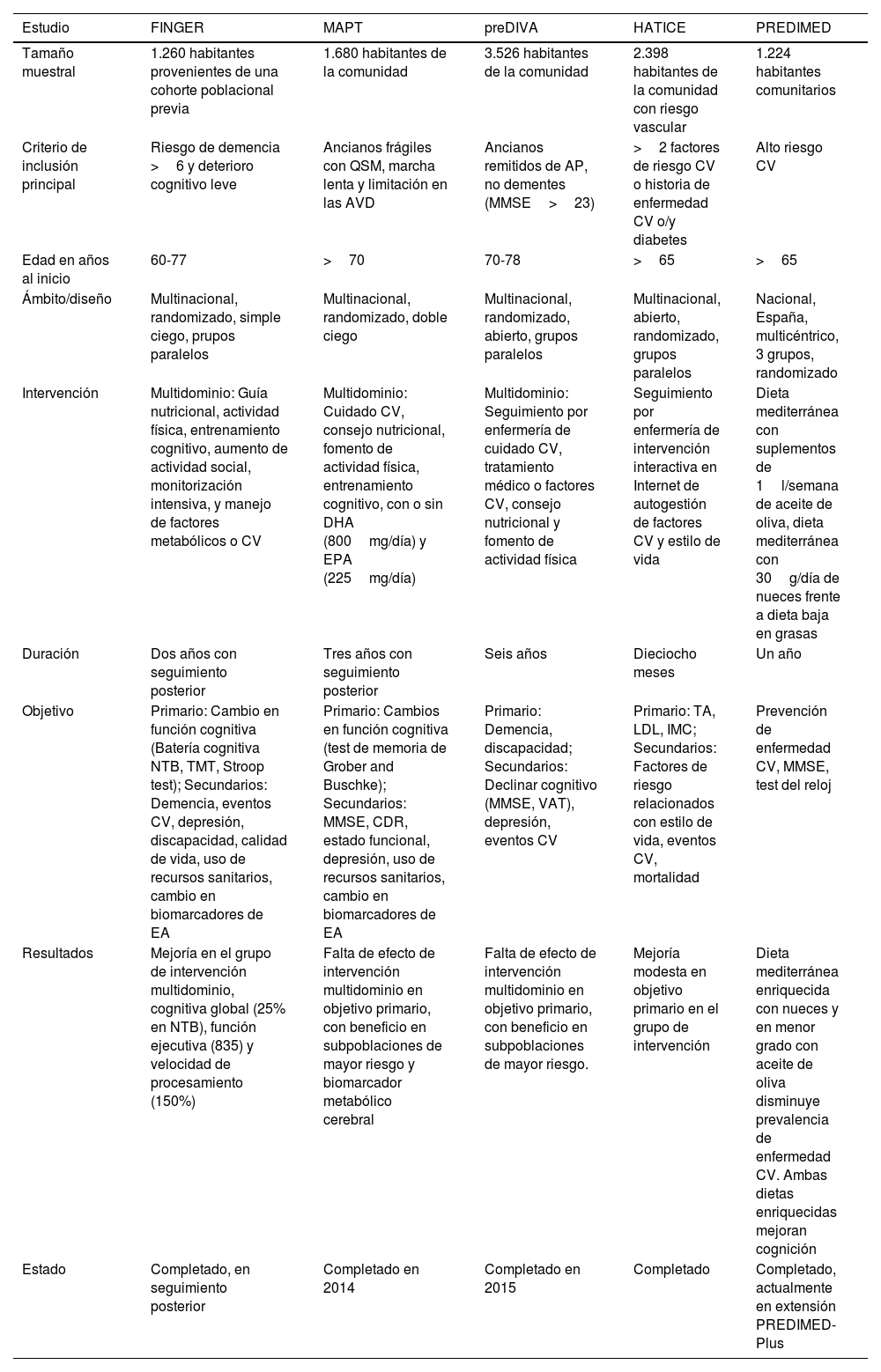
A partir de estas iniciativas aparecen grandes ensayos multicéntricos controlados y aleatorizados, entre los que el estudio FINGER es el más trascendente39. Aunque sus resultados fueron alentadores, otros 2 grandes ensayos clínicos multidominio, el francés Ensayo Preventivo de Alzheimer Multidominio (MAPT)40 y el holandés de Prevención de Demencia por Cuidados Vasculares Intensivos (PreDIVA)41 no consiguieron efecto positivo sobre sus resultados primarios, por la baja incidencia de factores de riesgo cardiovascular basales y el buen control de estos en la evolución, sin embargo, análisis posteriores mostraron beneficio cognitivo en subpoblaciones con mayor riesgo de demencia. Otros ensayos como Healthy Aging Through Internet Counseling in the Elderly (HATICE), fue el primero en evaluar mediante una intervención guiada interactiva basada en Internet42, y Prevención con Dieta Mediterránea (PREDIMED), el más extenso nacional sobre dieta mediterránea y suplementos de aceite de oliva y nueces43.
La OMS puso en marcha el plan de acción mundial sobre la respuesta de salud pública a la demencia 2017-202544, cuyas directrices brindan recomendaciones que apoyan a los países a desarrollar enfoques que retrasen o prevengan la demencia, destacando la importancia de realizar investigaciones adicionales sobre la eficacia de las intervenciones multidominio. El World-Wide FINGERS (WW-FINGERS) supone el primer ensayo global de intervención multidominio para reducir el riesgo de demencia, adaptando test y optimizando el modelo previo en diferentes entornos geográficos, económicos y culturales45. Probablemente, en los próximos años aportarán niveles de evidencia mayores que los actualmente disponibles sobre la capacidad de las intervenciones multidominio en prevenir o retrasar el inicio del deterioro cognitivo y la demencia (tabla 1).
Principales estudios de intervención multidominio para la prevención de la demencia
| Estudio | FINGER | MAPT | preDIVA | HATICE | PREDIMED |
|---|---|---|---|---|---|
| Tamaño muestral | 1.260 habitantes provenientes de una cohorte poblacional previa | 1.680 habitantes de la comunidad | 3.526 habitantes de la comunidad | 2.398 habitantes de la comunidad con riesgo vascular | 1.224 habitantes comunitarios |
| Criterio de inclusión principal | Riesgo de demencia >6 y deterioro cognitivo leve | Ancianos frágiles con QSM, marcha lenta y limitación en las AVD | Ancianos remitidos de AP, no dementes (MMSE>23) | >2 factores de riesgo CV o historia de enfermedad CV o/y diabetes | Alto riesgo CV |
| Edad en años al inicio | 60-77 | >70 | 70-78 | >65 | >65 |
| Ámbito/diseño | Multinacional, randomizado, simple ciego, prupos paralelos | Multinacional, randomizado, doble ciego | Multinacional, randomizado, abierto, grupos paralelos | Multinacional, abierto, randomizado, grupos paralelos | Nacional, España, multicéntrico, 3 grupos, randomizado |
| Intervención | Multidominio: Guía nutricional, actividad física, entrenamiento cognitivo, aumento de actividad social, monitorización intensiva, y manejo de factores metabólicos o CV | Multidominio: Cuidado CV, consejo nutricional, fomento de actividad física, entrenamiento cognitivo, con o sin DHA (800mg/día) y EPA (225mg/día) | Multidominio: Seguimiento por enfermería de cuidado CV, tratamiento médico o factores CV, consejo nutricional y fomento de actividad física | Seguimiento por enfermería de intervención interactiva en Internet de autogestión de factores CV y estilo de vida | Dieta mediterránea con suplementos de 1l/semana de aceite de oliva, dieta mediterránea con 30g/día de nueces frente a dieta baja en grasas |
| Duración | Dos años con seguimiento posterior | Tres años con seguimiento posterior | Seis años | Dieciocho meses | Un año |
| Objetivo | Primario: Cambio en función cognitiva (Batería cognitiva NTB, TMT, Stroop test); Secundarios: Demencia, eventos CV, depresión, discapacidad, calidad de vida, uso de recursos sanitarios, cambio en biomarcadores de EA | Primario: Cambios en función cognitiva (test de memoria de Grober and Buschke); Secundarios: MMSE, CDR, estado funcional, depresión, uso de recursos sanitarios, cambio en biomarcadores de EA | Primario: Demencia, discapacidad; Secundarios: Declinar cognitivo (MMSE, VAT), depresión, eventos CV | Primario: TA, LDL, IMC; Secundarios: Factores de riesgo relacionados con estilo de vida, eventos CV, mortalidad | Prevención de enfermedad CV, MMSE, test del reloj |
| Resultados | Mejoría en el grupo de intervención multidominio, cognitiva global (25% en NTB), función ejecutiva (835) y velocidad de procesamiento (150%) | Falta de efecto de intervención multidominio en objetivo primario, con beneficio en subpoblaciones de mayor riesgo y biomarcador metabólico cerebral | Falta de efecto de intervención multidominio en objetivo primario, con beneficio en subpoblaciones de mayor riesgo. | Mejoría modesta en objetivo primario en el grupo de intervención | Dieta mediterránea enriquecida con nueces y en menor grado con aceite de oliva disminuye prevalencia de enfermedad CV. Ambas dietas enriquecidas mejoran cognición |
| Estado | Completado, en seguimiento posterior | Completado en 2014 | Completado en 2015 | Completado | Completado, actualmente en extensión PREDIMED-Plus |
AP: atención primaria; AVD: actividades de la vida diaria; CDR: Clinical Dementia Rating; CV: aardiovascular; DHA: ácido docosahexaenoico; EA: enfermedad de Alzheimer; EPA: ácido eicosapentaenoico; FINGER: Finnish Geriatric Intervention Study to Prevent Cognitive Impairment and Disability; HATICE: Healthy Aging Through Internet Counseling in the Elderly; IMC: índice de masa corporal; LDL: lipoproteínas de baja densidad; MAPT: Multidomain Alzheimer Preventive Trial; MMSE: Mini-Mental State Examination; NTB: Neuropsychological Test Battery; PREDIMED: prevención con dieta mediterranea; preDIVA: Prevention of Dementia by Intensive Vascular Care; QSM: queja subjetiva de memoria; TA: tensión arterial; TMT: Trial Making Test; VAT: Visual Association Test.
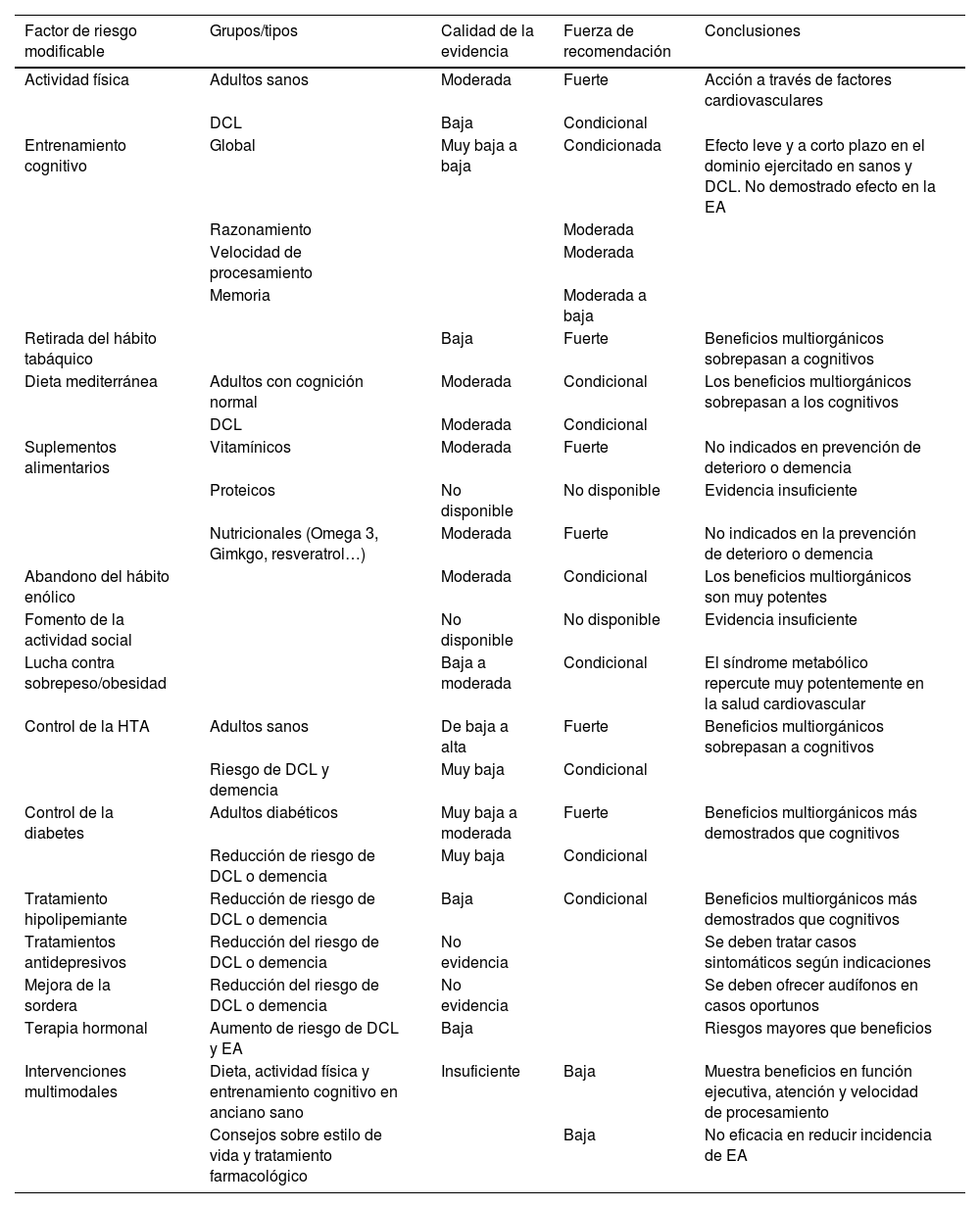
En la tabla 2 se resumen los siguientes artículos revisados que se ajustan a las directrices planteadas: las guías de la OMS46, estudios de investigación en la Comisión del Lancet3, documentos de consenso de expertos como el 5th Canadian Consensus Conference (5CCC) (Colaboración AGREE II)47, el de la American Heart Association (AHA)48 y el de UsAgainstAlzheimer's (USA-AA)49. Los 2 primeros establecen grados de calidad de la evidencia, y el resto son de carácter descriptivo, con recomendaciones asociadas, más o menos específicas. Hemos de destacar algunos aspectos de la evaluación de los diferentes factores de riesgo: únicamente la nutrición y la AF son valorados de manera unánime en todos los documentos revisados; en el extremo opuesto, solamente la Comisión del Lancet evalúa la contaminación y los traumatismos craneoencefálicos, y el 5CCC los fármacos.
Factores de riesgo modificables del deterioro cognitivo y de la demencia. Niveles de evidencia disponibles
| Factor de riesgo modificable | Grupos/tipos | Calidad de la evidencia | Fuerza de recomendación | Conclusiones |
|---|---|---|---|---|
| Actividad física | Adultos sanos | Moderada | Fuerte | Acción a través de factores cardiovasculares |
| DCL | Baja | Condicional | ||
| Entrenamiento cognitivo | Global | Muy baja a baja | Condicionada | Efecto leve y a corto plazo en el dominio ejercitado en sanos y DCL. No demostrado efecto en la EA |
| Razonamiento | Moderada | |||
| Velocidad de procesamiento | Moderada | |||
| Memoria | Moderada a baja | |||
| Retirada del hábito tabáquico | Baja | Fuerte | Beneficios multiorgánicos sobrepasan a cognitivos | |
| Dieta mediterránea | Adultos con cognición normal | Moderada | Condicional | Los beneficios multiorgánicos sobrepasan a los cognitivos |
| DCL | Moderada | Condicional | ||
| Suplementos alimentarios | Vitamínicos | Moderada | Fuerte | No indicados en prevención de deterioro o demencia |
| Proteicos | No disponible | No disponible | Evidencia insuficiente | |
| Nutricionales (Omega 3, Gimkgo, resveratrol…) | Moderada | Fuerte | No indicados en la prevención de deterioro o demencia | |
| Abandono del hábito enólico | Moderada | Condicional | Los beneficios multiorgánicos son muy potentes | |
| Fomento de la actividad social | No disponible | No disponible | Evidencia insuficiente | |
| Lucha contra sobrepeso/obesidad | Baja a moderada | Condicional | El síndrome metabólico repercute muy potentemente en la salud cardiovascular | |
| Control de la HTA | Adultos sanos | De baja a alta | Fuerte | Beneficios multiorgánicos sobrepasan a cognitivos |
| Riesgo de DCL y demencia | Muy baja | Condicional | ||
| Control de la diabetes | Adultos diabéticos | Muy baja a moderada | Fuerte | Beneficios multiorgánicos más demostrados que cognitivos |
| Reducción de riesgo de DCL o demencia | Muy baja | Condicional | ||
| Tratamiento hipolipemiante | Reducción de riesgo de DCL o demencia | Baja | Condicional | Beneficios multiorgánicos más demostrados que cognitivos |
| Tratamientos antidepresivos | Reducción del riesgo de DCL o demencia | No evidencia | Se deben tratar casos sintomáticos según indicaciones | |
| Mejora de la sordera | Reducción del riesgo de DCL o demencia | No evidencia | Se deben ofrecer audífonos en casos oportunos | |
| Terapia hormonal | Aumento de riesgo de DCL y EA | Baja | Riesgos mayores que beneficios | |
| Intervenciones multimodales | Dieta, actividad física y entrenamiento cognitivo en anciano sano | Insuficiente | Baja | Muestra beneficios en función ejecutiva, atención y velocidad de procesamiento |
| Consejos sobre estilo de vida y tratamiento farmacológico | Baja | No eficacia en reducir incidencia de EA |
DCL: deterioro cognitivo leve; EA: enfermedad de Alzheimer; HTA: hipertensión arterial.
El número de personas con demencia está aumentando en todo el mundo, aunque la incidencia en algunos países ha disminuido, debido a cambios en los estilos de vida.
El manejo adecuado de los factores de riesgo de la demencia puede retrasar o prevenir un tercio de sus casos en el mundo.
La OMS recomienda:
- •
Ser ambiciosos con respecto a la prevención, por medio del tratamiento activo de hipertensión, diabetes y obesidad, de la mejora de la educación infantil, fomentando el ejercicio físico y el compromiso social, reduciendo el tabaquismo y minimizando la pérdida auditiva y la depresión. Las intervenciones tecnológicas tienen el potencial de mejorar la atención integral de la persona con demencia, pero no deben reemplazar el contacto social.
- •
Individualizar la atención de la demencia con una adecuada atención médica, social y de apoyo, adaptada a las necesidades culturales de cada entorno e individuo.
- •
Mejorar la atención a los cuidadores, destacando la prevención de la depresión.
- •
Proteger a las personas con demencia de posibles riesgos, incluido el abandono de uno mismo, la vulnerabilidad, la gestión del dinero, la conducción de vehículos, la planificación previa del futuro y el final de la vida, equilibrando en todo momento la gestión de riesgos contra el derecho de la persona a la autonomía.
Los autores declaran no tener ningún conflicto de intereses.