El diagnóstico diferencial de la esclerosis múltiple (EM) incluye una gran variedad de enfermedades autoinmunitarias (lupus eritematoso sistémico, síndrome de Sjögren, síndrome antifosfolipídico, etc.). Los anticuerpos antifosfolipídicos (AAFL) en el suero de pacientes con EM se encuentran en cifras tan bajas como en el 10% y tan altas como en el 88% de los casos, pero su significación en la patogenia de la enfermedad o su utilidad diagnóstica aún no se han establecido. El objetivo fue conocer las características clínicas y demográficas de una muestra de pacientes con EM del Hospital General de México (HGM), y determinar presencia y frecuencia de anticuerpos antifosfolipídicos en líquido cefalorraquídeo y suero de estos pacientes.
Pacientes y métodosSe realizó un estudio prospectivo con pacientes captados en la consulta externa de neurología del HGM, con diagnóstico definido de EM a lo largo de 1 año. Se analizaron sus características clinicodemográficas y se determinó VDRL y anticuerpos anticomplejo cardiolipina-β2GP-1 en LCR y suero.
ResultadosSe incluyó a 12 pacientes, con predominio del sexo femenino (58%). El cuadro clínico predominante fue la neuritis óptica (66,6%) seguida de la afección medular (58%). La mayoría de los pacientes fueron ambulatorios (< 4 puntos EDSS). Los títulos de los autoanticuerpos fueron negativos en todos los casos, tanto en LCR como en sangre.
ConclusionesLas características clinicodemográficas en la muestra de este estudio son semejantes a las comunicadas con anterioridad y las concentraciones de anticardiolipina-β2GP-1 fueron negativas, lo cual puede indicar que hay diversas variables clínicas y demográficas que influyen en su detección.
The differential diagnosis of multiple sclerosis (MS) includes a wide variety of autoimmune diseases (systemic lupus erythematosus, Sjögren syndrome, antiphospholipid syndrome, etc.). The presence of antiphospholipid antibodies (APLA) in serum of MS patients has been reported to be as low as 10%, or sometimes as high as 88% of the cases, although its significance in the pathogenesis of the disease, or its diagnostic usefulness is still unknown. The goal of this study was to describe the clinic and demographic characteristics of a sample of patients with MS from the Hospital General de México (HGM), as well as to determine the presence and frequency of APLA in cerebrospinal fluid (CSF) and serum samples of these patients.
Patients and methodsA prospective study with patients from the Neurology Department at the HGM was performed. These patients were diagnosed with MS over a one-year period. Clinical and demographic characteristics were compiled. VDRL and anti-cardiolipin-β2GP-1 complex antibodies were analyzed in CSF and serum samples.
ResultsTwelve patients were included in the study, the majority females (58%). The predominant clinic feature was optic neuritis (66.6%) followed by medullary involvement (58%). Most of patients were ambulatory (< 4 EDSS points). Auto-antibody levels were found in negative ranges in all cases, both in CSF and serum.
ConclusionsThe clinical-demographic characteristics in patients studied in this work were similar to those previously reported, and the levels of anti-cardiolipin-β2GP-1 were negative, thus indicating the existence of different clinical and demographic variables influencing their detection.
La esclerosis múltiple (EM) es una enfermedad neurológica mediada por mecanismos inmunitarios que se caracteriza clínicamente por episodios de síntomas neurológicos multifocales de muy diversa índole: motores, sensitivos, cerebelosos, visuales, cognitivos, etc., que evolucionan con remisiones espontáneas y exacerbaciones periódicas1,2. Dicha sintomatología está ocasionada por un proceso de desmielinización inflamatoria de la sustancia blanca del sistema nervioso central, que puede evolucionar además con daño axonal secundario y pérdida neuronal progresiva3. En el mundo se estima que hay una prevalencia variable de la enfermedad según la región geográfica, que es tan alta en los países del norte como 80-300/100.000 habitantes y tan baja como 5/100.000 habitantes en algunas regiones de África, Asia y América del Sur3,4. Los primeros estudios de esta enfermedad realizados en México en los años setenta arrojaron una incidencia muy baja de la enfermedad (1,6/100.000)5,6; sin embargo, estudios más recientes han indicado un incremento de la incidencia en México2,7–12. En una revisión sistemática reciente sobre estudios epidemiológicos realizados en América del Sur, se estimó una prevalencia global de EM en esta región de 1,48-17/100.000 habitantes13. A pesar de ello, la información con la que se cuenta aún es escasa para estimar la situación epidemiológica real de la EM en México11.
Los criterios diagnósticos actuales de la EM requieren de la exclusión de una serie de enfermedades tanto neurológicas primarias como sistémicas, que pueden cursar con sintomatología o hallazgos paraclínicos semejantes; entre éstas se encuentran diversas enfermedades autoinmunitarias como el síndrome antifosfolipídico (SAF)1,14,15. Por otro lado, debido a que la EM comparte muchas características clínicas con las enfermedades autoinmunitarias en general, no es difícil encontrar la coexistencia de EM y otras enfermedades autoinmunitarias, como lupus eritematoso sistémico, artritis reumatoide, psoriasis, tiroiditis autoinmunitaria, diabetes mellitus tipo 1, síndrome de Sjogren o SAF16,17. El SAF es uno de los principales trastornos hemáticos que causan enfermedad trombooclusiva, sobre todo en mujeres jóvenes, y se caracteriza por la presencia de autoanticuerpos contra diversos antígenos sanguíneos (fosfolípidos, proteínas anticoagulantes, etc.) que generan un estado protrombótico y, consecuentemente, fenómenos vasooclusivos, isquémicos e infartos en diversos tejidos, incluido el sistema nervioso18. Hay diversos estudios que han demostrado la presencia de anticuerpos antifosfolipídicos en el suero de pacientes con EM, aunque los resultados hasta ahora demuestran una amplia variabilidad; se comunica desde el 10 hasta el 88% de positividad19–26. Esta situación complica el diagnóstico diferencial de la EM, además de que se desconoce la significación patológica real de estos anticuerpos en los pacientes con EM24,27–32. Los objetivos del presente estudio fueron: conocer las características clínicas y demográficas de una muestra de pacientes con EM del Hospital General de México (HGM), determinar la presencia y la frecuencia de anticuerpos antifosfolipídicos en el líquido cefalorraquídeo y suero de estos pacientes y, finalmente, establecer una posible correlación de estos anticuerpos con algunas variables clínicas y paraclínicas en los pacientes en estudio.
Pacientes y métodosSe realizó un estudio prospectivo en el que se incluyó a todos los pacientes recién diagnosticados con EM probable en la consulta externa del Servicio de Neurología del HGM a lo largo de 1 año, desde octubre de 2002 hasta octubre de 2003, y sólo fueron incluidos en el estudio final los pacientes que, después de su adecuado estudio diagnóstico, reunían características para considerarlos con EM definida, según los criterios revisados de McDonald14. Se excluyó del estudio a los pacientes que no reunieron los criterios de EM definida por cualquier motivo, así como los pacientes en que se sospechaba una enfermedad distinta o cursaban con alguna enfermedad sistémica o neurológica concomitante. A todos los pacientes se les realizó una historia clínica completa, y todos firmaron el consentimiento informado para ser incluidos en el estudio, así como la autorización del procedimiento de punción lumbar y extracción de líquido cefalorraquídeo (LCR), al igual que se realizó en todos los casos como parte del protocolo diagnóstico para el análisis de LCR y bandas oligoclonales33. Las variables a considerar fueron: edad, sexo, variedad clínica (brote-remisión, primaria-progresiva, secundaria-progresiva), tiempo de evolución de la enfermedad, puntos en la escala de discapacidad extendida de Kurtzke34 (EDSS) al momento del diagnóstico definitivo, alteración en los potenciales multimodales (auditivos, visuales, somatosensoriales), número de lesiones desmielinizantes en estudios de neuroimagen (resonancia magnética [RM] cerebral y medular, cuando estaba disponible, mediante un aparato de 1,5T; el protocolo de imagen incluyó cortes sagitales en T1, axiales en T1, T2 y FLAIR), ubicación de las lesiones desmielinizantes, bandas oligoclonales en LCR/suero (mediante técnica de electroforesis por foco isoeléctrico), títulos de anticuerpos anticardiolipina-β2GP1, tanto para IgM como para IgG (mediante prueba de ELISA según la metodología comunicada y estandarizada con anterioridad35, construyendo una curva estándar de 8 puntos expresada en unidades arbitrarias [U]), y finalmente, prueba de VDRL. Los títulos normales de anticuerpos se tomaron a partir del promedio de muestras sanguíneas obtenidas de 10 donadores voluntarios sanos. Los títulos de anticuerpos se consideraron positivos si se encontraban más allá de 2 desviaciones estándar del promedio normal encontrado para cada anticuerpo (IgG < 6 U; IgM < 4 U).
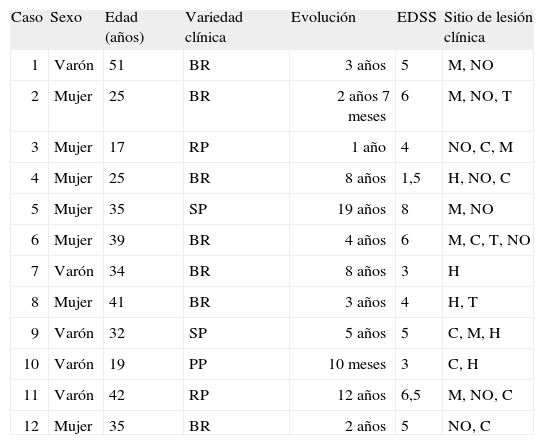
ResultadosDurante el periodo mencionado se captó en el HGM un total de 16 pacientes con diagnóstico de EM probable, de éstos, sólo 12 cumplieron con los criterios preestablecidos de EM definida. De éstos, 7 eran mujeres (58%), y 5 (42%), varones. El promedio de edad fue de 32,9 años con un intervalo de 17-51 años. Para el sexo femenino el promedio de edad fue 31 (intervalo, 17-41) años, y para el sexo masculino, 35,6 (intervalo, 19-51) años. En cuanto a la variedad de comportamiento clínico, el tipo más frecuente fue broteremisión en 7 casos (58,3%), recurrente-progresiva en 2 (16,6%), secundaria-progresiva en 2 (16,6%) y primaria-progresiva en 1 caso (8,3%). El tiempo promedio de evolución de la enfermedad en el momento del estudio fue de 5,8 años con un intervalo de 10 meses-19 años; no hubo diferencias significativas entre el tiempo de evolución para ambos sexos (5,8 frente a 5,6 años). En los puntos de discapacidad (EDSS), el promedio general fue de 4,75 puntos y el intervalo osciló en 1,5-8. Los sitios de lesiones clínicas estaban distribuidos de la siguiente manera: con lesión en nervio óptico (neuritis óptica), 8; en médula espinal, 7; en cerebelo, 7; en hemisferio, 5, y en tallo cerebral, 3 (tabla 1).
Características clínicas de los pacientes
| Caso | Sexo | Edad (años) | Variedad clínica | Evolución | EDSS | Sitio de lesión clínica |
| 1 | Varón | 51 | BR | 3 años | 5 | M, NO |
| 2 | Mujer | 25 | BR | 2 años 7 meses | 6 | M, NO, T |
| 3 | Mujer | 17 | RP | 1 año | 4 | NO, C, M |
| 4 | Mujer | 25 | BR | 8 años | 1,5 | H, NO, C |
| 5 | Mujer | 35 | SP | 19 años | 8 | M, NO |
| 6 | Mujer | 39 | BR | 4 años | 6 | M, C, T, NO |
| 7 | Varón | 34 | BR | 8 años | 3 | H |
| 8 | Mujer | 41 | BR | 3 años | 4 | H, T |
| 9 | Varón | 32 | SP | 5 años | 5 | C, M, H |
| 10 | Varón | 19 | PP | 10 meses | 3 | C, H |
| 11 | Varón | 42 | RP | 12 años | 6,5 | M, NO, C |
| 12 | Mujer | 35 | BR | 2 años | 5 | NO, C |
BR: brote, remisión; C: cerebelo; H: hemisferios; M: médula; NO: nervio óptico; PP: primaria progresiva; RP: recurrente progresiva; SP: secundaria progresiva; T: tallo.
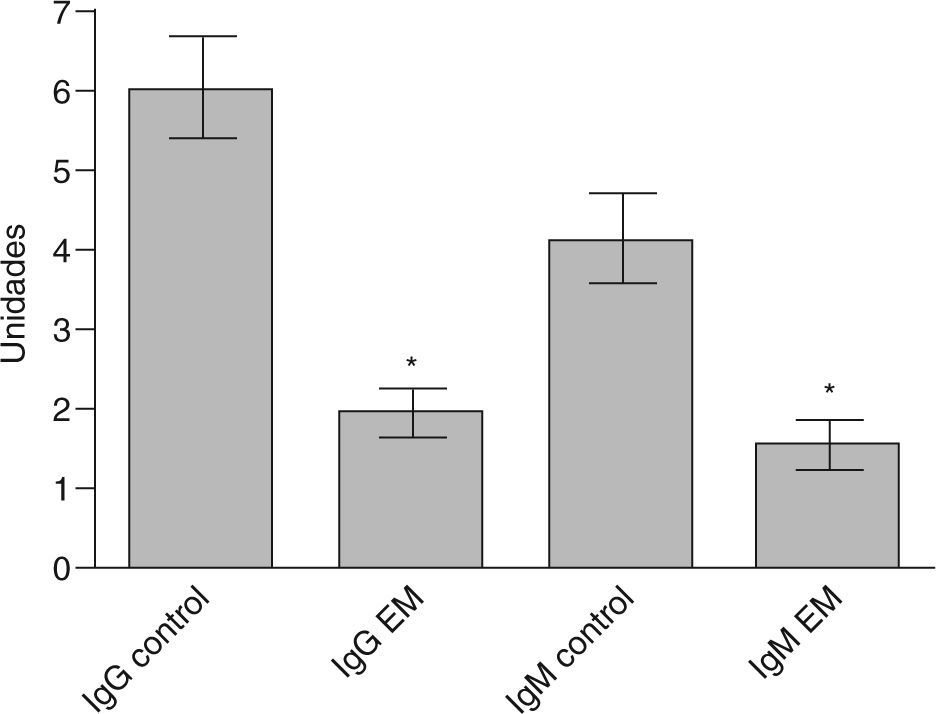
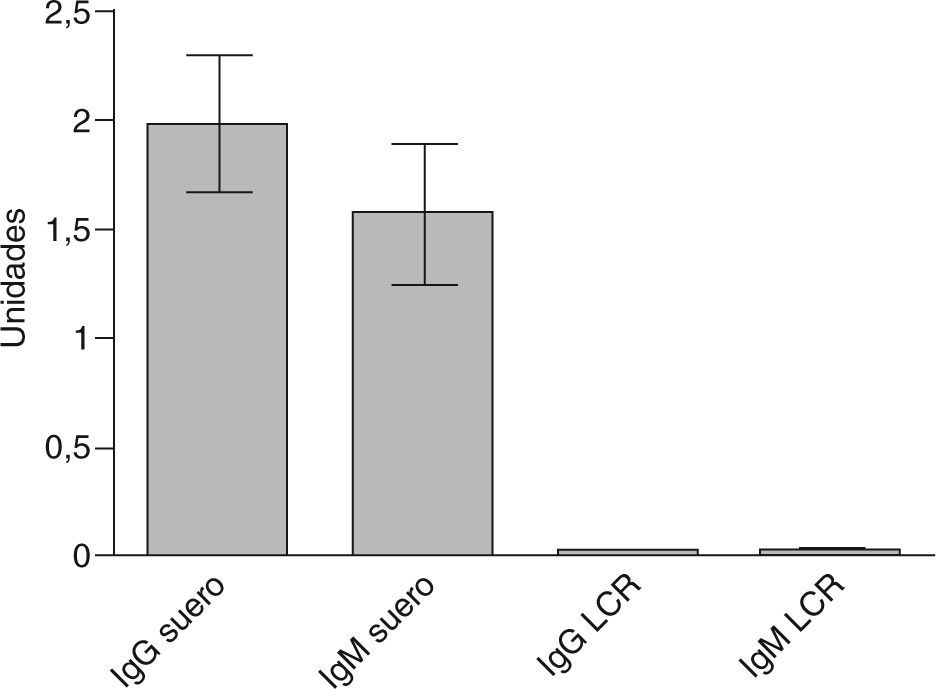
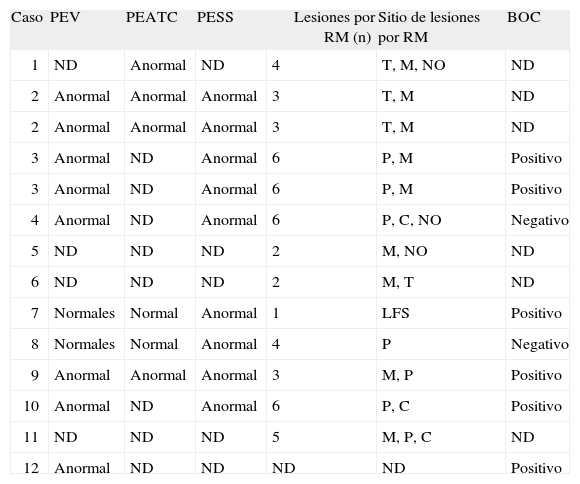
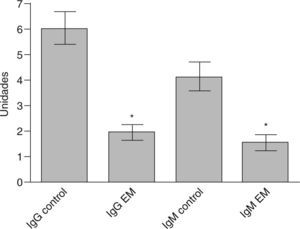
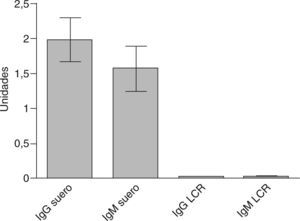
En relación con los estudios paraclínicos, los potenciales evocados visuales se realizaron en 8 pacientes (66,6%), de los cuales 6 fueron anormales (75%) y 2 normales. Los potenciales auditivos de tallo cerebral se realizaron en 5 pacientes (41,6%), y fueron anormales en 3 casos (60%). Los potenciales evocados somatosensoriales se realizaron en 7 pacientes (58,3%) y fueron anormales en todos los casos (100%). En los estudios de RM, el promedio de lesiones evidenciadas (compatibles con EM, según criterios de McDonald) fue de 3,8 (intervalo, 1-10) lesiones. La distribución de las lesiones por RM fue de la siguiente forma: médula en 7 pacientes (63,6%), periventriculares en 6 (54,4%), cerebelo en 3 (25%) y tallo en 2 pacientes (18,1%), e incluso una lesión frontal seudotumoral en 1 (caso 7). El estudio de bandas oligoclonales se determinó sólo en 7 pacientes (58,3%), y se consideró positivo en 5 (71,4%). En estos casos el patrón electroforético encontrado fue policlonal en suero frente a oligoclonal en LCR (tabla 2). En cuanto a las determinaciones inmunológicas, todos los pacientes tuvieron VDRL negativo en suero y en LCR; además, todos presentaron títulos negativos para todos los autoanticuerpos (tanto en LCR como en suero), e incluso los títulos fueron significativamente inferiores respecto del grupo control (fig. 1). En pacientes con EM los títulos de anticuerpos fueron significativamente inferiores en LCR respecto del suero (fig. 2). La distribución de los títulos fue la siguiente: para el anticomplejo cardiolipina-β2GP-1 en suero, el promedio de títulos para la IgG fue 1.939 (intervalo, 0-3,82) U, y para la IgM, 1.547 (intervalo, 0-4,3) U. En cuanto a la determinación en LCR, el promedio para IgG fue 0,014 (intervalo, 0,010-0,026) U, y para la IgM, 0,015 (intervalo, 0-0,158) U.
Características paraclínicas
| Caso | PEV | PEATC | PESS | Lesiones por RM (n) | Sitio de lesiones por RM | BOC |
| 1 | ND | Anormal | ND | 4 | T, M, NO | ND |
| 2 | Anormal | Anormal | Anormal | 3 | T, M | ND |
| 2 | Anormal | Anormal | Anormal | 3 | T, M | ND |
| 3 | Anormal | ND | Anormal | 6 | P, M | Positivo |
| 3 | Anormal | ND | Anormal | 6 | P, M | Positivo |
| 4 | Anormal | ND | Anormal | 6 | P, C, NO | Negativo |
| 5 | ND | ND | ND | 2 | M, NO | ND |
| 6 | ND | ND | ND | 2 | M, T | ND |
| 7 | Normales | Normal | Anormal | 1 | LFS | Positivo |
| 8 | Normales | Normal | Anormal | 4 | P | Negativo |
| 9 | Anormal | Anormal | Anormal | 3 | M, P | Positivo |
| 10 | Anormal | ND | Anormal | 6 | P, C | Positivo |
| 11 | ND | ND | ND | 5 | M, P, C | ND |
| 12 | Anormal | ND | ND | ND | ND | Positivo |
BOC: bandas oligoclonales; C: cerebelo; LFS: lesión frontal seudotumoral; M: médula; ND: no disponible; NO: nervio óptico; P: periventricular; PEATC: potenciales auditivos; PESS: potenciales evocados somatosensitivos; PEV: potenciales evocados visuales; T: tallo.
México ha sido considerado como un país con baja incidencia de EM5,36; sin embargo, estudios recientes han comunicado un incremento en la frecuencia de casos2,7–12. Este incremento puede explicarse por diversos factores: a) incremento en el número de pacientes que son diagnosticados debido a un mayor conocimiento de la enfermedad por parte de la comunidad médica y la población en general9; b) mayor disponibilidad actual de estudios de imagen de alta resolución para su diagnóstico, en especial la RM estructural y funcional; c) disminución de la alimentación infantil con leche materna, que puede conferir inmunidad pasiva contra algunas enfermedades infecciosas4; d) incremento en la frecuencia de enfermedades virales, como el herpes y el virus de la varicela zoster en la población mexicana, y cuyo antecedente se ha considerado como factor de riesgo para el desarrollo de EM37,38, y e) el incremento mundial de enfermedades autoinmunitarias y alérgicas asociadas, entre otras cosas, al uso diseminado de antibióticos y medidas antibacteriales (hipótesis de la higiene)39. Sin embargo, este incremento en la incidencia de la EM está basado sólo en los pocos estudios con los que se cuenta en la población mexicana, los cuales aún resultan insuficientes para estimar la situación real de la EM en México11.
En este artículo, se presenta un estudio prospectivo realizado en población mexicana, en un hospital de concentración, a lo largo de 1 año, que incluye sólo a pacientes con diagnóstico de certeza, según criterios revisados de McDonald14, y excluye por completo otras enfermedades concomitantes. Es importante resaltar el antecedente de un trabajo descriptivo previo en la misma población hospitalaria, a lo largo de 5 años, en que se obtuvo una incidencia anual de 12,6 casos40.
En el presente trabajo, obtuvimos una incidencia anual de 12 pacientes; sin embargo, no se incluyó a 4 pacientes que no completaron su protocolo diagnóstico al momento del cierre del estudio, y otros más (n = 5), en los que se sospechaba de EM pero cursaban con otras enfermedades intercurrentes.
Con respecto a las características clínicas de los pacientes, se encontró un predominio femenino (58%), así como una forma de presentación de tipo brote-remisión en la mayoría de los casos (58%), con sólo un 8% de casos con forma primaria progresiva, lo cual es previsible debido a que se trató de pacientes recientemente diagnosticados, lo cual concuerda con informes internacionales y nacionales previos12,41. El promedio de edad encontrado fue 32 años, un poco más alto que lo comunicado previamente en pacientes mexicanos (González et al9, 1995, 27 años; Velázquez et al12, 2002, 27 años). El tiempo promedio de evolución de la enfermedad al momento del diagnóstico fue de 5,8 años, un tiempo de atraso en el diagnóstico más alto que lo comunicado previamente (Luna40, 4,1 años; González et al9, 3,8 años). Estas cifras pueden deberse a que la mayoría de los pacientes incluidos ya habían recibido tratamiento previo por otras instancias médicas antes de llegar al HGM, e incluso estaban en tratamiento por otro diagnóstico etiológico.
Los síntomas clínicos más comunes coinciden con los informes previos, con una alta frecuencia de neuritis óptica (66,6%) (Luna40, 61,9%; Velázquez-Quintana et al2, 56%; González et al9, 28%) y afección medular (58,3%). Notablemente, esta característica se asemeja a lo comunicado en poblaciones asiáticas42, pero es mayor que lo observado en otros países de América del Sur (Vizcarra-Escobar et al43, 2005, 36%) o Europa41, lo cual pone de relieve la heterogeneidad genética de la población mexicana y su relación genealógica con la población asiática, más que con la europea44.
La mayoría de los pacientes incluidos tenían escalas bajas de discapacidad (EDSS, 4,75 puntos), lo cual ya ha sido comunicado en estudios previos, y se ha relacionado con las edades más tempranas de inicio y con los síntomas de neuritis óptica que pueden conllevar un mejor pronóstico9.
Respecto a los hallazgos inmunológicos, en este estudio no se encontraron títulos en intervalos positivos para anticuerpos anticardiolipina-β2GP-1 en ningún caso, ni en LCR ni en sangre. En la literatura hay una gran variabilidad en la obtención de anticuerpos antifosfolipídicos en pacientes con EM, desde el 10%19,21,45 hasta el 88%23, aunque también hay gran variabilidad metodológica en su determinación y en las condiciones clínicas de los pacientes estudiados, lo cual puede explicar estas grandes discrepancias.
Por un lado, los estudios buscan distintos anticuerpos dirigidos contra diversos antígenos: cardiolipina, β2GP-1, trombina, fosfolípidos específicos, factor VII, etc., así como diferentes isotipos de inmunoglobulinas IgG e IgM; en este caso, la variabilidad en los resultados puede reflejar una expresión diferencial de estos autoanticuerpos en los pacientes con EM en distintas circunstancias26. Otra variable que considerar son las condiciones clínicas de los pacientes estudiados, ya que algunos estudios no mencionan si los pacientes se encuentran en brote agudo de la enfermedad o en remisión, o si se trata de pacientes con formas progresivas o recurrentes de la enfermedad, lo cual puede afectar a la expresión de estos autoanticuerpos. Otro factor de confusión es la posible utilización de tratamientos inmunomoduladores (interferones, inmunosupresores, esteroides, etc.), que también pueden modificar la expresión de los anticuerpos31. Los estudios a este respecto han mostrado que el uso de interferones beta puede incrementar la expresión de autoanticuerpos séricos, como la antitiroglobulina y los antimicrosomales, aunque no se han detectado anticuerpos antifosfolipídicos46. En el presente estudio, se decidió realizar la determinación de anticuerpos contra el complejo β2GP-1 debido a que se trata del principal antígeno al que se unen los autoanticuerpos que se observan en el SAF47.
Lamentablemente, los resultados de los anticuerpos β2GP-1 en EM en los estudios comunicados hasta el momento también son muy variables, ya que se ha informado de casos positivos desde el 82% en pacientes con exacerbación aguda26 hasta el 6% en algunos casos20, o ninguno48. Esta variabilidad puede estar relacionada con los factores clínicos y metodológicos ya comentados, puesto que hasta el momento no existen informes consistentes sobre la frecuencia de estos anticuerpos22–24,26–28,32. En este trabajo, no se tiene documentado el estado de actividad de la enfermedad en los pacientes al momento del estudio, y la mayoría de los casos habían recibido ya algún tratamiento inmunomodulador al momento de la prueba, lo cual puede explicar en parte la negatividad de los estudios inmunológicos. Otra limitación de nuestro estudio es que no se contó con un grupo control de pacientes sanos o con otra enfermedad para las determinaciones de anticuerpos en LCR, lo cual limita la capacidad de analizar el comportamiento de estos anticuerpos en el LCR, datos que, por cierto, no se han publicado hasta el momento27.
Hasta donde tenemos conocimiento, éste es el primer trabajo en que se comunican los títulos de anticuerpos AFL, tanto en sangre como en LCR, en una muestra de pacientes mexicanos con EM. Desconocemos si el origen étnico tiene algún papel o no en la presencia de estos anticuerpos, una cuestión a investigar en futuros estudios mediante herramientas moleculares. En tanto, la significación de estos anticuerpos en la patogenia de la enfermedad es aún incierta, aunque algunos autores sugieren que pueden tener un papel en la alteración de la permeabilidad de la barrera hematoencefálica durante las exacerbaciones agudas de la EM26.
Finalmente, también es importante mencionar que, a pesar de la positividad de estos anticuerpos, en ningún caso de EM se ha documentado que éstos generen trastornos de coagulación que se traduzcan en fenómenos vasooclusivos clínicos. A pesar de las evidentes limitaciones metodológicas del presente estudio, consideramos que los resultados tienen relevancia debido a que sus hallazgos coinciden con algunos estudios en los que se ha comunicado una baja frecuencia de anticuerpos AFL en pacientes con EM, lo cual apoya la hipótesis de que estos autoanticuerpos no están en todos los casos, sino sólo en una parte de ellos que reúnen características específicas; sin embargo, serán necesarios más estudios en poblaciones más extensas de pacientes, considerando todas las variables tanto clínicas como metodológicas y técnicas, para establecer la frecuencia de presentación, así como el papel que tienen estos anticuerpos en la patogenia de la enfermedad y su relación con distintas variables clínicas.
AgradecimientosLos autores agradecen a los Dres. Francisco J. Mena Barranco, Rosalía Vázquez Alfaro, Minerva López Ruiz, Ricardo Ramos Ramírez, por el valioso apoyo y la colaboración para la realización y la revisión de este estudio.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.