Estudios previos demostraron que la atrofia cerebral (AC) aparece precozmente en esclerosis múltiple. Es nuestro objetivo evaluar la AC en pacientes con síndrome desmielinizante aislado (SDA) respecto a un grupo control en una población argentina.
MétodosSe incluyó prospectivamente a pacientes con SDA durante el período junio de 2008 a junio de 2009. El grupo control estaba formado por sujetos sanos apareados por edad y sexo. Se utilizó el programa SIENAX para medir el volumen cerebral total (VCT), el volumen de sustancia gris (VSG) y de sustancia blanca (VSB) en cada grupo. Los datos se compararon con la prueba de Mann-Whitney. Se consideró significativo p<0,05.
ResultadosSe incluyó a 20 pacientes con SDA y 30 controles sanos (8 frente a 17 mujeres; p=0,11). La media de edad en SDA fue 35±6 frente a 34,4±5 años en controles (p=0.61). El EDSS de los pacientes con SDA fue 1,1±0,5; 18 pacientes (90%) con SDA tenían lesiones en la resonancia magnética cerebral. El VCT en SDA fue 1,6±0,22 μl×106 frente a 1,65±0,15×106 en controles (p=0,005); el VSG en SDA fue 0,58±0,05×106 frente a 0,67±0,03×106 en controles (p ≤ 0,001), y el VSB en SDA fue 1±0,1×106 frente a 1,12±0,02×106 en controles (p=0,03).
ConclusionesÉste es el primer estudio en una población latinoamericana con SDA que demostró atrofia cerebral con predomino en la sustancia gris, respecto a un grupo control. Esta herramienta es coste-efectiva para la medición de la AC, aspecto poco estudiado en nuestro medio.
Previous reports have shown that brain atrophy appears early in the course of multiple sclerosis (MS). The aim of the present study was to evaluate whether brain atrophy already exists in clinically isolated syndrome (CIS) by comparing with a control sample.
MethodsPatients with CIS were included prospectively from June 2008 to June 2009. A control group of healthy persons, matched by age and gender with CIS, was also included during the same period of time. An automated analysis tool, SIENAX, was used to obtain total brain volume (TBV), gray matter volume (GMV) and white matter volume (WMV). Mann-Whitney U test was used to analyze the data.
ResultsTwenty CIS patients and 30 healthy controls were included (8 vs. 17 females, p=0.11). Mean age for CIS was 35±6 years vs. 34.4±5 in controls (p=0.61). Mean EDSS in CIS was 1.1±0.5. Eighteen patients with CIS (90%) had abnormal baseline MRI. The TBV in CIS was 1.6μl±0.22μl×106 vs.1.65±0.15×106 in controls (p=0.005), the GMV in CIS was 0.58±0.05×106 vs. 0.67±0.03×106 in controls (p ≤ 0.001) and the WMV in CIS was 1±0.1×106 vs. 1.12±0.02×106 in controls (p=0.03).
ConclusionsThis is the first study dealing with brain atrophy in a CIS sample from Latin America in which brain atrophy, mainly grey matter atrophy, was shown in early stages of the disease compared with healthy individuals.
La esclerosis múltiple (EM) se caracteriza por episodios recurrentes de disfunción neurológica en el 80% de los pacientes. La mayoría de los pacientes se presentan inicialmente con un síndrome desmielinizante aislado (SDA), caracterizado por un evento neurológico bien definido que dura más de 24 h y que afecta a la sustancia blanca cerebral, el tronco cerebral, la médula espinal, el cerebelo y los nervios ópticos, entre otros, habiéndose descartado otras enfermedades1.
Clásicamente, la EM se ha descrito como una enfermedad exclusiva de la sustancia blanca1. Sin embargo, recientes investigaciones han demostrado que junto con el daño de la mielina también hay un importante daño neuroaxonal en la sustancia gris cerebral2,3. Esto se ha demostrado mediante técnicas avanzadas de imágenes cerebrales (resonancia magnética [RM]) y posteriormente confirmado mediante estudios histopatológicos, así estos trabajos han dado origen a los pilares de la hipótesis neurodegenerativa como factor determinante de la progresión de la enfermedad y la discapacidad en pacientes afectados4–8.
Si bien en la EM existen evidencias claras de la pérdida neuroaxonal temprana y consecuente atrofia, esto ha sido escasamente evaluado en pacientes tras el SDA9.
Considerando lo previo, el objetivo del presente trabajo fue evaluar el volumen de la atrofia cerebral (AC) en pacientes con SDA en comparación con un grupo control de individuos sanos.
MétodosCasosSe incluyó, de manera prospectiva, a pacientes con SDA evaluados en la Sección de Enfermedades Desmielinizantes del Hospital Italiano de Buenos Aires durante el período junio de 2008 a junio de 2009. Los criterios de inclusión fueron presentar un síndrome clínico indicativo de desmielinización del sistema nervioso central (SNC) que afectara a los nervios ópticos, tronco cerebral, médula espinal u otras regiones, no atribuible a otras enfermedades. Los pacientes que en el interrogatorio comunicaron historia de trastorno neurológico focal que hubiese durado más de 24 h fueron excluidos. La evaluación clínica inicial fue realizada en todos los casos por un neurólogo con amplia experiencia en el manejo de enfermedades desmielinizantes considerando aspectos clínicos, demográficos y estudios complementarios. A todos los pacientes se les realizó una RM de cerebro y columna cervical a los 1,5-3 meses del evento. Ésta se efectuó con resonador Siemens 1.5 Tesla con técnicas de adquisición estandarizadas de imágenes para pacientes con enfermedades desmielinizantes (densidad protónica, T2 convencional, FLAIR, T1 sin y con contraste intravenoso). La RM fue evaluada por neurorradiólogos ciegos al objetivo del estudio. Se excluyó a los pacientes que habían recibido glucocorticoides en el mes previo a la realización de la RM.
ControlesEl grupo control consistió en personas sanas apareadas por edad y sexo con los casos de SDA sin historia previa de trastorno neurológico orgánico y/o funcional. Por cada paciente, se identificó al menos un control. Al ser identificado el control, se lo invitó a participar y tras su aceptación y posterior consentimiento por escrito se lo incluyó en el estudio. El protocolo de RM para los controles fue el mismo que para los casos. El apareamiento de los casos con los controles se realizó por frecuencia, seleccionando los controles que tuvieran iguales edad y sexo que los casos seleccionados.
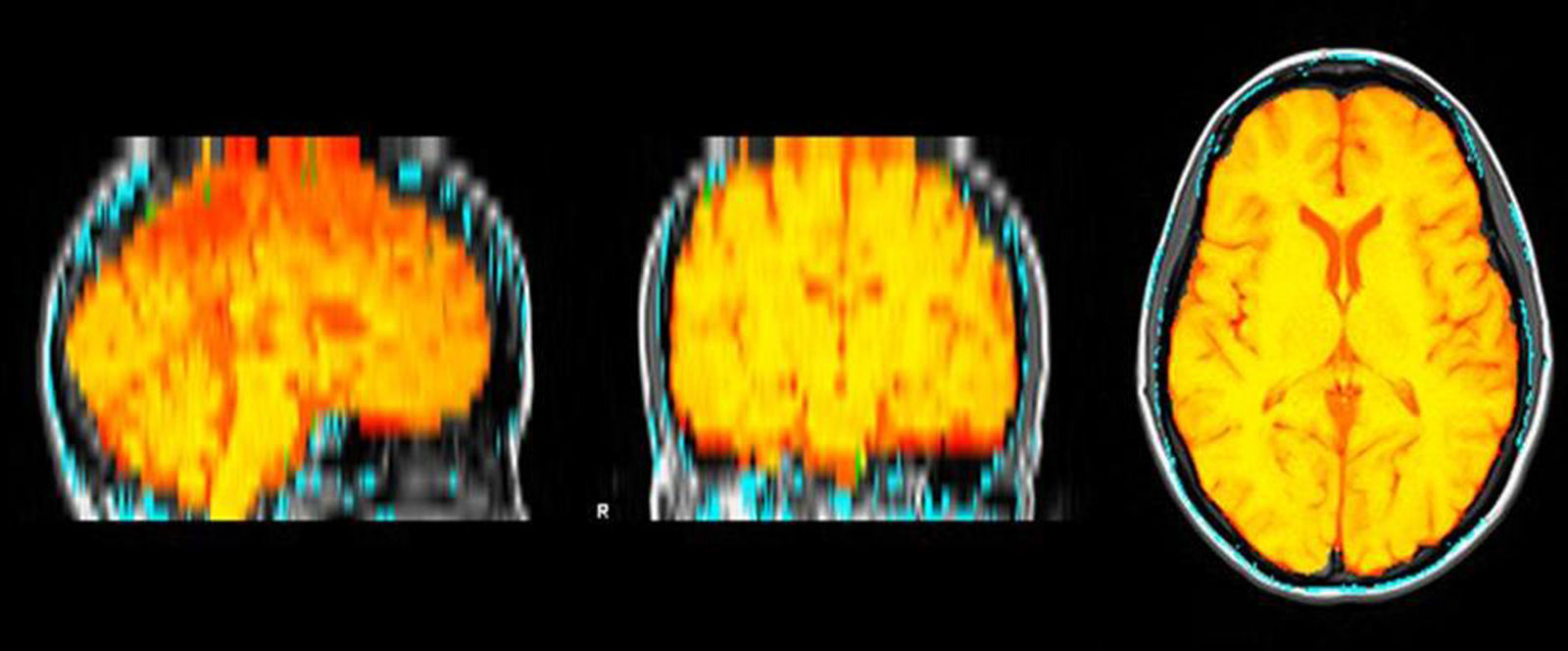
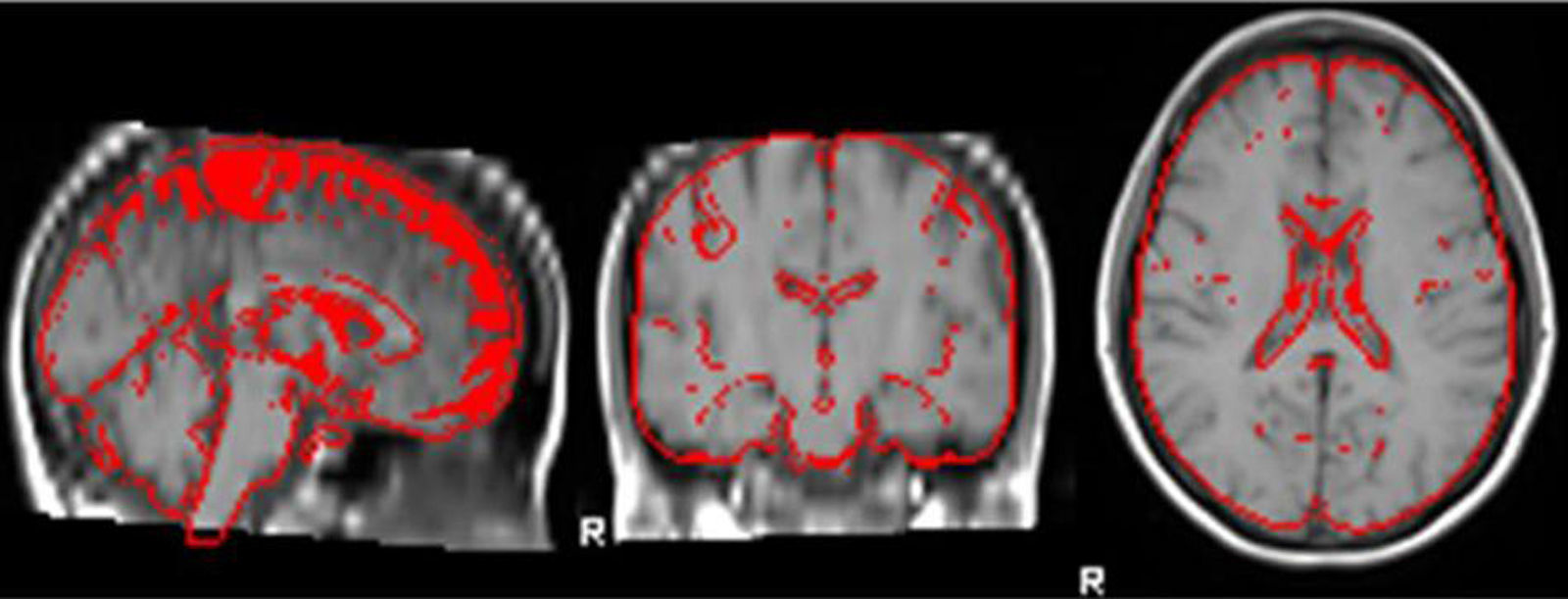
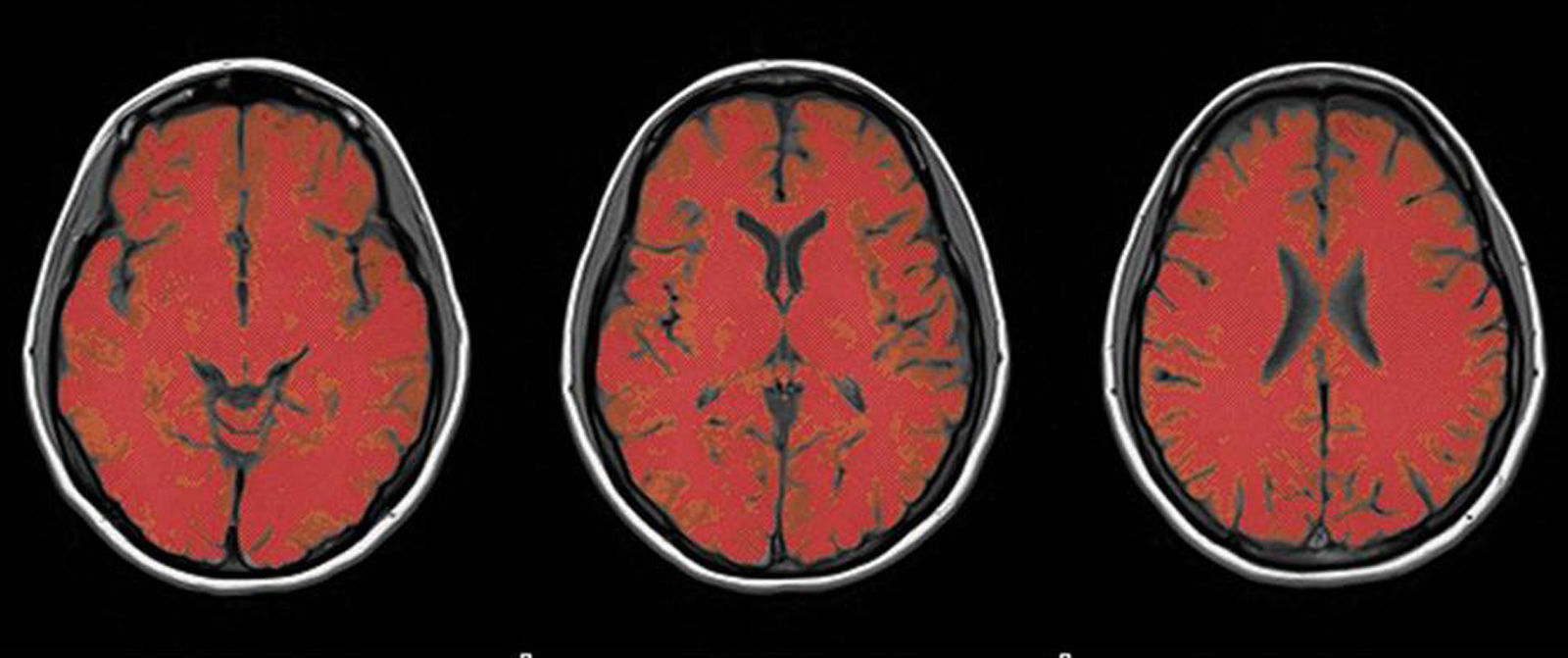
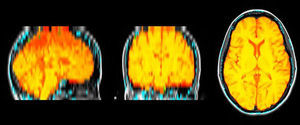
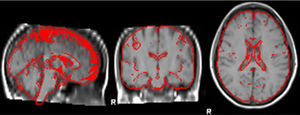
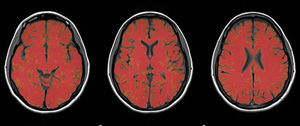
Medición del volumen cerebralUtilizando las secuencias T1 de la RM, se realizaron las mediciones de los volúmenes cerebrales (volumen cerebral total [VCT], volumen de sustancia gris neocortical [VSG] y volumen de sustancia blanca [VSB]) aplicando el método y el software automatizado de medición de atrofia cerebral SIENAX10. Para realizar la medición, SIENAX utiliza la herramienta BET (brain extraction tool), parte de los software de la librería FSL-FMRIB'S para extraer el cerebro y el cráneo de las imágenes de RM (fig. 1). Una vez extraído, un programa de segmentación tisular (FAST, otro software parte de la librería FSL)11 segmenta la imagen obtenida en sustancia gris neocortical, sustancia blanca y LCR, estimado así una vez segmentado el VCT, el VSG y el VSB16. De esa manera, SIENAX es capaz de obtener volúmenes cerebrales precisos y de manera automatizada (fig. 2). Ese volumen cerebral una vez obtenido luego se multiplica por un factor de normalización preestablecido y ya incorporado al software que determina los volúmenes cerebrales finales normalizados para el paciente (fig. 3).
El estudio fue aprobado por el Comité de Ética de Protocolos de Investigación del Hospital Italiano de Buenos Aires y todos los casos y controles dieron el consentimiento informado antes del ingreso en el estudio.
Análisis estadísticoLas características basales de la población evaluada se comunicó en porcentajes para los datos categóricos y en media y desviación estándar (DE) como medida de dispersión para los datos continuos. Los datos se compararon mediante la prueba exacta de Fisher y la U de Mann-Whitney para datos categóricos y continuos, respectivamente. Valores de p<0,05 se consideraron significativos. Para el cálculo del tamaño muestral se utilizó la fórmula de cálculo para datos continuos considerando la estimación de la diferencia entre dos medias, usando para tal fin la diferencia de medias en el VCT en pacientes frente a controles. Por datos previos en pacientes con EMRR en estadios tempranos12. Se aceptará para el error tipo I un valor de 0,05 y para el error de tipo II, 0,8. Considerando lo precedente, el tamaño muestral estimado es de 20 pacientes y mínimo de 20 controles. La recolección y el análisis de los datos se realizaron con el programa Stata 9.1.
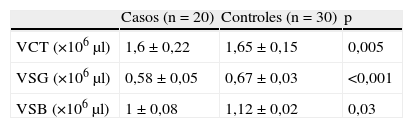
ResultadosSe incluyó en el estudio a 20 pacientes con SDA y 30 controles sanos (razón, 1:1,5). La media de edad de los casos de SDA fue 35±6 años, mientras en los controles fue de 34,4±5 años (p=0,11). El 41% (8) de los casos de SDA eran mujeres frente al 58% (17) en el grupo control (p=0,61). La presentación clínica del SDA fue la siguiente: 8 (40%) con neuritis óptica; 6 (30%) con afección del parénquima cerebral; 4 (20%), del tronco cerebral; 2 (10%), de médula cervical. El EDSS de los pacientes con SDA al momento de la RM fue 1,1±0,5. En la RM, el 90% (18) de los pacientes con SDA tenían lesiones desmielinizantes en cerebro y/o médula cervical. De los 18 pacientes con RM y lesiones, 11 (61%) tenían 2 criterios de Barkhof (CB)2, 6 (33%) cumplían 3 CB y sólo 1 (6%) paciente tenía 4 CB. Respecto a los datos volumétricos, el VCT en pacientes con SDA fue 1,6±0,22μl×106 frente a 1,65±0,15×106 en controles (p=0,005), el VSG en SDA fue 0,58±0,05×106 frente a 0,67±0,03×106 en controles (p ≤ 0,001) y el VSB en SDA fue 1±0,1×106 frente a 1,12±0,02×106 en controles (p=0,03) (tabla 1).
Volúmenes cerebrales en pacientes y controles
| Casos (n=20) | Controles (n=30) | p | |
| VCT (×106μl) | 1,6±0,22 | 1,65±0,15 | 0,005 |
| VSG (×106μl) | 0,58±0,05 | 0,67±0,03 | <0,001 |
| VSB (×106μl) | 1±0,08 | 1,12±0,02 | 0,03 |
VCT: volumen cerebral total; VSB: volumen de sustancia blanca; VSG: volumen de sustancia gris.
Los datos expresan media±desviación estándar.
La medición de la atrofia cerebral es un proceso fundamental que permite tomar conocimiento del daño del parénquima cerebral8,13.
El presente trabajo muestra la presencia de AC en una población de pacientes con SDA, predominantemente de la sustancia gris comparados contra controles sanos.
Si bien hay diversos informes en la literatura que describen el fenómeno de AC temprana en pacientes con EM3,12,14,15, a la fecha son escasos los trabajos que evalúen el fenómeno de atrofia al momento del SDA.
Se desconocen con exactitud el mecanismo y la causa de esta atrofia general y principalmente neocortical. Se sabe que la inflamación de la sustancia blanca, por transección axonal, lleva a la pérdida neuronal y consecuente atrofia cortical3. Sin embargo, es difícil sostener que este mecanismo causa la atrofia ante la presencia de escasa o eventualmente nula inflamación y/o desmielinización de la sustancia blanca subyacente12.
Basados en investigaciones previas y nuestra observación, parecería entonces haber dos mecanismos causantes de la atrofia, el previamente descrito secundario a daño desmielinizante y transección axonal3 y un proceso independiente de los cambios observables en la sustancia blanca y la desmielinización, que explican el porqué de la atrofia en presencia de escasa o nula inflamación12,15,16. Aún quedaría elucidar los mecanismos moleculares de este proceso neurodegenerativo, aunque un proceso apoptótico inducido vía mecanismo inflamatorio podría tener una función primordial en ello.
Si bien se pensaba que la atrofia comenzaba con el inicio clínico de la enfermedad, este y otros trabajos han demostrado que la AC podría estar mucho antes del evento clínico índice. Filippi et al17 han demostrado, con estudios de espectroscopia, la presencia de daño axonal diseminado e irreversible, independiente de las lesiones inflamatorias en la sustancia blanca cerebral, en estadios muy tempranos de la enfermedad, incluso mucho antes del comienzo clínico, por lo que la consecuente atrofia cerebral precoz medida por técnicas cuantitativas, como en el presente informe, podría ser esperable.
Siguiendo esta línea de análisis, es importante destacar el posible papel que tendrían, en cada paciente, ciertos factores asociados a la enfermedad que podrían influir negativamente en la AC y generar una tasa de progresión mayor aún. Entre éstos, se postula que habría factores genéticos que incidirían en una mayor tasa de atrofia, principalmente algunos estudios han implicado la relación entre la APOE-¿4 y una mayor tasa de AC; sin embargo, la asociación hallada ha sido débil y ocasional en los diversos estudios analizados7,18,19. Otro factor asociado con una mayor tasa de AC ha sido la alta cantidad de lesiones cerebrales identificadas en la sustancia blanca desde el comienzo de la enfermedad; sin embargo, hoy esta asociación no se ha demostrado completamente20.
En conclusión, éste es el primer trabajo en una población latinoamericana que explora la atrofia en pacientes con SDA. La atrofia precoz identificada en esta población, respecto al grupo control, se da principalmente en la sustancia gris con poca actividad inflamatoria desmielinizante sobre la sustancia blanca, lo que hace suponer que un mecanismo independiente del de la neurodegeneración por transección axonal actuaría desde los momentos iniciales en la enfermedad, aún mucho más precoces que el del inicio clínico, dañando progresivamente el parénquima cerebral. Futuras investigaciones ayudarán a aclarar los mecanismos moleculares que intervendrían en este proceso y el valor pronóstico del hallazgo.
CongresoSe deja constancia que el trabajo no ha sido presentado en la SEN. Sólo en el Congreso Argentino de Neurología de Mar del Plata 2009, y no ha recibido financiación alguna.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.