El último documento de consenso del Grupo de Estudio de Enfermedades Desmielinizantes de la Sociedad Española de Neurología sobre el tratamiento de la esclerosis múltiple (EM) data del año 2016. Aunque muchas consideraciones continúan todavía vigentes, desde entonces se han producido cambios significativos en el manejo y tratamiento de esta enfermedad, motivados no solo por la aprobación de nuevos fármacos con diferentes mecanismos de acción, sino también por la evolución de conceptos otrora consolidados. Esto ha permitido abordar situaciones especiales como el embarazo y la vacunación desde otra perspectiva, e incluir nuevas variables en la toma de decisiones en práctica clínica, como plantear tratamiento modificador de la enfermedad (TME) de alta eficacia en fases tempranas, considerar la perspectiva del paciente y utilizar nuevas tecnologías como monitorización remota.
Estos cambios han motivado la presente actualización del consenso mediante metodología Delphi, con el objetivo de reflejar el nuevo paradigma de manejo del paciente con EM basándose en la evidencia científica y la experiencia clínica de los participantes.
Entre las principales conclusiones destacan como recomendaciones: iniciar TME inmunomodulador en el síndrome radiológico aislado con actividad radiológica persistente, evaluar la perspectiva del paciente y abandonar la terminología «líneas de tratamiento» en la clasificación de los TME (consenso mayor del 90%). Tras el diagnóstico de EM la elección del primer TME debería considerar la presencia/ausencia de factores de mal pronóstico (epidemiológicos, clínicos, radiológicos y biomarcadores) para la aparición de nuevos brotes o progresión de discapacidad, pudiendo plantear desde el inicio TME de alta eficacia.
The last consensus statement of the Spanish Society of Neurology's Demyelinating Diseases Study Group on the treatment of multiple sclerosis (MS) was issued in 2016. Although many of the positions taken remain valid, there have been significant changes in the management and treatment of MS, both due to the approval of new drugs with different action mechanisms and due to the evolution of previously fixed concepts. This has enabled new approaches to specific situations such as pregnancy and vaccination, and the inclusion of new variables in clinical decision-making, such as the early use of high-efficacy disease-modifying therapies (DMT), consideration of the patient's perspective, and the use of such novel technologies as remote monitoring.
In the light of these changes, this updated consensus statement, developed according to the Delphi method, seeks to reflect the new paradigm in the management of patients with MS, based on the available scientific evidence and the clinical expertise of the participants.
The most significant recommendations are that immunomodulatory DMT be started in patients with radiologically isolated syndrome with persistent radiological activity, that patient perspectives be considered, and that the term “lines of therapy” no longer be used in the classification of DMTs (>90% consensus). Following diagnosis of MS, the first DMT should be selected according to the presence/absence of factors of poor prognosis (whether epidemiological, clinical, radiological, or biomarkers) for the occurrence of new relapses or progression of disability; high-efficacy DMTs may be considered from disease onset.
La esclerosis múltiple (EM) es una enfermedad inflamatoria, desmielinizante y neurodegenerativa del sistema nervioso central (SNC). Habitualmente la enfermedad comienza entre los 20 y 40 años y es la causa más frecuente de discapacidad no traumática en adultos jóvenes, disminuyendo la empleabilidad y productividad de esta población1. Su prevalencia en España ha aumentado en los últimos años y afecta a 80-180 casos por 100.000 habitantes2. Pese a presentar un curso clínico heterogéneo se identifican 3 fenotipos: recurrente-remitente (EMRR), secundaria progresiva (EMSP) y primaria progresiva (EMPP)3. Su evolución se caracteriza principalmente por la presencia o ausencia de actividad (clínica o radiológica) y de progresión de discapacidad, que puede ser dependiente o independiente de los brotes, en un determinado periodo de tiempo.
En los últimos años se han desarrollado guías de consenso destinadas a mejorar ciertos aspectos del manejo de la EM, tanto en el ámbito europeo (2018)4 y de Medio Oriente-África del norte (2020)5 como a nivel nacional en algunos países europeos (2021)6. En España el grupo de enfermedades desmielinizantes de la Sociedad Española de Neurología ha publicado tres documentos de consenso en los años 2010, 2013 y 20177–9. El último consenso7 estaba principalmente centrado en el tratamiento del paciente con EM, y no se utilizó una metodología sistemática y estructurada para formular las recomendaciones. Las novedades en los últimos cinco años son relevantes y numerosas. Entre otras, se han aprobado nuevos tratamientos modificadores de la enfermedad ([TME]; ocrelizumab, cladribina, siponimod, ozanimod, ponesimod, diroximelfumarato, ofatumumab [tabla 1 del material suplementario]), se han actualizado los criterios diagnósticos, se ha generado evidencia sobre el inicio temprano con TME de alta eficacia, cobran creciente importancia las herramientas de evaluación que recogen la percepción de la enfermedad por parte del paciente (patient-reported outcomes [PRO]) y se está intentando trasladar a la práctica clínica la incorporación del seguimiento remoto del paciente utilizado en los ensayos clínicos10-12.
El objetivo del presente documento de consenso es proporcionar un conjunto de recomendaciones actualizadas para el manejo de la EM en España, incluyendo aspectos relacionados con el diagnóstico, tratamiento y seguimiento de los pacientes. Estas recomendaciones han sido revisadas y consensuadas por los componentes del Grupo de Enfermedades Desmielinizantes de la SEN.
MétodosSe utilizó el método Delphi para alcanzar consenso en las recomendaciones. El método Delphi es una técnica que permite obtener la opinión de un grupo de expertos sobre temas complejos de forma estructurada. Se caracteriza por tener un proceso iterativo, garantizar el anonimato y recoger comentarios y feedback de los participantes.
Para este proyecto se constituyó un comité científico formado por cinco miembros (dos de ellos actuaron también como coordinadores) y un grupo de 21 panelistas, todos ellos considerados expertos en EM en el territorio nacional. El proceso Delphi fue desarrollado en diferentes fases: 1) revisión exhaustiva de la literatura; 2) selección de las dimensiones y elaboración de los ítems; 3) selección de los panelistas e invitación a participar a los mismos; 4) primera ronda de evaluación de los ítems; 5) revisión y edición de los ítems no consensuados en función del feedback proporcionado; 6) segunda ronda de revaluación de los ítems no consensuados; y 7) evaluación final de los ítems no consensuados. Las fases 4 y 6 fueron llevadas a cabo por los panelistas, mientras que el comité científico fue responsable del resto.
El nivel de acuerdo con cada ítem fue evaluado utilizando una escala Likert de 9 puntos (1 «completamente en desacuerdo» y 9 «completamente de acuerdo») y los panelistas podían añadir comentarios en cada ítem. Los ítems fueron categorizados (según las puntuaciones) como rechazado (de 1 a 3), indeterminado (de 4 a 6) o aceptado (de 7 a 9) y fueron considerados consensuados si existía un acuerdo ≥66,6% del panel de expertos, igual que en otros estudios con metodología Delphi13,14. Se realizó un análisis descriptivo de los resultados utilizando el programa IBM-SPSS versión 22.
ResultadosSe presentan aquí los resultados derivados del consenso de expertos obtenido mediante el proceso Delphi. En el material suplementario se muestra una representación esquemática de las fases del proceso Delphi (fig. 1 del material suplementario), los ítems consensuados en cada una de las dimensiones (tablas 2-9 y tabla 11 del material suplementario) y el listado de referencias bibliográficas revisadas durante la elaboración de los ítems (revisión de la literatura en material suplementario). En la tabla 1 del material suplementario se recogen los TME aprobados en la actualidad en España, sus indicaciones en la ficha técnica y las condiciones de financiación según informe de posicionamiento terapéutico (IPT).
El grado de consenso fue alto. De los 148 ítems sometidos a estudio se consensuaron 110, de los que 102 fueron aceptados en las rondas 1 o 2 con una media (desviación estándar) de 86,8% (10,3) de acuerdo; de hecho, el 73,5% de los ítems lograron un porcentaje de consenso>80%. En la ronda 2 no se alcanzó consenso en 34 ítems, que fueron evaluados por el comité científico (8 fueron consensuados y 26 no obtuvieron consenso). Los 8 ítems consensuados por el comité científico (tablas 6 y 8 del material suplementario) no disponen del porcentaje de consenso.
Diagnóstico tempranoLos criterios de McDonald 201710 han permitido un diagnóstico más temprano de la EM, principalmente por la inclusión nuevamente de bandas oligoclonales (BOC) en el líquido cefalorraquídeo (LCR) como alternativa a la demostración clínica o por resonancia magnética (RM) de diseminación en el tiempo. La ausencia de datos concluyentes, respecto a precisión diagnóstica, motivó que el nervio óptico no fuera considerado en estos criterios como una de las topografías requeridas para demostrar la diseminación en el espacio. Sin embargo, debido a que es una de las regiones más frecuentemente afectadas al inicio de la enfermedad, y a nuevos datos sobre sensibilidad, especificidad y diagnóstico15, son crecientes las opiniones que sugieren su inclusión16–19. Por otra parte, se han descrito nuevos hallazgos en la RM cerebral20,21 que podrían ayudar a confirmar el diagnóstico de EM17. Otras evaluaciones paraclínicas, como la RM medular, la tomografía de coherencia óptica (optic coherence tomography [OCT]), los potenciales evocados visuales (PEV) o el índice de inmunoglobulina G (IgG) han demostrado su relevancia en el diagnóstico22,23, por lo que se ha consensuado que:
- •
La precisión del diagnóstico de EM se vería incrementada por la inclusión de las lesiones en el nervio óptico en los criterios de diseminación en el espacio. Ante la sospecha de neuropatía óptica se debería evaluar el sistema visual también mediante OCT y PEV.
- •
El signo de la vena central y la presencia de lesiones con anillos de hierro podrían ser marcadores radiológicos de diagnóstico diferencial en pacientes con características clínicas y radiológicas no concluyentes.
- •
La RM medular es recomendable y permite determinar lesiones que pueden guiar la toma de decisión terapéutica.
- •
La evaluación paraclínica inicial debe incluir también la determinación de BOC e índice de producción intratecal de IgG.
En pacientes con síndrome radiológico aislado (radiologically isolated syndrome [RIS]), la presencia de hallazgos como lesiones medulares, lesiones con el signo de la vena central, BOC en LCR o determinados factores demográficos denotan una mayor probabilidad de desarrollar un evento clínico, y se recomienda:
- •
Programar una RM cerebral y evaluación clínica en los siguientes 6-12 meses.
- •
Realizar algunas exploraciones complementarias, como exploración cognitiva, oftalmológica, urológica, PEV y estudio de LCR (si no se ha realizado).
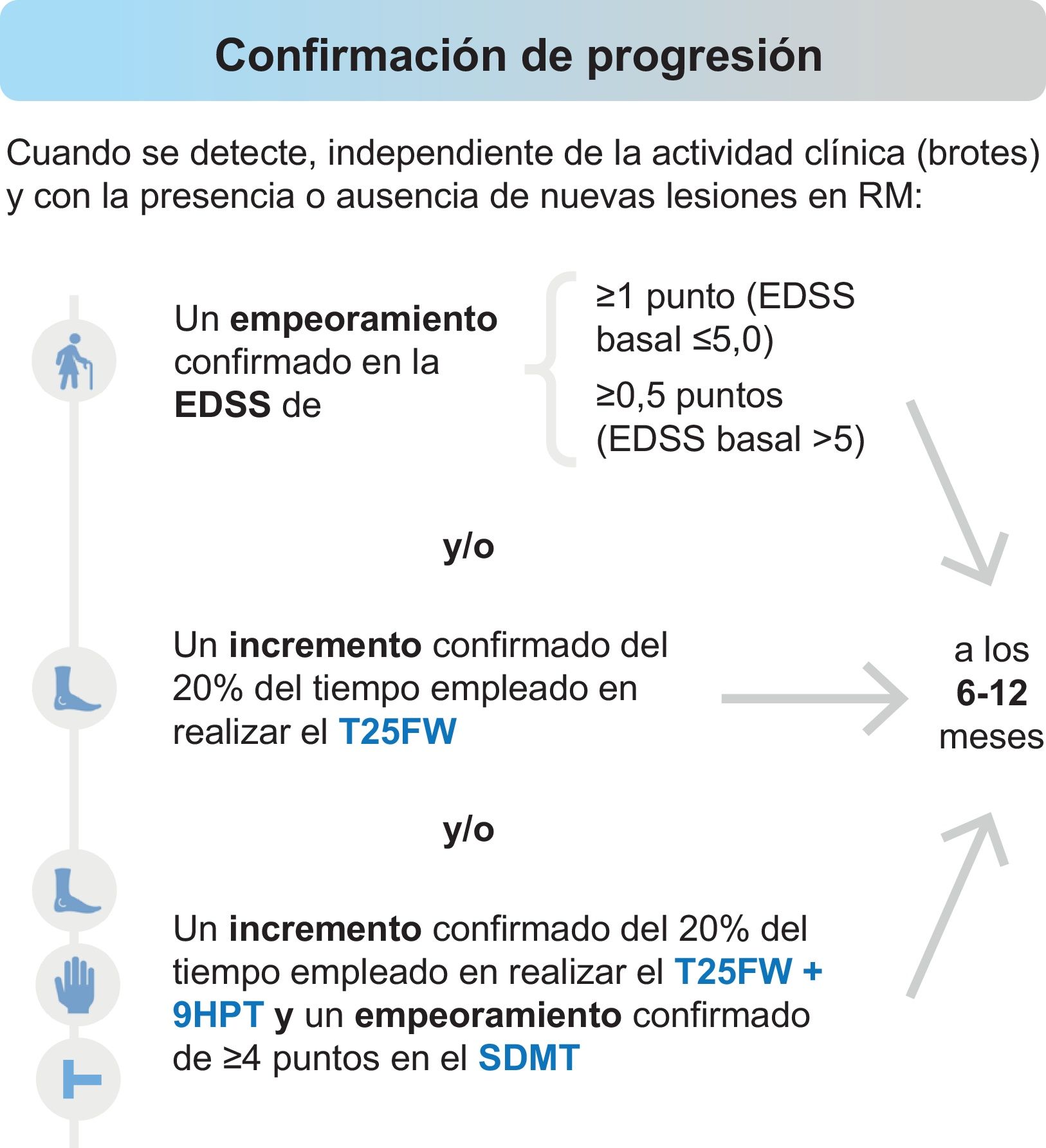
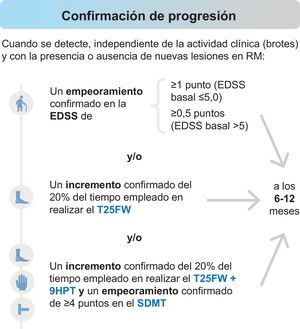
Por su parte, la identificación temprana de la transición de EMRR a EMSP es todo un reto, ya que ambos fenotipos se encuentran dentro de un espectro continuo. Consideramos que se podría confirmar una conversión a una fase progresiva cuando se detecte empeoramiento en medidas de discapacidad (Expanded Disability Status Scale [EDSS]) y/o en la exploración funcional de las extremidades inferiores (Timed 25-Foot Walk [T25FW]) y/o en la exploración conjunta de las extremidades inferiores y superiores (T25FW y Nine-Hole Peg Test [9HPT]) más cognición (Symbol Digit Modalities Test [SDMT]), de forma independiente de la actividad en brotes y con la presencia o ausencia de nuevas lesiones en la RM, tal y como se muestra en la figura 1. Para confirmar la evolución a EMSP con la escala EDSS es recomendable la realización de medidas adicionales de discapacidad (T25FW, 9HTP y SDMT). Un empeoramiento en las medidas de 9HPT y SDMT, de forma independiente, no sería suficiente para realizar el diagnóstico de progresión. Aunque hubo consenso en que un empeoramiento de un 20% exclusivamente en el T25FW puede utilizarse como diagnóstico de progresión (66,7%), confirmar un empeoramiento funcional en las extremidades inferiores (T25FW), junto con las superiores (9HPT), y de la velocidad de procesamiento de la información (SDMT) alcanzó pleno consenso (100%).
Evaluaciones para confirmar la progresión.
EDSS: Escala expandida del estado de discapacidad (Expanded Disability Status Scale); SDMT: Test de símbolos y dígitos (Symbol Digit Modalities Test); 9HPT: Prueba de los 9 palitos (Nine-Hole Peg Test); T25FWT: Prueba de la marcha cronometrada de 25 pies (Timed 25-Foot Walk).
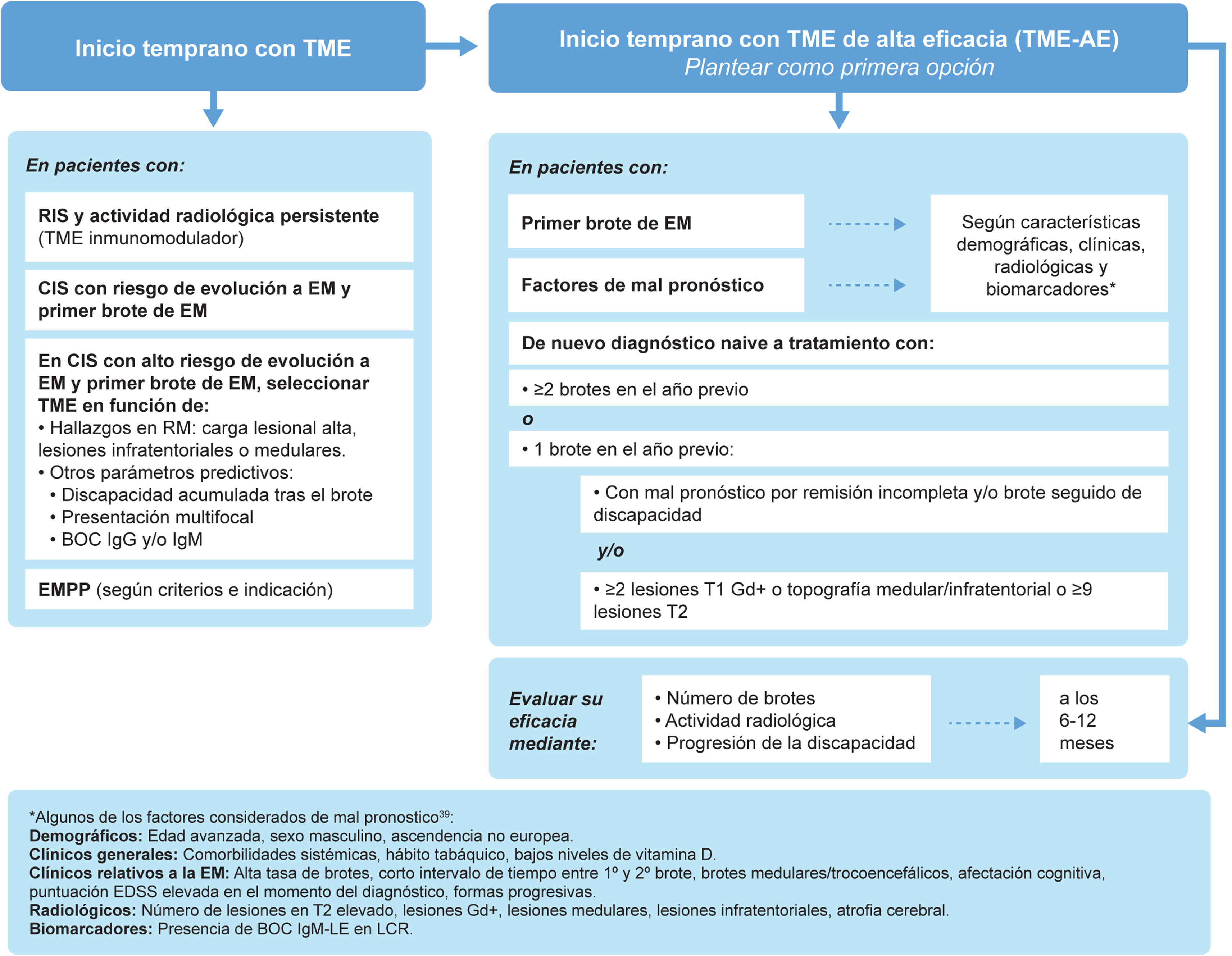
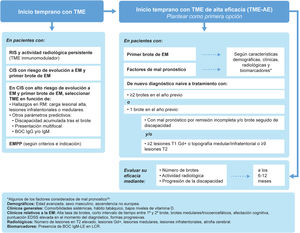
El síndrome clínico aislado (clinically isolated syndrome [CIS]) se define como un episodio único de síntomas neurológicos que sugieren EM. Aunque no todos los pacientes con CIS desarrollarán EM24, la mayoría sí lo hará, con tasas de hasta el 60% de pacientes con CIS con diagnóstico confirmado de EM durante los siguientes 4 años25. Varios estudios han demostrado los beneficios de comenzar TME temprano en esta población26–28. La cohorte de Barcelona, con un seguimiento mínimo de 10 años, reveló que los pacientes con CIS que iniciaron TME de forma temprana (mediana de 4 meses tras el brote) tuvieron menos riesgo de alcanzar una EDSS de 3 que aquellos que iniciaron TME más tarde (mediana de 36 meses)26. Entre los factores que predicen un peor pronóstico en el CIS destaca la alta carga lesional en la RM26,29, particularmente en la región infratentorial24. De hecho, en un estudio prospectivo con 1.015 pacientes con CIS concluyó que el número de lesiones en la RM cerebral es un factor pronóstico de alto impacto, mientras que la presencia de BOC de IgG es de mediano impacto y las características demográficas y topográficas son de bajo impacto30. Por otra parte, la presencia de lesiones medulares31 y de lesiones medulares con al menos 2 lesiones realzadas gadolinio en el CIS32 aumenta significativamente el riesgo de progresión. Teniendo en cuenta los beneficios del inicio temprano con TME, y según el diagnóstico del paciente, se recomienda (fig. 2):
- •
En pacientes con RIS con actividad radiológica persistente habría que plantearse iniciar TME inmunomodulador.
- •
En pacientes con un primer brote de EM o CIS con riesgo de evolución a EM:
- ∘
Ofrecer terapia con TME, aunque la carga lesional sea baja, y una vez excluidos otros posibles diagnósticos.
- ∘
Iniciar TME si la carga lesional es alta y hay factores de mal pronóstico o en pacientes con lesiones infratentoriales/medulares.
- ∘
La elección del TME debería estar basada en parámetros predictivos, tales como hallazgos en la RM, discapacidad acumulada tras el brote, presentación multifocal y BOC.
- ∘
- •
En pacientes recientemente diagnosticados de EM se debería ofrecer TME tan pronto fuera posible, para controlar la actividad y la progresión. Se podría iniciar tratamiento con un TME de alta eficacia (TME-AE), según las características del tratamiento, las características clínicas y radiológicas del paciente, su estilo de vida y preferencias.
- •
En pacientes con EMPP parece razonable iniciar TME lo antes posible según criterios e indicación del tratamiento, aunque el grado de evidencia sea bajo.
Inicio temprano del tratamiento modificador de la enfermedad.
*Entre los factores considerados de mal pronóstico (no todos los factores tienen el mismo peso específico en la toma de decisiones): características demográficas (edad avanzada, sexo masculino, procedencia no europea); características clínicas generales (comorbilidades sistémicas, hábito tabáquico, bajos niveles de vitamina D); datos clínicos relativos a la EM (alta tasa de brotes, intervalo corto entre 1.er y 2.° brote, inicio en tronco cerebral, cerebelo o médula espinal, escasa recuperación tras 1.er brote, elevada puntuación EDSS al diagnóstico, inicio polisintomático, déficits cognitivos, formas progresivas); datos radiológicos (elevado número de lesiones en secuencia T2, elevado volumen lesional en secuencia T2, presencia de lesiones Gd+ medulares e infratentoriales, atrofia cerebral global o en sustancia gris); biomarcadores de mal pronóstico (BOC IgM en LCR)39.
BOC: bandas oligoclonales; CIS: síndrome clínico aislado (clinically isolated syndrome); EM: esclerosis múltiple; EMPP: EM primaria progresiva; Gd+: con realce de gadolinio; IgM: inmunoglobulina M; RIS: síndrome radiológico aislado (radiologically isolated syndrome); RM: resonancia magnética; TME: tratamiento modificador de la enfermedad.
La disponibilidad un alto número de TME y la escasez de biomarcadores precisos para predecir su efectividad y seguridad en cada individuo hace que la elección del tratamiento personalizado sea todo un reto. Tradicionalmente se ha utilizado una estrategia de escalado terapéutico, en la que se trataba inicialmente con TME de eficacia moderada y bajo riesgo (llamados clásicamente de «primera línea») y se cambiaba a un TME-AE con más riesgo de acontecimientos adversos graves («segunda línea») si el paciente presentaba actividad de la enfermedad. A pesar de que aún no hay resultados de ensayos clínicos comparando directamente el escalado terapéutico con el uso de TME-AE como primer tratamiento, algunos estudios observacionales y análisis de subgrupos de ensayos clínicos, de forma consistente y con un aceptable nivel de evidencia, han mostrado que los pacientes con inicio temprano de TME-AE tuvieron, al menos en los siguientes cinco años, menos actividad de la enfermedad33,34, menos discapacidad34,35 y menos riesgo de progresar a EMSP36 que los que iniciaron estos tratamientos más tarde.
El objetivo último del tratamiento actual de la EM es conseguir el mejor control posible de la enfermedad, medido por la no evidencia de la actividad de la enfermedad (NEDA) y la mejor calidad de vida posible para el paciente. En estudios de vida real se ha visto que la probabilidad de alcanzar NEDA en los pacientes con inicio temprano de TME-AE es de aproximadamente el doble que los tratados con TME de eficacia moderada37. Por ello, y considerando que la actividad clínica o subclínica persistente podría causar daño neurológico irreversible, permitiendo la activación de vías moleculares que favorecen la progresión, es posible tratar con un TME-AE como primera opción, una vez se haya evaluado al paciente y los riesgos y beneficios del tratamiento. En particular, se recomienda comenzar con un TME-AE (fig. 2) en pacientes:
- •
Con factores de mal pronóstico demográficos, clínicos y radiológicos.
- •
De nuevo diagnóstico naive a tratamiento que presenten ≥2 brotes en el año previo.
También podrían ser candidatos para comenzar como primera opción con un TME-AE los pacientes:
- •
Con un primer brote de EM, en función de las características del paciente y de la enfermedad, sin necesidad de retrasar el tratamiento o de realizar un escalado terapéutico.
- •
De nuevo diagnóstico naive a tratamiento que hayan presentado un solo brote en el año previo, pero con evidencia clínica (remisión incompleta y/o brote seguido de discapacidad) y/o radiológica de un mal pronóstico, siendo esta evidencia radiológica≥2 lesiones T1 con realce de gadolinio (Gd+) o topografía medular/infratentorial o ≥9 lesiones T2.
A pesar de que existen datos que muestran que los pacientes con más actividad33, los más jóvenes38 y los que tienen menor duración de la enfermedad38 son los que podrían beneficiarse más del inicio temprano con TME-AE, se necesita más evidencia para recomendar el comienzo temprano con TME-AE en pacientes jóvenes de nuevo diagnóstico naive, independientemente del número de brotes previos o actividad radiológica.
En general, tras el diagnóstico de EM, la elección del tratamiento inicial no se debe basar en la utilización de las clásicamente denominadas «líneas de tratamiento», sino principalmente en la presencia o ausencia de factores de mal pronóstico (epidemiológicos, clínicos, radiológicos y otros biomarcadores) para la aparición de nuevos brotes o progresión de discapacidad (el 94,7% de los panelistas estuvieron de acuerdo con esta afirmación). Consideramos que, tanto la inercia terapéutica (mantener el mismo tratamiento pese a la presencia de actividad clínica o radiológica) como el denominado cycling (escalado lateral con TME orales e inyectables de moderada eficacia), retrasan el inicio de un TME-AE y suponen una pérdida de oportunidad terapéutica, considerando que la actividad clínica o subclínica persistente puede causar daño neurológico irreversible. En cualquier caso, la decisión de iniciar tratamiento será realizada en conjunto con el paciente, considerando sus prioridades y preferencias.
Para personalizar al máximo el tratamiento y conseguir el mejor control posible de la enfermedad, tras el inicio del TME, hay que evaluar periódicamente su efectividad. Para los TME-AE de comienzo temprano se recomienda evaluar su efectividad mediante el número de brotes y/o actividad radiológica a los 6-12 meses y la progresión de la discapacidad a los 6-12 meses.
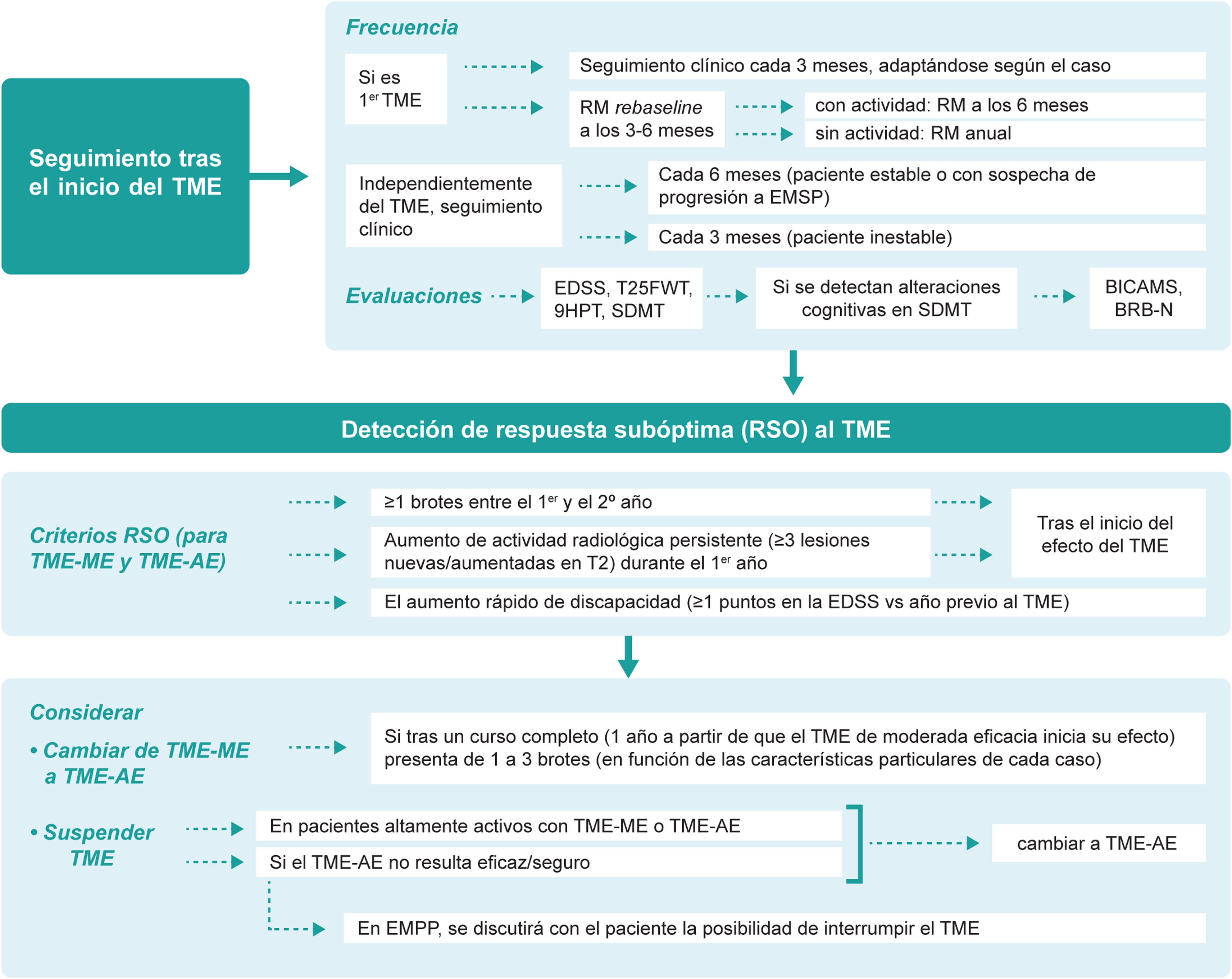
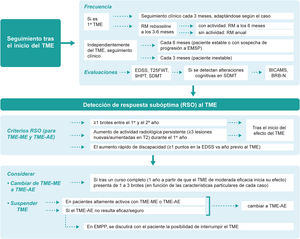
Seguimiento presencial y remotoDado que aún no se dispone de biomarcadores lo suficientemente precisos para predecir la idoneidad del TME elegido en cada paciente, el seguimiento minucioso tras el inicio del tratamiento desempeña un papel incuestionable. Se estima que el intervalo entre el inicio del TME y su efecto sobre la aparición de los brotes es de unas 12-30 semanas y sobre la progresión de la discapacidad de unas 30-70 semanas40. La guía MAGNIMS–CMSC–NAIMS recomienda realizar una RM re-baseline a los 3 a 6 meses después del inicio del TME para la detección de nuevas lesiones que acontezcan antes de que el TME comience a tener efecto y posteriormente de forma anual19. Además del seguimiento clínico y radiológico, la evaluación de la cognición aporta información de la situación actual y futura del paciente, pudiendo servir como un marcador temprano de la enfermedad41,42. Nuestras recomendaciones respecto al seguimiento presencial del paciente son (fig. 3):
- •
Tras el inicio del primer TME la periodicidad de seguimiento recomendada es cada 3 meses. No obstante, la frecuencia de las visitas será adaptada caso por caso, en función de las características del paciente y del tratamiento.
- •
Independientemente del TME (moderada o alta eficacia), el seguimiento debería realizarse al menos cada 6 meses en pacientes con estabilidad clínica y radiológica y cada 3 meses (si fuera posible) en pacientes con inestabilidad. Cuando se sospeche que el paciente esté progresando a una EMSP se recomienda realizar un seguimiento al menos cada 6 meses.
- •
Se debería realizar una RM a los 3-6 meses del inicio del TME (re-baseline) y de manera anual posteriormente. En caso de detectar actividad radiológica sin actividad clínica realizar otra RM a los 6 meses. Aunque la realización de esta RM es recomendable puede ser difícil de conseguir en la práctica clínica, incluso en centros de referencia, por cuestiones logísticas, organizativas, tecnológicas o asistenciales.
- •
Las evaluaciones clínicas recomendadas en las visitas de seguimiento son: la EDSS, el T25FW, el 9HPT y el SDMT. Para el cribado de la afectación cognitiva también se podrían utilizar otras pruebas validadas además del SDMT; la evaluación recomendable sería anual, utilizando la misma prueba en la reevaluación. Además, se pueden emplear baterías neuropsicológicas de duración corta o intermedia, tales como el Brief International Cognitive Assessment for Multiple Sclerosis o la Brief Repeatable Battery of Neuropsychological Test, respectivamente, en los casos en los que se hayan detectado alteraciones cognitivas en las pruebas de cribado.
Seguimiento durante el tratamiento y detección de respuesta subóptima.
EDSS: Escala expandida del estado de discapacidad (Expanded Disability Status Scale); EM: esclerosis múltiple; EMPP: EM primaria progresiva; RSO: respuesta subóptima; SDMT: Test de símbolos y dígitos (Symbol Digit Modalities Test); T25FWT: prueba de la marcha cronometrada de 25 pies (Timed 25-Foot Walk); TME: tratamiento modificador de la enfermedad; TME-EA: TME de alta eficacia; TME-ME: TME de moderada eficacia; 9HPT: Prueba de los 9 palitos (Nine-Hole Peg Test).
Desde el inicio de la pandemia por SARS-CoV-2, la telemedicina ha cobrado relevancia43, convirtiéndose en una alternativa a considerar en aquellos pacientes con dificultades para acceder a las visitas presenciales debido a las distancias o a su discapacidad44. Se ha alcanzado consenso en que, tras la experiencia de los últimos años, la telemedicina podría complementar el seguimiento presencial de los pacientes y sustituir ciertas visitas presenciales en los que están estables y no tienen dificultades visuales, auditivas ni cognitivas. La implementación de la telemedicina en la práctica clínica depende no solamente del desarrollo tecnológico, sino de los recursos disponibles, por lo que cuando se disponga de los recursos necesarios sería recomendable:
- •
El uso de aplicaciones validadas en dispositivos electrónicos (p. ej. smartphones) entre visitas para que los pacientes reporten su estado de salud y para la evaluación remota de su cognición.
- •
La incorporación de herramientas digitales en la consulta que ayuden a identificar la sospecha de progresión de la enfermedad.
- •
La utilización de un recurso que permita al paciente hacer seguimiento de su adherencia e incluir notificaciones para recordarle cuándo debe administrarse el tratamiento.
Se espera que el uso de programas de inteligencia artificial facilite la medicina de precisión, contribuyendo a la optimización del diagnóstico, seguimiento y toma de decisiones terapéuticas en los próximos años. Además, el uso de herramientas digitales podría fomentar también el compromiso del paciente, al proporcionarle información accesible y en tiempo real sobre su estado de salud y ayudarle a manejar su enfermedad.
Detección de respuesta subóptima y optimización del tratamientoLa aparición de nuevos brotes, nuevas lesiones en RM o el incremento de la discapacidad confirmada transcurrido un tiempo desde el inicio del TME, sugiere un curso activo de la enfermedad y, por tanto, una respuesta subóptima al tratamiento. Sin embargo, resulta complejo determinar el número concreto de lesiones y brotes o el grado de discapacidad acumulada que define la respuesta subóptima y varias han sido las propuestas realizadas en este sentido4,6,7,19,45–48. En función de los resultados obtenidos en el presente consenso, los criterios para identificar una respuesta subóptima deberían ser, en general los mismos para TME de moderada o alta eficacia:
- •
La presencia de uno o más brotes entre el primer y el segundo año desde el inicio del TME.
- •
La presencia de actividad radiológica persistente (≥3 lesiones nuevas/aumentadas en T2) durante el primer año tras el inicio del TME.
- •
El aumento rápido de progresión de la discapacidad (≥1 puntos en la EDSS en comparación con el año previo al inicio del TME).
Cuando se detecte una respuesta subóptima se recomienda cambiar de tratamiento. La decisión del TME dependerá del tipo de TME previo y de la actividad de la enfermedad. En general, la actividad clínica de la enfermedad que se considera suficiente para que los pacientes con TME de moderada eficacia tras un curso completo (un año a partir de que el TME inicia su efecto) sean susceptibles de iniciar un TME-AE sería de uno a tres brotes. La horquilla de número de brotes tan amplia (entre uno y tres) se explica porque ante la presencia de brotes hay que ponderar las siguientes variables: localización-semiología, repercusión funcional, secuelas y tiempo desde el inicio del TME de moderada eficacia.
Los pacientes estables con TME-AE que reciben seguimiento clínico y radiológico y no presentan problemas de seguridad/tolerabilidad deben mantener su tratamiento y no debe realizarse desescalado. Por su parte, los pacientes no respondedores pueden ser identificados durante el primer año de tratamiento, no antes de los 6-12 meses, tras el inicio del TME. La discontinuación o suspensión de la medicación se debe considerar en los siguientes casos:
- •
La discontinuación o suspensión de TME en pacientes altamente activos, por respuesta subóptima o por seguridad/tolerabilidad, debe ir acompañada de un inicio, lo antes posible, de la nueva terapia de alta eficacia, teniendo en cuenta la actividad de la enfermedad antes y durante el tratamiento, la farmacocinética y la actividad biológica del TME previo y el riesgo de rebote (rebound).
- •
Si el TME-AE utilizado no resulta eficaz o seguro se recomienda cambiar a otro TME-AE.
- •
En los pacientes con EMPP en los que el TME no sea efectivo y/o seguro y no exista otra alternativa terapéutica (hasta la fecha el único TME aprobado para la EMPP es ocrelizumab) se discutirá con el paciente la posibilidad de interrumpir el tratamiento.
La figura 3 muestra los principales aspectos consensuados sobre el seguimiento del paciente tras el inicio del TME y la detección de respuesta subóptima.
Perspectiva del paciente (patient reported outcomes measures y patient-reported experience measures)La inclusión de la perspectiva del paciente, mediante medidas de resultados reportados por los pacientes (patient reported outcomes measures) y medidas de experiencias reportadas por los pacientes (patient-reported experience measures) es clave a lo largo de todo el proceso de manejo de la enfermedad12. Para evaluar la perspectiva del paciente se recomienda, en la medida de lo posible, priorizar el uso de herramientas validadas específicas para EM con el objetivo de homogeneizar su utilización en los diferentes centros y de obtener resultados comparables. La frecuencia recomendada de evaluación con estas herramientas validadas sería, además de en función de cada caso, de al menos una vez al año. Se recomienda evaluar los siguientes aspectos percibidos por el paciente (se incluyen ejemplos de herramientas validadas que se podrían utilizar):
- •
Impacto físico y psicológico de la enfermedad (p. ej. MSIS-29).
- •
Síntomas depresivos y de ansiedad (p. ej. BDI y HADS).
- •
Fatiga (p. ej. FSS y MFIS).
- •
Calidad de vida (p. ej. MusiQoL y MSQoL).
- •
Espasticidad (p. ej. MSSS-88 y NRS-S).
- •
Satisfacción con el tratamiento tras su inicio.
Además, sin necesidad de emplear para ello herramientas validadas, se recomienda:
- •
Fomentar la comunicación de los problemas de la función sexual y alteraciones del sueño por parte del paciente.
- •
Valorar las preferencias de tratamiento antes del inicio del mismo.
Disponer de biomarcadores capaces de predecir la progresión de la enfermedad, evaluar la respuesta al tratamiento y monitorizar el estado del paciente resulta fundamental en la toma de decisiones y en el manejo de la EM. A pesar de los numerosos estudios realizados, solo unos pocos de estos biomarcadores han alcanzado la fase de validación y aún menos se han trasladado a la práctica clínica49. Para incorporar un biomarcador en la práctica clínica este debe tener una elevada precisión (alta especificidad y sensibilidad), y debe ser fácil de medir, analizar y coste-efectivo.
La pérdida de volumen cerebral o medular en la RM se relaciona con la progresión de la discapacidad y el deterioro cognitivo, siendo un biomarcador preciso de progresión de la enfermedad y de la respuesta temprana al tratamiento50; sin embargo, la complejidad de su uso y análisis y la dificultad para trasladar los resultados de grupo al ámbito individual han limitado su implementación en la práctica clínica50. La evaluación con otras técnicas de imagen, como la OCT, también se postulan como un biomarcador de la discapacidad y el deterioro cognitivo51. En este sentido, se considera la OCT como un biomarcador factible pero no útil en la práctica clínica habitual para predecir la progresión de la enfermedad.
En cuanto a los biomarcadores moleculares hay evidencias de que la proteína 1 similar a la quitinasa 3 (chitinase-3 like 1 protein [CHI3L1]) en LCR52,53, el miRNA en LCR, plasma o suero45,54 y los niveles de neurofilamentos de cadena ligera (NFL) en suero o LCR52,55 tienen valor pronóstico y de respuesta al tratamiento, aunque aún no han sido validados en la clínica. La presencia de BOC de inmunoglobulina M (IgM)56,57, en particular la lipidoespecífica, predice un curso agresivo de la enfermedad, por lo que podría ser de utilidad para identificar candidatos a TME-AE en estadios tempranos58. Consideramos que las BOC de IgM lipidoespecíficas son un biomarcador útil y factible de pronóstico de la EM en la práctica clínica habitual.
En general, consideramos que la mayoría de los biomarcadores potenciales aún no son lo suficientemente útiles o factibles como para recomendar su uso en la práctica clínica habitual. Se necesita más investigación dirigida a su validación y estandarización y un aumento de recursos que permita utilizarlos en la toma de decisiones de cada paciente individual.
EmbarazoDebido a que la incidencia EM es alta en mujeres en edad fértil, la toma de decisiones terapéuticas frente a un posible embarazo es una situación bastante frecuente. En pacientes que estén planificando un embarazo, se deben exponer los posibles riesgos para la madre y el feto y establecer juntos un plan de tratamiento. Si bien los datos disponibles sobre la seguridad de los TME en embarazadas han ido aumentando, el número de TME que se considera seguro durante el embarazo es aún limitado4,59. La decisión de continuar el tratamiento depende de la gravedad de la enfermedad y del TME en cuestión59,60. En relación con los TME y el embarazo se recomienda:
- •
En pacientes que no estén recibiendo TME y con algún brote en el año previo, iniciar el tratamiento y retrasar el embarazo hasta que se consiga 12 meses de estabilidad.
- •
En pacientes que estén planificando un embarazo y que no tengan estabilidad clínica y radiológica, optimizar el tratamiento y retrasar el embarazo al menos 12 meses. Si la paciente está recibiendo un TME y tiene algún brote en los últimos 12 meses se recomienda retrasar la planificación del embarazo.
- •
Ante embarazo no planificado se evaluará el riesgo/beneficio de cada TME, tal y como se indica en la ficha técnica (tabla 10 del material suplementario).
- •
En caso de que la paciente no desee amamantar y que se hubiera discontinuado el TME durante el embarazo, se recomienda retomar el tratamiento lo antes posible tras el parto, valorando el estado de la paciente.
Resultados de un estudio realizado en más de 1,4 millones de embarazos61 mostraron que el control de la actividad de la EM durante el primer trimestre utilizando RM sin contraste era seguro, mientras que el uso de gadolinio aumentaba el riesgo de algunas enfermedades, muerte fetal y muerte neonatal61. No obstante, dado que otros estudios sí que han mostrado un efecto teratogénico tras el uso de RM durante el embarazo62, y que los resultados radiológicos no son imprescindibles para el plan de tratamiento63, recomendamos evitar la RM de rutina durante el embarazo y, en caso de realizarla por considerarla necesaria, hacerla después del primer trimestre; además, las lesiones nuevas/aumentadas en T2 serían suficiente para detectar actividad, evitando la administración de gadolinio.
VacunaciónEntre los diferentes mecanismos de acción de los TME figura la reducción del recuento linfocitario, lo que eleva el riesgo de infecciones, que a su vez podrían repercutir en un aumento de la actividad de la EM64,65. Una estrategia para prevenir las infecciones, especialmente en los pacientes que reciben TME-AE, es mediante la vacunación65. La mayoría de los estudios muestran que, en pacientes tratados, las vacunas inactivadas no aumentan el riesgo de desarrollar EM ni de brotes65,66, mientras que existen evidencias de que las vacunas vivas atenuadas podrían aumentar este riesgo67, generando cierta controversia sobre su utilización en pacientes con EM.
La pandemia de COVID-19 ha puesto de manifiesto que los movimientos antivacunas siguen existiendo. En un contexto en el que la información, independientemente de su veracidad, se transmite de forma inmediata, resulta especialmente importante confiar en la evidencia científica. Los estudios han mostrado que las vacunas contra la COVID-19 son seguras en pacientes con EM, aunque se ha recomendado realizar un seguimiento serológico a aquellos tratados con anti-CD20 o un modulador del receptor S1P68. En el presente consenso recomendamos la vacunación en pacientes con EM siguiendo lo indicado por las autoridades sanitarias y teniendo en cuenta los siguientes aspectos:
- •
Una vez realizado el diagnóstico de EM se debería completar la pauta de vacunación local recomendada. Antes de comenzar el tratamiento inmunosupresor se debería evaluar los títulos de anticuerpos frente a patógenos relevantes y plantear al paciente la vacunación correspondiente.
- •
Si el paciente va a ser tratado con inmunosupresores se debería haber completado la vacunación al menos cuatro semanas antes del inicio del tratamiento para vacunas vivas atenuadas, y al menos dos semanas para vacunas inactivadas.
- •
Se deben evitar las vacunas vivas atenuadas en pacientes en tratamiento o recientemente tratados con TME inmunosupresores y TME inmunomoduladores orales. El uso de vacunas inactivadas se considera seguro.
- •
En caso de que el paciente presentara un brote, la vacunación debería retrasarse hasta que este se resuelva y cese la actividad clínica, si fuera posible.
- •
Para aquellas vacunas en las que sea posible se recomienda monitorizar la respuesta serológica transcurridos de uno a dos meses desde la última dosis.
- •
Dado que los beneficios superan los riesgos, se pueden administrar las vacunas contra el SARS-CoV-2 en pacientes tratados con TME inmunosupresores o inmunomoduladores.
El presente estudio de consenso, realizado utilizando la metodología Delphi, proporciona recomendaciones dirigidas a optimizar el manejo del paciente con EM en la práctica clínica española. Las recomendaciones han sido elaboradas teniendo en cuenta la evidencia científica acumulada en los últimos años y los recursos disponibles en los centros de nuestro país en el momento actual. Se considera imprescindible realizar un diagnóstico temprano y comenzar lo antes posible con el TME. Cabe resaltar que se debe abandonar la terminología clásica de líneas de tratamiento, ya que los en un principio considerados TME de «segunda línea» son fármacos de alta eficacia que se pueden plantear como primera opción, en función de las características del paciente y de su enfermedad.
FinanciaciónEl presente estudio ha recibido financiación de Novartis Farmacéutica S.A. España. Los autores tuvieron el control editorial del manuscrito en todo momento y dieron su aprobación final.
Conflicto de interesesJ.E. Meca-Lallana ha recibido honorarios por trabajos de consultoría, docencia o investigación y ha participado en ensayos clínicos y otros proyectos de investigación de Alexion, Biogen, Bristol-Meyers-Squibb, Janssen, Merck, Novartis, Roche y Sanofi.
La institución para la que trabaja S. Martínez Yélamos (Hospital Universitario de Bellvitge/Institud d’Investigació Biomèdica de Bellvitge) ha recibido en los últimos 3 años y dedicado exclusivamente a sufragar actividades de investigación, ingresos por asesorías, colaboraciones y donaciones de Bayer, Biogen, Bristol Myers Squibb, Celgene, Genzyme, Janssen, Merck, Novartis, Roche y Sanofi. S. Martínez-Yélamos ha recibido en los últimos 3 años y dedicado exclusivamente a la asistencia a congresos, ayudas de Biogen, Bristol Myers Squibb, Janssen, Merck, Novartis, Roche y Sanofi.
S. Eichau ha recibido honorarios por conferencias y consultoría de Biogen, Novartis, Merck, Bayer, Sanofi Genzyme, Roche, Janssen, Bristol-Meyers y Teva.
M.Á. Llaneza ha recibido honorarios por trabajos de consultoría, docencia o investigación o ha participado en ensayos clínicos y otros proyectos de investigación de Almirall, Bayer, Biogen, BMS, Janssen, Merck, Novartis, Sanofi-Genzyme, Roche, Teva y Viatris.
J. Peña Martinez ha recibido honorarios por conferencias, consultorías y para la asistencia a congresos de Biogen, Bristol-Myers Squibb, Janssen, Merck, Novartis, Roche y Sanofi-Genzyme.
V. Meca Lallana ha recibido honorarios por conferencias, actividades científicas o para asistencia a congresos de Almirall, Bayer, Biogen, Bristol Myers Squibb, Janssen, Merck, Novartis, Roche, Sandoz, Sanofi-Genzyme, Terumo y Teva.
A.M. Alonso Torres ha recibido honorarios como ponente y/o participación en reuniones de asesoría de Almirall, Biogen, BMS, Janssen, Merck, Novartis, Roche, Sandoz y Sanofi.
E. Moral Torres ha recibido honorarios por la participación en asesorías, por conferencias en reuniones, para la asistencia a congresos y por actividades científicas de Actelion, Almirall, Bayer, Biogen-Idec, Bristol-Myers Squibb, Merck, Teva, Novartis, Roche y Sanofi-Genzyme.
J. Río ha recibido honorarios como orador y compensación personal por participar en advisory boards de Biogen-Idec, Merck, Novartis, Teva, Janssen, Bristol Myers Squibb y Sanofi-Aventis.
C. Calles ha recibido honorarios por participar como ponente en reuniones, cursos, asesorias, monografías por parte de Teva, Biogen, Sanofi, Merck, Bristol-Myers, Roche, Celgene, Novartis, Sandoz y Janssen.
A. Ares Luque ha percibido honorarios como ponente y asesor, y financiación para la asistencia a congresos y otras reuniones médicas de Bayer, Biogen, Bristol, Janssen, Merck, Novartis, Roche, Sanofi y Teva.
L. Ramió-Torrentà ha recibido honorarios por conferencias y consultorías, y apoyo económico para reuniones y congresos de Biogen, BMS, Janssen, Merck, Novartis, Roche y Sanofi-Genzyme.
M.E. Marzo Sola declara no tener conflicto de intereses.
J.M. Prieto es consultor de Bayer Pharmaceuticals, Biogen Spain S.L., Bristol-Myers Squibb, Daiichi Sankyo España, Genzyme Corporation, Janssen España, Merck Serono, Novartis Pharmaceuticals Corporation, Sanofi, Sandoz Iberia, Teva Pharmaceutical Industries, Roche Pharma, Almirall Prodesfarma S.A. y Celgene España S.L; ha intervenido como conferenciante/moderador en reuniones y/o simposios organizados por las empresas Almirall Prodesfarma S.A., Bayer Pharmaceuticals, Biogen Spain S.L., Bristol-Myers Squibb, Genzyme Corporation, Janssen España, Merck Serono, Novartis Pharmaceuticals Corporation, Sanofi, Teva Pharmaceutical Industries y Roche Pharma y ha recibido financiación para la realización de proyectos de investigación de Almirall Prodesfarma S.A., Biogen Spain S.L., Novartis Pharmaceutical Corporation, Teva Pharmaceutical Industries y Sanofi.
M.L. Martínez Ginés ha recibido honorarios por la participación en asesorías y por conferencias de Merck, Biogen, Novartis, Sanofi-Genzyme, Almirall, BMS, Janssen, Roche y Viatris.
R. Arroyo ha recibido honorarios profesionales por conferencias o como asesor de Biogen, Novartis, Merck, Teva, Roche, Sanofi-Genzyme, Bristol-Myers Squibb y Janssen.
M.Á. Otano Martínez ha recibido honorarios por conferencias y consultorías de Biogen Idec, Sanofi-Genzyme, Novartis, Merck y Janssen.
L. Brieva Ruiz ha recibido financiación para proyectos de investigación de su grupo o en forma de honorarios por conferencias, tutorías y ayuda para asistencia a congresos por parte de Bayer, Biogen, Roche, Merck, Novartis, Allmirall, BMS, Janssen y Sanofi.
M. Gómez Gutiérrez ha recibido honorarios por presentaciones y consultoría de Novartis, Biogen, Merck, Sanofi, Janssen, Roche y Bial.
A. Rodríguez-Antigüedad Zarranz ha participado en asesorías científicas o ha sido ponente en reuniones científicas organizadas por Merck, Biogen, Novartis, Roche, Sanofi, Teva y BMS.
V. Galán Sánchez-Seco ha recibido honorarios por conferencias de Biogen Idec, Sanofi-Genzyme, Novartis, Roche y Teva.
L. Costa-Frossard ha recibido honorarios profesionales por conferencias o como asesor de Biogen, Novartis, Merck, Teva, Roche, Sanofi-Genzyme, Bristol-Myers Squibb y Janssen.
M.Á. Hernández Pérez ha recibido honorarios por conferencias y consultorías de Biogen, Bristol- Myer, Sanofi, Novartis, Roche, Merck y Janssen.
L. Landete Pascual ha recibido honorarios por la participación en asesorías, actividades científicas y formativas de Almirall, Bayer, Biogen, Bristol-Myers, Sanofi-Genzyme, Merck, Novartis, UCB Pharma, Roche y Teva.
M. González Platas ha recibido honorarios profesionales por conferencias o como asesoría de Biogen, Novartis, Roche, Sanofi-Genzyme, Bristol-Myers Squibb y Janssen.
C. Oreja-Guevara ha recibido honorarios por conferencias y consultorías de Biogen Idec, Celgene, Sanofi-Genzyme, Novartis, Roche, Merck y Teva.
Laura Prieto del Val (Evidenze Clinical Research) ha colaborado como asesora científica y redactora médica en la creación del presente manuscrito y durante la elaboración de los ítems. Agradecemos también los valiosos comentarios y aportaciones de Ricardo Ginestal, José Ramón Ara, Ana Belén Caminero, Georgina Arrambide y Óscar Fernández.