Las escalas pronósticas pueden ayudar a seleccionar pacientes para tratamientos de reperfusión. Objetivo: aplicar el índice SPAN-100 en una cohorte de pacientes tratados con rtPA por vía intravenosa y evaluar su capacidad pronóstica.
MétodosSe utilizaron datos del registro prospectivo de reperfusión de Cataluña y se seleccionaron casos consecutivos que recibieron rtPA por vía intravenosa aislado en 2011-2012. A partir del sumatorio de edad y NIHSS se categorizó la cohorte en SPAN-100 positivos [≥ 100] y SPAN-100 negativos [< 100 puntos]. Se determinaron las tasas crudas y ajustadas de hemorragia sintomática (HICS), muerte e independencia funcional (ERm 0-2) a partir del índice SPAN-100 y se calculó la curva ROC para la predicción de las principales medidas de resultado.
ResultadosDe los 1.685 casos incluidos, 1.405 (83%) eran SPAN-100 negativos. La tasa de HICS ajustada por sexo, ERm preictus, hipertensión, diabetes, dislipemia, cardiopatía isquémica, insuficiencia cardíaca, fibrilación auricular, ictus/AIT previos y tiempo hasta la trombólisis no fue diferente según las dos categorías pero la probabilidad de tener una ERm 0-2 al 3.er mes fue hasta casi 8 veces mayor entre los SPAN-100 negativos. El riesgo de muerte al 3.er mes fue 5 veces superior en los SPAN-100 positivos. El análisis ROC mostró especificidades altas tanto en la predicción de independencia funcional como mortalidad al 3.er mes cuando el punto de corte era de 100.
ConclusionesEl índice SPAN-100 es un índice sencillo y de fácil aplicación que puede guiar la selección de pacientes para trombólisis cuando existen dudas razonables y asesorar al paciente/familia acerca de los resultados esperables.
Prognostic scales can be helpful for selecting patients for reperfusion treatment. This study aims to assess the prognostic ability of the recently published SPAN-100 index in a large cohort of stroke patients treated with intravenous thrombolysis (IV rtPA).
MethodsUsing data from the prospective registery of all reperfusion treatments administered in Catalonia, we selected patients treated with IV rtPA alone between 2011 and 2012. The SPAN-100 index was calculated as the sum of age (years) and NIHSS score, and patients in the cohort were classified as SPAN-100 positive [≥ 100] or SPAN-100 negative [< 100]. We measured raw and adjusted rates of symptomatic intracerebral haemorrhage (SICH), mortality, and 3-month functional outcome (mRS 0-2) for each SPAN-100 category. Area under the ROC curve was calculated to predict the main outcome measures.
ResultsWe studied 1685 rtPA-treated patients, of whom 1405 (83%) were SPAN-100 negative. The SICH rates adjusted for sex, pre-stroke mRS, hypertension, diabetes, dyslipidaemia, ischaemic heart disease, heart failure, atrial fibrillation, prior TIA/stroke and time to thrombolysis did not differ between groups, but likelihood of functional independence (mRS 0-2) at 3 months was nearly 8 times higher in the SPAN-100 negative group than in the positive group. Furthermore, the 3-month mortality rate was 5 times higher in the SPAN-100 positive group. ROC curve analysis showed high specificities for predicting both functional independence and 3-month mortality for a cut-off point of 100.
ConclusionThe SPAN-100 index is a simple and straightforward method that may be useful for selecting candidates for rtPA treatment in doubtful cases, and for informing patients and their relatives about likely outcomes.
El activador del plasminógeno tisular, rtPA por vía intravenosa (rtPAiv), es el único tratamiento de reperfusión que ha demostrado su eficacia en pacientes con ictus isquémico agudo (IIA)1–3. Sin embargo, es bien conocido que no todos los pacientes con IIA muestran una respuesta satisfactoria al tratamiento trombolítico ya que en tan solo la mitad de ellos se alcanza la revascularización, aspecto que ha sido relacionado repetidamente con un pronóstico funcional favorable (Escala de Rankin modificada, ERm 0-2) a los 3 meses4,5. Son diversos los factores que influyen en el resultado final tras rtPAiv y entre ellos cabe destacar la edad, la gravedad basal del ictus y el tiempo hasta el tratamiento3,6–8. El desarrollo de escalas o índices pronósticos que permitan predecir el resultado tras un ictus es un área de investigación en rápido desarrollo. Por un lado, los médicos necesitamos estimar el pronóstico del paciente sobre todo porque es un factor crucial en el proceso de toma de decisiones. En el contexto del paciente con ictus agudo, la creciente complejidad terapéutica a la que se enfrenta el neurólogo en la práctica asistencial, donde el tiempo es una variable fundamental, justifica la premura por emitir un veredicto: ¿se trata o no se trata? Por otro lado, las familias necesitan también disponer de esta información con vistas a prepararse y adecuar el entorno del paciente ante su vuelta. Así, en los últimos años, la evidencia acerca de los beneficios del uso de escalas o índices pronósticos ha ido en aumento. En las condiciones actuales de uso rutinario del rtPAiv, los criterios de selección de pacientes para tratamiento trombolítico se han ampliado respecto de los estrictos criterios de inclusión aplicados en los ensayos clínicos originales9–11, y es en la administración fuera de licencia (off-label) de rtPAiv cuando el uso de índices pronósticos puede tener más sentido. El objetivo de este estudio fue determinar las capacidades predictivas del índice pronóstico SPAN-100 sobre los principales resultados clínicos en una cohorte prospectiva de pacientes consecutivos tratados con rtPAiv.
Pacientes y métodosDiseño y población del estudioEstudio observacional basado en una cohorte prospectiva de pacientes con IIA consecutivos tratados con rtPAiv en los hospitales de referencia (CRI, n=14) y hospitales comarcales con teleictus (HC-TI, n=3) de Cataluña en el período 01/01/2011–31/12/2012. En Cataluña desde enero de 2011 todos los pacientes con IIA que reciben alguna modalidad de tratamiento de reperfusión (rtPAiv aislado, rtPAiv seguido de rescate endovascular o intervencionismo primario) deben ser incluidos en el registro en línea Sistema Online d’Informació de l’Ictus Agut (SONIIA), cuyos datos son custodiados por el Plan Director de Enfermedades Cerebrovasculares que también se encarga de analizar y retornar a los profesionales toda la información contenida en el registro en forma de boletín trimestral. Además, el Plan Director de Enfermedades Cerebrovasculares se encarga de monitorizar la exhaustividad de la muestra a partir de un complejo proceso de auditoría externa con el fin de evitar el sesgo de inclusión. Así, todos los casos no declarados detectados por la auditoría se incluyen de forma retrospectiva en el registro SONIIA. Este estudio se realizó a partir de los pacientes tratados con rtPAiv aislado (excluye los casos que recibieron rescate endovascular) en el período 2011-2012.
Los datos recogidos de forma prospectiva incluyen un conjunto de variables clínico-radiológicas reducidas. Basalmente se recogen edad, sexo, antecedentes patológicos y estado funcional preictus, y variables clínicas (inicio del ictus, hora de llegada al hospital, gravedad del ictus medida con la escala NIHSS obtenida por neurólogos certificados, inicio de la trombólisis). A las 24-36 horas, se recoge la situación neurológica mediante la escala NIHSS, la ocurrencia de hemorragia cerebral sintomática (HICS) definida a partir de criterios SITS-MOST12, y la supervivencia. A los 3 meses, se recoge la supervivencia y la situación funcional medida con la escala de Rankin modificada (ERm) obtenida mediante entrevistas presenciales o telefónicas llevadas a cabo por clínicos certificados.
El registro SONIIA satisface todos los requerimientos legales de protección de datos personales y la inclusión de los casos se hace de acuerdo al consentimiento del paciente.
Variables de resultadoLas variables de resultado analizadas en este estudio son: a) tasa de HICS, definida como el porcentaje de pacientes que presentaron HICS (definición SITS-MOST)12 en las primeras 24-36 horas tras el ictus; b) mortalidad acumulada al 3.er mes, y c) independencia funcional al 3.er mes (ERm 0-2).
Análisis estadísticosEl índice SPAN-100 combina la edad en años y la puntuación en la escala NIHSS basal de un paciente dado. Un estudio previo ha establecido que un índice SPAN-100 positivo (edad+NIHSS ≥ 100 puntos totales) se asocia con un peor pronóstico13. A partir de la clasificación de la población a estudio en SPAN-100 positivos y SPAN-100 negativos, comparamos las tasas crudas y ajustadas de HICS, mortalidad e independencia funcional entre ambos grupos y determinamos el área bajo la curva ROC para la predicción del resultado final a partir del índice SPAN-100. Los modelos multivariados para independencia funcional y mortalidad al 3.er mes se ajustaron por sexo, mRS preictus, hipertensión, diabetes, dislipemia, cardiopatía isquémica, insuficiencia cardíaca, fibrilación auricular, ictus/AIT previos y tiempo hasta el tratamiento.
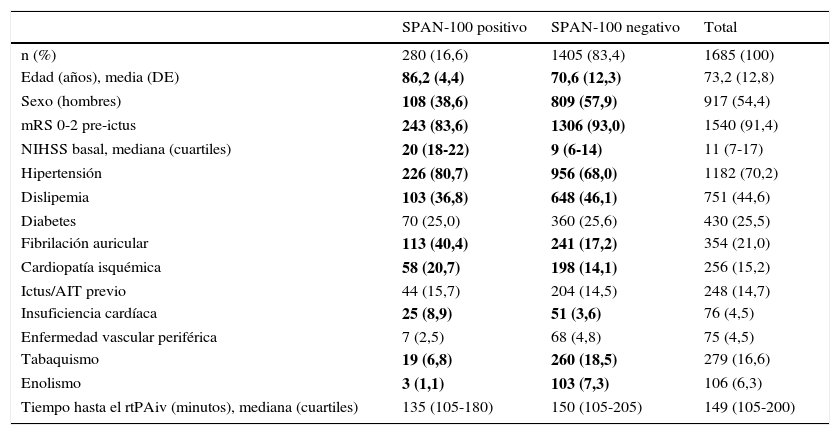
ResultadosEn el período de estudio, 1.685 pacientes con IIA recibieron tratamiento con rtPAiv, de los cuales 1.405 (83,4) fueron clasificados como SPAN-100 negativos. En la tabla 1 se muestran las características basales de la población a estudio. Dejando a un lado la edad y la NIHSS basal, condiciones sobre las que se definieron los grupos SPAN-100 (positivos y negativos) y que forzosamente debían ser significativamente diferentes entre los dos grupos, en el grupo SPAN-100 negativos hubo una mayor proporción de hombres y de personas independientes antes del ictus, un mayor porcentaje de dislipémicos, y menor presencia de hipertensión, fibrilación auricular, cardiopatía isquémica e insuficiencia cardíaca. Sin embargo, en este grupo se observó una proporción significativamente mayor de fumadores y pacientes con enolismo.
Características basales de la población a estudio de acuerdo a las dos categorías del índice SPAN-100
| SPAN-100 positivo | SPAN-100 negativo | Total | |
|---|---|---|---|
| n (%) | 280 (16,6) | 1405 (83,4) | 1685 (100) |
| Edad (años), media (DE) | 86,2 (4,4) | 70,6 (12,3) | 73,2 (12,8) |
| Sexo (hombres) | 108 (38,6) | 809 (57,9) | 917 (54,4) |
| mRS 0-2 pre-ictus | 243 (83,6) | 1306 (93,0) | 1540 (91,4) |
| NIHSS basal, mediana (cuartiles) | 20 (18-22) | 9 (6-14) | 11 (7-17) |
| Hipertensión | 226 (80,7) | 956 (68,0) | 1182 (70,2) |
| Dislipemia | 103 (36,8) | 648 (46,1) | 751 (44,6) |
| Diabetes | 70 (25,0) | 360 (25,6) | 430 (25,5) |
| Fibrilación auricular | 113 (40,4) | 241 (17,2) | 354 (21,0) |
| Cardiopatía isquémica | 58 (20,7) | 198 (14,1) | 256 (15,2) |
| Ictus/AIT previo | 44 (15,7) | 204 (14,5) | 248 (14,7) |
| Insuficiencia cardíaca | 25 (8,9) | 51 (3,6) | 76 (4,5) |
| Enfermedad vascular periférica | 7 (2,5) | 68 (4,8) | 75 (4,5) |
| Tabaquismo | 19 (6,8) | 260 (18,5) | 279 (16,6) |
| Enolismo | 3 (1,1) | 103 (7,3) | 106 (6,3) |
| Tiempo hasta el rtPAiv (minutos), mediana (cuartiles) | 135 (105-180) | 150 (105-205) | 149 (105-200) |
Los datos expresan n (%) a no ser que se especifique lo contrario. Los números en negrita indican valores de p<0,05.
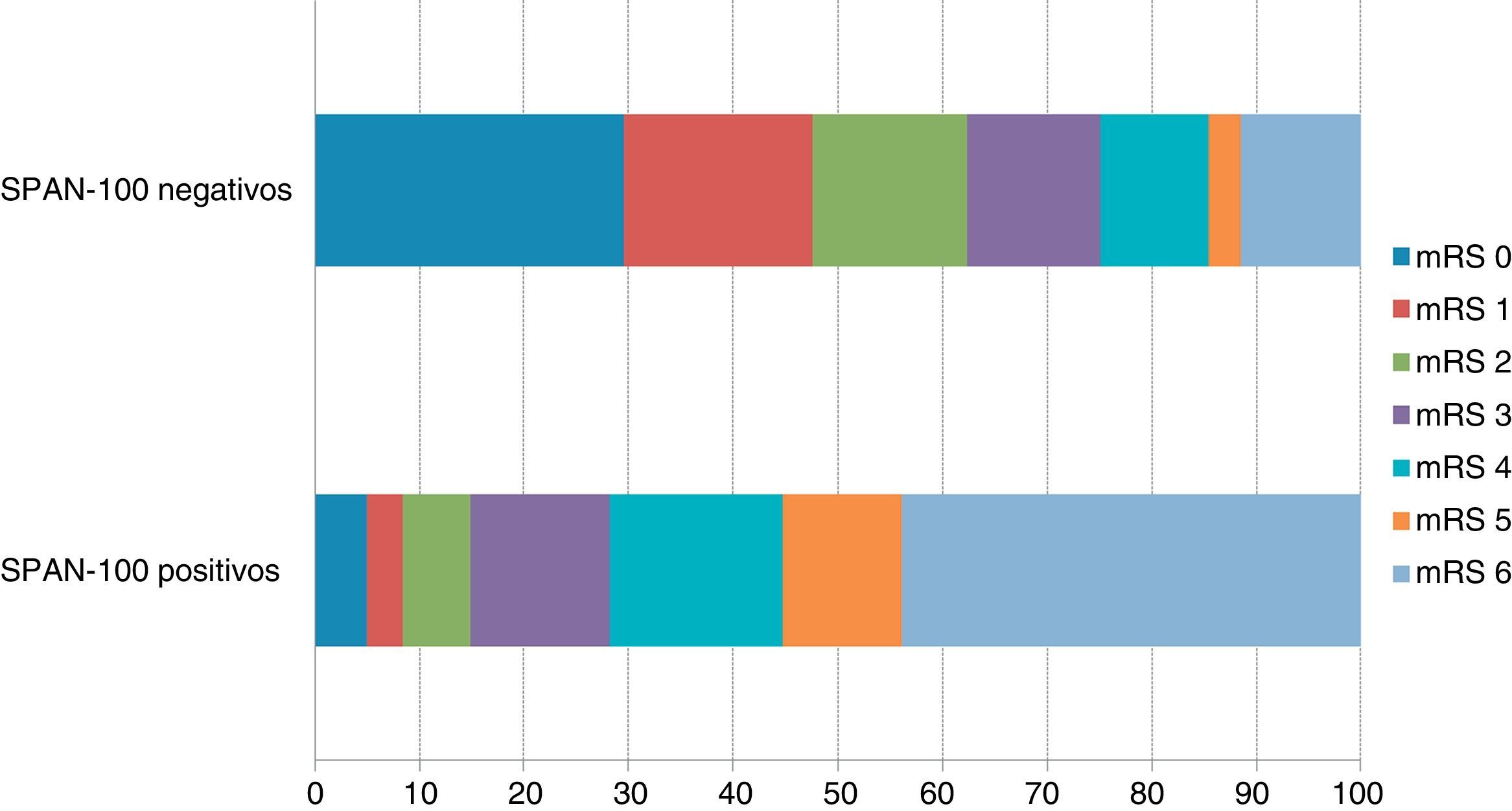
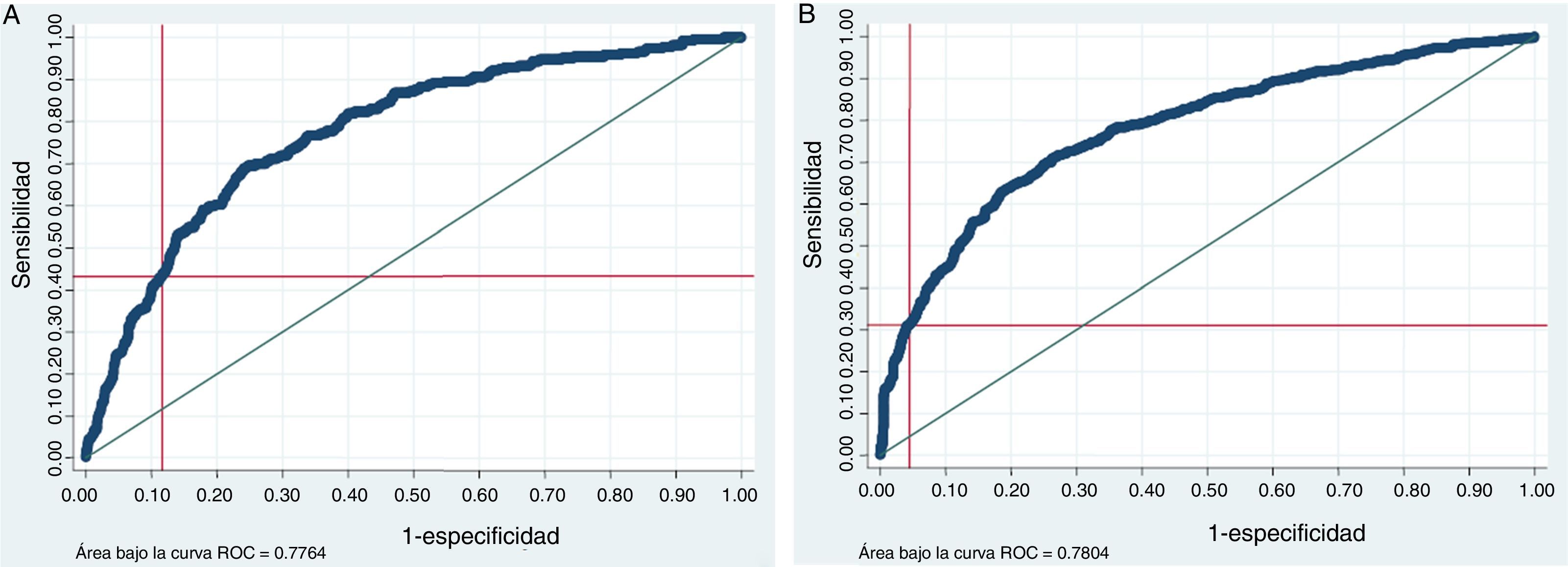
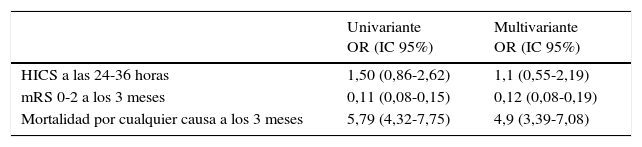
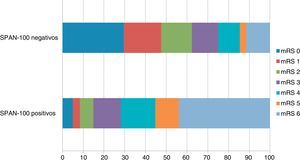
La distribución de la ERm al 3.er mes de acuerdo a las dos categorías SPAN-100 muestra diferencias muy significativas tanto para la proporción de pacientes que alcanzaron una situación de independencia funcional al 3.er mes, como para la mortalidad al 3.er mes (fig. 1). En cuanto a las tasas crudas y ajustadas de las variables de resultado, en el grupo de SPAN-100 positivos se observó una probabilidad significativamente menor de alcanzar una situación de independencia funcional a los 3 meses y un riesgo 5 veces mayor de mortalidad (tabla 2). El análisis ROC mostró un área bajo la curva de 0,78 tanto para la predicción de mortalidad como para la predicción de independencia funcional al 3.er mes. Tomando como punto de corte el valor SPAN-100 (< 100 y ≥ 100) el análisis ROC mostró bajas sensibilidades (ERm 0-2: 0,31; mortalidad: 0,42) y altas especificidades (ERm 0-2: 0,95; mortalidad: 0,88) (fig. 2).
Riesgo de HICS, muerte e independencia funcional en el grupo SPAN-100 positivos
| Univariante OR (IC 95%) | Multivariante OR (IC 95%) | |
|---|---|---|
| HICS a las 24-36 horas | 1,50 (0,86-2,62) | 1,1 (0,55-2,19) |
| mRS 0-2 a los 3 meses | 0,11 (0,08-0,15) | 0,12 (0,08-0,19) |
| Mortalidad por cualquier causa a los 3 meses | 5,79 (4,32-7,75) | 4,9 (3,39-7,08) |
Se toma la categoría SPAN-100 negativos como referencia. Los modelos multivariantes están ajustados por sexo, mRS preictus, hipertensión, diabetes, dislipemia, cardiopatía isquémica, insuficiencia cardíaca, fibrilación auricular, ictus/AIT previos y tiempo al tratamiento.
El objetivo de nuestro estudio fue aplicar el índice SPAN-100, que se calcula sumando la puntuación de la NIHSS basal y la edad en años, en una muestra independiente de pacientes tratados con rtPAiv y describir su rendimiento predictivo en cuanto a los resultados clínicos alcanzados tras el tratamiento. De forma similar a lo que a principios de 2013 publicaban Saposnik et al.13, en nuestra cohorte prospectiva de pacientes consecutivos tratados con rtPAiv –sin rescate endovascular posterior– aquellos categorizados como SPAN-100 positivos (edad+NIHSS ≥ 100 puntos) presentaron un mayor riesgo de muerte y discapacidad (mRS ≥ 3) al 3.er mes comparados con sus homólogos SPAN-100 negativos. Además, el análisis de la curva ROC muestra una buena capacidad predictiva del índice SPAN-100 (con un valor del área bajo la curva de 0,78) tanto para la predicción de la situación funcional como para la predicción de muerte al 3.er mes.
Distintas variables clínico-demográficas, incluyendo la edad8,14, la gravedad inicial8,15, la comorbilidad preictus16, la glucemia basal17,18, o el tiempo hasta el tratamiento3, han mostrado su capacidad predictiva sobre el pronóstico tras un ictus. En consecuencia, la mayoría de los índices o escalas predictivas del resultado final tras un ictus combinan varios de estos factores. Un aspecto muy relevante en el manejo del paciente con IIA es la rapidez con que hay que establecer un diagnóstico y tomar decisiones sobre el tratamiento. Ello condiciona que el uso y diseminación de un instrumento o escala predictiva dependa, a parte de sus características métricas, de la facilidad (y rapidez) de su aplicación en la cabecera del enfermo. Los instrumentos e índices pronósticos disponibles (iScore, DRAGON, ASTRAL, y HAT score) son complejos ya que su aplicación depende de la interpretación del subtipo de ictus por parte del médico, de la neuroimagen inicial, etc., lo cual limita su implantación a gran escala13,19–24. A principios de 2013 se publicaron los resultados de una nueva escala pronóstica: el índice SPAN-10013 que se calcula únicamente a partir de la edad y la NIHSS basal. Son evidentes las ventajas de trabajar con una escala predictiva fácil de memorizar y que se calcula mentalmente en pocos segundos. El estudio de Saposnik et al.13 analizó la capacidad predictiva de la escala sobre resultados clínicos a corto y largo plazo, incluyendo el riesgo de presentar complicaciones hemorrágicas. En nuestro estudio, no observamos la capacidad predictiva de la escala SPAN-100 en cuanto al riesgo de HICS aunque ello podría ser debido al bajo poder estadístico en nuestra cohorte, donde solo el 5,8% presentó HICS, o a diferencias en las definiciones de HICS usadas en ambos estudios. En relación a este aspecto, el estudio original utilizaba la definición de HICS de la NINDS donde la hemorragia sintomática se definió como la presencia de sangre en la TC craneal de las 24 horas o entre el 7.° y 10.° día postictus y cualquier empeoramiento neurológico. En nuestro estudio, la HICS se definió siguiendo los criterios SITS-MOST como la presencia de un hematoma parenquimatoso tipo 2, local o remoto, en la neuroimagen obtenida entre las 22-36 horas postratamiento, asociado a un empeoramiento neurológico (incremento de 4 o más puntos en la NIHSS de las 24 horas) o cualquier hemorragia causante de muerte2. Nuestros datos, sin embargo, sí que reproducen la capacidad de la escala SPAN-100 para discriminar entre pacientes supervivientes/no supervivientes y en situación de dependencia/independencia funcional a los 3 meses del ictus. En ambos casos, tener un índice SPAN-100 basal positivo predijo una menor probabilidad de alcanzar buenos resultados.
Vale la pena detenerse un momento en el análisis de la curva ROC y los datos de sensibilidad y especificidad. A primera vista podría parecer que la baja sensibilidad de la escala SPAN-100 para predecir dependencia (= 0,32) y muerte (0,44) es una limitación para su uso. Sin embargo, en este caso el test no es un test diagnóstico sino un índice pronóstico que queremos utilizar para guiar la toma de decisiones terapéuticas en aquellos casos en que puedan existir dudas razonables o bien para asesorar al paciente/familia sobre el pronóstico tras el tratamiento. Así, en nuestro caso, nos interesaría que los falsos positivos; es decir, casos que la escala SPAN-100 identificaría erróneamente como pacientes con mal pronóstico fueran los menos posibles, sobre todo si de ello pudiera depender una decisión de no tratar. Las especificidades altas que observamos para el punto de corte de SPAN-100 en nuestra cohorte se corresponderían con pocos falsos positivos; es decir, pacientes identificados por el índice SPAN-100 como de mal pronóstico pero que en realidad obtendrían buenos resultados clínicos tras trombólisis. Esto apoyaría el uso de este índice para guiar la idoneidad de tratar con rtPAiv pacientes fuera de las indicaciones clásicas. En estas circunstancias el índice SPAN-100 podría mejorar el rendimiento terapéutico (los resultados clínicos de los tratados) al identificar pacientes con un mejor pronóstico sin negar la administración de rtPAiv a pacientes que a pesar de tener un índice SPAN-100 positivo, pudieran beneficiarse clínicamente del tratamiento. En cualquier caso, es importante destacar que la aplicación de esta escala no puede reemplazar los criterios de selección de pacientes para trombólisis testados en condiciones experimentales. Así, esta selección debe realizarse a partir de los criterios clásicos y aun cuando el índice aporte información pronóstica válida no parece sensato basar la decisión de tratar únicamente en esta escala.
La principal limitación de este estudio es no disponer de un grupo control con el que comparar el rendimiento pronóstico de la escala SPAN-100, aspecto resuelto en el estudio original de Saposnik et al.13. A pesar de esta limitación, pensamos que los resultados de nuestro estudio apoyan el uso del índice SPAN-100 para sistematizar y cuantificar información basada en variables pronósticas bien conocidas como la edad y la gravedad al inicio del ictus. Finalmente, destacar que la muestra de este estudio no procede de un único hospital sino que incluye todos los tratamientos trombolíticos intravenosos aislados realizados en Cataluña entre 2011 y 2012, siendo los resultados representativos de lo que sucede en condiciones de práctica clínica rutinaria, y en oposición al trabajo original que se realizó con los datos del ensayo clínico NINDS1. Esta exhaustividad es posible dada la existencia del registro SONIIA desde enero de 2011, de cumplimiento obligatorio por parte de los centros, y de un proceso externo de auditoría que garantiza la inclusión consecutiva de los casos. Si bien el número total de tratamientos trombolíticos intravenosos realizados en el período de estudio fue de 2.032, que se corresponden a una tasa global de trombólisis del 13%, en este estudio se seleccionaron únicamente aquellos en los que se administró rtPAiv de forma aislada con el fin de conseguir una muestra más homogénea en cuánto a gravedad basal y manejo terapéutico.
ConclusionesEn condiciones de asistencia rutinaria, la disponibilidad de un índice pronóstico fácil de recordar y rápido de aplicar en el box de urgencias ante un paciente con IIA puede resultar de gran ayuda tanto en la selección de pacientes para tratamiento trombolítico intravenoso cuando existen dudas razonables sobre su indicación (administración fuera de licencia) como en el proceso de informar al paciente y/o familia acerca de los resultados clínicos esperables.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Este trabajo se ha realizado gracias a la participación de una larga lista de profesionales médicos de los servicios de urgencias de todos los hospitales de Cataluña, así como de los profesionales del Servicio de Emergencias Médicas.
Miembros del Consorcio Catalán de Código Ictus y Reperfusión (Cat-SCR) Hospital Arnau de Vilanova (Lleida): Jordi Sanahuja, Francisco Purroy; Hospital Doctor Josep Trueta (Girona): Joaquín Serena, Mar Castellanos, Yolanda Silva, Cecile van Eendenburg; Hospital Joan XXIII (Tarragona): Anna Pellisé, Xavier Ustrell, Rafael Marés; Hospital Verge de la Cinta (Tortosa): Juanjo Baiges, Moisés Garcés; Hospital Fundació Althaia (Manresa): Júlia Saura, Josep Maria Soler Insa; Hospital General de Vic (Vic): Josep Maria Aragonés; Hospital General de Granollers (Granollers): Pilar Otermin, Dolores Cocho; Hospital de Mataró (Mataró): Ernest Palomeras; Hospital Universitari Germans Trias i Pujol (Badalona): Antoni Dávalos, Mònica Millán, Natalia Pérez de la Ossa, Meritxell Gomis, Elena López-Cancio, Laura Dorado, Carlos Castaño, Pablo García-Bermejo; Hospital Universitari Vall d’Hebron (Barcelona): José Álvarez-Sabín, Marc Ribó, Marta Rubiera, Esteban Santamarina, Jorge Pagola, Carlos Molina, Alejandro Tomasello, Pilar Coscojuela; Hospital Universitari de Bellvitge (L’Hospitalet): Helena Quesada, Lluis Cano, Pere Cardona, Francisco Rubio, Lucía Aja, María Ángeles de Miquel, Paloma Mora; Hospital Clínic i Provincial (Barcelona): Ángel Chamorro, Víctor Obach, Álvaro Cervera, Sergio Amaro, Xabier Urra, Juan M. Macho, Jordi Blasco-Andaluz, Luis San Roman; Hospital de Sant Pau (Barcelona): Joan Martí-Fàbregas, Raquel Delgado-Mederos, Lavinia Dinia, David Carrera-Giraldo; Hospital del Mar (Barcelona): Jaume Roquer, Ana Rodríguez-Campello, Ángel Ois, Elisa Cuadrado-Godia, Elio Vivas; Hospital del Parc Taulí (Sabadell): David Cánovas, Maria del Carmen García, Jordi Estela, Joan Perendreu; Hospital Mútua de Terrassa (Terrassa): Jerzy Krupinski, Sonia Huertas-Folch, M. Carme Nicolás-Herrerias; Hospital Moisès Broggi (Sant Joan Despí): Manuel Gómez-Choco, Sonia García, Raul Martínez; Stroke Programme (Health Department of Catalunya): Miquel Gallofré, Sònia Abilleira.