La amiloidosis leptomeníngea es una forma rara de amiloidosis causada por un reducido espectro de mutaciones del gen de la transtirretina (TTR), incluyendo la que afecta al codón 25, suponiendo la sustitución de alanina por treonina. Describimos una paciente de con esta variante A25T TTR. Solo existe un caso publicado en la literatura1,2.
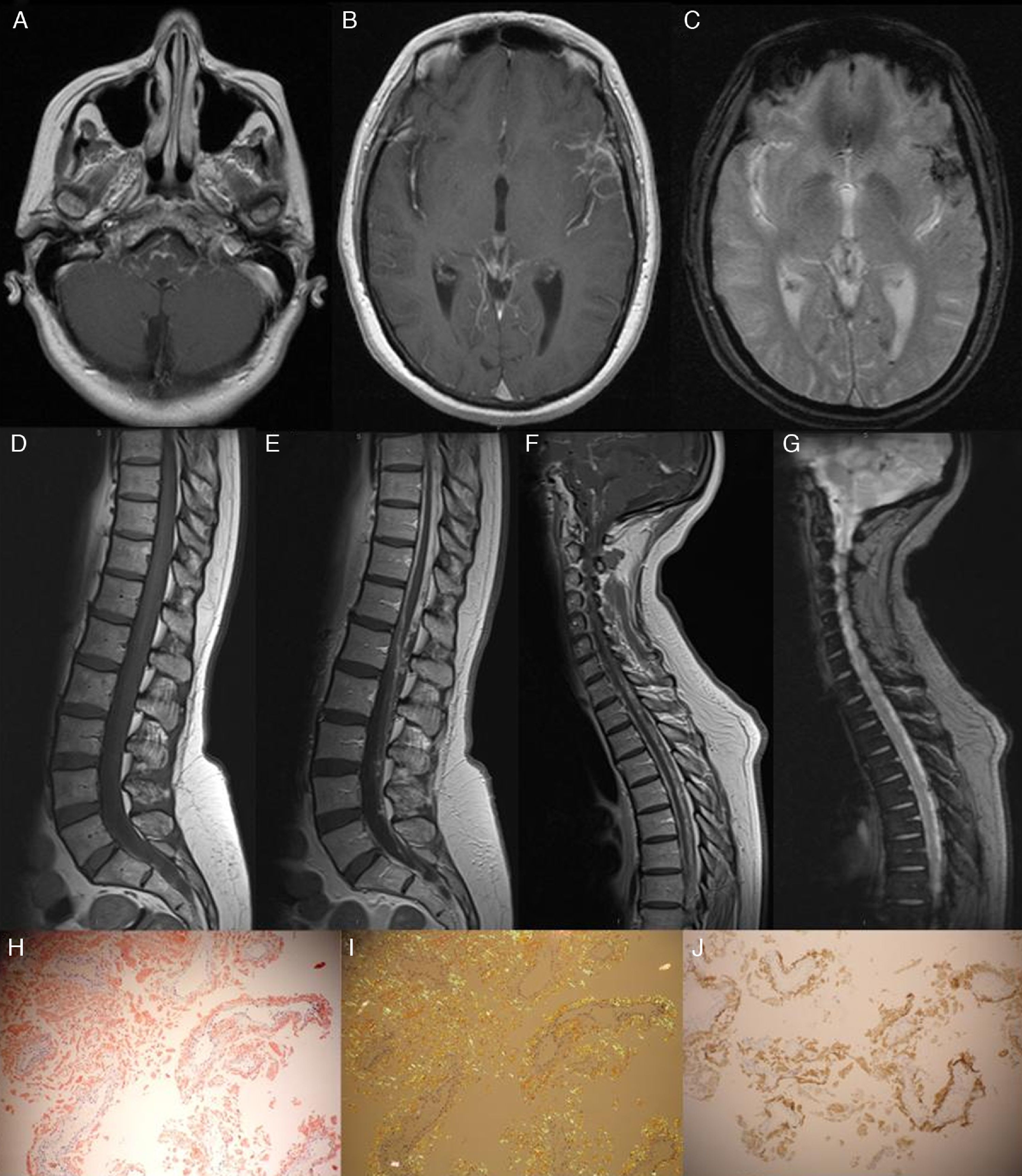
Mujer de 53 años de edad, con clínica progresiva de vértigo, paraparesia y ataxia de la marcha de 4 años de evolución. El mes previo presentó sordera neurosensorial de inicio brusco. La exploración neurológica reveló normalidad de las funciones superiores e hipoacusia derecha. Los reflejos osteotendinosos eran vivos de forma generalizada, con reflejo cutáneo-plantar extensor bilateral. Moderada paresia de la pierna derecha e hipoestesia táctil e hipopalestesia en ambas extremidades inferiores, así como marcha atáxica. El estudio de líquido cefalorraquídeo (LCR) mostró hiperproteinorraquia (177mg/dl) y xantocromía. El estudio electromiográfico descartó la presencia de signos de neuropatía periférica. La resonancia magnética craneal y medular reveló siderosis superficial en la cisura de Silvio izquierda y signos de sangrado crónico en el LCR (fig. 1). En ambos estudios, las meninges se encontraban engrosadas y captaban gadolinio (véase la figura 1). En la biopsia meníngea se encontró depósito abundante intersticial y perivascular de amiloide positivo para TTR (véase la figura 1). El estudio genético confirmó la mutación A25T TTR. La paciente es madre de 2 hijos sanos que no han querido realizarse el estudio genético. La madre de la paciente falleció a los 60 años de una enfermedad similar que no fue diagnosticada. No se realizaron estudios para descartar el diagnóstico de amiloidosis.
RM con gadolinio, T1 axial. Se observa captación leptomeníngea en la superficie del tronco encefálico y la cisura silviana izquierda (A y B). La T2* axial muestra siderosis superficial, fundamentalmente en la cisura de Silvio y el surco occipital, así como depósito de hemosiderina en el asta occipital izquierda (C). La T2* sagital revela signos de sangrado crónico (G) y en el T1 con contraste se observa un engrosamiento y captación de contraste meníngeo (E y F). Biopsia meníngea: La tinción rojo congo y el revelado con luz polarizada muestran abundante depósito de amiloide intersticial y perivascular (H e I). Las fibrillas de amiloide fueron reveladas con anticuerpo anti-TTR (J).
La amiloidosis leptomeníngea asociada a mutaciones de la TTR es una forma rara pero fatal de amiloidosis. La mutación A25T TTR hallada en nuestra paciente ha sido previamente publicada en un paciente japonés que también desarrolló siderosis superficial y falleció a consecuencia de múltiples sangrados intracraneales. La autopsia confirmó el depósito selectivo de amiloide en las leptomeninges1,2.
Nuestra paciente presentaba signos clínicos y hallazgos radiológicos compatibles con siderosis superficial. La siderosis superficial del sistema nervioso central se produce por el depósito de hemosiderina en las leptomeninges y en la superficie del cerebro. Este depósito es el resultado del sangrado continuo o recurrente al espacio subaracnoideo debido a múltiples causas3. Esta presentación fue descrita en el caso de mutación A25T TTR previamente publicado, así como en otros casos de amiloidosis familiar con depósito predominantemente en las meninges4,5. En conjunto, estos datos enfatizan la necesidad de considerar la amiloidosis leptomeníngea como una causa infrecuente de siderosis superficial.
Actualmente, no se dispone de ningún tratamiento específico para la amiloidosis leptomeníngea. El trasplante hepático, de elección para prevenir la progresión de la neuropatía asociada a la mayoría de las mutaciones de la TTR, no es efectiva en estos casos puesto que las células de los plexos coroideos son las principales productoras de la TTR en el cerebro6. El tafamidis es un inhibidor que se une de forma selectiva a la TTR en el plasma y estabiliza la estructura tetramérica del amiloide previniendo su depósito7,8. Desafortunadamente, no existen datos que sugieran que el tafamidis atraviese la barrera hematoencefálica, por lo que no se considera de utilidad para frenar el curso de la enfermedad en casos de amiloidosis leptomeníngea (comunicación personal Dr. Said). La administración intraventricular de un oligonucleótido antisentido específico TTR en el cerebro de ratones transgénicos portadores del gen TTR humano mutado provoca una reducción dependiente de la dosis de la expresión de TTR en el plexo coroideo y supone una estrategia terapéutica atractiva en estos pacientes6.
Al Dr. Solé, por las fotos de la biopsia meníngea
Este trabajo ha sido aceptado como póster en la LXIV Reunión Anual de la SEN.