Analizar en los pacientes fallecidos dentro del proceso asistencial (PA) de cuidados paliativos (CP) todas las fases del procedimiento de la sedación paliativa (SP) cuya indicación se realizó en nuestra unidad.
MétodoEstudio retrospectivo de revisión de historias clínicas (HHCC) de pacientes a los que se aplicó una SP entre julio de 2009 y junio de 2010 en una unidad de atención a crónicos de media y larga estancia de Valencia. Se analizaron variables generales de los pacientes y específicas de la SP.
ResultadosSe realizó una SP en 51 pacientes (17,7% de los fallecidos). La mayoría tenían más de 64 años (76,5%), patología oncológica (63%) y, al ingreso, dependencia total (76,5%), deterioro cognitivo de grado significativo (65%) y desnutrición importante (84,5%). Los síntomas refractarios (SSRR) más frecuentes fueron disnea (38,5%), dolor (23%), sufrimiento inespecífico (23%) y agitación (20,5%). Los pasos de la SP que se registraron con menor frecuencia fueron la situación de fallecimiento cercano (37%) y la intensidad (41%) y el motivo de la refractariedad (31%) del SR. El consentimiento informado (CI) fue mayoritariamente dado por la familia (83%) y el mismo día en que se inició la SP (81%). El empleo de hidratación artificial (HA) fue escaso (12%). Como fármaco sedante se utilizó en un 96% de casos midazolam (MDZ), administrándose en la gran mayoría (98%) en una pauta continua y por vía subcutánea. La dosis media final de MDZ fue de 28mg/d. Se mantuvieron durante la SP un opioide mayor (100%) y un anticolinérgico (68%). Un 71% de los pacientes tenían registrados datos sobre la monitorización de la SP con aceptable control del SR en un 80%. La duración media de la SP fue de 68h. Los pacientes no oncológicos (NO) con SP presentaron, respecto a los oncológicos (O), mayor dependencia al ingreso, menor inclusión al ingreso en el PA de CP y menor posibilidad de poder dar el CI.
ConclusionesLa frecuencia de uso y duración de la SP y los SSRR y su control se encuentran dentro de los rangos referidos en la literatura. Se realiza de forma casi exclusiva con MDZ y es escaso el uso de HA. Todavía existe un margen importante de mejora en el registro de ciertos pasos de la SP. Anticipar la planificación de los cuidados al final de la vida haría que aumentara la participación de los pacientes en el CI para la SP. Las diferencias en el empleo de la SP entre pacientes O y NO depende más de sus distintas características clínicas y asistenciales que de la técnica en sí.
To analyse, all phases of palliative sedation therapy (PST) procedure in our Palliative Care Unit, in patients who died during the palliative care process (PCP).
MethodA retrospective and descriptive study was conducted. The clinical histories of patients admitted to a Chronic and Long Term Care Hospital in Valencia during the period from July 15, 2009 and June 15, 2010 were reviewed. The general variables of the patients, as well as those specific to the PST, were analysed. The data analysis was performed using SPSS 15.0 statistical program.
ResultsPST was performed on 51 patients (17.7% of deaths). The majority (76.5%) were over 64 years old, with an oncological disease (63%) and, on admission, total dependence (76.5%), and with a significant degree of cognitive impairment (65%) and malnutrition (84.5%). The most common refractory symptoms (RS) were: dyspnea (38.5%), pain (23%), non-specific suffering (23%), and agitation (20.5%). The steps of PST that were recorded less frequently were: near death situation (37%), and intensity (41%), and the reason for the refractoriness (31%) of the RS. The informed consent (IC) was given mostly by the family (83%), and on the same day the PST was started (81%). The use of artificial hydration (AH) was low (12%). As a sedative drug was used in 96% of cases, Midazolam (MDZ) was the drug most used for sedation (96%), administered in the vast majority (98%) as a continuous and subcutaneous infusion. The final mean dose of MDZ was 28mg/day. A major opioid (100%) and an anticholinergic (68%) were associated with PST. Data on the PST monitoring had been recorded in 71% of patients, with acceptable control of the RS in 80% of cases. The average duration of the PST was 68hours. Non-oncological patients (NO) with PST were less likely to be included in the PCP on admission, as well as being more dependent, and less likely to give IC, compared to oncological patients (O).
ConclusionsThe frequency of use and duration of the PST and the RS and their control are within the ranges reported in the literature. It is almost exclusively performed with, and there is little use of AH. There is still significant scope for improvement in certain steps of the PST. To do an Advance Care Planning before the last days of life would increase patient involvement in the IC for PST. The differences in the use of PST in oncological patients and non-oncological patients depends more on distinct clinic and care characteristics than that of the technique itself.
La sedación paliativa (SP) es una opción claramente aceptada dentro de las diversas alternativas terapéuticas disponibles para el adecuado manejo de los pacientes con una enfermedad en fase avanzada que se encuentran en una situación de muerte muy cercana1,2. En un 20 a 25% de estos pacientes, según el rango medio descrito en la literatura3, va a ser el último recurso terapéutico disponible para poder conseguir aliviar de forma soportable el sufrimiento generado por los síntomas refractarios (SSRR)4. Como tales se entienden aquellos síntomas intolerables para el paciente en los que el equipo asistencial ha realizado intensos esfuerzos terapéuticos para encontrar un tratamiento que los controle de forma adecuada sin comprometer el nivel de conciencia y con una relación riesgo-beneficio aceptable durante un periodo de tiempo razonable3.
Para conseguir con la SP el alivio deseado se utilizan ciertos fármacos sedantes en las dosis y combinaciones adecuadas con el objetivo de reducir de forma proporcionada, en su justa medida y durante el tiempo preciso el nivel de conciencia del paciente. Para su aplicación es obligado disponer de un consentimiento informado (CI) dado por el paciente y, en su defecto, por la familia más cercana. Tras el inicio de la SP es ineludible realizar un seguimiento cercano de sus efectos, tanto beneficiosos como adversos, con el fin de conseguir el alivio buscado, minimizando las posibles complicaciones derivadas de ella. Además, debe realizarse un registro pormenorizado de todo el proceso en la historia clínica (HC) que permita reconstruir todos los pasos necesarios para asegurar que se ha actuado de una forma correcta5. Idealmente, debe ser la hoja de evolución clínica (HEC) el documento de la HC donde se anoten todas las actuaciones seguidas.
La SP es un tratamiento médico planteado por el equipo asistencial que atiende a cada paciente con el apoyo, en caso necesario, de un recurso especializado de cuidados paliativos (CP). Su indicación debe ser valorada, decidida y planificada en un contexto de final de vida, después de una deliberación clínica cuidadosa, sopesada y compartida. Por tanto, como cualquier otro procedimiento asistencial, precisa del cumplimiento de una serie de requisitos metodológicos y éticos claramente definidos que garanticen un empleo apropiado. Esto conlleva aprender en qué consiste y cuáles son los distintos pasos a seguir. Para facilitar y unificar todo este proceso se recomienda la realización de protocolos de actuación adaptados a cada contexto asistencial que deben cumplir una serie de requisitos básicos reconocidos por diversas guías de práctica clínica y grupos de expertos en publicaciones recientes1,6–9.
Los estudios publicados en nuestro medio sobre el empleo de la SP son escasos, describiendo, en diversos contextos asistenciales y por distintos especialistas, el proceso seguido10–16. En ellos se analizan, en mayor o menor medida, datos sobre la frecuencia de su uso y su duración, la enfermedad principal que padecen los pacientes sedados, los SSRR que justifican su indicación, los fármacos sedantes empleados (tipo, dosis y vía) y quién da el CI. En ninguno se hace una descripción completa de los diversos pasos que hay que seguir para valorar en profundidad la correcta realización de dicho procedimiento. El objetivo principal de este estudio es analizar, según los registros de la HC, todos los pasos del proceso de la SP de aquellos casos cuya indicación se realizó en nuestra unidad, comparándose el grupo de pacientes con procesos oncológicos (O) con el de los no oncológicos (NO).
Pacientes y métodoÁmbito de estudioEl estudio se ha realizado en el Área Médica Integral del Hospital Pare Jofré de Valencia, un hospital de atención a pacientes crónicos de media y larga estancia de la red asistencial pública de la Agencia Valenciana de Salut. Dicha área dispone de 75 camas y a él son remitidos pacientes con uno de los 3 posibles procesos asistenciales (PPAA): convalecencia, larga estancia o CP. Tras su valoración multidimensional inicial y el posterior seguimiento clínico se asigna a cada paciente, según su momento evolutivo, a uno de los PPAA señalados, adaptándose los cuidados a los objetivos específicos de cada PA. Los equipos asistenciales están formados por médicos internistas, personal de enfermería, recursos rehabilitadores (médico rehabilitador, fisioterapeutas, terapeutas ocupacionales y logopeda), psicólogos, trabajador social y dietista.
MuestraPara el estudio se seleccionaron, entre los pacientes dados de alta dentro del PA de CP desde el 15 de julio de 2009 al 15 de junio de 2010, aquellos que iniciaron una SP durante la estancia en el Área Médica Integral. Se excluyeron del estudio los pacientes que ya fueron remitidos a nuestra unidad con una SP porque muchos de los datos que se iban a analizar no se pudieron obtener con la información aportada en el informe de remisión. Para ello, se analizó en las anotaciones de la HC realizadas por los médicos responsables del paciente si la intención del empleo de fármacos sedantes (benzodiacepinas y/o neurolépticos) administrados por vía parenteral fue la de realizar una SP. Los documentos analizados para ello fueron las HEC, la hoja biopsicosocial (documento de recogida de datos con un apartado específico sobre el uso de la SP), el informe de alta y las hojas de tratamiento.
Tipo de estudioSe trata de un estudio retrospectivo y descriptivo, comparando el uso de la SP entre pacientes O y NO.
MetodologíaLas HHCC de los pacientes seleccionados fueron revisadas por 5 médicos internistas del Área Médica Integral con una experiencia de más de 5 años de trabajo en la unidad y una formación académica reconocida en CP como mínimo de nivel intermedio. Ninguno analizó HHCC propias.
Los datos analizados se dividieron en:
- 1)
Generales: a) al ingreso: edad, sexo, proceso de base (O o NO), PA inicial (CP o convalecencia/larga estancia), antecedentes personales de demencia, situación funcional con el índice de Barthel17, estado cognitivo con el cuestionario de Pfeiffer18, situación emocional con la Hospital Anxiety and Depression Scale19, estado nutricional con el filtro CONUT20 y sobrecarga del cuidador principal con la escala de Zarit reducida21 y b) al alta: PA final y estancia hospitalaria.
- 2)
Específicos sobre el uso de la SP: documentos de la HC donde el médico responsable anota que ha realizado una SP (HEC, hoja biopsicosocial y/o informe de alta), días entre el ingreso y su inicio, referencia a un escaso tiempo de supervivencia (horas, días o 1-2 semanas) en la semana previa a su instauración y forma de valorarlo (impresión clínica subjetiva o con escalas), quién habla por primera vez de la posibilidad de realizar una SP (equipo, paciente o familia), síntoma/s que obligan a su empleo (agitación, disnea, dolor, psicoexistencial, sufrimiento inespecífico, vómitos y/u otros), referencia a la intensidad de dicho síntoma y al método de evaluarla (de forma subjetiva por el equipo o mediante escalas realizadas por el propio paciente), motivo de la refractariedad (tratamientos agotados o no efectivos o tratamientos posibles pero no indicados por el contexto clínico del paciente o por haber sido limitados previamente por este o por su familia si el paciente es incapaz de participar en la toma de decisiones), estudio de la etiología del SR, tratamientos que el paciente estaba recibiendo para el control del síntoma justo antes de su inicio, consulta con algún otro profesional médico antes de su inicio, realización del CI y quién y cuándo lo da y por qué no lo puede dar el paciente (no competente o competente pero no quiere participar o no está informado y con poco tiempo para hacerlo), tipo inicial de SP (intermitente o continua y urgente o no), vía inicial de administración, fármacos sedantes y dosis iniciales (mg/24h), frecuencia y tipo de monitorización y si se usan escalas, grado de control del síntoma principal en las 48h posteriores a su inicio según las anotaciones realizadas en la HEC tanto por enfermería (número de rescates en dicho periodo administrados para su control) como por el médico (descripciones específicas al respecto), nivel de conciencia en las 48h posteriores a su inicio según la respuesta a estímulos verbales y físicos, fármacos no sedantes asociados, uso de la hidratación artificial (HA) (ya presente o nueva indicación, vía de administración y cómo y quién toma la decisión para su empleo), fármacos sedantes finales utilizados y sus dosis, el tipo y la vía final, grado de control del síntoma y nivel de conciencia en las 48h previas a la muerte y horas entre el inicio de la SP y el fallecimiento. Todos los datos específicos referidos al uso de la SP debían estar registrados en las HEC de la HC para considerarlos en el análisis del estudio, salvo los datos relativos a los fármacos que se obtuvieron de las hojas de tratamiento, tanto médicas como de enfermería, que figuraban en las HHCC.
El análisis descriptivo de las variables cuantitativas continuas se realizó utilizando la media y desviación típica y el de las categóricas mediante la frecuencia absoluta y relativa. Se realizó un análisis bivariante entre pacientes tratados con SP según tuvieran o no un proceso de base oncológico. Se utilizaron las pruebas de la Ji-cuadrado de Pearson, la exacta de Fisher y la «t» de Student según el tipo de variable. Se consideraron estadísticamente significativos valores de p menores de 0,05. Para el procesamiento de datos se utilizó el paquete estadístico SPSS versión 15.0.
ResultadosDurante el periodo de estudio fueron dados de alta bajo el PA de CP 322 pacientes, de los cuales fallecieron 288 (87,9%). De estos últimos, 167 (58%) presentaban una enfermedad de base O y 113 (39,2%) no ingresaron inicialmente en el PA de CP. Se indicó una SP en nuestra unidad en 51 pacientes, lo que equivale a una frecuencia de instauración del 17,7% de los fallecidos. No hubo diferencias significativas en la frecuencia de uso de la SP entre pacientes O y NO (19,2 y 15,7%, respectivamente, p=0,188) y entre los que ya ingresaron bajo el PA de CP y los que cambiaron a él durante su estancia (18,9 y 15,9%, respectivamente, p=0,253). Todos los pacientes con una SP fallecieron en la unidad.
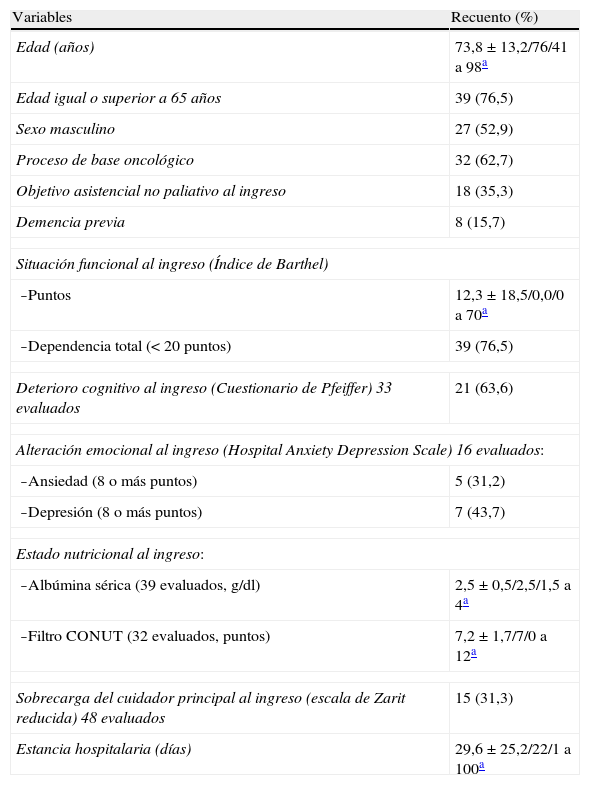
En la tabla 1 se describen las características generales al ingreso de los 51 pacientes referidos. En los 32 pacientes con enfermedad O los tumores primarios más frecuentes fueron de pulmón (31,3%), aparato genital femenino (18,8%), tracto gastrointestinal (12,5%) y nefrourológicos (12,5%). Los procesos de base más frecuentes en los pacientes NO fueron enfermedades neurológicas (ictus agudos graves y demencias) en un 52,6% y cardiorrespiratorias crónicas en un 26,3%.
Características generales de los pacientes incluidos en el estudio (n=51)
| Variables | Recuento (%) |
| Edad (años) | 73,8±13,2/76/41 a 98a |
| Edad igual o superior a 65 años | 39 (76,5) |
| Sexo masculino | 27 (52,9) |
| Proceso de base oncológico | 32 (62,7) |
| Objetivo asistencial no paliativo al ingreso | 18 (35,3) |
| Demencia previa | 8 (15,7) |
| Situación funcional al ingreso (Índice de Barthel) | |
| -Puntos | 12,3±18,5/0,0/0 a 70a |
| -Dependencia total (<20 puntos) | 39 (76,5) |
| Deterioro cognitivo al ingreso (Cuestionario de Pfeiffer) 33 evaluados | 21 (63,6) |
| Alteración emocional al ingreso (Hospital Anxiety Depression Scale) 16 evaluados: | |
| -Ansiedad (8 o más puntos) | 5 (31,2) |
| -Depresión (8 o más puntos) | 7 (43,7) |
| Estado nutricional al ingreso: | |
| -Albúmina sérica (39 evaluados, g/dl) | 2,5±0,5/2,5/1,5 a 4a |
| -Filtro CONUT (32 evaluados, puntos) | 7,2±1,7/7/0 a 12a |
| Sobrecarga del cuidador principal al ingreso (escala de Zarit reducida) 48 evaluados | 15 (31,3) |
| Estancia hospitalaria (días) | 29,6±25,2/22/1 a 100a |
Los motivos por los que no pudieron ser evaluados cognitivamente al ingreso 18 pacientes (35,3%) fueron tener bajo nivel de conciencia, demencia muy avanzada o afasia. Del resto de pacientes en los que la función cognitiva pudo ser evaluada y esta se encontraba afectada el deterioro objetivado era principalmente de grado moderado o severo (71,4%) y de naturaleza aguda (90,5%). Desde el punto de vista emocional solo fueron evaluados al ingreso aquellos 18 pacientes (35,3%) cuyo nivel cognitivo permitía que los resultados obtenidos pudieran ser valorables (menos de 5 errores en el cuestionario de Pfeiffer).
De los 32 pacientes con el CONUT completo al ingreso solo uno (3%) no estaba desnutrido, 4 presentaban una desnutrición leve (12,5%), 17 moderada (53%) y 10 severa (31,5%). A 10 pacientes no se les realizó analítica al ingreso por encontrarse ya en una clara situación de últimos días de vida (estancia media 4,5d).
La estancia media de los pacientes que fallecieron bajo el PA de CP y no recibieron una SP fue de 26,7±24,4d sin diferencia significativa con respecto a los que si la recibieron. De los 18 pacientes con SP que cambiaron al PA de CP durante su estancia en la unidad en 4 (22%) coincidió en el mismo día el cambio a dicho PA y el inicio de la SP.
El documento de la HC donde con mayor frecuencia se registra el uso de la SP es la hoja biopsicosocial en 44 pacientes (86,3% de los casos), seguido de la HEC en 37 (72,5%) y del informe de alta en 30 (58,8%). En 21 pacientes (41,2%) el empleo de la SP se registró en los 3 documentos, en 18 (35,3%) en 2 y en 12 (23,5%) solo en uno.
En la tabla 2 se describen los datos referentes a los parámetros recogidos en la HEC con respecto al inicio de la SP en los pacientes analizados. En los casos en los que se anotó la impresión de que el fallecimiento estaba muy próximo este dato se apoyó en la impresión subjetiva del médico o del equipo responsable, siendo testimonial el uso de escalas pronósticas validadas para pacientes O.
Características específicas en relación con el inicio de la sedación paliativa (SP) en los pacientes incluidos en el estudio (n=51)
| Variables | Recuento (%) |
| Tiempo entre ingreso en la unidad e inicio de la SP (días) | 26,8±25,1/18/1 a 98a |
| Registro de alta probabilidad de fallecimiento cercanob | 19 (37,3) |
| Registro de quién comenta inicialmente la posibilidad de la SPb | 46 (90,2) |
| Registro del síntoma intensob | 21 (41,2) |
| Registro del síntoma refractariob | 39 (76,5) |
| Registro del motivo de la refractariedadb | 16 (31,4) |
| Registro del estudio etiológico del síntoma refractariob | 16 (31,4) |
| Registro de la consulta previa a otros médicosb | 2 (3,9) |
| Registro del consentimiento informadob | 42 (82,4) |
| Administración continua de la SP | 50 (98) |
| Vía de administración subcutánea de la SP | 50 (98) |
| Empleo de midazolam como fármaco sedante | 49 (96,1) |
En los casos en los que se registró quién habló por primera vez de la posibilidad del empleo de la SP en 35 pacientes (76,1%) lo hizo el equipo asistencial y dentro de él, de forma casi exclusiva, el médico. En el resto de los casos lo planteó el paciente o la familia a partes iguales.
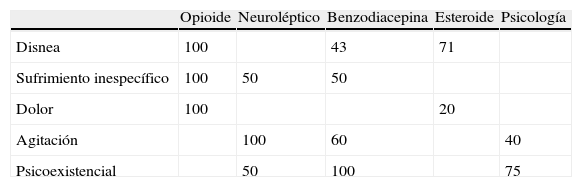
Los SSRR registrados en la HEC que obligaron al uso de la SP fueron: disnea en 15 pacientes (38,5%), sufrimiento inespecífico en 9 (23,1%), dolor en 9 (23,1%), agitación en 8 (20,5%), sufrimiento psicoexistencial en 4 (10,2%) y vómitos en 3 (7,7%). En cuanto al número de dichos síntomas por paciente en 29 (74,3%) fue solo uno, en 9 (23,1%) 2 y en 1 (2,6%) 3. Solo en 2 pacientes (5,1%) en cada caso el dolor o el sufrimiento psicoexistencial de forma aislada fueron indicación de la SP. En la mayoría de ocasiones en las que no se registró en la HEC el SR sí lo estaba en la hoja biopsicosocial y/o en el informe de alta. En los 16 casos en los que estaba recogido en la HEC el motivo de la refractariedad en 10 (62,5%) era la falta de respuesta a los distintos tratamientos sintomáticos que se habían utilizado y en el resto la existencia de posibles tratamientos efectivos pero no indicados por el contexto clínico del paciente o porque ya habían sido limitados previamente por el paciente o la familia si este era incompetente. Con respecto al registro de la intensidad del SR era anotada de forma predominante (71% de los casos) por el equipo asistencial y solo se apoyaba en el uso de escalas analógico-visuales realizadas por los pacientes en un 19% de los casos.
En la tabla 3 se exponen, para cada SR, los tratamientos sintomáticos que los pacientes recibían antes del inicio de la SP. Además de los referidos en dicha tabla cabe destacar otros de amplio uso en relación con cada uno de los SR. En la disnea se usaba oxigenoterapia en un 64%, algún broncodilatador inhalado en un 43% y un tratamiento antibiótico en otro 43%. En el dolor se empleaba un analgésico no opioide en un 20% y algún fármaco coadyuvante en otro 20%. En la agitación se utilizaba una hidratación parenteral en un 40% y en el sufrimiento psicoexistencial un antidepresivo en un 75%.
En los 42 casos en los que se registró en la HEC el CI este fue dado en 34 pacientes (81%) el mismo día en el que se inició la SP y en el resto antes. El CI lo otorgaron los propios pacientes en 7 casos (16,7%) y en el resto la familia. En la mayoría de los casos (88,6%) en los que el paciente no pudo otorgar por sí mismo el CI se registró el motivo de ello, siendo la causa casi exclusiva (93,5%) la existencia de un grado de deterioro cognitivo que le impedía participar en la toma de decisiones complejas. En bastantes casos en los que no estaba registrado en la HEC quién daba el CI sí lo estaba en la hoja biopsicosocial.
En 49 casos se utilizó MDZ como fármaco sedante en la pauta inicial de la SP. Solo en 3 casos (5,9%) se usó un neuroléptico, en dos levomepromazina y en uno haloperidol. Durante el periodo de estudio no se registró ningún caso que precisara una SP urgente por algún evento catastrófico, como una hemorragia masiva o un cuadro de asfixia aguda.
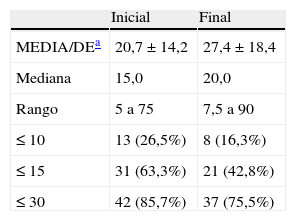
En la tabla 4 se encuentran recogidas las dosis de midazolam (MDZ) utilizadas tanto en la pauta inicial como final de la SP, existiendo entre ambas una significación estadística (p=0,001). En 29 de estos casos (59,2%) no hubo cambios entre dichas dosis, mientras en los restantes 20 hubo un aumento variable de entre 2,5 a 75mg. La duración media de la SP fue significativamente menor (p=0,03) en aquellos 30 pacientes a los que no se les modificó la dosis inicial, llevaran o no MDZ, que en los 21 en que sí se hizo (50,4±43,8h y 95,2±95,1h, respectivamente). En aquellos casos en los que no se modificó la dosis inicial de MDZ la media de dicha dosis y de la final fue de 22,9mg/d. En aquellos otros en que sí se modificó la dosis inicial de MDZ fue de 17,8±10,2mg/d y la final de 34,8±21,7mg/d (p=0,000).
Dosis diarias de midazolam (mg) utilizadas durante la sedación paliativa en situación de últimos días de vida (n=49)
| Inicial | Final | |
| MEDIA/DEa | 20,7±14,2 | 27,4±18,4 |
| Mediana | 15,0 | 20,0 |
| Rango | 5 a 75 | 7,5 a 90 |
| ≤10 | 13 (26,5%) | 8 (16,3%) |
| ≤15 | 31 (63,3%) | 21 (42,8%) |
| ≤30 | 42 (85,7%) | 37 (75,5%) |
Como fármacos para el control sintomático asociados a la pauta inicial de la SP se utilizaron un opioide mayor en el 100% de los casos (en 98% morfina), un anticolinérgico en el 52,9% (buscapina en 60% y escopolamina en el resto), un neuroléptico en el 31,4% (haloperidol en 86% y levomepromazina en el resto), un esteroide en el 28,3% y un antiemético en el 23,5%. En el momento del fallecimiento no existían cambios llamativos en dichas proporciones, salvo en el uso del anticolinérgico que aumentó hasta un 66,7%, manteniéndose los porcentajes de buscapina y escopolamina.
Se empleó la HA asociada a la pauta inicial de la SP solo en 6 pacientes (11,8%), de forma mayoritaria (66,7%) por vía subcutánea, y siendo de nueva instauración en un 20% de los casos. Se encontraron anotaciones en la HEC sobre el CI del uso o no de la HA solo en 3 pacientes (6%). Durante el periodo de la SP se retiró la HA en un caso. No hubo diferencias significativas en el tiempo de supervivencia tras el inicio de la SP entre los pacientes con o sin HA (66,0±86,1 y 68,8±72,0h, respectivamente).
Se registraron datos en la HEC sobre alguno de los aspectos de la monitorización de la SP en 36 casos (70,6%) con una frecuencia diaria en casi todos ellos. En 29 de dichos casos se registró el grado de control del SR y en 31 el nivel de conciencia. Solo en 2 casos (5,5%) se utilizó la escala de Ramsay con dicha intención. En 5 casos (13,9%) se registraron posibles efectos adversos de la medicación utilizada durante la SP, tanto sedante como no. El grado de control del SR durante la SP fue aceptable en 41 (80,4%) de los 51 pacientes. Se definió como tal la necesidad de utilizar menos de 2 rescates para el SR y la ausencia de alguna anotación sobre un mal control del SR en la HEC en los 2 periodos de tiempo analizados. En la tabla 5 se refleja el nivel de conciencia, en los casos en los que se registró, tanto al inicio como al final de la SP.
El intervalo medio de tiempo entre el inicio de la SP y el fallecimiento fue de 68,1h±71,8h, una mediana de 48h y un rango entre 1 y 360h. Un 88% de los pacientes fallecieron en 4d o menos tras el inicio de la SP.
En el momento del fallecimiento seguían utilizando MDZ como fármaco sedante los mismos pacientes que ya lo utilizaban al inicio y 4 pacientes (7,8%) llevaban un neuroléptico. En un caso al ingreso y en 2 al alta se utilizó la asociación de MDZ y un neuroléptico. En ningún caso fue necesario el empleo de otros sedantes de reserva como fenobarbital o propofol.
En el estudio comparativo bivariante entre pacientes con enfermedad O y NO que recibieron la SP en nuestra unidad cabe reseñar como únicos datos con diferencias significativas entre ambos grupos la puntuación del índice de Barthel al ingreso (16 puntos y 5 puntos, p=0,03), el ingresar dentro del PA de CP (89,5 y 10,5%, p<0,001), el registro en la HEC del proceso del CI (65,5 y 95%, p=0,02) y el CI para la SP dado por el paciente en aquellos casos registrados (25 y 5,5%, p=0,047).
DiscusiónLa cifra sobre el empleo de la SP en nuestra unidad está dentro de los límites medios del amplio rango, entre un 1,3 y un 52,5%, referidos en la literatura9. Esta gran variabilidad se ha intentado explicar por múltiples motivos relacionados tanto con los médicos que la indican, tales como su experiencia y formación en CP22, sus actitudes y creencias personales o su situación laboral23–25, como con los propios estudios sobre el uso de la SP, tales como las definiciones de SP utilizadas y los tipos incluidos, el contexto concreto donde son realizados o su naturaleza retro o prospectiva. Una de las posibles soluciones para intentar disminuir al máximo dicha variabilidad sería realizar protocolos de amplia aceptación, por lo menos a nivel de una gran zona geográfica6.
La mayoría de los estudios publicados sobre el uso de la SP incluyen solo a pacientes adultos con cáncer12–16,22,26–34, aunque algunos se realizaron en España10,11, y otros de ámbito poblacional, tanto nacionales como internacionales35–38, incluyen, como el nuestro, una proporción importante de pacientes NO.
En aquellos estudios que incluyen pacientes tanto O como NO la edad media de los pacientes se encuentra, como en el nuestro, en la década de los 70. En cuanto al sexo, en la mayoría de estudios publicados22,27–33,37 suele existir, como en este, un cierto predominio del masculino (entre 55 y 60%).
La casi totalidad de los pacientes con procesos de base NO que recibieron una SP en este estudio se identificaron como subsidiarios de recibir CP durante su estancia en la unidad. Este hecho se relaciona habitualmente con la dificultad existente para identificar la situación de final de vida en dichos pacientes, como ya se ha señalado en la literatura39. En ellos, tanto una evaluación integral sistemática al ingreso y durante toda su estancia como la realizada en nuestra unidad facilita su identificación y su inclusión en un proceso de CP40.
La estancia de los pacientes estudiados no difiere de la referida en otros trabajos publicados26,28, aunque esta suele depender del tipo de recurso asistencial de CP donde se realiza el estudio, siendo claramente menor en unidades de CP ubicadas en recursos asistenciales que atienden a pacientes más agudos30,32.
En una cuarta parte de pacientes no se registró claramente en la HEC que la intención del uso de los fármacos sedantes pautados fue la SP, aunque posteriormente el médico responsable sí lo anotase en algún otro documento incluido dentro de la HC, como la hoja biopsicosocial o el informe de alta.
En este estudio es deficitaria, en las anotaciones de la HEC antes del inicio de la SP, la referencia al tiempo previsto de supervivencia y cuando se hace se suele basar más en impresiones clínicas subjetivas del médico o del equipo que en datos objetivos. En los estudios publicados que describen este dato su valoración suele apoyarse no solo en la impresión clínica subjetiva38, sino también en datos objetivos de tipo funcional, clínico o analítico o en escalas multidimensionales22,27–29. A pesar de ello, en la mayor parte de los pacientes sedados en este estudio ya disponíamos al ingreso, gracias a la valoración global que se realiza en dicho momento, de ciertos datos objetivos que apoyaban un previsible corto periodo de supervivencia. Entre ellos, cabe destacar una gran dependencia funcional, un llamativo deterioro del estado cognitivo y una evidente situación de desnutrición. Aunque en los días previos al inicio de la SP no se registraron de forma habitual dichos datos, como en otros estudios26–29,38, con gran seguridad debían estar todavía más deteriorados que al ingreso por el empeoramiento progresivo que los pacientes experimentaron durante las casi 3 semanas que, por término medio, transcurrieron hasta entonces. Todo lo señalado viene a corroborar, de forma indirecta, la proximidad a la muerte de los pacientes a los que se les aplicó la SP en este estudio. El uso al ingreso de escalas multidimensionales validadas para pacientes O como el Palliative Prognostic Index41 o el Palliative Prognostic Score42 podrían ayudar a objetivar mejor en este tipo de pacientes, y posiblemente también en los NO, su escaso periodo de supervivencia22,29.
En este estudio, como en otros publicados27,29,35, es normalmente el equipo, y dentro de él en particular el médico, el primero que comenta la posibilidad de plantear la idoneidad de una SP, siendo menos frecuente que lo haga el paciente y/o su familia. Con bastante frecuencia la decisión de iniciar la SP la decide el equipo asistencial básico (médico y enfermería) de un día para otro. Por ello, es muy poco frecuente que dicha decisión se plantee, comente y acuerde en la reunión semanal del equipo interdisciplinar y/o se consulte con algún otro médico con experiencia, del mismo o de otro centro, como se recomienda en muchas de las guías referenciadas.
En clara relación con la alta proporción de pacientes que al ingreso presentaban, y posteriormente mantuvieron, un grado clínicamente significativo de deterioro cognitivo pocos de ellos fueron capaces de valorar la intensidad de los síntomas que sufrían. Esto motivó que con bastante frecuencia dicha valoración se realizara según la impresión subjetiva del equipo asistencial con ayuda de la familia y/o los cuidadores.
Los SSRR que obligaron al uso de la SP fueron los habitualmente descritos en la literatura revisada10,22,27–29,31–34,38,43. Aunque la proporción concreta de los más frecuentes suele variar en cada estudio, en este están dentro de los rangos descritos para ellos9. Como en nuestro estudio, en todos los trabajos publicados que aportan datos al respecto12,22,29,34,42,43 una proporción significativa de pacientes que reciben una SP presentan más de un SR. Debido a la frecuente presencia de pacientes con un importante deterioro cognitivo o un bajo nivel de conciencia fue difícil que estos pudieran referir cuál era el síntoma concreto que les producía un sufrimiento intenso y si este era insoportable. Por ello, en dichas situaciones la valoración de la intensidad y de la necesidad de utilizar una SP para su control fue realizada, a través de datos indirectos, por el equipo asistencial con el apoyo de los cuidadores. De ahí que en este estudio aparezca el sufrimiento inespecífico como un SR bastante habitual. Este SR ya es referido en otro trabajo, aunque en una proporción mucho menor29.
Aunque en la HEC se registraron con poca frecuencia los motivos de la refractariedad de los síntomas que obligaron al inicio de la SP, diversos datos indirectos, ya señalados en otro estudio29, pueden evidenciar si se han realizado esfuerzos importantes para intentar conseguir su control. Así referir que la SP se inició tras una estancia mediana de 2 semanas y media, lo que claramente permitió tanto una adecuada valoración de dichos síntomas como el empleo de la gran mayoría de los tratamientos sintomáticos con eficacia probada, tal como se constata en los datos reseñados al respecto.
Es difícil que los pacientes que reciben una SP en nuestra unidad puedan participar en la toma de decisiones con respecto a su uso, si no lo han hecho previamente, al presentar la mayoría de ellos, tanto en el momento del ingreso como posteriormente, un grado importante de deterioro cognitivo. Este es el motivo que con mayor frecuencia, como en otro estudio29, impide su participación en la toma de esa y otras decisiones. Esto nos debe estimular, como recomiendan las distintas guías ya señaladas, a anticipar cuanto antes la planificación de los cuidados al final de la vida, incluyendo la posibilidad del uso futuro de la SP.
En este estudio se evidencia un uso inicial testimonial de la SP intermitente en comparación con otros estudios publicados en los que esta suele oscilar entre un 19,5 y un 66%22,26–29,33. Es muy posible que el uso de ese tipo de SP haya sido infravalorado en nuestros pacientes al no haber sido identificada como tal las dosis de rescate de fármacos sedantes administradas en los días previos al inicio de la SP continua cuyo objetivo fue controlar de forma aceptable el SR ante exacerbaciones puntuales. Por otra parte, dicho tipo de SP permite comprobar al paciente y/o su familia el efecto real de la sedación y decidir con más criterio qué nivel y duración de la misma desearían si posteriormente el síntoma se convierte en refractario.
Las dosis relativamente bajas de MDZ empleadas y la forma de administrarlas, vía subcutánea y en infusión continua, hacen pensar que el objetivo buscado con ello fue el alivio proporcionado del SR. Pese a ello, es difícil prever de antemano en cada paciente cuál va a ser el grado de disminución del nivel de conciencia que se va a producir. No es extraño que tanto el contexto agónico en el que nos encontramos como el empleo de otros fármacos sintomáticos puedan interaccionar con el fármaco sedante y todo ello acabe influyendo en el nivel de sedación finalmente conseguido.
En nuestro estudio la vía de administración de la pauta de SP fue casi exclusivamente la subcutánea, una vía efectiva y mucho más cómoda que la intravenosa. Pese a ello, en la mayoría de los estudios revisados la vía más utilizada es la intravenosa13,15,29.
El fármaco sedante inicial y final utilizado casi de forma exclusiva es el MDZ, incluso en los casos en los que el SR fue el delirium, donde las guías suelen recomendar el uso de un neuroléptico como la levomepromazina. Esto también sucede en muchos de los estudios publicados13,14,28–30,32,34 y parece estar en consonancia con la impresión clínica de una mayor seguridad y eficacia del MDZ14, siendo fácil, al disponer de un antídoto, revertir con rapidez sus efectos en caso de dosificación excesiva. La dosis final de MDZ utilizada en este estudio es relativamente baja en comparación con las publicadas en otros trabajos en los cuales suelen ser superiores a 50mg/d14,28–31.
Se consiguió, con los criterios señalados, un buen control del SR en la gran mayoría de los pacientes en la línea de otros trabajos publicados27,30,33.
En todos los pacientes que recibieron una SP se asociaron a la pauta sedante otros fármacos para conseguir un buen control tanto del SR como de otros síntomas acompañantes con el objetivo de asegurar el máximo confort en los últimos días de vida. Entre ellos, destacan en este estudio la morfina para el control del dolor y la disnea, la buscapina para los estertores y el haloperidol para la agitación. Está ampliamente reconocido en la literatura que es imprescindible mantener estos fármacos (sobre todo los opioides mayores) si el paciente ya los estaba recibiendo, aunque se inicie una SP, para cumplir el objetivo referido11,13,16,28,30,34,38.
En este estudio se observa un empleo muy escaso de la escala de Ramsay como ayuda para facilitar la monitorización del nivel de sedación obtenido. También se han propuesto con dicho fin el empleo de otras escalas algo más complejas como la Critical-care pain observation tool o la Richmond agitation-sedation scale8. Pese a la escasa utilización de la escala señalada en un importante número de casos fue posible conocer ese aspecto de la monitorización a través de las descripciones clínicas, más o menos detalladas, realizadas en la HEC por los médicos y enfermeras sobre el nivel de respuesta a los estímulos en cada momento evolutivo.
Hubo un uso escaso de la HA tras el inicio de la SP ya que solo uno de cada 10 pacientes la recibió. Esta es una cifra baja en relación con las descritas en la mayoría de los trabajos publicados que se encuentran entre un 36 y un 100%29–31,37,38,43. Solo en un par de estudios se mencionan cifras de HA parecidas a la nuestra, de un 1526 y de un 8,7%43, las cuales están referidas a pacientes sedados en residencias de ancianos. En nuestro estudio el tiempo de supervivencia tras el inicio de la SP no difiere significativamente entre los que recibieron HA y los que no. Solo en uno de los trabajos revisados se estudia la implicación específica de la HA en la supervivencia tras el inicio de la SP43, mostrando un resultado similar al nuestro. Pese a ello, en un estudio se señala que un tercio de los profesionales sospechan que no poner la HA en estas circunstancias puede acelerar la muerte del paciente, sobre todo en aquellos casos en que la SP tenía una mayor duración38.
El tiempo medio de supervivencia tras el inicio de la SP entra dentro del rango habitual descrito en la literatura: entre 19 y 96h10–14,22,26,29,30,32–34,38,43.
En ninguno de los casos de SP de este estudio se disminuyó la dosis inicial del fármaco sedante pautado. En 3 de cada 5 pacientes no fue necesario modificar dicha dosis durante el periodo de la SP, precisando el resto un aumento de la dosis inicial. En estos últimos, tanto la dosis media final en relación con la inicial como la duración de la SP fue el doble respecto a las de aquellos pacientes en los que la dosis inicial no se modificó. La mayor supervivencia durante la SP posiblemente pueda explicar la necesidad de tener que aumentar la dosis del fármaco sedante al dar tiempo tanto a que se desarrolle tolerancia al MDZ27 como a que pueda aumentar la intensidad del SR.
Las diferencias significativas entre los pacientes O y los NO que recibieron una SP en nuestra unidad estuvieron claramente relacionadas con las distintas características clínicas y asistenciales que definen a cada uno de dichos grupos, no evidenciándose diferencias en aquellos aspectos específicos de la propia técnica de la SP. Algunas de estas diferencias también se describen en un artículo muy recientemente publicado44.
Como novedad de nuestro estudio, con respecto a otros publicados en nuestro ámbito asistencial más cercano, cabe señalar que se ha realizado un análisis muy pormenorizado del registro en la HC, de forma prioritaria en la HEC, de todos los pasos que componen el proceso de la SP.
Como limitaciones cabe referir que la recogida de los datos ha sido retrospectiva, con todos los problemas metodológicos que de ello se derivan, relacionados con la pérdida de aquella información que no se registra o cuyo registro es parcial y a veces de difícil interpretación. No obstante, nos muestra la realidad de la práctica clínica habitual en el periodo estudiado y dónde están las deficiencias para poder mejorar la aplicación de la SP. También una proporción relativamente importante de los datos señalados en la literatura revisada se basa en estudios que utilizan cuestionarios rellenados por personal médico en relación con los casos de SP atendidos en un periodo de tiempo anterior, por lo que están sometidos a sesgos debidos tanto a fallos de recuerdo como a una tendencia natural a disminuir la complejidad de los casos de más difícil manejo. Otra limitación es que la muestra aquí analizada es poco numerosa, aunque en bastantes de los estudios publicados el número de pacientes incluidos es similar16,28,32 o incluso menor10,16,26,30.
Los resultados de este estudio pueden no ser generalizables a otros entornos diferentes debido al contexto asistencial donde se ha realizado y la sistemática de trabajo utilizada, aunque aquellos resultados comparables no difieren de forma llamativa de los señalados en los estudios realizados en nuestro entorno asistencial y cultural más cercano10–16,34.
Evidenciamos que todavía existe un margen importante de mejora en el registro de ciertos pasos de la SP que es necesario recoger en las anotaciones realizadas en la HC. Muchos de los datos analizados sobre la SP que no habían sido registrados en la HEC ni tampoco en los otros documentos referidos por los comentarios de los equipos asistenciales realizados al respecto sí fueron valorados pero no se llegaron a anotar. Por lo tanto, es necesario recordar, de forma periódica, a los distintos profesionales que los forman, la obligación de realizar el registro de todas las intervenciones que lleven a cabo junto a su justificación5. Una forma de mejorar el registro del proceso de la SP sería desarrollar un documento específico, que se deberá incluir en la HC, que ayudará a recoger de forma sistemática, por lo menos, aquellos pasos básicos.
Es recomendable que en todas aquellas unidades o recursos asistenciales que realizan un número significativo de SSPP dispongan de un protocolo de actuación al respecto y que una vez implantado se hagan auditorías periódicas sobre su seguimiento. Con ello, detectaremos los puntos más deficitarios de cara a proponer actuaciones para facilitar su mejor cumplimentación2,45.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Algunas partes de este trabajo han sido motivo de 2 comunicaciones en el 9.° Congreso de la SECPAL, (pendiente de confirmar su aceptación en la fecha de elaboración del artículo).