Auditar la calidad de la atención brindada por nuestra Unidad de Cuidados Paliativos (UCP) a nuestros pacientes de esclerosis lateral amiotrófica (ELA), y comparar nuestra experiencia con la recogida en la literatura.
Material y métodosPresentamos un estudio descriptivo observacional retrospectivo en el que analizamos los primeros 14 pacientes de ELA en situación terminal atendidos por nuestra UCP en un hospital de agudos. Se analizan los casos a través de 52 variables seleccionadas por el equipo multiprofesional agrupadas en 8 categorías (datos demográficos 2, naturaleza de la enfermedad 8, final de la vida 10, síntomas 11, dimensión psicológica 2, dimensión ética 9, terapia farmacológica 6, impacto en el equipo 3).
ResultadosEl análisis no estadístico sugiere que se trata de una muestra de gran complejidad para el manejo paliativo, y aporta información interesante relativa al lugar del fallecimiento, causa del mismo, presencia de instrucciones previas, empleo de la ventilación mecánica y retirada de la misma, e impacto del miedo a la muerte por ahogamiento en el manejo del paciente y la familia. La dosis diaria equivalente de morfina oral al inició de los CP osciló en un rango de 0 a 90mg/día, mientras que al éxitus el rango fue de 0 a 2.700mg/día. La dosis diaria de midazolam parenteral al inicio de los CP osciló en un rango de 0 a 45mg/día, mientras que al éxitus el rango fue de 0 a 415mg/día. Las altas dosis de morfina y midazolam se precisaron en los 6 casos con exposición previa a psicofármacos, y muy especialmente en los pacientes con consumo previo de opioides.
ConclusionesLa experiencia inicial avala la importancia de facilitar el acceso de estos pacientes a las UCP de hospitales de agudos, y más aún si trabajan estrechamente asociadas a Unidades específicas de ELA ubicadas en la misma institución.
To audit the quality of the care delivered by our Palliative Care Unit (PCU) to our patients with Amyotrophic Lateral Sclerosis (ALS), and to compare our experience with the relevant literature.
Material and methodsWe report a descriptive observational retrospective study with our first 14 ALS patients who attended our PCU within an acute teaching hospital. The cases were analysed using 52 variables selected by our multiprofessional team, and then grouped into 8 categories (demographics 2, nature of illness 8, end of life 10, symptoms 11, psychological 2, ethics 10, drug therapy 6, and team 3).
ResultsThe non-statistical analysis suggested that we are faced with a highly complex sample to manage with palliative care, and revealed interesting information regarding place of death, cause of death, use of advanced directives, use of mechanical ventilation and its discontinuation, and impact of the fear of choking to death in patients and family. The median equivalent daily dose of oral morphine ranged from 0 to 90mg/day on admission to PCU, and 0 to 2700mg/day on day of death. Midazolam parenteral doses ranged from 0 to 45mg/day on admission to PCU, and 0 to 415mg/day on day of death. High doses of morphine and midazolam for symptom control were associated in all cases with previous exposure to central nervous system (CNS) drugs, most notably to opioids (6 cases).
ConclusionsOur initial experience validates the importance of allowing such patients to be treated within PCUs in acute teaching hospitals, and even more so if they work closely together with specific ALS units located in the same institution.
La atención a los enfermos en situación terminal por esclerosis lateral amiotrófica (ELA) se considera un aspecto infrecuente de la actividad de los programas específicos de cuidados paliativos (CP). La literatura abunda en revisiones de calidad que resumen la experiencia adquirida en el manejo de la ELA en estás décadas de desarrollo de los CP1–4. El papel de los especialistas experimentados en Neurología, el tratamiento con riluzol, el control adecuado de síntomas bajo los cuidados de un equipo multidisciplinar, la mejoría de la nutrición y la calidad de vida mediante el empleo de la gastrostomía percutánea endoscópica, la mejoría de la supervivencia mediante el empleo de la ventilación mecánica no invasiva, así como la mejoría de la calidad de vida de los pacientes y sus familias mediante la intervención de CP en las fases finales – son algunas de las conclusiones y recomendaciones más relevantes de las revisiones ya citadas.
Nuestra Unidad de Cuidados Paliativos (UCP) ha incorporado a los pacientes de ELA a su programa, tan recientemente, como hace tan solo pocos años. En este tiempo, los profesionales de la UCP hemos ido adquiriendo progresivamente conciencia de la existencia de algunas diferencias entre la evolución clínica y recomendaciones descritas, y nuestra propia experiencia cotidiana.
Ante esta situación nos hemos planteado una iniciativa de auditoría clínica, con el objetivo de comparar nuestra experiencia inicial en el manejo de pacientes de ELA con la recogida en la literatura científica. De este modo pretendemos comprobar la calidad de nuestra atención paliativa, y si existen desviaciones en los parámetros habitualmente analizados entre nuestra experiencia y los datos de estudios similares.
Material y métodoEste trabajo es un estudio descriptivo observacional retrospectivo de todos los pacientes con ELA atendidos por nuestra UCP desde marzo de 2008 hasta julio de 2010. Los pacientes accedían a los diferentes recursos de la UCP tras derivación mediante parte de interconsulta desde la Unidad de ELA de nuestra institución. La atención a los pacientes de ELA en la Comunidad de Madrid está completamente centralizada, desde el año 2006, en 5 unidades de ELA hospitalarias multidisciplinarias dirigidas por neurólogos especializados en esta patología. Estos compañeros altamente cualificados son quienes diagnostican el caso de ELA atendiendo a los consensos relevantes vigentes, lo tratan durante los periodos iniciales de la enfermedad, y son quienes definen la situación clínica como terminal en base a su extensa experiencia clínica acumulada (más de 200 pacientes tratados a día de hoy en nuestra Unidad de ELA). Experiencias prácticamente idénticas de otras unidades de ELA de Madrid están ya publicadas en la literatura5.
Tras la correspondiente revisión de la literatura relevante se efectuó, por consenso del equipo multiprofesional, la selección de 52 variables para la revisión de la calidad de la asistencia brindada a los pacientes. Estas variables fueron agrupadas por conveniencia en 8 categorías, no necesariamente homogéneas:
Datos demográficos (2 variables): edad, sexo.
Naturaleza de la enfermedad (8 variables): ventilación mecánica (VM), gastrostomía, facilitador de tos, tipo ELA, tiempo desde el diagnóstico de ELA, demencia, dificultad de comunicación, tratamiento activo con riluzol en la UCP.
Final de la vida (10 variables): lugar del éxitus, causa del éxitus, tiempo hasta éxitus desde valoración UCP, deseo morir en casa, preferencia habitación individual, ubicación del paciente dentro de la UCP, participación ESAD, insuficiencia respiratoria, saturación de oxígeno en la primera valoración UCP, palliative performance scale (PPS) en la primera valoración UCP.
Síntomas (11 variables): debilidad, disfagia, disnea, depresión/ ansiedad, insomnio, secreciones, dolor, risa/ llanto patológicos, espasmos, espasticidad, xialorrea.
Dimensión psicológica (2 variables): necesidad apoyo psicológico formal, percepción de ahogo final por la familia (percepción subjetiva diferente de la disnea objetivada por los profesionales).
Dimensión ética (9 variables): instrucciones previas, negativa VM, retirada VM, negativa a gastrostomía, conocimiento del diagnóstico del paciente, conocimiento del diagnóstico de la familia, conocimiento del pronóstico del paciente, conocimiento del pronóstico de la familia, consenso paliativo paciente y familia.
Terapia farmacológica (6 variables): exposición previa a psicofármacos, dosis diaria equivalente de morfina oral (MEDD) al inicio programa de CP, MEDD al éxitus, dosis diaria de midazolam parenteral (MDZDD) al inicio, MDZDD al éxitus, empleo de anticolinérgicos.
Impacto en el equipo (3 variables): impacto psicológico percibido, tiempo invertido en el manejo del paciente y familia, posibilidad de ventilación emociones.
Los datos correspondientes a las diferentes variables se obtuvieron de un estudio detallado de la historia clínica. Además, la consulta directa a los profesionales de la UCP implicados en la atención fue imprescindible para algunas variables (por eje. todas las variables de impacto en el equipo). Desde el principio se desestimó realizar un análisis estadístico ante el previsible pequeño tamaño de la muestra. No obstante, se optó por elegir algunas medidas de tendencia central, por ser precisamente estas las empleadas en los estudios más relevantes para comparar nuestra actividad6.
No se consideró necesario solicitar aprobación por el Comité de Ética de Investigación Clínica (CEIC) de nuestro centro para este estudio. La metodología de auditoría clínica paliativa es una práctica que no precisa de este requisito7, estudios previos similares de auditoría clínica en nuestra UCP no fueron aceptados para su análisis por el CEIC por esta razón, y publicaciones recientes en revistas internacionales de CP avalan nuestro criterio8.
ResultadosDurante el periodo de estudio nuestra UCP ha atendido un total de 14 pacientes en situación terminal por ELA. Durante el mismo periodo de estudio la Unidad atendió los siguientes pacientes nuevos por todas las patologías: 1896 en el Equipo de Soporte Hospitalario (ESH), 1.038 en la UCPA, y 291 en la Unidad de Cuidados Paliativos de Subagudos (UCPSA). En el periodo de estudio se produjeron 55 éxitus dentro de los pacientes de la Unidad de ELA: 38 en el hospital (fundamentalmente en la Unidad de Soporte Ventilatorio y en la UCP, 15 en casa o una residencia, 8 fueron atendidos por el ESAD en su domicilio pero tan solo 4 de ellos fallecieron en el domicilio). En conjunto los pacientes en situación terminal por ELA suponen tan solo entre el 1-2% de la actividad de la UCP (según se analicen los datos del ESH o la UCPA). Sin embargo, ello supone que la UCP atiende ya el 25% de la mortalidad por ELA en su entorno.
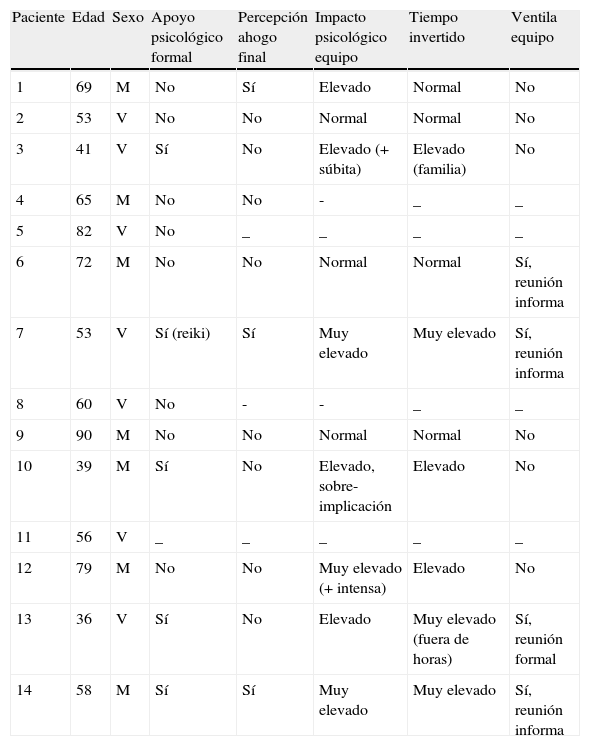
Se han agrupado los resultados en 6 tablas con los pacientes ordenados en orden cronológico. En la primera de las mismas se incluyen los datos demográficos junto con la dimensión psicológica y la de impacto en el equipo (tabla 1). La edad media de los pacientes atendidos fue de 60,93 años (rango 36-90), con una distribución al 50% entre ambos sexos. Cinco enfermos y sus familias recibieron apoyo formal por la psicóloga del equipo (uno de ellos aceptó además participar en un estudio experimental sobre Reiki de la UCP). La percepción de una muerte en ahogo por parte de los familiares fue poco frecuente (3 casos). En general el equipo de la UCP refiere un elevado impacto emocional en el manejo de estos pacientes y sus familias (incluso llegando a la sobreimplicación), y una dedicación superior a la habitual. Ello no se ha traducido todavía en la práctica de reuniones formales del equipo para ventilación emocional.
Datos demográficos, dimensión psicológica, e impacto en el equipo
| Paciente | Edad | Sexo | Apoyo psicológico formal | Percepción ahogo final | Impacto psicológico equipo | Tiempo invertido | Ventila equipo |
| 1 | 69 | M | No | Sí | Elevado | Normal | No |
| 2 | 53 | V | No | No | Normal | Normal | No |
| 3 | 41 | V | Sí | No | Elevado (+ súbita) | Elevado (familia) | No |
| 4 | 65 | M | No | No | - | _ | _ |
| 5 | 82 | V | No | _ | _ | _ | _ |
| 6 | 72 | M | No | No | Normal | Normal | Sí, reunión informa |
| 7 | 53 | V | Sí (reiki) | Sí | Muy elevado | Muy elevado | Sí, reunión informa |
| 8 | 60 | V | No | - | - | _ | _ |
| 9 | 90 | M | No | No | Normal | Normal | No |
| 10 | 39 | M | Sí | No | Elevado, sobre-implicación | Elevado | No |
| 11 | 56 | V | _ | _ | _ | _ | _ |
| 12 | 79 | M | No | No | Muy elevado (+ intensa) | Elevado | No |
| 13 | 36 | V | Sí | No | Elevado | Muy elevado (fuera de horas) | Sí, reunión formal |
| 14 | 58 | M | Sí | Sí | Muy elevado | Muy elevado | Sí, reunión informa |
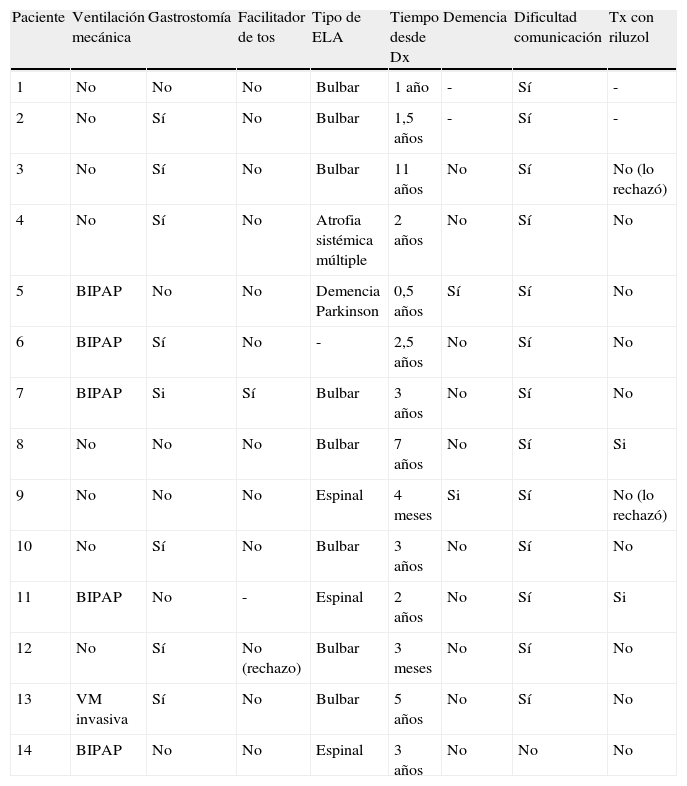
En la tabla 2 se recogen aspectos relacionados con la evolución de la enfermedad de ELA. Un elevado porcentaje de nuestros pacientes recibieron tratamiento de VM (5 BIPAP, 1 VM invasiva), una minoría empleó facilitadores de tos (un caso), y la mayoría eran portadores de gastrostomía (8 casos). La mayoría de los casos atendidos fueron de tipo bulbar, con un tiempo medio desde el diagnóstico al acceso a la UCP de 3,5 años (rango 3 meses - 11 años). Todos los pacientes salvo uno presentaron dificultades en la comunicación, resueltas en muchos casos con apoyo informático, no siendo la demencia un motivo importante para esta dificultad (2 casos). El tratamiento activo con riluzol se había suspendido en casi todos los casos en el momento de la valoración por el ESH.
Datos relativos a la evolución de la enfermedad
| Paciente | Ventilación mecánica | Gastrostomía | Facilitador de tos | Tipo de ELA | Tiempo desde Dx | Demencia | Dificultad comunicación | Tx con riluzol |
| 1 | No | No | No | Bulbar | 1 año | - | Sí | - |
| 2 | No | Sí | No | Bulbar | 1,5 años | - | Sí | - |
| 3 | No | Sí | No | Bulbar | 11 años | No | Sí | No (lo rechazó) |
| 4 | No | Sí | No | Atrofia sistémica múltiple | 2 años | No | Sí | No |
| 5 | BIPAP | No | No | Demencia Parkinson | 0,5 años | Sí | Sí | No |
| 6 | BIPAP | Sí | No | - | 2,5 años | No | Sí | No |
| 7 | BIPAP | Si | Sí | Bulbar | 3 años | No | Sí | No |
| 8 | No | No | No | Bulbar | 7 años | No | Sí | Si |
| 9 | No | No | No | Espinal | 4 meses | Si | Sí | No (lo rechazó) |
| 10 | No | Sí | No | Bulbar | 3 años | No | Sí | No |
| 11 | BIPAP | No | - | Espinal | 2 años | No | Sí | Si |
| 12 | No | Sí | No (rechazo) | Bulbar | 3 meses | No | Sí | No |
| 13 | VM invasiva | Sí | No | Bulbar | 5 años | No | Sí | No |
| 14 | BIPAP | No | No | Espinal | 3 años | No | No | No |
Dx: diagnóstico; Tx: tratamiento.
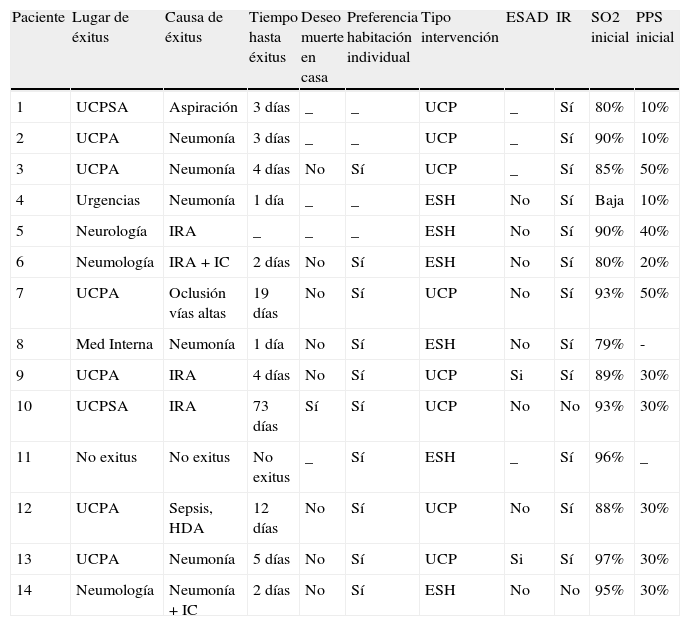
La tabla 3 muestra aspectos relacionados con la atención en los últimos días de vida. Los pacientes fallecieron tanto fuera de nuestra Unidad atendidos por el ESH (5 casos), como dentro de ella (6 UCPA, 2 UCPSA). La causa más habitual del éxitus fue la neumonía (7 casos), siendo la insuficiencia respiratoria aguda la única causa de muerte en tan solo 3 casos. El éxitus se produjo a los 10,83 días de media tras la valoración inicial por CP (rango 1 - 73 días). La casi totalidad de los pacientes prefirieron enfrentar la muerte en un contexto hospitalario (tan solo un caso manifestó deseo de morir en casa), y preferiblemente en una habitación individual. La presencia de insuficiencia respiratoria fue parte del cuadro a manejar por CP en todos los casos salvo dos, si bien tan solo 5 casos presentaron SO2 inferiores a 85% desde el inicio. La capacidad funcional media, medida mediante PPS al inicio de la valoración por CP, fue de 34% (rango 10-50%).
Datos relativos al final de la vida
| Paciente | Lugar de éxitus | Causa de éxitus | Tiempo hasta éxitus | Deseo muerte en casa | Preferencia habitación individual | Tipo intervención | ESAD | IR | SO2 inicial | PPS inicial |
| 1 | UCPSA | Aspiración | 3 días | _ | _ | UCP | _ | Sí | 80% | 10% |
| 2 | UCPA | Neumonía | 3 días | _ | _ | UCP | _ | Sí | 90% | 10% |
| 3 | UCPA | Neumonía | 4 días | No | Sí | UCP | _ | Sí | 85% | 50% |
| 4 | Urgencias | Neumonía | 1 día | _ | _ | ESH | No | Sí | Baja | 10% |
| 5 | Neurología | IRA | _ | _ | _ | ESH | No | Sí | 90% | 40% |
| 6 | Neumología | IRA + IC | 2 días | No | Sí | ESH | No | Sí | 80% | 20% |
| 7 | UCPA | Oclusión vías altas | 19 días | No | Sí | UCP | No | Sí | 93% | 50% |
| 8 | Med Interna | Neumonía | 1 día | No | Sí | ESH | No | Sí | 79% | - |
| 9 | UCPA | IRA | 4 días | No | Sí | UCP | Si | Sí | 89% | 30% |
| 10 | UCPSA | IRA | 73 días | Sí | Sí | UCP | No | No | 93% | 30% |
| 11 | No exitus | No exitus | No exitus | _ | Sí | ESH | _ | Sí | 96% | _ |
| 12 | UCPA | Sepsis, HDA | 12 días | No | Sí | UCP | No | Sí | 88% | 30% |
| 13 | UCPA | Neumonía | 5 días | No | Sí | UCP | Si | Sí | 97% | 30% |
| 14 | Neumología | Neumonía + IC | 2 días | No | Sí | ESH | No | No | 95% | 30% |
ESAD: equipo de soporte de atención domiciliaria; IC: insuficiencia cardíaca; IR: insuficiencia respiratória; PPS: palliative performance scale; SO2: saturación de oxígeno.
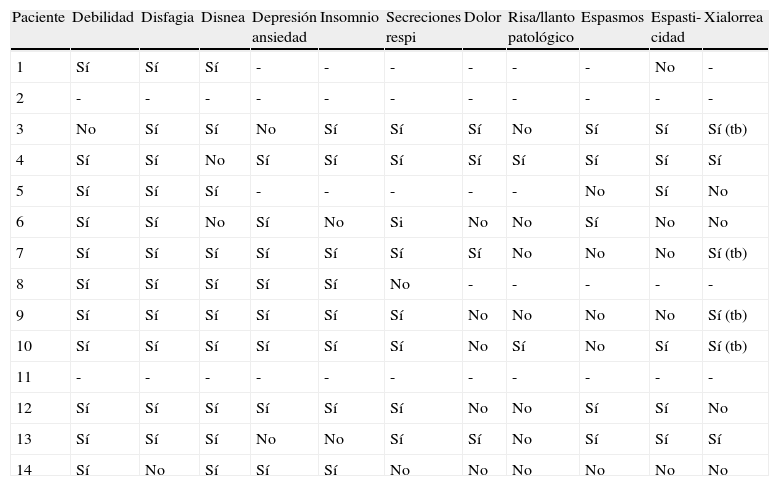
La tabla 4 recoge la presencia (o ausencia) de la sintomatología más habitual descrita en la literatura. Algunos síntomas estaban prácticamente presentes en todos los pacientes (debilidad, disfagia, disnea, depresión/ ansiedad, insomnio y secreciones respiratorias), mientras otros tienen una presencia más escasa (espasmos, espasticidad, dolor, risa/ llanto patológico, xialorrea). Es importante destacar que en 4 casos la xialorrea era de tal intensidad que justificaba la consideración de un posible tratamiento con toxina botulínica que no llegó a realizarse.
Síntomas
| Paciente | Debilidad | Disfagia | Disnea | Depresión ansiedad | Insomnio | Secreciones respi | Dolor | Risa/llanto patológico | Espasmos | Espasti-cidad | Xialorrea |
| 1 | Sí | Sí | Sí | - | - | - | - | - | - | No | - |
| 2 | - | - | - | - | - | - | - | - | - | - | - |
| 3 | No | Sí | Sí | No | Sí | Sí | Sí | No | Sí | Sí | Sí (tb) |
| 4 | Sí | Sí | No | Sí | Sí | Sí | Sí | Sí | Sí | Sí | Sí |
| 5 | Sí | Sí | Sí | - | - | - | - | - | No | Sí | No |
| 6 | Sí | Sí | No | Sí | No | Si | No | No | Sí | No | No |
| 7 | Sí | Sí | Sí | Sí | Sí | Sí | Sí | No | No | No | Sí (tb) |
| 8 | Sí | Sí | Sí | Sí | Sí | No | - | - | - | - | - |
| 9 | Sí | Sí | Sí | Sí | Sí | Sí | No | No | No | No | Sí (tb) |
| 10 | Sí | Sí | Sí | Sí | Sí | Sí | No | Sí | No | Sí | Sí (tb) |
| 11 | - | - | - | - | - | - | - | - | - | - | - |
| 12 | Sí | Sí | Sí | Sí | Sí | Sí | No | No | Sí | Sí | No |
| 13 | Sí | Sí | Sí | No | No | Sí | Sí | No | Sí | Sí | Sí |
| 14 | Sí | No | Sí | Sí | Sí | No | No | No | No | No | No |
(tb): se planteó la posibilidad de toxina botulínica.
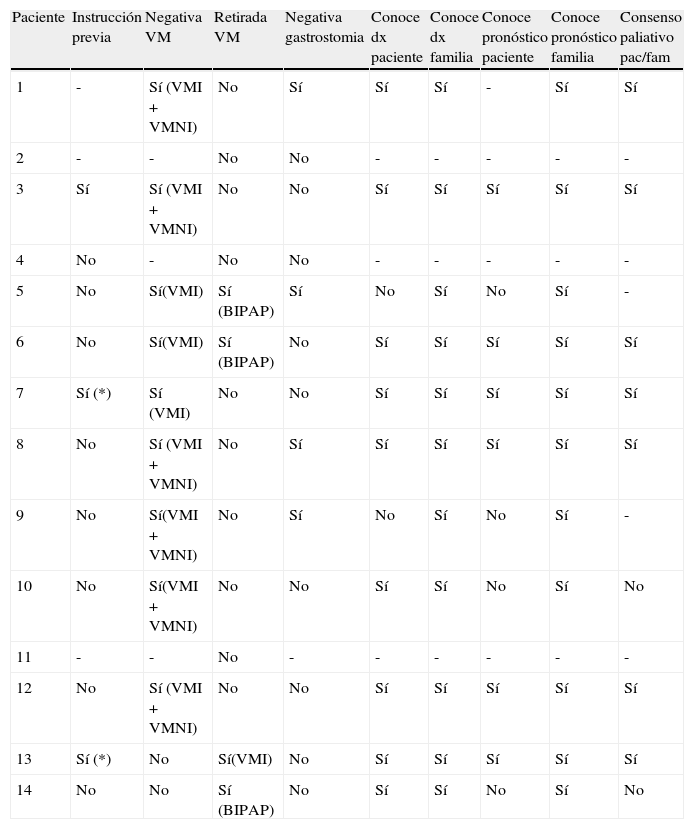
La tabla 5 aporta datos relativos a la dimensión ética. Tres pacientes accedieron a CP con instrucciones previas – este porcentaje de enfermos (3/14) es muy superior en nuestra experiencia a lo que observamos en situación terminal oncológica. Por otra parte, 2 de los pacientes tuvieron miedo y dudas durante la implementación por parte de la UCP de sus propias instrucciones (estos miedos/ dudas se resolvieron con apoyo al paciente y familia sin tener que dar marcha atrás en las instrucciones en ningún caso). La mayoría de los pacientes (9 casos) rechazaron de forma explícita en algún momento de la enfermedad la ventilación mecánica invasiva (VMI), y la mitad (6 casos) rechazó también la ventilación mecánica no invasiva (VMNI). De hecho nuestro equipo participó directamente, a petición de los propios enfermos, en la retirada de la VMNI (BIPAP) en 3 pacientes, y de la VMI en un paciente (este último caso planteó unos retos de control sintomático muy complejos). Finalmente, también la mayoría de nuestros pacientes se habían negado a la realización de una gastrostomía de alimentación (9 casos).
Datos relativos a la dimensión ética
| Paciente | Instrucción previa | Negativa VM | Retirada VM | Negativa gastrostomia | Conoce dx paciente | Conoce dx familia | Conoce pronóstico paciente | Conoce pronóstico familia | Consenso paliativo pac/fam |
| 1 | - | Sí (VMI + VMNI) | No | Sí | Sí | Sí | - | Sí | Sí |
| 2 | - | - | No | No | - | - | - | - | - |
| 3 | Sí | Sí (VMI + VMNI) | No | No | Sí | Sí | Sí | Sí | Sí |
| 4 | No | - | No | No | - | - | - | - | - |
| 5 | No | Sí(VMI) | Sí (BIPAP) | Sí | No | Sí | No | Sí | - |
| 6 | No | Sí(VMI) | Sí (BIPAP) | No | Sí | Sí | Sí | Sí | Sí |
| 7 | Sí (*) | Sí (VMI) | No | No | Sí | Sí | Sí | Sí | Sí |
| 8 | No | Sí (VMI + VMNI) | No | Sí | Sí | Sí | Sí | Sí | Sí |
| 9 | No | Sí(VMI + VMNI) | No | Sí | No | Sí | No | Sí | - |
| 10 | No | Sí(VMI + VMNI) | No | No | Sí | Sí | No | Sí | No |
| 11 | - | - | No | - | - | - | - | - | - |
| 12 | No | Sí (VMI + VMNI) | No | No | Sí | Sí | Sí | Sí | Sí |
| 13 | Sí (*) | No | Sí(VMI) | No | Sí | Sí | Sí | Sí | Sí |
| 14 | No | No | Sí (BIPAP) | No | Sí | Sí | No | Sí | No |
VM: ventilación mecánica; VMI; ventilación mecánica invasiva; VMNI: ventilación mecánica no invasiva; *: miedo al implementar.
La misma tabla recoge datos relativos al conocimiento del diagnóstico y pronóstico por parte del paciente y su familia. En general la mayoría de los pacientes conocían su diagnóstico y pronóstico (igual que sus familiares), y existió bastante concordancia entre los objetivos paliativos de los pacientes y sus familias.
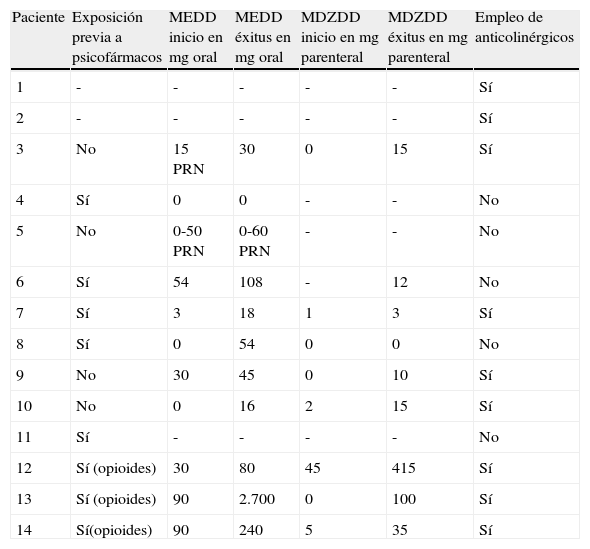
La tabla 6 recoge los datos relativos a la terapia farmacológica. La mayoría de los pacientes (8 casos) tenían exposición previa a psicofármacos (benzodiacepinas y antidepresivos) antes de la valoración por el ESH, y 3 de ellos además exposición a opioides por dolor o/y disnea. La MEDD en mg orales al inicio de los CP osciló en un rango de 0 a 90mg/día, mientras que al éxitus el rango fue de 0 a 2.700mg/día. Algunos de los primeros enfermos tuvieron opción a dosis de rescate muy elevadas de hasta 60mg/día para alivió de disnea, y ello en pacientes vírgenes de opioides. La MDZDD en mg parenterales al inicio de los CP osciló en un rango de 0 a 45mg/día, mientras que al éxitus el rango fue de 0 a 415mg/día. Las altas dosis de morfina y midazolam se precisaron en los 6 casos con exposición previa a psicofármacos, y muy especialemente en los pacientes con consumo previo de opioides. Finalmente se detectó que el empleo de anticolinérgicos para las secreciones respiratorias tan solo se efectuó en los casos en que el tratamiento fue responsabilidad exclusiva de CP.
Terapia farmacológica
| Paciente | Exposición previa a psicofármacos | MEDD inicio en mg oral | MEDD éxitus en mg oral | MDZDD inicio en mg parenteral | MDZDD éxitus en mg parenteral | Empleo de anticolinérgicos |
| 1 | - | - | - | - | - | Sí |
| 2 | - | - | - | - | - | Sí |
| 3 | No | 15 PRN | 30 | 0 | 15 | Sí |
| 4 | Sí | 0 | 0 | - | - | No |
| 5 | No | 0-50 PRN | 0-60 PRN | - | - | No |
| 6 | Sí | 54 | 108 | - | 12 | No |
| 7 | Sí | 3 | 18 | 1 | 3 | Sí |
| 8 | Sí | 0 | 54 | 0 | 0 | No |
| 9 | No | 30 | 45 | 0 | 10 | Sí |
| 10 | No | 0 | 16 | 2 | 15 | Sí |
| 11 | Sí | - | - | - | - | No |
| 12 | Sí (opioides) | 30 | 80 | 45 | 415 | Sí |
| 13 | Sí (opioides) | 90 | 2.700 | 0 | 100 | Sí |
| 14 | Sí(opioides) | 90 | 240 | 5 | 35 | Sí |
Por último, puede resultar relevante destacar que varios enfermos aceptaron donación de cerebros al banco de cerebros de la Comunidad, y ello a pesar de su ubicación en un contexto de CP, donde las autopsias son escasas y vividas habitualmente por los familiares como una agresión terapéutica final9.
DiscusiónEn primer lugar, resulta adecuado señalar que algunos de los datos presentados no deben cuestionar la validez del conjunto. Por ejemplo, la presencia de 2 casos en 14 de demencia/ déficit cognitivo asociados al diagnóstico de ELA, no debería poner en cuestión el segundo diagnóstico. La asociación de ambas entidades en algunos pacientes es un hecho conocido desde hace tiempo10. Por otro lado, la excesiva supervivencia de uno de nuestros pacientes de comienzo bulbar (11 años), tampoco es un hecho excepcional11. Además, el comienzo bulbar tampoco es garantía de un pronóstico de supervivencia más corto5.
En segundo lugar, el cuidado multidisciplinar se considera un instrumento importante para el manejo de apoyo y sintomático de los pacientes de ELA. La ausencia de estudios controlados impide valorar la efectividad de este tipo de cuidado, y revisiones recientes basadas en la evidencia proponen que se explore la interfase entre neurología, rehabilitación y CP para proporcionar apoyo a largo plazo a estos enfermos12. Por este motivo emplearemos aportaciones procedentes de los 3 ámbitos para la discusión de los resultados.
Las 2 variables en nuestro estudio dedicadas al impacto psicológico en paciente y familia no nos permiten intervenir en el debate actual sobre la importancia de la esperanza y el sentido de la vida para el bienestar psicológico del paciente con ELA13–15. Tampoco podemos contribuir a aclarar las complejas interacciones detectadas entre sufrimiento y espiritualidad de los pacientes, y el bienestar de sus familiares cuidadores principales16,17.
Todo lo contrario cabe decir de los datos de nuestra serie relativos al lugar del éxitus y la causa inmediata del mismo. A pesar del trabajo del ESAD nuestra serie confirma una cierta tendencia a la muerte en el entorno hospitalario ya descrita en Francia (63% fallecimientos en hospitales)18, y contraria a la experiencia italiana en Sicilia (82,5% fallecimientos en domicilio)19. Por otro lado, nuestra serie identifica correctamente desde un punto de vista clínico la neumonía como la principal causa de éxitus, y no la insuficiencia respiratoria como en las series ya referidas. En este sentido, es importante destacar que un estudio de correlación clínico – anatomopatológico con autopsias en 100 pacientes de ELA – ha confirmado la neumonía como la causa principal de muerte en estos enfermos20.
El porcentaje de pacientes con ELA que hemos atendido con instrucciones previas (21%) es ciertamente muy superior al que encontramos en nuestra población con situación terminal oncológica. Ello indica un interés superior en el colectivo de pacientes con ELA por este instrumento que busca garantizar el respeto a su autonomía. No obstante, la mayoría de nuestros pacientes habían rechazado ya de forma explícita la VMI (64%) y la gastrostomía (64%) sin necesidad de recurrir a la instrucción previa formal.
En nuestra experiencia, la presencia de las instrucciones previas ha resultado de gran ayuda para implementar las medidas terapéuticas acordes a la voluntad del propio paciente. Sin embargo, ello no obvia el hecho de la dificultad psicológica de llevar a cabo estas instrucciones en una etapa de gran vulnerabilidad del paciente, y además dentro de nuestro contexto cultural que prima el papel de la familia. En este sentido, la experiencia en países culturalmente cercanos como Francia, demuestra la dificultad de discutir anticipadamente en pacientes con ELA sus voluntades para el final de la vida. En un estudio con 35 pacientes franceses, mayoritariamente conocedores de su diagnóstico y pronóstico, tan solo el 20% de los mismos estuvo dispuesto a expresar sus instrucciones previas21. Por el contrario, en un estudio con 16 pacientes norteamericanos, el 87% de los mismos habían registrado sus instrucciones previas, si bien este hecho había hipertrofiado la importancia de la decisión autónoma, sugiriendo a las familias que esta es la ideal22. En resumen, no creemos que las instrucciones previas se vayan a emplear de forma tan generalizada en nuestros pacientes con ELA, como para llegar a ser un factor determinante que facilite su cuidado paliativo.
El papel de la ventilación mecánica (VM) en los pacientes con ELA ha sido revisado recientemente con criterios de medicina basada en la evidencia23. Esta revisión sistemática ha concluido, en base a un estudio randomizado controlado, que la VMNI prolonga significativamente la supervivencia (48 días más de media), y mejora la calidad de vida, en los enfermos con afectación bulbar inexistente o moderada. Por el contrario la VMNI no prolonga la supervivencia de los pacientes con pobre función bulbar. En este sentido conviene destacar que nuestra serie de pacientes presenta un elevado porcentaje de pacientes con afectación bulbar desde el principio, y de hecho tan solo uno de ellos empleó VMNI8.
Un estudio norteamericano sugiere que los pacientes que optan por traqueostomía y VMI son más jóvenes, con mayores recursos económicos, y con un mayor consumo de recursos sanitarios ya desde antes de la traqueostomía24. En nuestra serie el único caso con traqueostomía y VMI cumplía perfectamente el perfil descrito, y requirió de un proceso prolongado e individualizado para llegar a esta decisión similar al ya descrito en otro estudio25.
La retirada de la VM en cumplimiento de las instrucciones previas, o/y los deseos de un paciente competente y no depresivo, puede plantear dudas éticas, legales o clínicas al profesional no suficientemente cualificado, pudiendo llegar a interpretarse erróneamente como eutanasia el derecho legalmente reconocido del paciente a rehusar un procedimiento invasivo26,27. Algunos estudios recientes sugieren las dificultades que manifiestan los especialistas en medicina intensiva para manejar estos conceptos a la hora de retirar la VM28,29. Por otro lado, los especialistas en neurología norteamericanos diferencian adecuadamente los conceptos de eutanasia y sedación terminal, pero son reacios a aplicar la sedación terminal a pacientes de ELA30. Todo ello conlleva una prolongación innecesaria de tratamientos fútiles, por miedo del profesional a tomar una decisión injustificada o ilegal. En nuestra serie tan solo un caso de retirada de VM fue interpretado erróneamente por profesionales de fuera de nuestro centro como un caso de eutanasia, generando con ello un sufrimiento evitable en el paciente y su familia.
El proceso psicológico que lleva al paciente a solicitar la retirada de la VM previamente aceptada no es sencillo, y en nuestra experiencia el miedo a la «muerte por ahogamiento» al retirar la VM tiñe el proceso. Dos de nuestros pacientes manifestaron sus dudas durante la retirada de la VMNI y VMI. En ambos casos se ofreció reinstaurar la VM, lo que los pacientes no aceptaron una vez comprobaron el buen control de la disnea en nuestras manos en ausencia de VM. Es llamativo el hecho de que la «muerte por ahogamiento» es excepcional en la literatura cuando el paciente es manejado en un contexto de CP (un caso de 397 pacientes)6. En nuestra propia serie aunque la familia recordó en 3 casos la muerte como asociada a un ahogo final, lo cierto es que objetivamente tan solo un paciente falleció en ahogamiento por aspiración en vías respiratorias altas.
En este sentido es importante señalar que los trabajos de Maessen et al.31,32 en Holanda apuntan la posibilidad de que el miedo a la muerte por ahogamiento pueda justificar el elevado número de fallecimientos por eutanasia o suicidio asistido en ELA (20%) versus en cáncer (5%). Este miedo no es del todo infundado como demuestra la experiencia en la vecina Alemania, donde en un estudio de 29 pacientes y familias tan solo una minoría de los mismos se planteó suicidio asistido o eutanasia. Sin embargo, en ese mismo estudio una proporción excesiva de pacientes bulbares (6 en total) presentaron «muerte por ahogamiento», y tan solo 17 pacientes de 29 presentaron una muerte en paz en opinión de sus familiares. Es importante destacar de este estudio alemán que la mayoría de los pacientes fallecieron en su domicilio y no en el hospital, y que los autores especialistas en neurología recomiendan en el mismo la incorporación de los CP al manejo de los enfermos33.
Un aspecto particularmente interesante de nuestra serie es la información novedosa que aporta respecto de los fármacos (opioides, benzodiacepinas y anticolinérgicos) y dosis empleados para el control sintomático en los últimos días de vida. En el reciente trabajo y revisión de Oliver et al.6 con 62 pacientes atendidos en 6 hospicios ingleses, la MEDD al éxitus osciló entre 10 y 520mg/día de morfina oral, la MDZDD al éxitus osciló entre 5 y 80 m/día de midazolam parenteral, y el 53% de los pacientes recibieron fármacos anticolinérgicos. Los autores concluyen que la estabilidad de las dosis de opioides en las últimas 72 h de vida es una evidencia de la eficacia de la medicación, y de que la misma no anticipa la muerte de los pacientes.
En llamativa comparación con el estudio citado, nuestra serie describe rangos muy superiores de opioides y benzodiacepinas – MEDD al éxitus osciló entre 0 y 2.700mg/día de morfina oral, la MDZDD al éxitus osciló entre 0 y 415mg/día de midazolam parenteral –, y recibieron anticolinérgicos pautados tan solo aquellos pacientes bajo responsabilidad exclusiva de CP. Además, en bastantes casos se detecta un incremento progresivo en las dosis de opioides y midazolam con el transcurso del tiempo. Por otro lado, estas dosis fueron muy superiores a las recomendadas en la vía clínica para ELA vigente en ese momento en nuestra institución, y que por este motivo ha dejado de aplicarse.
Varios son los posibles factores que justifiquen estas diferencias (algunos previamente conocidos y otros apuntados por primera vez):
- •
Nuestra serie incluye algunos pacientes atendidos bajo responsabilidad compartida con otros servicios del hospital. En estos casos la prescripción no siguió los estándares y protocolos habituales en CP, ausencia de medicación anticolinérgica, dosis escasas de opioides/ benzodiacepinas o, por el contrario, inexplicablemente elevadas en pacientes vírgenes de opioides sin titulación previa.
- •
Nuestra serie incluye pacientes en los que se ha retirado VMNI y VMI a petición de los mismos. En una comunicación de Meyer et al.34 sobre su experiencia en la retirada de la VMNI en 4 pacientes y de la VMI en 5 pacientes, los autores detectaron la necesidad de aplicar estrategias farmacológicas diferentes en estos pacientes para garantizar un buen control sintomático. Los autores llegaron a alcanzar dosis superiores de morfina (300mg/h) a las mencionados en nuestro trabajo, pero con supervivencias muy breves (80 min). Coincidimos por tanto con Meyer et al. en su observación clínica de que las altas dosis de opioides pueden estar motivadas en parte por la retirada de la VM, y también apoyamos su conclusión de que necesitamos más estudios para poder aplicar protocolos basados en la evidencia en los procesos de retirada de VM.
- •
Nuestra serie señala por primera vez la más que probable relación entre la exposición previa a psicofármacos (fundamentalmente benzodiacepinas y opioides) con las dosis finales de morfina y midazolam en los pacientes. Es lógico plantear la hipótesis de que la exposición prolongada a estos fármacos contribuye a la aparición de un fenómeno de tolerancia, así como de habituación a los efectos tóxicos de los mismos.
Nos gustaría señalar que también coincidimos con Meyer et al. en su observación clínica34 de que la retirada de la VM no implica la aplicación de una sedación terminal profunda en todos los casos para garantizar el confort del paciente. Algunos trabajos recientes sugieren que las retiradas de VMI pueden ser efectuadas en el domicilio con un buen control sintomático, siempre que vayan precedidas de sedación terminal profunda35,36. En contraste con esta posición, nuestra experiencia sugiere que en el contexto de UCPA la sedación profunda no es imprescindible, sin que ello comprometa el control adecuado de la disnea. De hecho, la sedación no garantiza el buen control sintomático siempre, tal y como demuestran algunos fracasos en domicilio en este contexto37.
Asimismo, nuestra serie no confirma los plazos que describen estos autores desde la retirada de la VM hasta el éxitus (15min a 28 h), ya que son claramente superiores en nuestros pacientes (2 a 4 días). Es posible que la diferencia tenga que ver con la diferente competencia farmacológica en el manejo de los opioides y la sedación terminal entre los profesionales de CP y otros especialistas, ya señalada en otros estudios33.
Somos conscientes de las limitaciones de la discusión en nuestro estudio en razón de su pequeño tamaño muestral, la ausencia de un análisis estadístico, y las posibilidades de sesgo en la elección de la muestra. No es aventurado suponer que los enfermos remitidos por la Unidad de ELA a la UCP sean precisamente aquellos de mayor complejidad, y que además se hayan manifestado más firmemente en contra de medidas terapéuticas que hayan podido interpretar como excesivas (VM, gastrostomía etc.).
Aún así creemos que este estudio aporta una primera intuición de la elevada complejidad para el manejo paliativo que caracteriza a nuestros pacientes (la discusión pormenorizada del concepto «complejidad» en CP excede con mucho los límites de este trabajo). Confiamos en que la experiencia clínica que seguimos acumulando día a día permita en breve un análisis estadístico cuantitativo de mayor profundidad (a día de hoy la cifra total de pacientes atendidos supera ya los 40 enfermos).
ConclusionesAunque el paciente con ELA en situación terminal tiene derecho a ser atendido en contexto de CP, su presencia no ha sido frecuente en nuestros programas hasta hace relativamente poco tiempo en Madrid. Nuestra experiencia inicial parece que se orienta más hacia el manejo de la etapa final, que a aportar periodos de respiro a las familias claudicadas.
Nuestra experiencia inicial no parece indicar que los escasos pacientes de ELA vayan a saturar nuestros programas de CP (1% actividad total), pero este trabajo sí resulta fundamental para la actividad de las Unidades de ELA (25% de los éxitus por ELA).
No obstante, la percepción de nuestro equipo es que el paciente de ELA en situación terminal y su familia demandan mucho más trabajo e inversión psicológica del profesional de CP que el paciente habitual de cáncer.
El trabajo multidisciplinar y de titulación de dosis para un adecuado control de la disnea terminal, con el grado de sedación o lucidez que el paciente desee, obliga a la intervención directa de CP en la mayoría de los casos, y preferiblemente en contexto de una UCPA en muchos de ellos. Parece razonable concentrar la actividad de CP en las UCP ubicadas en las mismas instituciones que dispongan de Unidades de ELA específicas. La colaboración de ambas unidades beneficiaría a los pacientes y sus familias gracias al manejo especializado de una patología poco frecuente, en la cual es difícil adquirir experiencia suficiente8.
Por último, creemos que el debate sobre la necesidad de eutanasia en la enfermedad de ELA en situación terminal, estará irremediablemente sesgado mientras no garanticemos el control sintomático de la disnea, y la muerte por ahogamiento, a todos los pacientes afectos de esta patología.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
A los profesionales de la Unidad de ELA del Hospital General Universitario Gregorio Marañón, por su colaboración en la redacción de este artículo.
Este trabajo ha sido presentado de forma incompleta y parcial como conferencia invitada en el Palliative Medicine and Supportive Oncology: the 14th Annual International Symposium de la Cleveland Clinic celebrado en Fort Lauderdale (EE. UU.) del 10 al 12 de marzo de 2011, y como poster en el 12.° Congreso de la EAPC celebrado en Lisboa del 18-21 de mayo de 2011.