Analizar el impacto de la vacunación antigripal anual sobre la mortalidad invernal en una cohorte de diabéticos mayores de 65 años seguidos durante 4 años.
Material y métodosCohorte de 2.650 individuos mayores de 65 años con diabetes mellitus, no institucionalizados, seguidos desde enero de 2002 hasta abril de 2005, pertenecientes a 8 áreas básicas de salud. El estado vacunal antigripal se consideró como una condición cambiante en el tiempo y la variable principal fue la muerte por todas las causas en los períodos enero-abril del cuatrienio de estudio.
ResultadosGlobalmente, durante los períodos enero–abril de 2002–2005, la mortalidad invernal (por 100.000 personas/semana) fue de 97,0 para vacunados y de 110,5 para no vacunados, con un riesgo atribuible de 13,5 muertes invernales por 100.000 personas/semana (IC 95%: −11,4 a 38,4). La recepción de la vacuna antigripal se asoció con una reducción no significativa del 12% en el riesgo de mortalidad invernal por cualquier causa (riesgo relativo: 0,88; IC 95%: 0,67–1,19).
ConclusiónNuestros datos apuntan hacia un pequeño beneficio de la vacunación antigripal para disminuir la mortalidad invernal en pacientes diabéticos mayores de 65 años, aunque la posibilidad de un efecto nulo no puede ser excluida totalmente.
To analyze the effectiveness of annual influenza vaccination on winter mortality in a cohort of diabetic patients over 65 years followed-up for 4 years.
MethodsCohort of 2650 non-institutionalized, individuals older than 65 years with Diabetes Mellitus, followed-up from January 2002 until April 2005, from 8 primary health care centers. The vaccination status was considered as a condition changing over time and the endpoint was death from all causes in the period from January to April of the 4-year study period.
ResultsOverall, during the January to April periods including the years 2002–2005, the winter mortality (per 100,000 person-week) was 97.0 for vaccinated and 110.5 for non-vaccinated subjects, with an attributable risk of 13.5 deaths per 100,000 person-weeks in winter (95% CI: −11.4 to 38.4). The reception of the influenza vaccine was associated with a non-significant reduction of 12% in the risk of mortality from all causes during winter in the 2002–2005 overall period (relative risk 0.88; 95% CI: 0.67–1.19).
ConclusionOur data suggest a small benefit of influenza vaccination to reduce winter mortality in diabetic patients over 65 years, although the possibility of no effect cannot be excluded completely.
El virus de la gripe es uno de los mayores causantes de morbimortalidad, sobre todo por enfermedades respiratorias. La incidencia de gripe es mayor en niños y adultos jóvenes, pero la morbilidad asociada y la mortalidad aumentan con la edad, especialmente en individuos con enfermedades crónicas de base como la diabetes mellitus1–3.
El impacto de las epidemias anuales de gripe sobre la morbimortalidad en personas mayores y la efectividad de la vacuna antigripal han sido la base de la implementación de programas de vacunación en personas mayores a nivel mundial4.
La inmunización antigripal es importante en la medicina preventiva de enfermedades crónicas como la diabetes, en la cual el equipo de atención primaria tiene un papel protagonista. De acuerdo con el Advisory Committee on Immunization Practices (ACIP), el American Academy of Family Physicians (AAFP), el Ministerio de Sanidad y Consumo y las recomendaciones del Programa de Actividades Preventivas y de Promoción de la Salud (PAPPS) de la Sociedad Española de Medicina de Familia y Comunitaria (SEMFyC), la vacunación anual de individuos de alto riesgo antes de la época gripal es la medida más efectiva para reducir el impacto de la gripe. En relación con la diabetes mellitus, el objetivo en la atención primaria debería ser la inmunización de todas aquellas personas diabéticas, sobre todo si tienen factores de riesgo como enfermedad renal o cardíaca, o aquellas que han sido hospitalizadas recientemente5.
Aunque la efectividad de la vacuna antigripal en la prevención de la mortalidad ha sido extensamente estudiada en pacientes institucionalizados y hospitalizados en épocas de alta actividad gripal, hay pocos estudios sobre el beneficio clínico de la vacunación a medio o largo plazo en pacientes no institucionalizados6–14, y poco se sabe sobre la efectividad de los programas de vacunación anual de personas mayores con patología de riesgo15.
Con objeto de estudiar el impacto potencial vacunal en la prevención de mortalidad en nuestro medio se realizó un estudio de cohortes que incluyó 11.240 personas no institucionalizadas mayores de 65 años y que fueron seguidas entre los años 2002–2005. Los análisis de la efectividad de la vacuna antigripal en personas mayores con enfermedad pulmonar obstructiva crónica y con cardiopatía han sido publicados previamente16–18. En el presente estudio nos planteamos analizar la relación entre la vacunación antigripal anual y la mortalidad invernal en el subgrupo de 2.650 diabéticos seguidos durante el cuatrienio de estudio.
Material y métodosDiseño del estudio, emplazamiento y criterios de inclusión/exclusiónEstudio de cohortes multicéntrico. Se incluyó a todos los diabéticos de 65 años o más (n=2.650), no institucionalizados, asignados a las 12 áreas básicas de salud (ABS) del Servicio de Atención Primaria de la región de Tarragona-Valls, pertenecientes al Institut Català de Salut. Se eligió como participantes a 8 de las 12 ABS, teniendo en cuenta la existencia de historia clínica informatizada desde 1999 o antes. Las 4 restantes ABS quedaron fuera del estudio al no cumplir este requisito.
La cohorte incluyó un total de 2.650 pacientes que constaban registrados como diabéticos y fueron seguidos desde el comienzo del estudio (1 de enero de 2002) hasta el cese por traslado, muerte o final del estudio (30 de abril de 2005). El estudio fue aprobado por el comité ético del Institut Català de la Salut.
Todas las ABS participantes tenían historias clínicas informatizadas, con registro de inmunizaciones, análisis clínicos, medicación y diagnósticos codificados según la clasificación internacional de enfermedades en su 9.a revisión (ICD-9). El registro electrónico de cada miembro de la cohorte fue usado para conocer el estado vacunal y para identificar la presencia de diabetes mellitus y comorbilidades.
Estado vacunalEl período gripal fue definido como el período durante el cual son generalmente diagnosticados los cuadros influenza-like en el área de estudio, considerándose entre el 1 de enero hasta el 30 de abril para cada año.
El estado vacunal se consideró como una condición dicotómica (vacunado-no vacunado) variable en el tiempo durante el período de estudio. Por ejemplo, en el análisis de todo el período de estudio, una misma persona podía estar no vacunada en el año 2002, vacunada en el año 2003 y no vacunada en el año 2004, de acuerdo con la recepción o no de la vacuna antigripal el otoño previo.
Medida del efectoLa variable principal fue la muerte por todas las causas. Inicialmente se reclutaron las muertes en la base de datos demográficos de la institución (actualizado mensualmente con datos administrativos sobre muertes, pacientes trasladados o nuevos pacientes asignados). Posteriormente, se completó y validó la fecha exacta de muerte con una revisión de los registros civiles municipales. Finalmente, las muertes fueron clasificadas como ocurridas dentro del período gripal (enero–abril) o fuera del período gripal (mayo–diciembre).
CovariablesSe incluyeron edad, sexo, enfermedad pulmonar crónica (incluyendo asma, enfisema o bronquitis crónica), enfermedad cardíaca crónica, hipertensión, obesidad, tabaquismo, inmunodeficiencia (cáncer de órgano sólido o neoplasia hematológica), nefropatía crónica grave (síndrome nefrótico, insuficiencia renal, diálisis o trasplante renal), enfermedad hepática grave (cirrosis), asplenia funcional o anatómica, sida, terapia oral corticoidea de larga duración (20mg/día de prednisona) u otra medicación inmunosupresiva. La presencia de condiciones de comorbilidad fue determinada por revisión de códigos diagnósticos en la historia clínica electrónica para cada miembro de la cohorte.
Pruebas estadísticasLas tasas de mortalidad fueron calculadas como personas/año y personas/semana (en el numerador, el número de muertes, y en el denominador, el total de personas-tiempo). El riesgo atribuible (RA) fue la diferencia entre las tasas de mortalidad entre los no vacunados y los vacunados (RA=incidencia en expuestos-incidencia en no expuestos). El número necesario de vacunaciones anuales antigripales para evitar una muerte fue calculado por períodos gripales (enero–abril=17,1 semanas) y fue calculado como el inverso del RA (número necesario de vacunaciones=1/RA). Para comparar variables categóricas entre grupos se utilizó el test de Ji cuadrado, y para las variables continuas el test de la t de Student. Todos los resultados se expresan con su intervalo de confianza (IC) del 95%.
Se hicieron análisis separadamente por período gripal (enero–abril) y 4 análisis suplementarios por años y período gripal. El estado vacunal fue una covariable cambiante en el tiempo en el estudio estratificado por períodos gripales y una condición fija dicotómica (vacunado/no-vacunado) en el análisis por años.
ResultadosConsiderando los 40 meses del período de estudio, los 2.650 miembros de la cohorte fueron observados por un total de 8.167 personas/año (426.143 personas/semana). La edad media al inicio del estudio era de 74,4 años (desviación estándar: 6,7), siendo un 58,8% mujeres. Fallecieron 384 (14,5%) durante el período de estudio (167 durante enero-abril y 217 durante mayo–diciembre) y 38 (1,4%) fueron pérdidas.
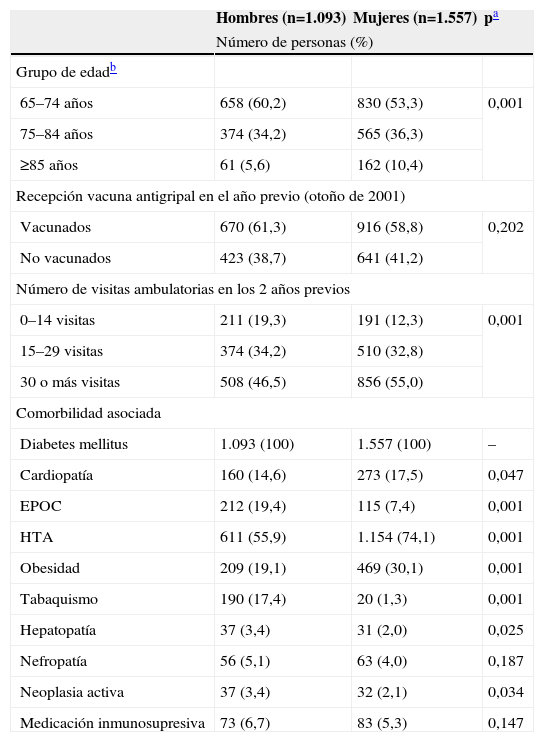
Un total de 2.180 (82,3%) de los sujetos tenían, además de la diabetes, alguna otra comorbilidad, principalmente hipertensión arterial (66,6%), cardiopatía (16,3%) o enfermedad pulmonar crónica (12,3%). La tabla 1 muestra las características basales de la cohorte de estudio al inicio del periodo de seguimiento.
Características de la población de estudio al comienzo del período de seguimiento (1 enero de 2002)
| Hombres (n=1.093) | Mujeres (n=1.557) | pa | |
| Número de personas (%) | |||
| Grupo de edadb | |||
| 65–74 años | 658 (60,2) | 830 (53,3) | 0,001 |
| 75–84 años | 374 (34,2) | 565 (36,3) | |
| ≥85 años | 61 (5,6) | 162 (10,4) | |
| Recepción vacuna antigripal en el año previo (otoño de 2001) | |||
| Vacunados | 670 (61,3) | 916 (58,8) | 0,202 |
| No vacunados | 423 (38,7) | 641 (41,2) | |
| Número de visitas ambulatorias en los 2 años previos | |||
| 0–14 visitas | 211 (19,3) | 191 (12,3) | 0,001 |
| 15–29 visitas | 374 (34,2) | 510 (32,8) | |
| 30 o más visitas | 508 (46,5) | 856 (55,0) | |
| Comorbilidad asociada | |||
| Diabetes mellitus | 1.093 (100) | 1.557 (100) | – |
| Cardiopatía | 160 (14,6) | 273 (17,5) | 0,047 |
| EPOC | 212 (19,4) | 115 (7,4) | 0,001 |
| HTA | 611 (55,9) | 1.154 (74,1) | 0,001 |
| Obesidad | 209 (19,1) | 469 (30,1) | 0,001 |
| Tabaquismo | 190 (17,4) | 20 (1,3) | 0,001 |
| Hepatopatía | 37 (3,4) | 31 (2,0) | 0,025 |
| Nefropatía | 56 (5,1) | 63 (4,0) | 0,187 |
| Neoplasia activa | 37 (3,4) | 32 (2,1) | 0,034 |
| Medicación inmunosupresiva | 73 (6,7) | 83 (5,3) | 0,147 |
DE: desviación estándar; EPOC: enfermedad pulmonar obstructiva crónica; HTA: hipertensión arterial.
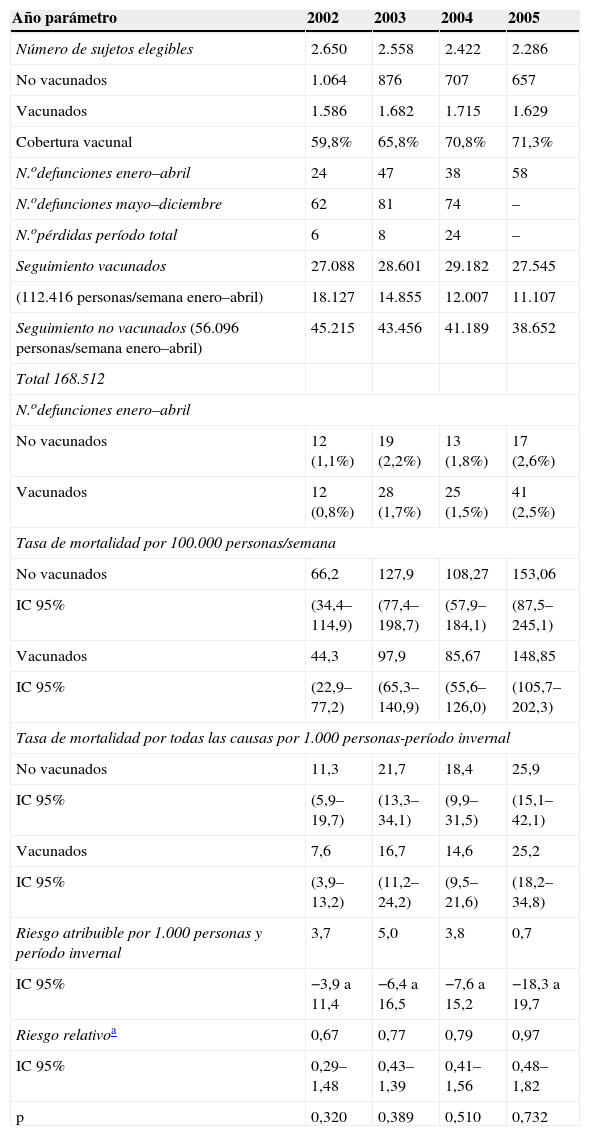
Si consideramos los sujetos elegibles en cada campaña vacunal, la cobertura alcanzó un 59,8% en el otoño de 2001, un 65,8% en el otoño de 2002, un 70,8% en el otoño de 2003 y un 71,3% en el otoño de 2004. En total, 168.512 personas/semana fueron observadas dentro de los períodos enero-abril, de los cuales 112.416 personas/semana (66,8%) correspondían a personas vacunadas y 56.096 personas/semana no habían recibido la vacuna antigripal en el otoño previo.
A lo largo del período de estudio, la tasa de mortalidad por cualquier causa fue de 47,5 muertes por 1.000 personas/año (IC 95%: 43,0–52,3). La mortalidad varió significativamente durante los meses del año, observándose 167 muertes durante enero–abril y 217 muertes durante mayo-diciembre, lo cual significó una tasa de mortalidad (por 100.000 personas/semana) de 90,2 (IC 95%: 81,5–99,3) durante el período total de estudio; 99,1 (IC 95%: 84,8–114,9) en el período enero–abril, y 84,2 (IC 95%: 73,6–95,8) dentro del período mayo-diciembre.
Durante la suma de los cuatro períodos enero–abril 2002–2005, se observaron 106 muertes entre las personas que habían recibido la vacuna antigripal en el otoño previo y 61 muertes entre las personas que no la habían recibido; esto significó una tasa de mortalidad invernal (por 100.000 personas/semana) de 97,0 (IC 95%: 80,1–116,4) en vacunados y de 110,5 (IC 95%: 85,3–140,5) en no vacunados. Estos valores supusieron un RA para no vacunados de 13,5 muertes invernales por 100.000 personas/semana (IC 95%: −11,4 a 38,4) a lo largo del período total de estudio. El RA a lo largo del estudio fue de 2,3 muertes por 1.000 personas/invierno (IC 95%: −1,9 a 6,6).
El análisis global del cuatrienio estudiado (2002–2005) mostró que la recepción de una dosis de vacuna antigripal en el otoño previo no se asociaba a una reducción significativa en el riesgo de mortalidad invernal por cualquier causa (RR: 0,88; IC 95%: 0,67–1,19).
Cuando analizamos separadamente la relación entre la recepción de la vacuna antigripal en cada otoño y el riesgo de muerte por cualquier causa en el siguiente invierno, tampoco observamos un efecto protector estadísticamente significativo, con unos RR para vacunados que oscilaron entre un 0,67 (IC 95%: 0,29–1,48) en el período gripal 2001-2002, un 0,77 (IC 95%: 0,43–1,39) en el período 2002–2003, un 0,79 (IC 95%: 0,41–1,56) en el período 2003–2004 y un 0,97 (IC 95%: 0,48–1,82) en el período 2004–2005.
La tabla 2 muestra las coberturas vacunales, el número de muertes y los diferentes resultados evaluando la relación entre la recepción de la vacuna antigripal en el otoño previo y la mortalidad invernal por todas las causas durante cada una de las estaciones gripales 2002–2005.
Incidencia y riesgo de mortalidad por cualquier causa entre la población a estudio durante los períodos gripales 2002–2005 según la recepción o no de la vacuna antigripal
| Año parámetro | 2002 | 2003 | 2004 | 2005 |
| Número de sujetos elegibles | 2.650 | 2.558 | 2.422 | 2.286 |
| No vacunados | 1.064 | 876 | 707 | 657 |
| Vacunados | 1.586 | 1.682 | 1.715 | 1.629 |
| Cobertura vacunal | 59,8% | 65,8% | 70,8% | 71,3% |
| N.odefunciones enero–abril | 24 | 47 | 38 | 58 |
| N.odefunciones mayo–diciembre | 62 | 81 | 74 | – |
| N.opérdidas período total | 6 | 8 | 24 | – |
| Seguimiento vacunados | 27.088 | 28.601 | 29.182 | 27.545 |
| (112.416 personas/semana enero–abril) | 18.127 | 14.855 | 12.007 | 11.107 |
| Seguimiento no vacunados (56.096 personas/semana enero–abril) | 45.215 | 43.456 | 41.189 | 38.652 |
| Total 168.512 | ||||
| N.odefunciones enero–abril | ||||
| No vacunados | 12 (1,1%) | 19 (2,2%) | 13 (1,8%) | 17 (2,6%) |
| Vacunados | 12 (0,8%) | 28 (1,7%) | 25 (1,5%) | 41 (2,5%) |
| Tasa de mortalidad por 100.000 personas/semana | ||||
| No vacunados | 66,2 | 127,9 | 108,27 | 153,06 |
| IC 95% | (34,4–114,9) | (77,4–198,7) | (57,9–184,1) | (87,5–245,1) |
| Vacunados | 44,3 | 97,9 | 85,67 | 148,85 |
| IC 95% | (22,9–77,2) | (65,3–140,9) | (55,6–126,0) | (105,7–202,3) |
| Tasa de mortalidad por todas las causas por 1.000 personas-período invernal | ||||
| No vacunados | 11,3 | 21,7 | 18,4 | 25,9 |
| IC 95% | (5,9–19,7) | (13,3–34,1) | (9,9–31,5) | (15,1–42,1) |
| Vacunados | 7,6 | 16,7 | 14,6 | 25,2 |
| IC 95% | (3,9–13,2) | (11,2–24,2) | (9,5–21,6) | (18,2–34,8) |
| Riesgo atribuible por 1.000 personas y período invernal | 3,7 | 5,0 | 3,8 | 0,7 |
| IC 95% | −3,9 a 11,4 | −6,4 a 16,5 | −7,6 a 15,2 | −18,3 a 19,7 |
| Riesgo relativoa | 0,67 | 0,77 | 0,79 | 0,97 |
| IC 95% | 0,29–1,48 | 0,43–1,39 | 0,41–1,56 | 0,48–1,82 |
| p | 0,320 | 0,389 | 0,510 | 0,732 |
IC: intervalo de confianza.
Aunque existe consenso para la recomendación de la vacuna antigripal en personas mayores y adultos de alto riesgo2,3, la magnitud de la efectividad clínica y el beneficio de las campañas vacunales anuales son controvertidos14,15,19.
Nuestro estudio apunta un posible efecto beneficioso de la vacunación en la reducción de mortalidad invernal en los pacientes diabéticos mayores de 65 años, puesto que, globalmente y para cada una de las cuatro estaciones gripales analizadas, los pacientes vacunados presentaron menores tasas de mortalidad invernal por cualquier causa que los no vacunados. Sin embargo, nuestros hallazgos deben ser interpretados con cautela puesto que, considerando el relativamente bajo número de eventos, nuestros resultados no alcanzaron significación estadística en ninguno de los períodos analizados.
Nuestros resultados son inferiores a los reportados por Voordouw et al en un estudio de cohortes retrospectivo en mayores de 65 años en Holanda, que demostraron que la vacunación anual estaba asociada a una reducción del riesgo de mortalidad de aproximadamente el 24% durante el período total de estudio y de un 28% durante los períodos epidémicos10.
En el presente estudio, las coberturas vacunales anuales variaron entre el 59,8 y el 71,3%, datos que concuerdan con otros reportados en gente mayor con diabetes mellitus en España y otros países desarrollados, donde aproximadamente un 30% de estos pacientes diabéticos no se vacuna anualmente contra la gripe1,2,20–22.
En el presente estudio se analizaron 4 épocas gripales, con variabilidad interanual sustancial de virus circulantes y con buena correlación antigénica entre las cepas circulantes y vacunales23. Durante nuestro período de estudio (2002–2005), la actividad gripal en los países del hemisferio norte fue moderada-débil en la mayoría de los países, y se asoció con una circulación mixta de virus A y B. En este período, las cepas vacunales y las circulantes predominantes (principalmente A [H3N2]) fueron coincidentes24–27.
Aunque el beneficio de la vacunación antigripal para prevenir hospitalización y muerte ha sido largamente estudiado, la efectividad de la vacunación antigripal no es bien conocida en la mayoría de las causas específicas de muerte, excepto para la neumonía. En el año 2007, Wang et al analizaron datos de mortalidad durante 10 meses de 102.689 pacientes de 65 años o más en el sur de Taiwán, describiendo que la vacuna antigripal se asoció con un 44% de menor riesgo de mortalidad por todas las causas y una reducción significativa de un 55% en el riesgo de muerte por diabetes ente los sujetos vacunados7.
Recientes estudios sugieren que existe una clara asociación entre la gripe, las infecciones respiratorias y el desencadenamiento de eventos cardiovasculares agudos (infartos agudos de miocardio, muerte súbita, accidentes vasculares cerebrales), y, por tanto, la vacuna antigripal reduciría no sólo la muerte específica por gripe o neumonía, sino que de forma indirecta reduciría la muerte por eventos cardiovasculares27.
En el presente estudio, como medida del efecto hemos elegido mortalidad por todas las causas para minimizar un posible sesgo de clasificación y falta de poder estadístico en el análisis de mortalidad específica. En general, cuando el evento de interés es la muerte, la mortalidad por todas las causas se considera como un evento más robusto que la causa específica de muerte28. Considerando, además, las dificultades de la confirmación serológica de las infecciones por el virus de la gripe, la mortalidad por todas las causas es considerada como un parámetro aceptable para evaluar la efectividad de la vacuna antigripal en varios estudios observacionales29,30.
Debido a las dificultades que comporta un diagnóstico serológico y atendiendo a los problemas éticos derivados de un diseño randomizado, la efectividad de la vacuna a nivel poblacional ha sido evaluada generalmente mediante estudios observacionales que utilizaban índices poco específicos y/o indirectos de efectividad (incidencia de cuadros influenza-like, hospitalizaciones y muerte por enfermedad respiratoria o por cualquier causa). La efectividad descrita hasta ahora de la vacuna antigripal para reducir la mortalidad por todas las causas se ha situado entre un 45–56% en estudios de cohortes y un 17–30% en estudios de casos y controles29,30. La efectividad de la vacuna antigripal para prevenir la mortalidad por todas las causas es controvertida. Simonsen et al analizaron las coberturas vacunales y estimaron la mortalidad relacionada con la gripe y las muertes por cualquier causa en 33 períodos gripales desde 1968 a 2001 en población anciana de EE. UU., sin encontrar correlación entre el aumento de cobertura vacunal después de 1980 con las descendentes tasas de mortalidad en cualquier grupo de edad, y concluyeron que muchos estudios sobrestimaban sustancialmente los beneficios de la vacuna19.
En nuestro estudio, la diferencia entre la mortalidad por todas las causas en no vacunados y vacunados fue de 13,5 muertes por 100.000 personas/semana durante el período enero-abril total. Esto implicaría un RA de 2,3 muertes por 1.000 personas/invierno y, por tanto, un número aproximado de 431 vacunaciones anuales necesarias para prevenir una muerte, aunque debe resaltarse que el IC del RA no excluyó la posibilidad de un efecto negativo de la vacunación.
Algunas cuestiones metodológicas deben ser comentadas para una mejor valoración de los resultados. El estado vacunal se consideró como una variable dicotómica (“vacunado” o “no vacunado”) para cada año, pero otras categorías tales como “primera vacunación”, “revacunación”, “vacunación interrumpida” o “restablecimiento de la vacunación”, que pueden influir en los efectos de la vacuna antigripal, no se consideraron4,13. En nuestro estudio, la situación vacunal y la presencia de comorbilidad fueron consideradas sobre la base de la información registrada. Somos conscientes de que puede haber existido un cierto sesgo de clasificación al considerar como no vacunadas a algunas personas que en realidad podrían haber estado vacunadas pero en las que este hecho no constase registrado en nuestras fuentes de datos (por falta de reinformación de la vacunación o por vacunación fuera del ABS). Un problema similar, motivado por las mismas razones, puede haberse producido en la consideración de los antecedentes de factores de riesgo y/o patologías crónicas de la población estudiada. Por último, y tratándose de un estudio no randomizado, un posible problema puede radicar en la falta de comparabilidad inicial de los grupos. Este hecho puede haber supuesto cierta infraestimación de la efectividad vacunal, puesto que los vacunados eran algo más viejos y tenían más comorbilidad que los no vacunados.
La eficacia de la vacunación antigripal y la estimación del impacto de ésta sobre la morbimortalidad han sido las bases para la implementación de los programas de vacunación en gente mayor y en individuos de riesgo2,3,23,30. Nuestros datos sugieren un beneficio de la vacunación antigripal en pacientes diabéticos, incluso en épocas gripales moderadas y de baja severidad. Para confirmar esta tendencia es necesaria la realización de estudios que controlen mejor las variables principales, los criterios de selección y amplíen el tiempo de seguimiento para estimar la verdadera efectividad de la vacuna antigripal en pacientes diabéticos en nuestro medio, con el fin de desarrollar e implementar nuevas estrategias vacunales. No olvidemos que el gold estándar sería conseguir un 100% de vacunaciones entre los pacientes diabéticos.
Conflicto de interesesLos autores declaran no tener conflicto de intereses.
FinanciaciónEste estudio está becado con una de la Fundación Jordi Gol i Gurina, Barcelona.
Los autores agradecen a los médicos de familia y enfermeras de los centros de Atención Primaria de Tarragona-Valls su colaboración en este estudio.