Crear y validar un modelo de predicción clínica que permita mejorar la gestión de recursos y determinar el pronóstico de los pacientes hospitalizados por COVID-19.
Material y métodosEstudio de cohorte retrospectivo en el Hospital Universitario de Guadalajara, incluyendo 1.043 pacientes hospitalizados por COVID-19 entre marzo y mayo de 2020. Los datos fueron extraídos del registro hospitalario y anonimizados. Se recopilaron variables demográficas, clínicas, analíticas, radiológicas y terapéuticas, y se realizó un análisis estadístico para identificar factores asociados a la mortalidad. Se emplearon modelos de regresión logística y de Cox para evaluar los predictores de mortalidad. Se realizó una validación interna mediante comparación de curvas ROC del modelo de derivación y validación.
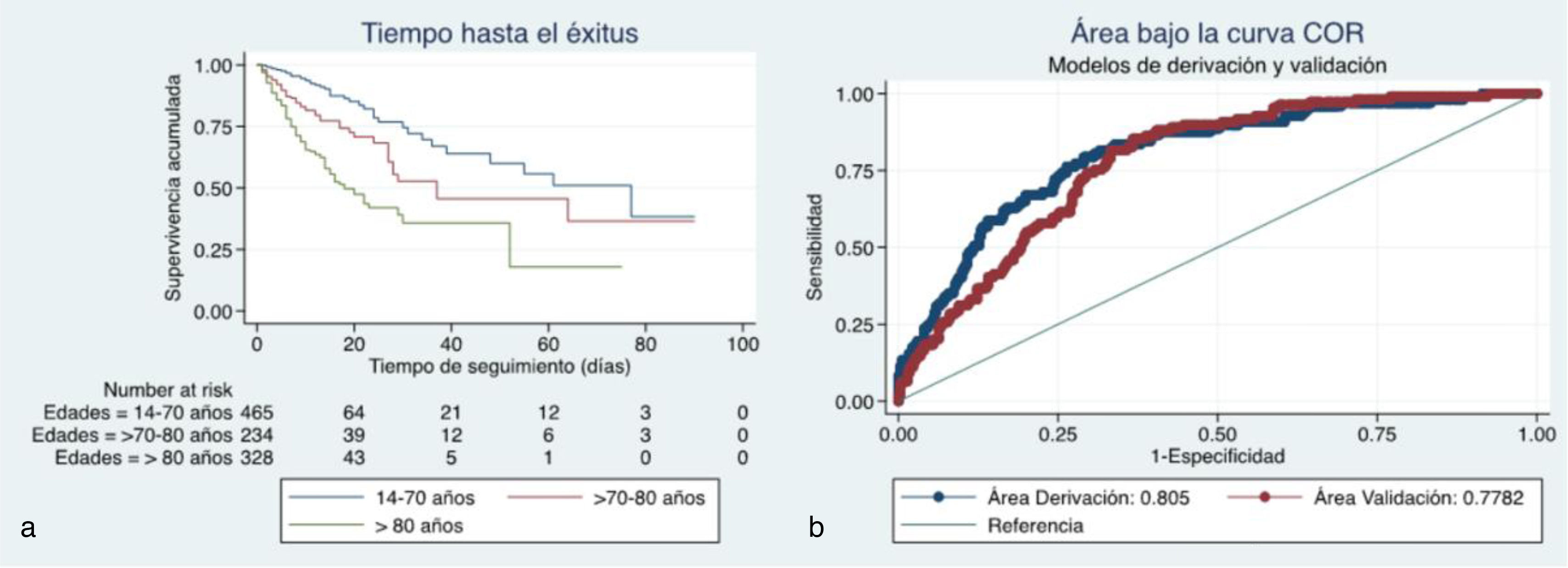
ResultadosLa mediana de edad fue de 70años (P25-P75: 59-84), siendo el 59% varones y falleciendo el 23,2% de la muestra. La hipertensión (55%), la dislipemia (36%) y la diabetes (27%) fueron las comorbilidades más frecuentes. Los predictores independientes de mortalidad incluyeron edad mayor de 80años (OR: 6,2), enfermedad pulmonar obstructiva crónica (OR: 2,4), saturación de oxígeno <90% (OR: 1,7), neumonía multilobar bilateral (OR: 2,4) y niveles elevados de LDH (OR: 1,2). El área bajo la curva del modelo de derivación fue de 0,81, y para el modelo de validación el área bajo la curva fue de 0,78.
ConclusionesLa edad avanzada, la enfermedad pulmonar obstructiva crónica, la baja saturación de oxígeno, la neumonía multilobar bilateral y los niveles elevados de LDH se asocian de forma independiente con un mayor riesgo de muerte. El modelo clínico predictivo de estas cinco variables está validado y permite clasificar a los pacientes en grupos de alto o bajo riesgo, lo que facilita una mejor toma de decisiones clínicas y optimiza el manejo de recursos.
To develop and validate a clinical prediction model aimed at improving resource management and determining the prognosis of patients hospitalized with COVID-19.
Materials and methodsA retrospective, single-center cohort study conducted at the University Hospital of Guadalajara, including 1,043 patients hospitalized with COVID-19 between March and May 2020. Data were extracted from hospital records and anonymized. Demographic, clinical, laboratory, radiological, and therapeutic variables were collected, and statistical analysis was performed to identify factors associated with mortality. Logistic regression and Cox models were employed to evaluate mortality predictors. Validation was conducted by comparing ROC curves.
ResultsThe median age of the patients was 70.4years (P25-P75: 59-84), with 59.2% being male, and a mortality rate of 23.2%. The most common comorbidities were hypertension (54.8%), dyslipidemia (36.3%), and diabetes (27.1%). Independent predictors of mortality included age over 80years (OR: 6.18), chronic obstructive pulmonary disease (OR: 2.35), oxygen saturation <90% (OR: 1.7), multilobar pneumonia (OR: 2.4), and elevated LDH levels (OR: 1.2). The area under the curve (AUC) for the derivation model was 0.805 (P<.001), and for the validation model, the AUC was 0.78 (P<.001).
ConclusionsAdvanced age, chronic obstructive pulmonary disease, low oxygen saturation, multilobar pneumonia, and elevated LDH levels are significantly associated with increased mortality risk. The validated predictive model enables classification of patients into high- or low-risk groups, thereby facilitating improved clinical decision-making and resource management.
El SARS-CoV-2, responsable de la COVID-19, emergió en Wuhan en 2019 y se diseminó rápidamente, generando una pandemia global. Este Betacoronavirus es genéticamente similar al MERS-CoV y SARS-CoV1. Utiliza su proteína S para unirse a los receptores ACE2 en células respiratorias, desencadenando una respuesta inflamatoria que puede causar complicaciones severas, como el síndrome de dificultad respiratoria aguda (SDRA)2.
La OMS declaró la pandemia en marzo de 2020. Durante la crisis emergieron variantes del virus con diferentes características de transmisibilidad y gravedad. La transmisión del SARS-CoV-2 ocurre principalmente de persona a persona, con un período de incubación de 4 a 5días, aunque puede llegar hasta 10días3,4. La prevención mediante mascarillas y distanciamiento social fue fundamental para mitigar la transmisión5.
En España, la primera ola afectó gravemente la atención sanitaria. Para mayo de 2020 se habían reportado 250.273 casos2, y de ellos, 20.477 en Castilla-La Mancha6. Se registró una alta hospitalización y mortalidad, especialmente en personas mayores y con comorbilidades7,8. La provincia de Guadalajara enfrentó una alta mortalidad, influenciada por factores geográficos y la distancia al hospital principal9.
El diagnóstico se realizó principalmente a través de pruebas de RT-PCR y serológicas10,11. En Guadalajara se implementaron cambios hospitalarios para aumentar la capacidad de atención12. Los tratamientos más eficaces descritos en la literatura para casos graves incluyeron glucocorticoides, remdesivir y ciertos inmunomoduladores (tocilizumab, baricitinib), destacando los beneficios de los glucocorticoides13-15.
Durante la primera ola no estaba definido el perfil de los pacientes con mal pronóstico (que requerían un ingreso hospitalario y una atención cuidadosa con medidas terapéuticas avanzadas) ni aquellos con buen pronóstico (a los que se les daría de alta desde el servicio de urgencias o bien un alta precoz). La dificultad para establecer una escala pronóstica es lo que motiva este estudio. Por tanto, nuestro objetivo consiste en crear y validar un modelo de predicción clínica que permita mejorar la gestión de recursos y determinar el pronóstico de los pacientes hospitalizados por COVID-19.
Material y métodosSe trata de una cohorte retrospectiva en el Hospital Universitario de Guadalajara, analizando a pacientes ingresados por COVID-19 del 1 de marzo al 31 de mayo de 2020 (primera ola). Los pacientes fueron identificados a través de los registros hospitalarios y los datos fueron anonimizados para su inclusión en una base de datos.
Se recopilaron datos del programa de microbiología y las historias clínicas electrónicas de atención especializada y primaria, incluyendo a 1.043 pacientes con pruebas positivas de SARS-CoV-2 mediante RT-PCR o serología16. El estudio fue aprobado por el comité de ética e investigación con medicamentos y se garantizó la confidencialidad de los datos, sin requerir consentimiento informado debido a la pandemia17.
Se incluyeron pacientes mayores de 18años positivos para SARS-CoV-2 y hospitalizados por COVID-19, excluyendo a menores, embarazadas y quienes no fueron hospitalizados. El seguimiento comenzó con la fecha de ingreso y se censuraron los pacientes por fallecimiento o a 31 de mayo de 2020. Se analizaron variables demográficas (sexo y edad), pruebas diagnósticas realizadas (radiografía de tórax y analíticas), comorbilidades (hipertensión, diabetes, dislipemia, enfermedades cardiovasculares, EPOC, enfermedades pulmonares, enfermedad renal y hepática crónica), tratamientos (azitromicina, heparina, cloroquina, interferón beta, entre otros, y soporte respiratorio) y otras variables consideradas de importancia (mortalidad, días de ingreso y UCI).
Análisis estadísticoLas variables cualitativas se reportaron en frecuencias y porcentajes, y las cuantitativas, con la media y desviación estándar o mediana y rango intercuartílico. Se compararon los fallecidos con los supervivientes utilizando chi-cuadrado y prueba exacta de Fisher para las variables cualitativas y t de Student, ANOVA y regresión lineal para las cuantitativas. Se aplicó regresión logística para identificar predictores independientes de mortalidad y un modelo de Cox para evaluar el tiempo hasta el fallecimiento, utilizando un intervalo de confianza del 95%. La base fue dividida al azar para seleccionar un modelo de derivación y otro de validación (50% en cada uno de los grupos). Se analizaron sensibilidades, especificidades, valores predictivos positivos y negativos y curvas ROC. Para la validación del modelo se compararon las áreas bajo la curva de las ROC del modelo de derivación y del de validación. Se emplearon para la calibración las pruebas de Hosmer y Lemeshow. Se empleó el paquete STATA 15.1 para el análisis estadístico.
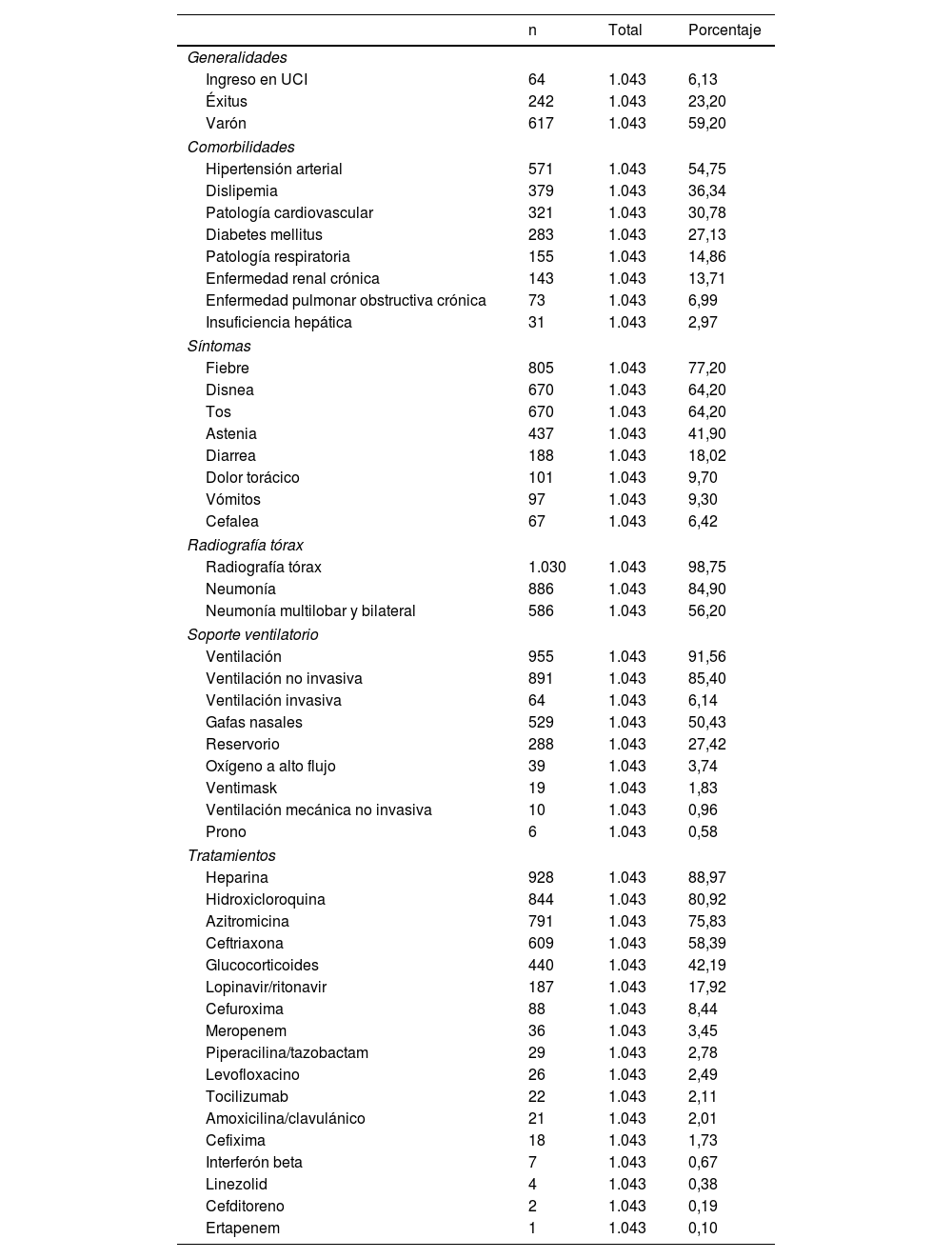
ResultadosAnálisis descriptivoSe estudiaron 1.043 pacientes hospitalizados con una mediana de edad de 73años (P25-P75: 59-84), predominando los varones (59%). Antes del 30 de mayo de 2020, el 23,2% (242) fallecieron y el 6,1% (64) requirieron ingreso en la UCI. Las comorbilidades más comunes incluyeron hipertensión arterial (55%), dislipemia (36%) y diabetes mellitus (27%).
Los signos y síntomas más frecuentes fueron la fiebre (77%), la disnea (64%) y la tos (64%), con una saturación de oxígeno promedio del 92,2% (DE: 7). Se realizó radiografía de tórax a casi todos los pacientes (98,8%); de estos, presentaban neumonía el 85%, y de estos, en el 56% era multilobar y bilateral.
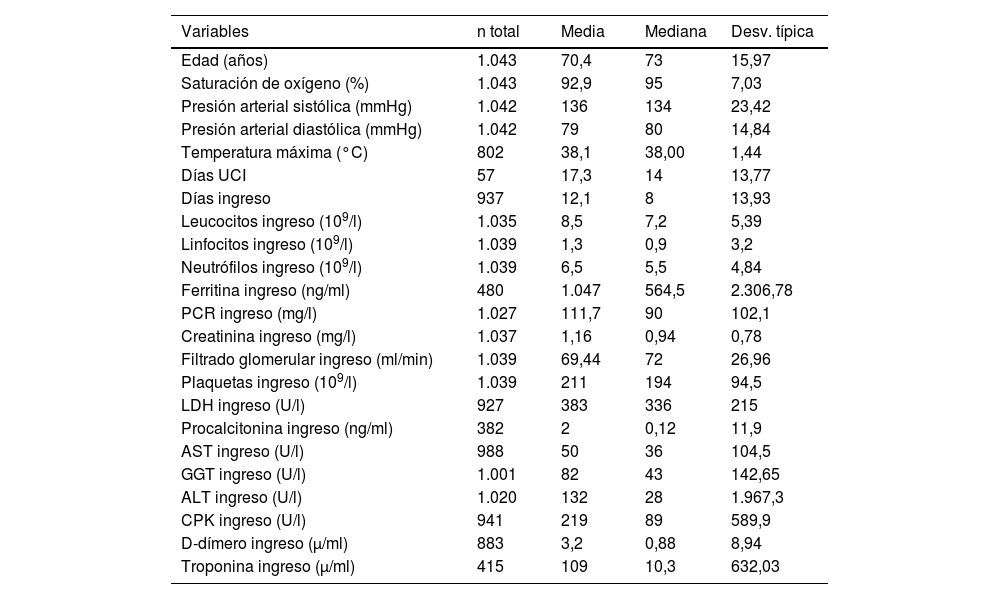
El 85% de los pacientes requirieron soporte respiratorio. Los tratamientos administrados incluyeron hidroxicloroquina (81%), azitromicina (76%), glucocorticoides (42%), con antibióticos como ceftriaxona (58%) y otros en menor proporción (tabla 1). La descripción de las variables analíticas se puede ver en la tabla 2.
Análisis descriptivo variables cualitativas
| n | Total | Porcentaje | |
|---|---|---|---|
| Generalidades | |||
| Ingreso en UCI | 64 | 1.043 | 6,13 |
| Éxitus | 242 | 1.043 | 23,20 |
| Varón | 617 | 1.043 | 59,20 |
| Comorbilidades | |||
| Hipertensión arterial | 571 | 1.043 | 54,75 |
| Dislipemia | 379 | 1.043 | 36,34 |
| Patología cardiovascular | 321 | 1.043 | 30,78 |
| Diabetes mellitus | 283 | 1.043 | 27,13 |
| Patología respiratoria | 155 | 1.043 | 14,86 |
| Enfermedad renal crónica | 143 | 1.043 | 13,71 |
| Enfermedad pulmonar obstructiva crónica | 73 | 1.043 | 6,99 |
| Insuficiencia hepática | 31 | 1.043 | 2,97 |
| Síntomas | |||
| Fiebre | 805 | 1.043 | 77,20 |
| Disnea | 670 | 1.043 | 64,20 |
| Tos | 670 | 1.043 | 64,20 |
| Astenia | 437 | 1.043 | 41,90 |
| Diarrea | 188 | 1.043 | 18,02 |
| Dolor torácico | 101 | 1.043 | 9,70 |
| Vómitos | 97 | 1.043 | 9,30 |
| Cefalea | 67 | 1.043 | 6,42 |
| Radiografía tórax | |||
| Radiografía tórax | 1.030 | 1.043 | 98,75 |
| Neumonía | 886 | 1.043 | 84,90 |
| Neumonía multilobar y bilateral | 586 | 1.043 | 56,20 |
| Soporte ventilatorio | |||
| Ventilación | 955 | 1.043 | 91,56 |
| Ventilación no invasiva | 891 | 1.043 | 85,40 |
| Ventilación invasiva | 64 | 1.043 | 6,14 |
| Gafas nasales | 529 | 1.043 | 50,43 |
| Reservorio | 288 | 1.043 | 27,42 |
| Oxígeno a alto flujo | 39 | 1.043 | 3,74 |
| Ventimask | 19 | 1.043 | 1,83 |
| Ventilación mecánica no invasiva | 10 | 1.043 | 0,96 |
| Prono | 6 | 1.043 | 0,58 |
| Tratamientos | |||
| Heparina | 928 | 1.043 | 88,97 |
| Hidroxicloroquina | 844 | 1.043 | 80,92 |
| Azitromicina | 791 | 1.043 | 75,83 |
| Ceftriaxona | 609 | 1.043 | 58,39 |
| Glucocorticoides | 440 | 1.043 | 42,19 |
| Lopinavir/ritonavir | 187 | 1.043 | 17,92 |
| Cefuroxima | 88 | 1.043 | 8,44 |
| Meropenem | 36 | 1.043 | 3,45 |
| Piperacilina/tazobactam | 29 | 1.043 | 2,78 |
| Levofloxacino | 26 | 1.043 | 2,49 |
| Tocilizumab | 22 | 1.043 | 2,11 |
| Amoxicilina/clavulánico | 21 | 1.043 | 2,01 |
| Cefixima | 18 | 1.043 | 1,73 |
| Interferón beta | 7 | 1.043 | 0,67 |
| Linezolid | 4 | 1.043 | 0,38 |
| Cefditoreno | 2 | 1.043 | 0,19 |
| Ertapenem | 1 | 1.043 | 0,10 |
Análisis descriptivo variables cuantitativas
| Variables | n total | Media | Mediana | Desv. típica |
|---|---|---|---|---|
| Edad (años) | 1.043 | 70,4 | 73 | 15,97 |
| Saturación de oxígeno (%) | 1.043 | 92,9 | 95 | 7,03 |
| Presión arterial sistólica (mmHg) | 1.042 | 136 | 134 | 23,42 |
| Presión arterial diastólica (mmHg) | 1.042 | 79 | 80 | 14,84 |
| Temperatura máxima (°C) | 802 | 38,1 | 38,00 | 1,44 |
| Días UCI | 57 | 17,3 | 14 | 13,77 |
| Días ingreso | 937 | 12,1 | 8 | 13,93 |
| Leucocitos ingreso (109/l) | 1.035 | 8,5 | 7,2 | 5,39 |
| Linfocitos ingreso (109/l) | 1.039 | 1,3 | 0,9 | 3,2 |
| Neutrófilos ingreso (109/l) | 1.039 | 6,5 | 5,5 | 4,84 |
| Ferritina ingreso (ng/ml) | 480 | 1.047 | 564,5 | 2.306,78 |
| PCR ingreso (mg/l) | 1.027 | 111,7 | 90 | 102,1 |
| Creatinina ingreso (mg/l) | 1.037 | 1,16 | 0,94 | 0,78 |
| Filtrado glomerular ingreso (ml/min) | 1.039 | 69,44 | 72 | 26,96 |
| Plaquetas ingreso (109/l) | 1.039 | 211 | 194 | 94,5 |
| LDH ingreso (U/l) | 927 | 383 | 336 | 215 |
| Procalcitonina ingreso (ng/ml) | 382 | 2 | 0,12 | 11,9 |
| AST ingreso (U/l) | 988 | 50 | 36 | 104,5 |
| GGT ingreso (U/l) | 1.001 | 82 | 43 | 142,65 |
| ALT ingreso (U/l) | 1.020 | 132 | 28 | 1.967,3 |
| CPK ingreso (U/l) | 941 | 219 | 89 | 589,9 |
| D-dímero ingreso (μ/ml) | 883 | 3,2 | 0,88 | 8,94 |
| Troponina ingreso (μ/ml) | 415 | 109 | 10,3 | 632,03 |
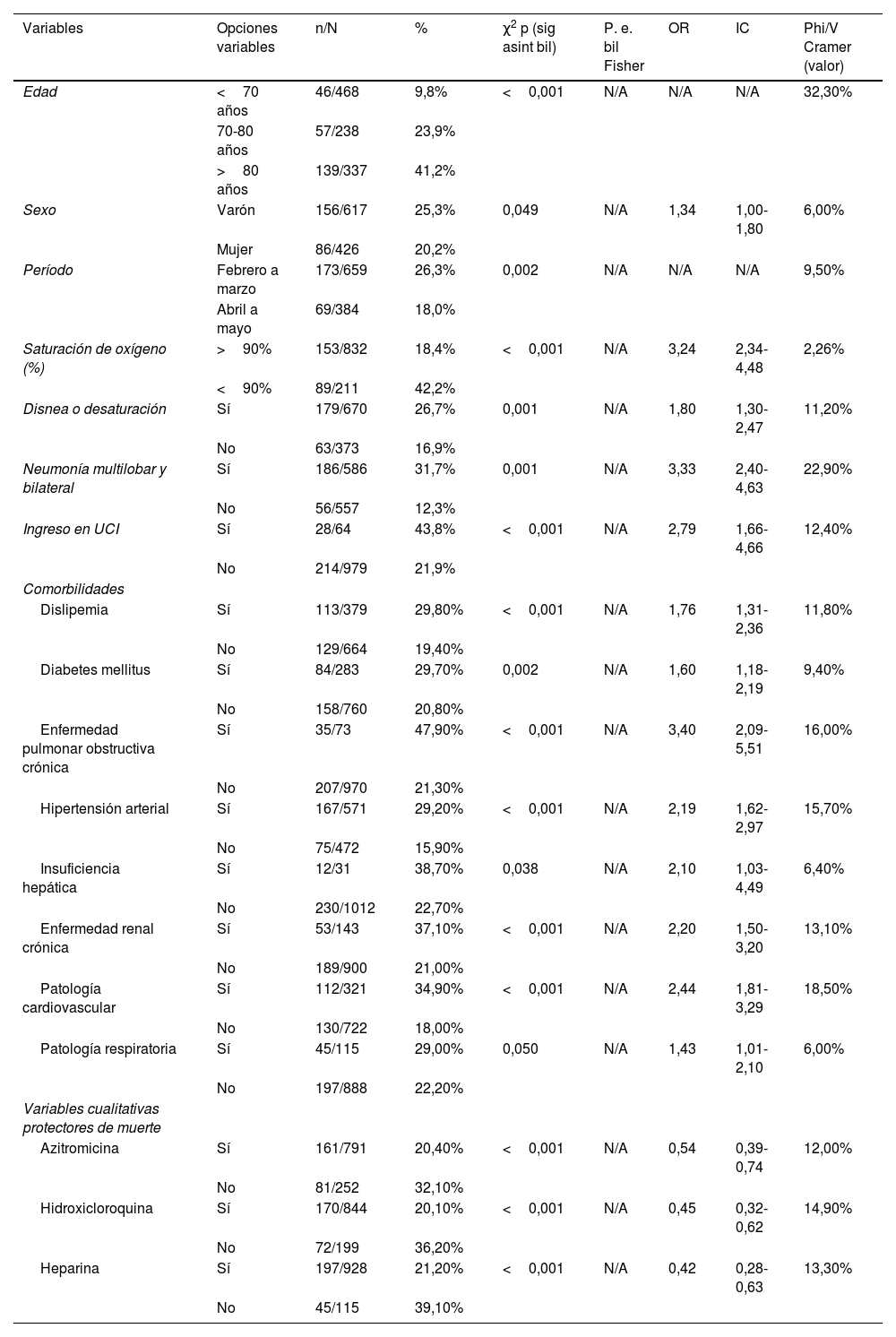
En el análisis comparativo entre el grupo de fallecidos frente al de supervivientes se realizó un análisis univariante, como se muestra en las tablas 3, 4, 5 y 6.
Análisis univariante
| Variables | Opciones variables | n/N | % | χ2 p (sig asint bil) | P. e. bil Fisher | OR | IC | Phi/V Cramer (valor) |
|---|---|---|---|---|---|---|---|---|
| Edad | <70 años | 46/468 | 9,8% | <0,001 | N/A | N/A | N/A | 32,30% |
| 70-80 años | 57/238 | 23,9% | ||||||
| >80 años | 139/337 | 41,2% | ||||||
| Sexo | Varón | 156/617 | 25,3% | 0,049 | N/A | 1,34 | 1,00-1,80 | 6,00% |
| Mujer | 86/426 | 20,2% | ||||||
| Período | Febrero a marzo | 173/659 | 26,3% | 0,002 | N/A | N/A | N/A | 9,50% |
| Abril a mayo | 69/384 | 18,0% | ||||||
| Saturación de oxígeno (%) | >90% | 153/832 | 18,4% | <0,001 | N/A | 3,24 | 2,34-4,48 | 2,26% |
| <90% | 89/211 | 42,2% | ||||||
| Disnea o desaturación | Sí | 179/670 | 26,7% | 0,001 | N/A | 1,80 | 1,30-2,47 | 11,20% |
| No | 63/373 | 16,9% | ||||||
| Neumonía multilobar y bilateral | Sí | 186/586 | 31,7% | 0,001 | N/A | 3,33 | 2,40-4,63 | 22,90% |
| No | 56/557 | 12,3% | ||||||
| Ingreso en UCI | Sí | 28/64 | 43,8% | <0,001 | N/A | 2,79 | 1,66-4,66 | 12,40% |
| No | 214/979 | 21,9% | ||||||
| Comorbilidades | ||||||||
| Dislipemia | Sí | 113/379 | 29,80% | <0,001 | N/A | 1,76 | 1,31-2,36 | 11,80% |
| No | 129/664 | 19,40% | ||||||
| Diabetes mellitus | Sí | 84/283 | 29,70% | 0,002 | N/A | 1,60 | 1,18-2,19 | 9,40% |
| No | 158/760 | 20,80% | ||||||
| Enfermedad pulmonar obstructiva crónica | Sí | 35/73 | 47,90% | <0,001 | N/A | 3,40 | 2,09-5,51 | 16,00% |
| No | 207/970 | 21,30% | ||||||
| Hipertensión arterial | Sí | 167/571 | 29,20% | <0,001 | N/A | 2,19 | 1,62-2,97 | 15,70% |
| No | 75/472 | 15,90% | ||||||
| Insuficiencia hepática | Sí | 12/31 | 38,70% | 0,038 | N/A | 2,10 | 1,03-4,49 | 6,40% |
| No | 230/1012 | 22,70% | ||||||
| Enfermedad renal crónica | Sí | 53/143 | 37,10% | <0,001 | N/A | 2,20 | 1,50-3,20 | 13,10% |
| No | 189/900 | 21,00% | ||||||
| Patología cardiovascular | Sí | 112/321 | 34,90% | <0,001 | N/A | 2,44 | 1,81-3,29 | 18,50% |
| No | 130/722 | 18,00% | ||||||
| Patología respiratoria | Sí | 45/115 | 29,00% | 0,050 | N/A | 1,43 | 1,01-2,10 | 6,00% |
| No | 197/888 | 22,20% | ||||||
| Variables cualitativas protectores de muerte | ||||||||
| Azitromicina | Sí | 161/791 | 20,40% | <0,001 | N/A | 0,54 | 0,39-0,74 | 12,00% |
| No | 81/252 | 32,10% | ||||||
| Hidroxicloroquina | Sí | 170/844 | 20,10% | <0,001 | N/A | 0,45 | 0,32-0,62 | 14,90% |
| No | 72/199 | 36,20% | ||||||
| Heparina | Sí | 197/928 | 21,20% | <0,001 | N/A | 0,42 | 0,28-0,63 | 13,30% |
| No | 45/115 | 39,10% |
Análisis univariante. Variables politómicas
| Variables | Opciones variables | n/N | % | χ2 p (sig asint bil) | P. e. bil Fisher | OR | IC | Phi/V Cramer (valor) |
|---|---|---|---|---|---|---|---|---|
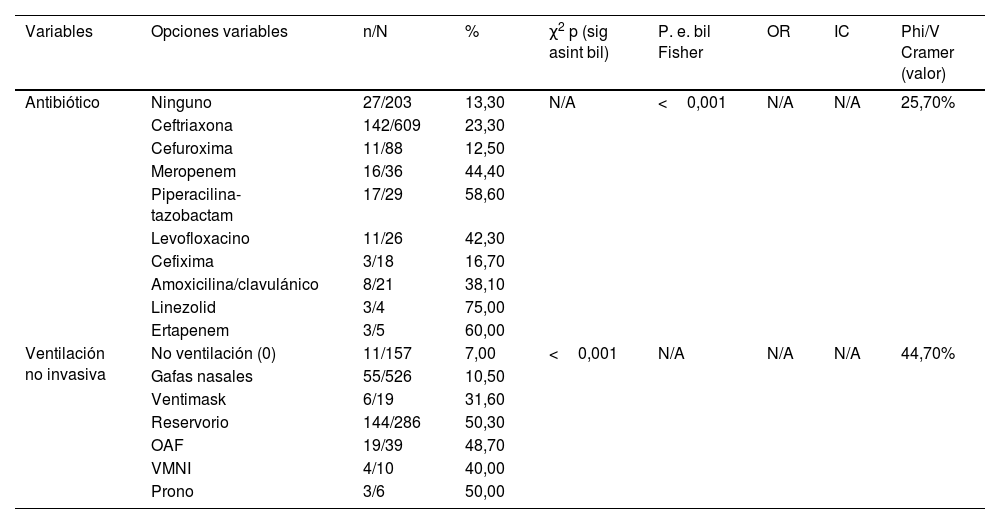
| Antibiótico | Ninguno | 27/203 | 13,30 | N/A | <0,001 | N/A | N/A | 25,70% |
| Ceftriaxona | 142/609 | 23,30 | ||||||
| Cefuroxima | 11/88 | 12,50 | ||||||
| Meropenem | 16/36 | 44,40 | ||||||
| Piperacilina-tazobactam | 17/29 | 58,60 | ||||||
| Levofloxacino | 11/26 | 42,30 | ||||||
| Cefixima | 3/18 | 16,70 | ||||||
| Amoxicilina/clavulánico | 8/21 | 38,10 | ||||||
| Linezolid | 3/4 | 75,00 | ||||||
| Ertapenem | 3/5 | 60,00 | ||||||
| Ventilación no invasiva | No ventilación (0) | 11/157 | 7,00 | <0,001 | N/A | N/A | N/A | 44,70% |
| Gafas nasales | 55/526 | 10,50 | ||||||
| Ventimask | 6/19 | 31,60 | ||||||
| Reservorio | 144/286 | 50,30 | ||||||
| OAF | 19/39 | 48,70 | ||||||
| VMNI | 4/10 | 40,00 | ||||||
| Prono | 3/6 | 50,00 |
Análisis univariante. Variables cuantitativas
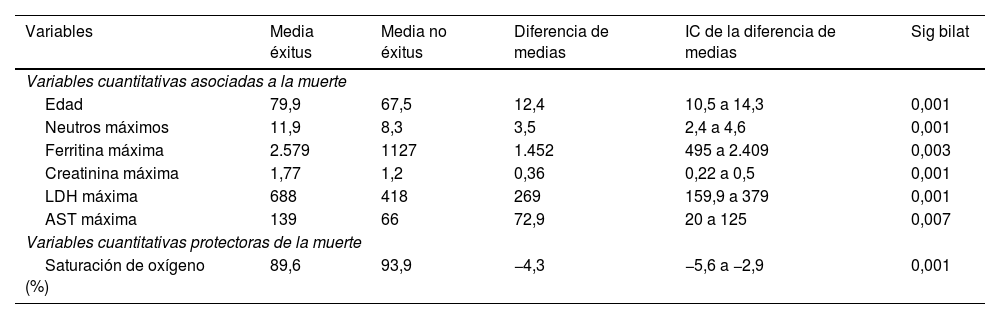
| Variables | Media éxitus | Media no éxitus | Diferencia de medias | IC de la diferencia de medias | Sig bilat |
|---|---|---|---|---|---|
| Variables cuantitativas asociadas a la muerte | |||||
| Edad | 79,9 | 67,5 | 12,4 | 10,5 a 14,3 | 0,001 |
| Neutros máximos | 11,9 | 8,3 | 3,5 | 2,4 a 4,6 | 0,001 |
| Ferritina máxima | 2.579 | 1127 | 1.452 | 495 a 2.409 | 0,003 |
| Creatinina máxima | 1,77 | 1,2 | 0,36 | 0,22 a 0,5 | 0,001 |
| LDH máxima | 688 | 418 | 269 | 159,9 a 379 | 0,001 |
| AST máxima | 139 | 66 | 72,9 | 20 a 125 | 0,007 |
| Variables cuantitativas protectoras de la muerte | |||||
| Saturación de oxígeno (%) | 89,6 | 93,9 | −4,3 | −5,6 a −2,9 | 0,001 |
Análisis multivariante
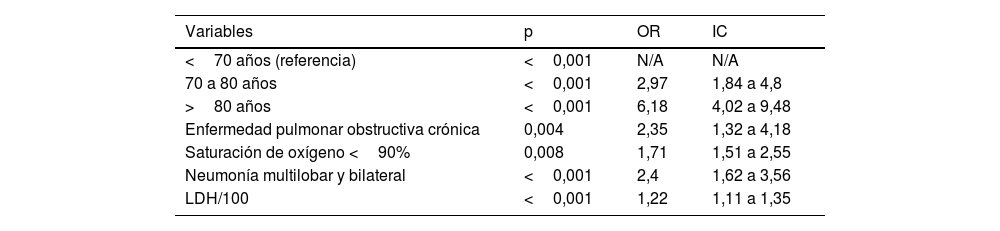
| Variables | p | OR | IC |
|---|---|---|---|
| <70 años (referencia) | <0,001 | N/A | N/A |
| 70 a 80 años | <0,001 | 2,97 | 1,84 a 4,8 |
| >80 años | <0,001 | 6,18 | 4,02 a 9,48 |
| Enfermedad pulmonar obstructiva crónica | 0,004 | 2,35 | 1,32 a 4,18 |
| Saturación de oxígeno <90% | 0,008 | 1,71 | 1,51 a 2,55 |
| Neumonía multilobar y bilateral | <0,001 | 2,4 | 1,62 a 3,56 |
| LDH/100 | <0,001 | 1,22 | 1,11 a 1,35 |
El ser varón y una mayor edad mostraron asociación con mayores tasas de mortalidad. La media de edad de los fallecidos fue de 79,9años, frente a 67,5años en los que sobrevivieron, con una diferencia de 12,4años (tabla 5).
Todos los antecedentes personales evaluados (hipertensión arterial, patologías cardiovasculares y respiratorias, enfermedad pulmonar obstructiva crónica, diabetes mellitus, dislipemia, enfermedad renal crónica, insuficiencia hepática) se asociaron de forma estadísticamente significativa con la mortalidad (tabla 3).
Se registraron más fallecimientos de febrero a marzo que de abril a mayo. Una saturación de oxígeno basal inferior al 90% se asoció con mayor riesgo de muerte, con un promedio del 89% en fallecidos versus el 93,9% en los supervivientes. También se apreció un mayor número de muertes en pacientes con neumonía multilobar y bilateral (tabla 3). Se apreció mayor mortalidad entre quienes requirieron soporte ventilatorio y en los que habían sido tratados con interferón beta y glucocorticoides, en comparación con aquellos que fueron tratados con hidroxicloroquina, azitromicina y heparina, que mostraron menos mortalidad. Aquellos que precisaron el empleo de antibióticos como linezolid, ertapenem y piperacilina-tazobactam se asociaron significativamente con un mayor porcentaje de éxitus (tabla 4). Además, los sujetos que fallecieron presentaron niveles más altos de marcadores inflamatorios (neutrófilos, LDH, ferritina, creatinina y AST) durante el ingreso (tabla 5).
Análisis multivarianteComo se aprecia en la figura 1a y la tabla 6, estar en la década de 70 a 80años incrementa la mortalidad (OR: 2,97; IC95%: 1,8-4,8) con respecto a tener menos de 70años, y tener una edad mayor de 80años multiplica por 6,18 (OR: 6,18; IC95%: 4-9,5) el riesgo de muerte con respecto a tener menos de 70años. De igual forma, padecer enfermedad pulmonar obstructiva crónica, tener una saturación de O2 inferior a 90%, presentar una neumonía adquirida en la comunidad multilobar y bilateral y presentar un incremento de la LDH se asocia de forma independiente con la mortalidad (tabla 6).
Se realizó una división de la muestra al azar utilizando el 50% para un modelo de derivación y el otro para la validación del modelo. Cuando se comparan las dos curvas ROC del modelo de derivación y validación no se observan diferencias estadísticamente significativas (p=0,424) (fig. 1b).
DiscusiónEl estudio revela la alta mortalidad que supuso la COVID en la primera ola, y se ha podido derivar y validar un modelo predictivo con utilidad para la clasificación de los pacientes en alto y bajo riesgo de mortalidad. En el análisis univariante se han observado múltiples factores asociados a la mortalidad. Uno de ellos es el sexo. En nuestro estudio los hombres tienen un riesgo 1,34 veces mayor de morir que las mujeres, posiblemente por una respuesta inflamatoria más intensa18. También las comorbilidades, como hipertensión arterial, diabetes mellitus y enfermedades cardiovasculares, aumentan notablemente el riesgo de mortalidad19. La hipertensión afectó al 54,8% de los casos, mientras que la diabetes y la dislipemia también presentaron tasas elevadas20. La insuficiencia renal y la hepática se asocian con mortalidad, y se vincula a la expresión del receptor ACE2, facilitando disfunción multiorgánica21. Sin embargo, estas variables no fueron significativas en el análisis multivariante, como vemos también en algunos estudios22.
Algunos fármacos mostraron asociación con mayor supervivencia (azitromicina e hidroxicloroquina, aunque actualmente se desaconseja su uso)16, y otros, con mayor mortalidad (heparina y glucocorticoides). A pesar de que el estudio RECOVERY sugiere beneficios en el subgrupo de pacientes que requieran oxígeno, esto no se observó en nuestra cohorte.
Se seleccionaron para el análisis multivariante tan solo las variables que en la literatura habían sido de interés, y, de las analizadas, algunas se asociaron de forma independiente a mortalidad.
La edad se mostró como un factor de riesgo independiente en el análisis de mortalidad hospitalaria, especialmente en mayores de 70años. Durante la primera ola de COVID-19, la tasa de mortalidad fue elevada (23,2%), aunque comparable a otros estudios (17%-28%). Tener entre 70 y 80años multiplicó el riesgo de muerte por 2,97 veces, y ser mayor de 80, por 6,18 veces. Estudios previos, como el metaanálisis de Docherty et al.18, con 20.133 pacientes, confirman la edad como factor predictor de mortalidad con HR de hasta 8,51 en mayores de 80años. Otros estudios españoles también mencionan la edad como factor de riesgo independiente de mortalidad23. El envejecimiento disminuye la función inmune (inmunosenescencia), aumentando la susceptibilidad a infecciones y enfermedades. Las células senescentes secretan citocinas inflamatorias. En mayores, la disfunción de células inmunes, como linfocitosT yB y macrófagos, agrava la respuesta inflamatoria, comprometiendo el control de infecciones y aumentando la mortalidad por COVID-197.
En nuestro análisis, la EPOC aumenta el riesgo de muerte 3,4 veces en el análisis univariante y 2,35 veces en el multivariante. La prevalencia nacional de EPOC es del 10%; en este estudio es del 7%, y hasta del 18% según se describe en la literatura18. Otros estudios muestran que la EPOC incrementa hasta 4 veces el riesgo de hospitalización y mortalidad en COVID-1923. La EPOC podría agravar los resultados por reservas pulmonares bajas, regulación al alza de ACE2 (facilitando la diseminación viral) y respuestas inmunes deterioradas. Sin embargo, en algunos estudios revisados, otros factores comunes en personas con EPOC, como edad avanzada y enfermedades cardiovasculares, pueden confundir su efecto en la mortalidad20.
Una saturación de oxígeno menor del 90% (FiO2 al 21%) al ingreso multiplica por 3,24 veces la mortalidad en el análisis univariante y 1,71 veces en el multivariante. En un estudio español con 4.035 pacientes, la OR ajustada fue de 2,62 (sin embargo, en este estudio consideran baja saturación de oxígeno según la edad, en menores de 50años menor o igual al 93%, y en mayores de 50años menor o igual al 90%)24. Esta asociación podría deberse a varios factores: el virus induce un daño alveolar inflamatorio, afectando a la difusión de oxígeno pero manteniendo el CO2 en niveles normales hasta etapas avanzadas, lo que genera «hipoxia silenciosa»; además, el flujo sanguíneo en el pulmón puede estar alterado en la COVID-19, llevando más sangre a zonas pulmonares dañadas, y los coágulos en vasos pulmonares podrían reducir el flujo a áreas bien oxigenadas, por la alteración de la coagulación en COVID-1925.
La LDH se identificó como un factor independiente de mortalidad, aumentando en un 22% el riesgo de muerte por cada 100 unidades adicionales. Su elevación refleja hipoxia, daño tisular o fallo multiorgánico, y se relaciona con enfermedades cardíacas, pulmonares, renales, hepáticas, musculares, hematológicas y neoplasias. Algunos estudios indican que la LDH elevada aumenta hasta 1,6 veces el riesgo de muerte8. La lesión pulmonar consiste especialmente en lesión intersticial, y es similar a la que ocurre en la neumonía por Pneumocystis jirovecii en pacientes con infección por VIH, en la que su elevación se asocia con afectación severa y morbimortalidad26.
La neumonía multilobar y bilateral al ingreso se detectó en el 56% de los pacientes, asociándose significativamente a mortalidad, con un aumento de 3,3 veces en el análisis univariante y de 2,4 en el multivariante. La neumonía multilobar y bilateral está relacionada con la mortalidad por varios mecanismos. 1)La afectación pulmonar extensa disminuye el intercambio gaseoso y causa hipoxemia grave, pudiendo derivar en SDRA, complicación grave en COVID-19. No evaluamos el SDRA debido a falta de criterios clínicos y gasométricos completos. 2)La respuesta inflamatoria exacerbada desencadena una «tormenta de citoquinas», dañando órganos, entre ellos el pulmón. 3)Comorbilidades como hipertensión, diabetes y obesidad incrementan el riesgo de neumonía severa y disfunción multiorgánica, elevando la mortalidad en análisis univariante y multivariante. La neumonía bilateral en la COVID-19, sumada a las comorbilidades, trombosis y daño pulmonar, contribuye a una alta mortalidad y riesgo de fallo multiorgánico27.
Realizamos un análisis de sensibilidad y especificidad con un punto de corte del 0,5. En este caso obtenemos una sensibilidad del 27% y una especificidad del 94%, y la exactitud global es del 79%, siendo útil para detectar qué pacientes tiene alta posibilidades de mortalidad y requiere medidas terapéuticas avanzadas o un posible ingreso en la UCI. Sin embargo, con un punto de corte de 0,1 se incrementa la sensibilidad al 93% y el valor predictivo negativo al 95%, con una precisión del 53%. Al aumentar la sensibilidad creamos un modelo más útil para detectar pacientes con un valor predictivo negativo de muerte, lo que permite altas precoces hospitalarias.
Para la validación interna del modelo se formaron dos grupos al azar a partir de la muestra de pacientes para desarrollar modelos predictivos, uno para derivación y otro para validación, ambos con curvas ROC. La comparativa de las curvas mostró que la diferencia no era estadísticamente significativa, lo que respalda la validez interna del estudio. El modelo desarrollado es parsimonioso, con solo cinco variables, y logra discriminar con una precisión aceptable la posibilidad de mortalidad. En la literatura se identifican otros modelos de predicción relevantes. Un estudio multivariante, que incluyó 380.081 pacientes relacionados con la variante ómicron, desarrolló un modelo enfocado en la evolución del paciente basado en comorbilidades y factores clínicos. Este modelo presentó un área bajo la curva (AUC) de 0,84. Vemos que es similar a la nuestra y tiene una precisión en torno al 80%, con un elevado número de variables. Nuestro estudio con menos pacientes y más parsimonioso consigue un modelo comparable a este28. El Score de Mortalidad 4C es otro modelo importante que integra ocho variables fácilmente registrables en atención primaria y muestra una AUC de 0,79, similar a la de nuestro estudio29.
Creemos que es crucial que las variables utilizadas sean accesibles para asegurar la aplicabilidad de los modelos en diversos servicios de salud o en los servicios de urgencia hospitalarios, o ya en planta de hospitalización. Aunque nuestro modelo está validado internamente, las variables son universales y accesibles, lo que permite su potencial uso en otras poblaciones, a pesar de la falta de una validación externa.
El estudio presenta varias limitaciones, incluyendo su diseño observacional y retrospectivo, con pérdidas de valores de algunas de las variables. Los datos incompletos, una muestra limitada de 1.043 pacientes y la falta de seguimiento a largo plazo con inclusión de otras olas u otras variantes del virus pueden limitar la validez externa del modelo. Ningún paciente fue vacunado en nuestro estudio, por lo que el modelo no se puede aplicar directamente a una epidemia actual por SARS-CoV-2, aunque ayuda a obtener un modelo parsimonioso que facilita analizar lo verdaderamente importante en una epidemia en la que se produce una neumonía severa con insuficiencia respiratoria.
La COVID-19, causada por el SARS-CoV-2, ha tenido un impacto muy importante en la mortalidad. Los factores de riesgo independientes asociados a esta fueron una edad avanzada, la EPOC, una saturación de oxígeno inferior al 90%, neumonía multilobar y bilateral, y un aumento en los niveles de LDH. Este modelo ha sido validado internamente, mostrando una adecuada precisión y permitiendo clasificar a los pacientes según su pronóstico en alto o bajo riesgo. Esta clasificación facilita la implementación de estrategias terapéuticas específicas y el alta precoz de pacientes de bajo riesgo con seguridad.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.