La obesidad es una enfermedad de alta prevalencia en las consultas de Atención Primaria. Se asocia a comorbilidades mayores (dislipidemia, diabetes, hipertensión) que aumentan la morbimortalidad, el gasto sanitario y disminuye la calidad de vida de los pacientes. Los cambios en el estilo de vida siguen siendo los pilares del tratamiento del exceso de peso. Debemos plantearnos tratamiento farmacológico cuando hay dificultades para alcanzar objetivos de pérdida de peso. En este artículo revisamos los fármacos autorizados actualmente para el tratamiento de la obesidad y del sobrepeso con comorbilidades mayores.
Obesity is a disease of high prevalence in Primary Care clinics. It is associated with major comorbidities (dyslipidaemia, diabetes, hypertension) that increase morbidity and mortality, health expenditure, and reduces the quality of life of patients. Changes in lifestyle are still the pillars of the treatment of excess weight. Pharmacological treatment should be considered when there are difficulties in achieving weight loss goals. In this article, a review is presented on the currently authorised drugs for the treatment of obesity and overweight with major comorbidities.
El exceso de peso constituye para la sociedad actual un importante reto de Salud Pública a nivel mundial y nacional. Su incremento exponencial en los últimos 30 años, íntimamente ligado a un estilo de vida inadecuado, ha supuesto una mayor incidencia y prevalencia de las enfermedades cardiovasculares y del cáncer.
Está bien documentada la obesidad como enfermedad crónica responsable de morbimortalidad y discapacidad, generando además una baja calidad de vida percibida y un incremento en el gasto sanitario1. Los programas de intervención intensiva sobre el estilo de vida con dieta mediterránea, como la propuesta en el reciente estudio Predimed-Plus en una cohorte de 6.874 adultos con sobrepeso y obesidad con seguimiento de 6 años, demuestran que ya se obtienen beneficios cardiovasculares de forma precoz tras los primeros 12 meses de seguimiento2.
La prevalencia de obesidad general y abdominal en España son altas según los resultados del estudio ENPE realizado en población adulta española. Los resultados indican que el 39,3% de la población presenta sobrepeso, mientras que la obesidad general es del 21,6% (22,8% en varones y 20,5% en mujeres). Si tenemos en cuenta la obesidad abdominal la prevalencia es del 33,4% (23,3% en varones y 43,3% en mujeres) con un aumento en relación con la edad3.
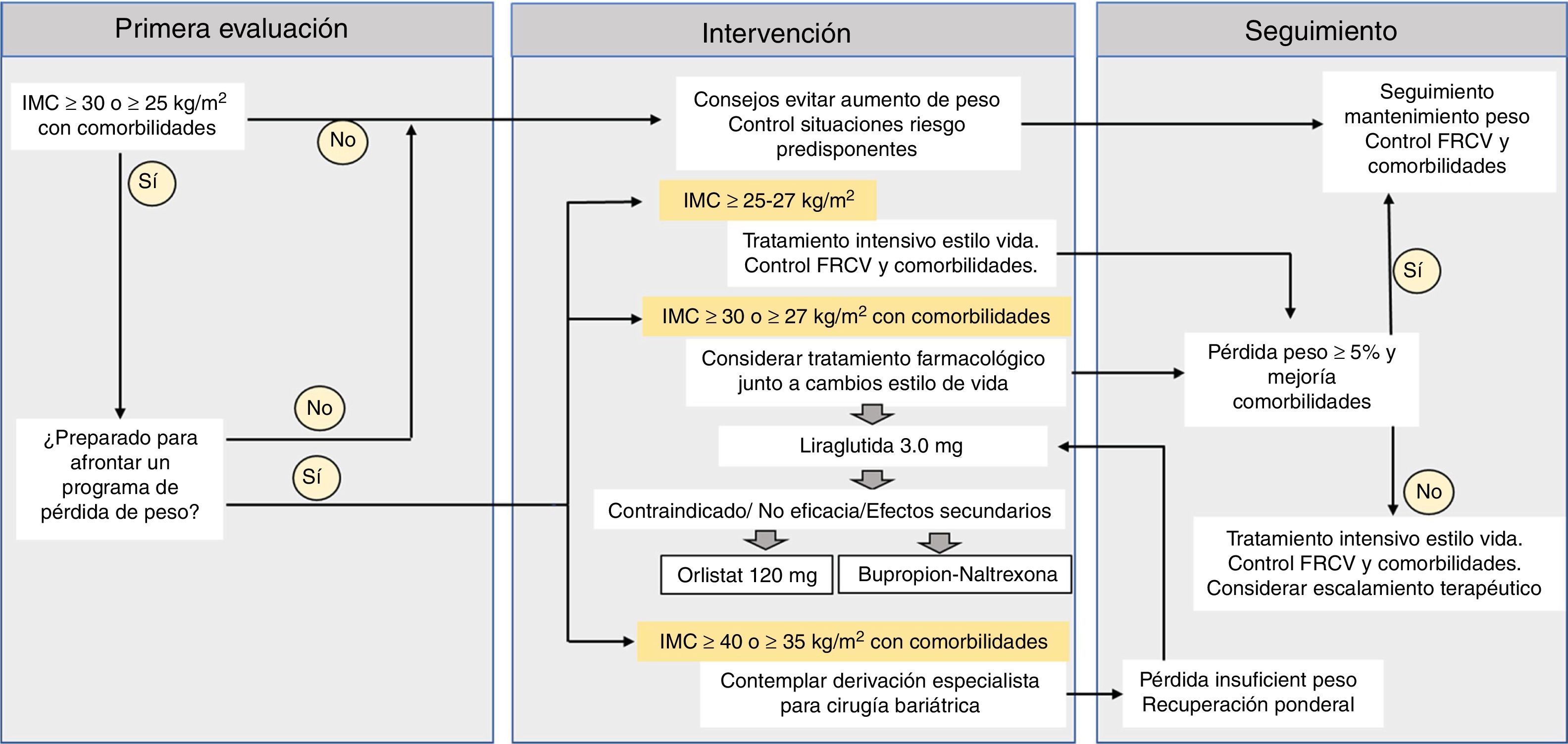
El pilar fundamental en el abordaje de la obesidad en Atención Primaria es la modificación de los estilos de vida poco saludables, asociados a una dieta inadecuada y al escaso tiempo dedicado a la actividad física. Este cambio en dieta y ejercicio mediante iniciativas tanto individuales como grupales es el primer planteamiento que el médico de familia debe proponer e insistir tanto en la prevención como en el tratamiento de la obesidad a cualquier edad. En 2007 se elaboró un consenso entre diferentes sociedades científicas (SEMERGEN, SEEDO y SEEN), donde se plasmaron las estrategias de prevención y tratamiento del exceso de peso en Atención Primaria4. Los objetivos básicos de reducción del peso se centraron entonces, al igual que ahora, en alcanzar al menos una disminución del 5 al 10% del peso corporal por su impacto notable en la mejoría de las comorbilidades asociadas.
La pérdida de peso requiere que el sujeto responda bien a la restricción calórica y al incremento del gasto energético que se le propone. Sin embargo, si las condiciones ambientales son obesogénicas y se ponen en marcha los sistemas biológicos internos cuando un individuo comienza a realizar una dieta hipocalórica, las expectativas de adherencia a los planes de alimentación y ejercicio previstos se atenúan con el paso del tiempo. En este contexto, los tratamientos farmacológicos facilitan el mantenimiento del peso a largo plazo5.
Algunos aspectos de interés para los clínicos que emplean fármacos para la obesidad son conocer:
¿Qué factores predicen la pérdida de peso con los fármacos antiobesidad?Normalmente la pérdida ≥5% de peso a las 12-16 semanas de tratamiento predice el éxito de la pérdida de peso a más de un año de tratamiento. De hecho, si un paciente no ha alcanzado esa cuota de pérdida ponderal y/o aparecen efectos secundarios no deseables en este periodo de tiempo se recomienda suspender la medicación6.
¿Qué sucede si se suspende la medicación?La tasa de adherencia a los fármacos antiobesidad a largo plazo disminuye de manera significativa. En estudios de vida real, a los 6 meses de tratamiento, el 41,8% de los pacientes permanecen en tratamiento con liraglutida 3mg, pero solo el 18,1% de los que comenzaron tratamiento con la asociación de bupropión/naltrexona mantienen este mismo tratamiento de manera prolongada7. La razón fundamental, más allá de posibles efectos secundarios, son los elevados costes que suponen el tratamiento sin reembolso. Al suspender la medicación, y como sucedería con cualquier otro tratamiento para enfermedades crónicas que se retire, el peso tiende a recuperarse de manera progresiva a las pocas semanas.
¿Qué pacientes son candidatos a recibir un tratamiento farmacológico para la obesidad?Las agencias reguladoras FDA y EMA, así como las indicaciones de las correspondientes fichas técnicas de los fármacos aprobados para el tratamiento de la obesidad, establecen su indicación para los individuos con obesidad (IMC≥30kg/m2) o con sobrepeso (IMC≥27kg/m2) en presencia de al menos una comorbilidad mayor8,9. A pesar de estas amplias indicaciones, menos del 3% de los pacientes con estas características reciben este tratamiento. Las razones para esta baja tasa de prescripción se relacionan con la falta de formación en obesidad en los profesionales de la sanidad, la limitada información acerca de los mecanismos de acción, efectividad y seguridad de los fármacos o la ausencia de reembolso por parte de los sistemas sanitarios públicos5. La sospecha sobre seguridad planea sobre los fármacos antiobesidad debido al efecto legado que supuso la retirada de este grupo terapéutico en años recientes: fenfluramina y dexfenfluramina (1997), rimonabant (2009) y sibutramina (2010). No obstante, desde 2012 se han aprobado 4 nuevos fármacos con un buen perfil de seguridad que permite disponer de mayores opciones terapéuticas para las personas con obesidad.
La tipología de pacientes que pueden beneficiarse del tratamiento farmacológico incluye a aquellos que tienen dificultades para mantener una intervención del estilo de vida o que han realizado numerosos intentos de pérdida de peso sin éxito; pacientes que no llegan a alcanzar una pérdida de peso suficiente a pesar de realizar correctamente la intervención del estilo de vida o bien las personas incapaces de realizar estas modificaciones conductuales por dificultades relacionadas con enfermedades crónicas5. Los pacientes que tienen sensación de hambre y algunas conductas ligadas con los picoteos y compulsiones no encuadradas en definiciones psiquiátricas de trastornos del comportamiento alimentario (trastorno por atracón, bulimia) pueden beneficiarse igualmente del tratamiento farmacológico.
¿Qué fármacos se pueden utilizar en el tratamiento de la obesidad?Clásicamente los fármacos indicados para el tratamiento de la obesidad tienen un mecanismo de acción central, actuando en centros hipotalámicos relacionados con el apetito (acción anorexígena) o bien con acciones periféricas, retrasando el vaciamiento gástrico o interfiriendo en la absorción de las grasas. A continuación, revisaremos cada uno de los fármacos aprobados y comercializados en Europa y/o EE.UU.:
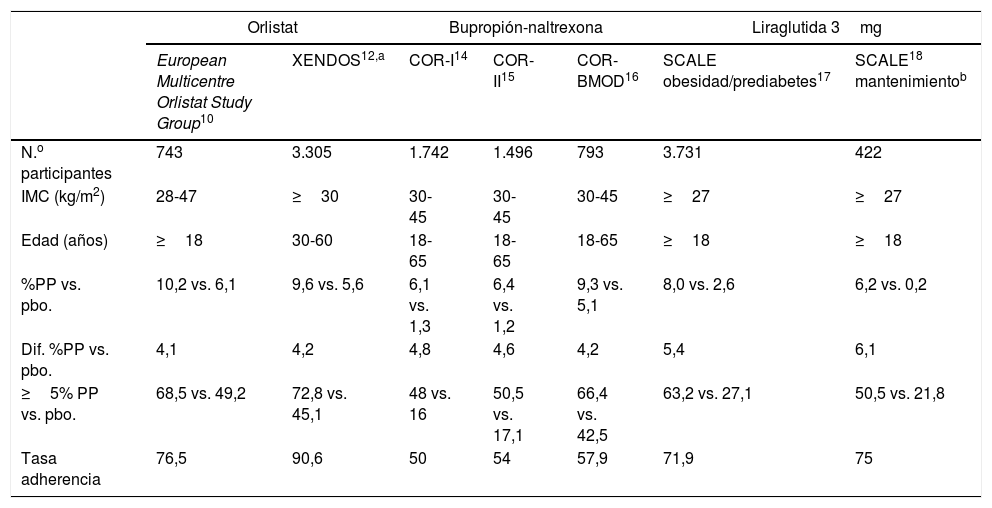
OrlistatAprobado en 1998 tanto en EE.UU. como en Europa. Se trata de un derivado sintético de la lipostatina, procedente del hongo Streptomyces toxytricini. Orlistat es un inhibidor de las lipasas gástricas y pancreáticas que impide la hidrólisis de las grasas a nivel gastrointestinal en una proporción del 30%. El primer estudio multicéntrico demostró una diferencia de pérdida de peso respecto a placebo del 4,1%10 (tabla 1). En un metaanálisis de 31 estudios, el tratamiento con orlistat, 120mg 3 veces/día, produce una pérdida de peso en una proporción de 2,9kg superior al placebo, contribuyendo a disminuir las comorbilidades metabólicas asociadas a la obesidad11. El estudio XENDOS (Xenical in the prevention of diabetes in obese subjects), realizado durante 4 años, ratificó una disminución del 37% en la progresión a diabetes tipo 2 en los pacientes con prediabetes que se encontraban en el brazo de tratamiento activo12. Orlistat puede ser útil en pacientes con prediabetes y/o dislipidemia que no toleren los fármacos de acción central o que tengan estreñimiento crónico. También está aprobado para su empleo en adolescentes con obesidad13.
Ensayos clínicos de fármacos para el tratamiento de la obesidad a 52 semanas (intención de tratar)
| Orlistat | Bupropión-naltrexona | Liraglutida 3mg | |||||
|---|---|---|---|---|---|---|---|
| European Multicentre Orlistat Study Group10 | XENDOS12,a | COR-I14 | COR-II15 | COR-BMOD16 | SCALE obesidad/prediabetes17 | SCALE18 mantenimientob | |
| N.o participantes | 743 | 3.305 | 1.742 | 1.496 | 793 | 3.731 | 422 |
| IMC (kg/m2) | 28-47 | ≥30 | 30-45 | 30-45 | 30-45 | ≥27 | ≥27 |
| Edad (años) | ≥18 | 30-60 | 18-65 | 18-65 | 18-65 | ≥18 | ≥18 |
| %PP vs. pbo. | 10,2 vs. 6,1 | 9,6 vs. 5,6 | 6,1 vs. 1,3 | 6,4 vs. 1,2 | 9,3 vs. 5,1 | 8,0 vs. 2,6 | 6,2 vs. 0,2 |
| Dif. %PP vs. pbo. | 4,1 | 4,2 | 4,8 | 4,6 | 4,2 | 5,4 | 6,1 |
| ≥5% PP vs. pbo. | 68,5 vs. 49,2 | 72,8 vs. 45,1 | 48 vs. 16 | 50,5 vs. 17,1 | 66,4 vs. 42,5 | 63,2 vs. 27,1 | 50,5 vs. 21,8 |
| Tasa adherencia | 76,5 | 90,6 | 50 | 54 | 57,9 | 71,9 | 75 |
%PP: porcentaje de peso perdido; BMOD: behavior modification; COR: Contrave Obesity Research; IMC: índice de masa corporal; pbo: placebo; XENDOS: XENical in the Prevention of Diabetes in Obese Subjects Study.
Debido a que carece de efecto sistémico sus efectos secundarios guardan relación con su mecanismo de acción: flatulencia, aumento de deposiciones, heces grasientas, manchas oleosas, etc., presentes en el 15-20% de los pacientes, aunque no suele ser motivo habitual de abandono del tratamiento.
Contraindicaciones y precaucionesEmbarazo y lactancia, síndrome de malabsorción intestinal, colestasis y nefrolitiasis por oxalatos. Hay que prestar especial atención a la presencia de colelitiasis, hepatopatía, la posibilidad de malabsorción de vitaminas liposolubles y la interferencia en la absorción de levotiroxina, warfarina, amiodarona, antiepilépticos y ciclosporina, debiendo tomarse con un intervalo de al menos 4h con la toma de orlistat19.
Combinación bupropión-naltrexonaAprobada su comercialización en Europa en 2015, bupropión es un inhibidor de la recaptación de los neurotransmisores dopamina y noradrenalina implicados en la regulación del apetito (acción anorexígena) y en los circuitos de recompensa hedónica (comida, alcohol, drogas…). Había sido aprobado previamente para la deshabituación tabáquica y como antidepresivo. Pero, como su acción inhibitoria del apetito es transitoria debido a un mecanismo de autorregulación mediado por una endorfina, la asociación con naltrexona permite bloquear este opiode y mantener así la acción anorexígena del bupropión de manera prolongada.
La administración combinada de bupropión SR (sustained release) (360mg) y naltrexona SR (32mg) [BN], que se analizó en los estudios COR (Contrave Obesity Research), consigue promedios de pérdida de peso del 5,0-6,4% para BN versus 1,2-1,8% con placebo14,15, alcanzando una pérdida del 9,2% de peso cuando se combina con tratamiento intensivo del estilo de vida16 (tabla 1). Aproximadamente un 50% de los pacientes perdieron ≥5% del peso inicial frente a un 17% del grupo placebo, aunque la tasa de abandonos promedio fue del 49,1%20. El tratamiento con BN disminuye la glucemia, la insulina, el índice HOMA, y mantiene un perfil lipídico favorable; sin embargo, la disminución de la presión arterial y la frecuencia cardiaca fue menor que con placebo, por lo que la FDA recomendó un estudio de seguridad cardiovascular (estudio LIGHT) que se interrumpió por revelar la casa comercial resultados favorables al fármaco cuando se llevaba el 25% del estudio realizado21.
BN produce algunos efectos gastrointestinales leves-moderados (náuseas, vómitos, sequedad de boca y estreñimiento) que suelen reducirse tras varias semanas de tratamiento. Para minimizar los síntomas se recomienda una titulación progresiva del tratamiento (desde 1 a 4 comp/día) a lo largo de 4 semanas, siendo la última toma por la tarde para evitar insomnio.
BN está indicado en sujetos con tendencia al picoteo o atracones, que suele coincidir con bajo estado de ánimo y predisposición a la depresión. BN está contraindicado en embarazadas y lactantes, en pacientes con HTA descontrolada, en trastornos del comportamiento alimentario (anorexia nerviosa y bulimia), en la depresión grave, en pacientes en tratamiento con IMAO, y en los que están en fase de retirada brusca de alcohol o en tratamiento con mórficos22. Debe prestarse especial atención a la presencia de arritmia cardiaca, glaucoma de ángulo estrecho, migrañas persistentes, crisis de ansiedad generalizada, trastorno bipolar y alteraciones hepáticas o renales. Puede también interferir con las concentraciones de otros fármacos metabolizados por el citocromo CYP2D6: metoprolol, propafenona, fleicanida, ticlopidina, clopidogrel, venlafaxina, tricíclicos, carbamacepina, fenitoína, antirretrovirales, ciclofosfamida, tamoxifeno, etc.
Liraglutida 3,0mgLiraglutida es un análogo de la incretina GLP-1 (glucagon like peptide-1) que se libera en las células L intestinales tras la ingesta de alimentos. Su acción incretínica es la más conocida, siendo un fármaco de uso habitual en el tratamiento de la diabetes mellitus tipo 2 (a dosis de 1,2 a 1,8mg/día, por vía subcutánea).
Liraglutida ejerce una acción anorexígena, a nivel hipotalámico, actuando sobre las vías de las melanocortinas (pro-opio-melanocortina), e inhibiendo las neuronas orexígenas (neuropéptido Y). Al mismo tiempo produce un enlentecimiento moderado del vaciamiento gástrico que contribuye a implementar la sensación de plenitud y saciedad tras la ingesta23. Los estudios de escalamiento de dosis señalan que la máxima efectividad de liraglutida se produce con dosis superiores (3,0mg) a las empleadas en la diabetes mellitus tipo 2, consiguiendo pérdidas de peso del 9,2% vs 3,1% con placebo24. Es la dosis de liraglutida 3,0mg la que está comercializada para el tratamiento de la obesidad desde 2015 tanto en EE.UU. como en Europa.
Entre los 4 estudios SCALE (Satiety and Clinical Adiposity - Liraglutide Evidence), el realizado en obesidad con/sin prediabetes es el más importante por el número de sujetos participantes (3.731 pacientes), donde se objetivó que la pérdida de peso de ambos grupos al cabo de 56 semanas fue del 8% (2,6% con placebo)17 (tabla 1). Además, liraglutida 3,0mg redujo en 8 veces la posibilidad de que el paciente con prediabetes evolucionara a diabetes (OR 8,1 [IC 95%: 2,6 a 25,3]). Un 63% de los pacientes consiguieron perder ≥5% del peso inicial, siendo baja la tasa de abandonos (24,3%)20. La extensión del estudio a 3 años en los sujetos con prediabetes demuestra una acción mantenida en la pérdida de peso, en la prevención de nuevos casos de diabetes mellitus tipo 2 y de seguridad cardiovascular, neuropsiquiátrica o cáncer25. La mayor pérdida de peso se produce en las primeras 16 semanas de tratamiento, por lo que los individuos que alcanzan la dosis diaria de 3,0mg y hayan perdido ≥5% del peso inicial en este periodo se identifican como «respondedores tempranos». Un 77,3% de los participantes se incluyen en esta categoría, perdiendo un promedio del 10,8% del peso a las 56 semanas de tratamiento (un 84% y 50% de los pacientes respondedores tempranos perdieron ≥5% y ≥10% del peso inicial, respectivamente)26. Cuando liraglutida se combina con un tratamiento intensivo de cambios en el estilo de vida, las pérdidas de peso alcanzadas son mayores, como promedio del 11,8±1,3%27. Un aspecto interesante en las estrategias del tratamiento de la obesidad es que en aquellos pacientes que ya han perdido peso con un tratamiento intensivo de estilo de vida, la asociación con liraglutida 3,0mg durante la fase de mantenimiento del peso perdido es capaz de duplicar la pérdida ponderal durante los meses subsiguientes18.
Liraglutida se ha empleado con éxito en diferentes situaciones clínicas con sobrepeso u obesidad donde hasta ahora no se disponía de alternativas farmacológicas claras para combatir el exceso de peso: síndrome de ovarios poliquísticos29, pacientes psiquiátricos en tratamiento con olanzapina30, insuficiencia cardiaca con disminución de la fracción de eyección31 o en casos de obesidad monogénica como el síndrome de Prader-Willi y en los portadores de mutaciones del gen de melanocortina MCR432.
Liraglutida 3,0mg mejora varios parámetros cardiovasculares (presión arterial, dislipidemia aterogénica, proteína C reactiva, adiponectina, glucemia, resistencia a la insulina…), que se traducen en una tendencia a menor riesgo cardiovascular33, siguiendo la estela de los resultados beneficiosos del estudio LEADER34.
Los efectos secundarios más comunes de liraglutida (náuseas, vómitos, estreñimiento o diarreas) son bien conocidos, de carácter leve-moderado y transitorios al cabo de pocas semanas de tratamiento. Por este motivo, liraglutida se administra de forma progresiva, comenzando con una dosis de 0,6mg/día, por vía subcutánea, e incrementándose cada semana en 0,6mg/día hasta llegar a la dosis máxima efectiva de 3,0mg/día.
Liraglutida 3,0mg no se recomienda en pacientes con neoplasia endocrina múltiple (MEN-2), antecedentes de carcinoma medular de tiroides, en enfermedad renal o hepática avanzadas, en embarazadas y lactantes. Tampoco hay experiencia en adolescentes (<18 años) o mayores de 75 años. Se debe emplear con precaución en casos con antecedentes de colelitiasis, pancreatitis, gastroparesia o enfermedad inflamatoria intestinal13.
La experiencia clínica demostrada durante años, la seguridad de su empleo en diferentes situaciones clínicas de obesidad, el bajo potencial de interferencia con otros fármacos, y la posibilidad de generar beneficios que van más allá de la pérdida de peso, ubicaría a liraglutida 3,0mg como fármaco de primera elección en el tratamiento de la obesidad. Tal y como se ha reflejado en el reciente consenso ibérico de las Sociedades para el estudio de la obesidad en España (SEEDO) y Portugal (SPEO)28, en caso de contraindicación, intolerancia o ausencia de efecto a medio plazo con liraglutida 3,0mg, podrían emplearse otros fármacos (BN y orlistat) en un segundo escalón terapéutico (fig. 1).
Otros fármacos: lorcaserina y fentermina-topiramatoEn EE.UU. se aprobaron sucesivamente en 2012 lorcaserina y la combinación de fentermina-topiramato, pero no han conseguido su aprobación en Europa hasta la fecha. Lorcaserina es un inhibidor selectivo de la recaptación de serotonina a nivel del receptor 5HT2c, evitando posibles acciones sobre las válvulas cardiacas como sucedió con la dexfenfluramina. Lorcaserina ejerce por tanto una acción anorexígena actuando sobre las neuronas de las vías melanocortinas. La reducción de peso es muy moderada; a dosis de 10mg 2 veces al día, muestra una diferencia del 3,6% de peso respecto a placebo35,36. Recientemente se ha publicado el estudio de seguridad CAMELLIA-TIMI-61 que demuestra la no inferioridad respecto a placebo en eventos cardiovasculares (hazard ratio: 0,97; IC 95%: 0,87 a 1,07; p=0,55)37.
La combinación de fentermina-topiramato es una asociación de un fármaco empleado para el tratamiento de la obesidad desde 1955 (fentermina) junto con el antiepiléptico topiramato que ejerce una acción anorexígena al actuar sobre los receptores del GABA y del glutamato. Se presenta en 4 modalidades de dosis (desde 3,75/23mg hasta 15/92mg de fentermina/topiramato), alcanzando una pérdida de peso en dosis altas de hasta un 9,3% superior a placebo38-40.
¿Hacia dónde se dirige el futuro del tratamiento farmacológico de la obesidad?La investigación en posibles dianas del tratamiento de la obesidad se centra en nuevas moléculas más potentes, como la semaglutida41, o bien en los tratamientos combinados que puedan interactuar en diferentes centros de control del apetito y saciedad, pero sobre todo buscando mecanismos que contribuyan a mejorar comorbilidades asociadas a la obesidad (diabetes, esteatohepatitis no alcohólica, miocardiopatía…), sin incrementar el riesgo cardiovascular o renal de los pacientes. Combinaciones duales o triagonistas de GLP1 con agonistas del receptor de glucagón, GIP o péptido YY, se encuentran ya en estudios clínicos en fase II-III42,43.
FinanciaciónNo existe fuente de financiación en este artículo. La elaboración parte de la inquietud de los autores tras una reunión científica.
Conflicto de interesesNinguno.