El objetivo fue conocer la prevalencia de antecedentes familiares de cáncer colorrectal (CCR) en la población de entre 40 y 75 años, así como la aceptabilidad y realización de pruebas de detección precoz.
Material y métodosEstudio descriptivo transversal, con emplazamiento en los centros de salud El Coto y El Llano (Gijón). Participaron 800 individuos con edades entre 40 y 75 años seleccionados mediante muestreo aleatorio simple, a los que se realizó un cuestionario telefónicamente, estudiando antecedentes familiares (AF) de CCR, edad al diagnóstico, realización de sangre oculta en heces (SOH)/colonoscopia, motivo de realización y/o rechazo y variables sociodemográficas.
ResultadosFueron válidos 664 cuestionarios. La prevalencia de AF fue el 15,8% (intervalo de confianza del 12,9 al 18,6). Con al menos un familiar de primer grado diagnosticado de CCR el 8,8%. Habían realizado previamente la prueba de SOH el 7,1% y colonoscopia el 17,9%, en su mayoría por motivos clínicos. La aceptabilidad fue del 90,7% para la SOH y del 65,2% para la colonoscopia. El principal motivo de rechazo de SOH fue la creencia de que el diagnóstico precoz no cambiaría el pronóstico y en la colonoscopia la incomodidad o miedo a la prueba.
ConclusionesBaja tasa de realización de pruebas por AF. Gran aceptabilidad para SOH y baja para colonoscopia. Se considera necesario tener en cuenta aspectos que afectan a la población general (motivos de rechazo, necesidad de información clara) y coordinación entre atención primaria, especializada y salud pública.
The objective of this study was to determine the prevalence of family history of colorectal cancer (CRC) in a population between 40 and 75 years-old, as well as acceptability and early diagnosis tests made.
Material and methodsCross-sectional study. Location: El Coto and El Llano (Gijon) primary care health centres. A total of 800 individuals aged between 40 and 75 years participated, selected by simple random sampling. Key measurements: questionnaire conducted by telephone with previous notice by newsletter. The variables studied were: family history (FH) of CRC, age at diagnosis, performance of faecal occult blood test (FOBT)/colonoscopy, reason for doing it or refusing it, and sociodemographic data.
ResultsA total of 664 questionnaires were valid. The prevalence of FH was 15.8% (confidence interval 12.9 to 18.6), with 8.8% with at least one first degree relative. An FOBT screening had been performed on 7.1%, and 17.9% had undergone colonoscopies, mostly on clinical grounds. Acceptability was 90.7% for FOBT and 65.2% for colonoscopy. Main reason for the refusal of an FOBT was the belief that early diagnosis would not alter prognosis. Main reason for rejection of colonoscopy was discomfort or fear of the test.
ConclusionsThere was a low rate of testing for FH, and a high acceptability for FOBT and a low acceptability for colonoscopy. Aspects affecting the general population (causes for rejection, need for clear information), as well as a correct coordination between Primary Care, specialized care, and public health, need to be reviewed.
Se estima que al año se diagnostican 25.000 nuevos casos de cáncer colorrectal (CCR) en España1. Este es el cáncer más frecuente en nuestro país en términos absolutos, situándose en tercer lugar en los hombres tras el de pulmón y el de próstata. En las mujeres se sitúa en segundo lugar tras el de mama. Si consideramos ambos sexos juntos, es la segunda causa de muerte por cáncer2,3.
En los últimos años se ha avanzado en el conocimiento de la historia natural de esta enfermedad, demostrando la potencial malignidad de los adenomas colorrectales y el aumento de incidencia y riesgo relativo con la edad. Además se han identificado factores genéticos que influyen en su aparición. Aunque la mayoría de los tumores son esporádicos, una pequeña proporción de ellos corresponde a formas hereditarias, ya sea poliposis adenomatosa familiar (menos del 1%) o síndrome de Lynch (2-5%). Sin embargo, se estima que en un 15-20% adicional de casos puede haber un componente hereditario: la presencia de antecedentes familiares de CCR supone un mayor riesgo de presentarlo, aumentando éste según el grado de parentesco y la edad al diagnóstico del familiar afectado (mayor cuanto más joven)4.
Por tratarse de un problema de salud importante, con una elevada incidencia y morbimortalidad asociada, del que se conoce su historia natural, y para el que se dispondría de pruebas que permiten detectar la enfermedad en las fases iniciales5, su cribado se ha incorporado dentro de los diferentes programas de algunas comunidades autónomas6: el Principado de Asturias tiene en marcha un programa dirigido a personas de alto riesgo, que incluye a la población con formas hereditarias de CCR, con la colonoscopia como prueba de elección para el diagnóstico y seguimiento7. Con respecto al resto de la población, recientemente se acordó comenzar a realizarlo en correspondencia con los acuerdos del Pleno del Consejo Interterritorial del Sistema Nacional de Salud.
Las guías de práctica clínica existentes permiten clasificar con diferentes grados de evidencia a la población susceptible de realizar pruebas complementarias para el diagnóstico precoz del CCR, así como orientar en su selección2. En este sentido, las guías establecen que la prueba de elección en estos programas poblacionales debería ser la de sangre oculta en heces (SOH) cuantitativa, con un punto de corte positivo que garantice un balance óptimo entre sensibilidad y especificidad7 (grado de recomendación B, nivel de evidencia 2a). La elección de otras pruebas (SOH anual o bienal, sigmoidoscopia cada 5 años o colonoscopia cada 10 años) podría estar justificada según la aceptabilidad y la disponibilidad de recursos, entre otros factores2,8 (grado de recomendación B, nivel de evidencia 2a). Pese a todas estas recomendaciones, se considera que la importancia radica en asegurar la captación y el seguimiento de pacientes con riesgo aumentado de presentar este tumor9, más que en determinar la prueba de detección precoz a realizar.
Aunque a efectos de planificación sanitaria resultaría de interés conocer la prevalencia de antecedentes familiares (AF) en la población general, apenas existen datos disponibles en España, por lo que el objetivo principal de nuestro estudio fue conocer dicha prevalencia en nuestro ámbito geográfico. Además, como objetivos secundarios nos planteamos conocer qué población susceptible de cribado ya ha realizado alguna prueba de detección precoz, así como determinar el porcentaje de personas que aceptarían someterse a las pruebas disponibles e indicadas en cada caso, y los motivos de rechazo de las mismas.
Material y métodosSe realizó un estudio descriptivo transversal, en las fechas comprendidas entre los meses de junio de 2009 y mayo de 2010.
La población de estudio fueron los individuos con edades comprendidas entre 40 y 75 años adscritos a 2 zonas básicas de salud correspondientes al área sanitaria V de Asturias (centros de salud El Coto y El Llano de Gijón) con un total de 11.350 habitantes.
Se calculó una muestra de la población de estudio para una prevalencia estimada de antecedentes familiares del 8%, un intervalo de confianza del 95%, con un margen de error del 2% y una estimación de pérdidas del 20%, resultando un tamaño muestral de 800 individuos. Se realizó un muestreo aleatorio simple a partir de la base de datos de la tarjeta sanitaria individual.
Consideramos como criterios de exclusión los pacientes desplazados, aquellos en los que no constaba ningún teléfono de contacto, enfermos en situación terminal o grave, aquellos con barreras en el lenguaje y formas familiares de CCR.
La variable principal fue la presencia o no de AF de CCR según refirió la persona entrevistada, y las variables secundarias, el número de familiares afectados, el parentesco con ellos y la edad en el momento del diagnóstico. Se encuestó también acerca de la realización previa o no de SOH y colonoscopia, así como la edad de realización, el motivo y la periodicidad de la misma. A partir de los datos anteriores, se valoró el riesgo individual, mediante la guía elaborada por el grupo de trabajo de prevención del cáncer colorrectal de la Asociación Española de Gastroenterología, Sociedad Española de Medicina de Familia y Comunitaria, y Centro Cochrane Iberoamericano; 2009. Así, en el caso de presentar un antecedente de primer grado diagnosticado antes de los 60 años o más de un familiar de primer grado, la prueba realizada sería la colonoscopia comenzando a los 40 años. Si el familiar de primer grado fue diagnosticado con más de 60 años, o se tratase de más de un familiar de segundo grado, la prueba sería la colonoscopia o la SOH a partir de los 40 años. Si se tratase de familiares de tercer grado o uno de segundo grado, las pruebas se deberían realizar a partir de los 50 años. En los casos en los que estaba indicada la realización de la SOH y/o colonoscopia, se preguntó por la aceptabilidad de realización de estas pruebas, y los motivos de rechazo en cada caso. Con el fin de controlar los efectos de confusión se añadieron también al cuestionario la edad, el sexo, el origen y el nivel de estudios.
A cada paciente seleccionado se le envió una carta informativa a su domicilio explicándole la finalidad del trabajo y pidiéndole su consentimiento para colaborar en el mismo. En todo momento del estudio se tuvo en cuenta la confidencialidad de los datos.
Posteriormente se contactó telefónicamente con cada uno de los seleccionados para cumplimentar las variables del estudio. En todas las ocasiones se utilizó el mismo guión para su recogida. Se realizaron como máximo 3 llamadas a cada individuo, en caso de no contactar se consideró como pérdida.
La hoja de recogida de datos fue la misma para cada individuo seleccionado y se completó tras realizar la entrevista.
Durante la realización del estudio, si se detectaba la presencia de AF se informaba de la existencia del cribado y se recogía en la historia clínica de la persona.
Para el análisis estadístico de los datos se utilizó el programa SPSS versión 14.0, y el programa Epidat versión 3.1.
La descripción general de las variables cualitativas se realizó mediante porcentajes y/o frecuencias absolutas. Las variables cuantitativas se expresaron como el valor de la media y su desviación estándar. En ambos casos se calculó el intervalo de confianza del 95%.
En el análisis bivariante se utilizó la prueba de chi cuadrado para la comparación de proporciones, aceptándose como significativas las diferencias encontradas cuando el valor de p fue igual o inferior a 0,05.
Este estudio se realizó en el contexto de los trabajos de investigación realizados por los residentes de cuarto año de la especialidad de MFYC y contó con la aprobación de la Unidad Docente de MFYC y de la Comisión de investigación del Área V (Gijón).
ResultadosDe los individuos seleccionados, se obtuvieron datos de 664, lo que representa el 83% del tamaño de la muestra. El 2,94% del total de pérdidas correspondía a sujetos que se negaron a participar, perteneciendo el resto a los criterios de exclusión considerados previamente.
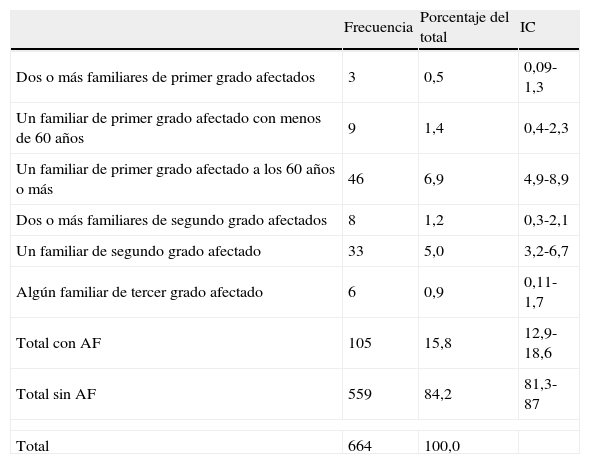
La prevalencia declarada de AF de CCR en la población de Gijón adscrita a los centros de salud de El Llano y El Coto entre 40 y 75 años resultó del 15,8% (IC: 12,9 a 18,6) (tabla 1).
Familiares afectados de cáncer colorrectal del entrevistado en función del grado de parentesco y edad de diagnóstico
| Frecuencia | Porcentaje del total | IC | |
| Dos o más familiares de primer grado afectados | 3 | 0,5 | 0,09-1,3 |
| Un familiar de primer grado afectado con menos de 60 años | 9 | 1,4 | 0,4-2,3 |
| Un familiar de primer grado afectado a los 60 años o más | 46 | 6,9 | 4,9-8,9 |
| Dos o más familiares de segundo grado afectados | 8 | 1,2 | 0,3-2,1 |
| Un familiar de segundo grado afectado | 33 | 5,0 | 3,2-6,7 |
| Algún familiar de tercer grado afectado | 6 | 0,9 | 0,11-1,7 |
| Total con AF | 105 | 15,8 | 12,9-18,6 |
| Total sin AF | 559 | 84,2 | 81,3-87 |
| Total | 664 | 100,0 | |
Siguiendo la estratificación de riesgo en función de los AF de las guías de práctica clínica utilizadas7, el 8,8% de los encuestados tenían como antecedente algún familiar de primer grado. En el 6,9% (IC: 4,9 a 8,9) éste había sido diagnosticado con 60 años o más. Presentaron AF de segundo grado el 6,2% de los encuestados (tabla 1).
La edad media al diagnóstico del familiar afectado fue de 65,97 años (IC: 63,62 a 68,32). El 0,6% de los encuestados estaba diagnosticado de cáncer de colon.
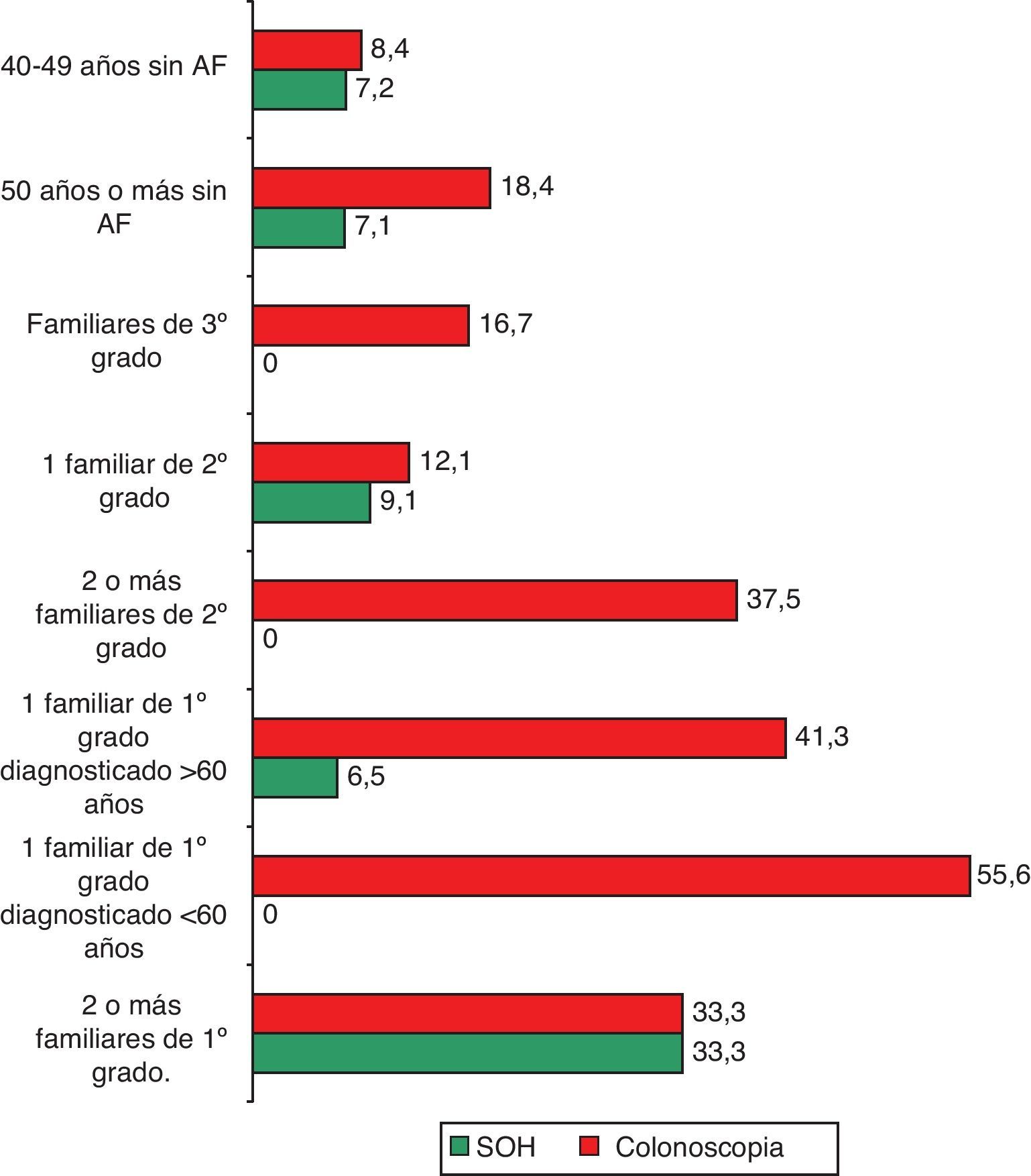
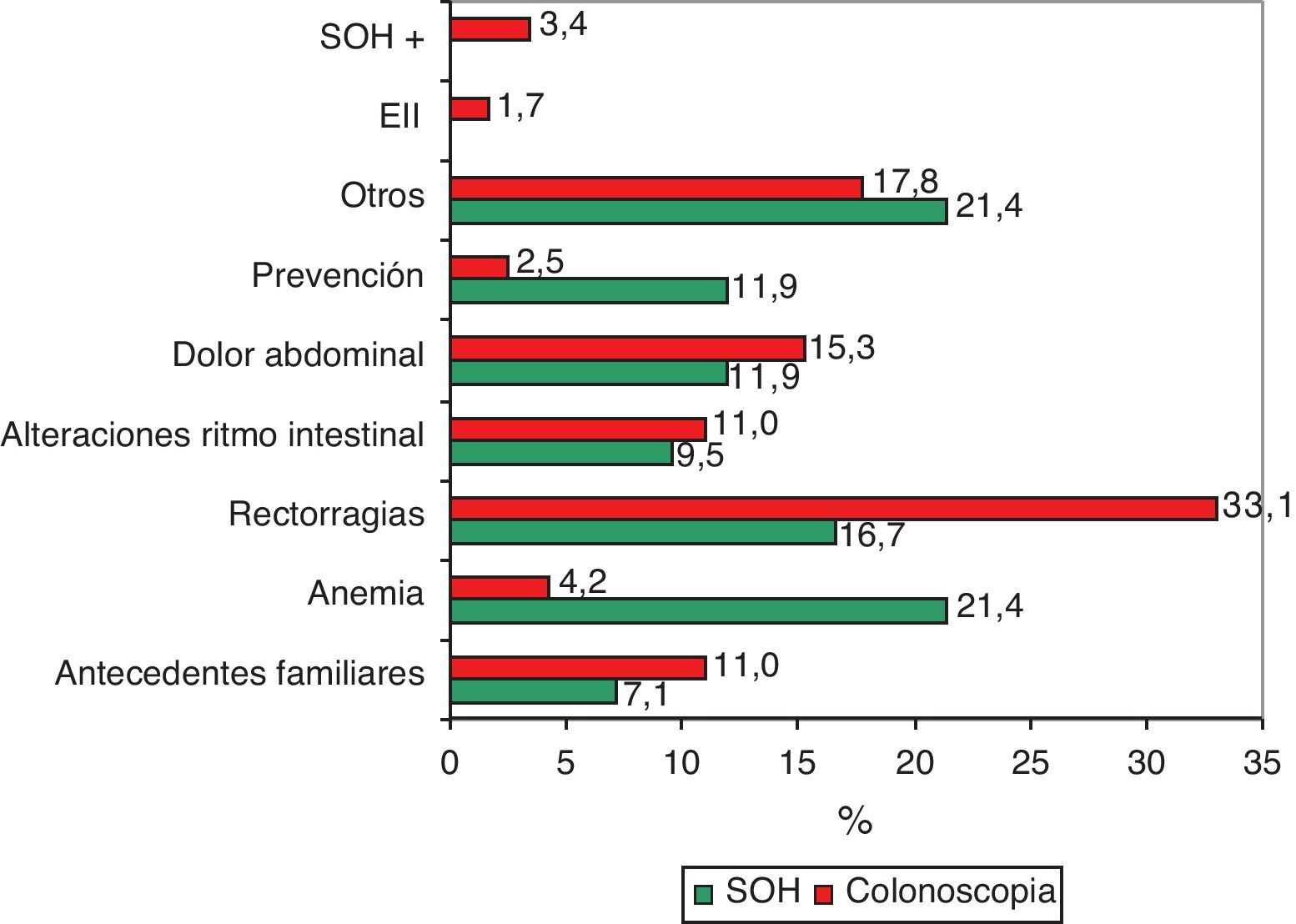
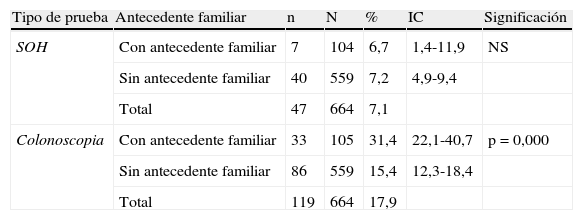
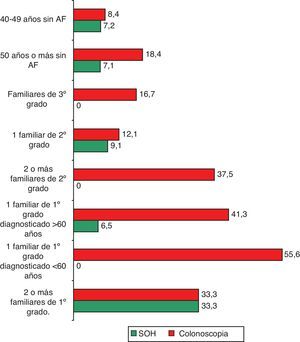
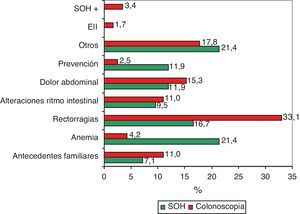
El 7,1% de los entrevistados (IC: 5 a 9,1) había realizado alguna vez la prueba para detectar SOH, sin diferencias estadísticamente significativas entre los porcentajes según la presencia o no de antecedentes familiares (tabla 2; fig. 1). Los principales motivos para su realización fueron la anemia (21,4%) y las rectorragias (16,7%) (fig. 2). En cuanto a la colonoscopia, un 17,9% (IC: 14,9 a 20,9) la había realizado alguna vez. Entre los entrevistados con antecedentes familiares, la proporción fue del 31,4 frente al 15,4% en el conjunto de los que no tenían antecedentes, diferencia que fue estadísticamente significativa (p=0,000). Según los diferentes grupos de riesgo, la proporción de entrevistados con la prueba realizada osciló en un rango entre el 55,6% de los que referían tener un familiar de primer grado diagnosticado antes de los 60 años y el 12,1% de los que tenían un familiar de segundo grado afectado (tabla 2; fig. 1). Los principales motivos de realización de esta prueba fueron las rectorragias (33,1%), el dolor abdominal (15,3%) y los AF (11%) (fig. 2).
Realización previa de pruebas de cribado según tipo de antecedente familiar de cáncer colorrectal
| Tipo de prueba | Antecedente familiar | n | N | % | IC | Significación |
| SOH | Con antecedente familiar | 7 | 104 | 6,7 | 1,4-11,9 | NS |
| Sin antecedente familiar | 40 | 559 | 7,2 | 4,9-9,4 | ||
| Total | 47 | 664 | 7,1 | |||
| Colonoscopia | Con antecedente familiar | 33 | 105 | 31,4 | 22,1-40,7 | p=0,000 |
| Sin antecedente familiar | 86 | 559 | 15,4 | 12,3-18,4 | ||
| Total | 119 | 664 | 17,9 |
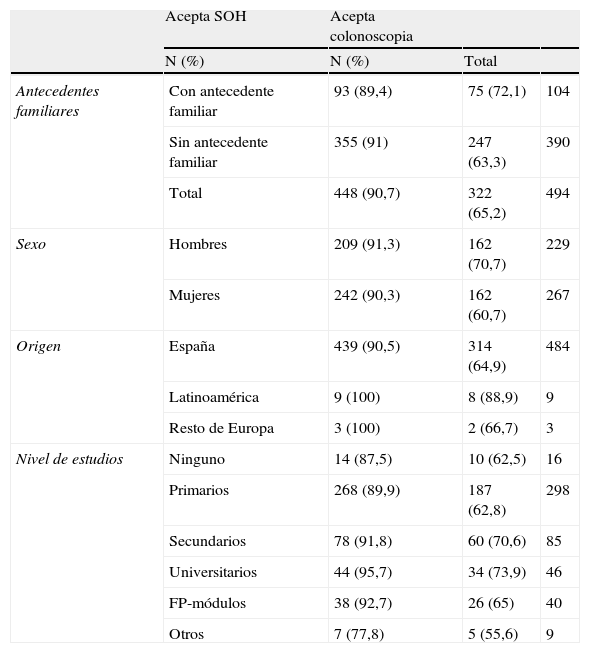
La aceptabilidad global de las pruebas de detección precoz fue del 90,7% para la SOH (IC: 88,8 a 93,1) y del 65,2% (IC: 61 a 69,6) en el caso de la colonoscopia (tabla 3). En aquellos con antecedentes de CCR, la aceptabilidad de la SOH fue del 89,4 y del 91,9% en quienes no los tenían. En el caso de la colonoscopia, los porcentajes de aceptabilidad fueron del 72,1 y del 63,5%, respectivamente. En ninguno de los 2 casos, esta diferencia fue estadísticamente significativa (p=0,331 y p=0,238, respectivamente). Tampoco se encontraron diferencias estadísticamente significativas en la aceptabilidad de las pruebas según las variables sociodemográficas recogidas en el estudio (tabla 3).
Aceptabilidad de pruebas de detección precoz según la presencia de antecedentes familiares de cáncer colorrectal y otras variables sociodemográficas
| Acepta SOH | Acepta colonoscopia | |||
| N (%) | N (%) | Total | ||
| Antecedentes familiares | Con antecedente familiar | 93 (89,4) | 75 (72,1) | 104 |
| Sin antecedente familiar | 355 (91) | 247 (63,3) | 390 | |
| Total | 448 (90,7) | 322 (65,2) | 494 | |
| Sexo | Hombres | 209 (91,3) | 162 (70,7) | 229 |
| Mujeres | 242 (90,3) | 162 (60,7) | 267 | |
| Origen | España | 439 (90,5) | 314 (64,9) | 484 |
| Latinoamérica | 9 (100) | 8 (88,9) | 9 | |
| Resto de Europa | 3 (100) | 2 (66,7) | 3 | |
| Nivel de estudios | Ninguno | 14 (87,5) | 10 (62,5) | 16 |
| Primarios | 268 (89,9) | 187 (62,8) | 298 | |
| Secundarios | 78 (91,8) | 60 (70,6) | 85 | |
| Universitarios | 44 (95,7) | 34 (73,9) | 46 | |
| FP-módulos | 38 (92,7) | 26 (65) | 40 | |
| Otros | 7 (77,8) | 5 (55,6) | 9 |
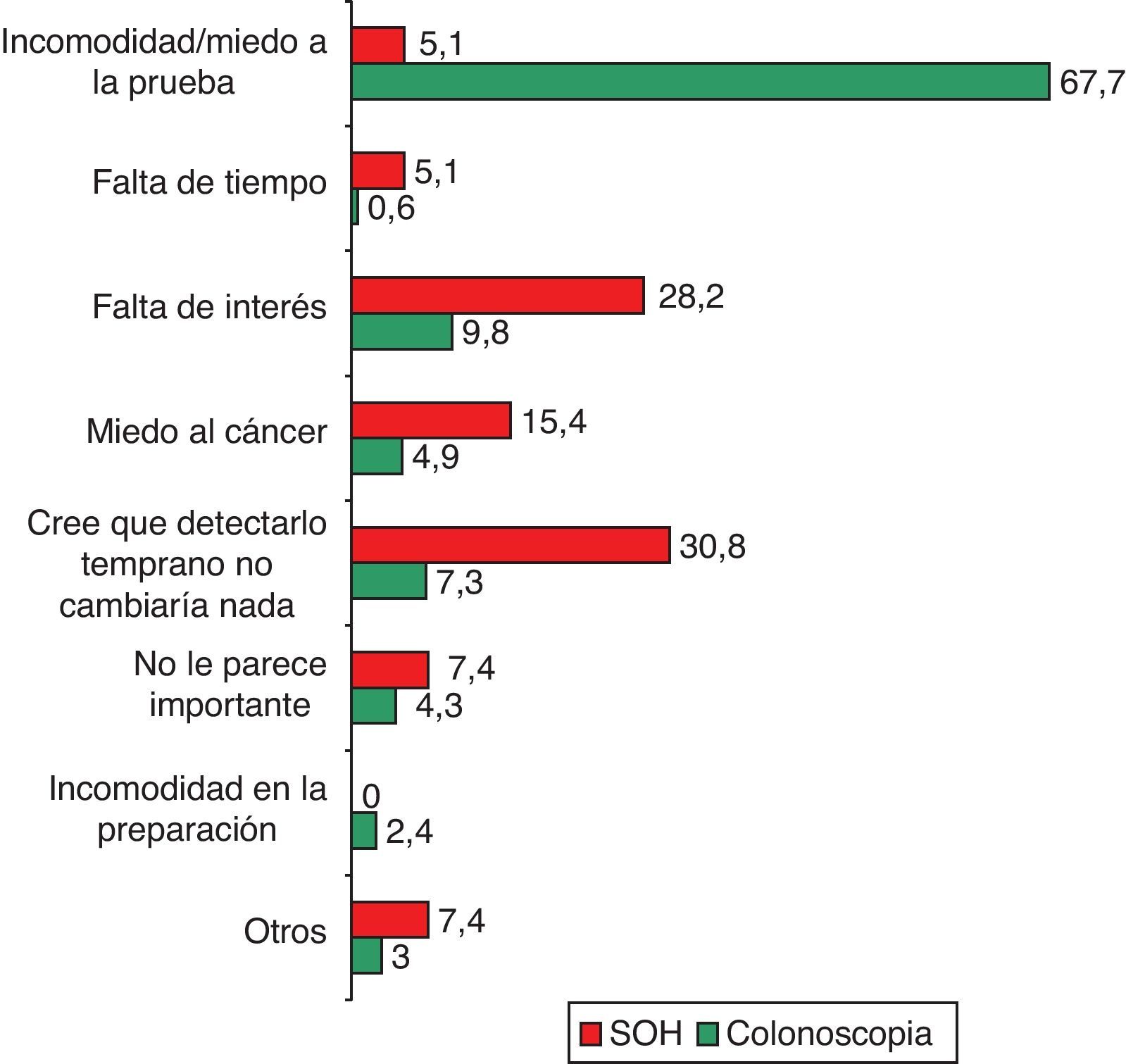
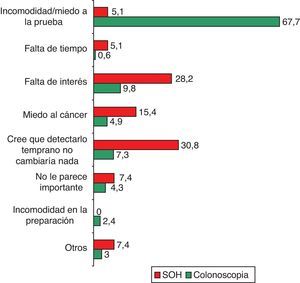
Los 2 motivos principales de rechazo de la SOH fueron no creer que el diagnóstico precoz fuera a cambiar la evolución de la enfermedad (30,8%) y la falta de interés (28,2%) (fig. 3). En el caso de la colonoscopia el principal motivo de no aceptación fue la incomodidad de la prueba o el miedo a la misma (67,7%) (fig. 3).
DiscusiónLos resultados de nuestro estudio contribuyen al conocimiento de la situación actual y futura del CCR en nuestro entorno, aportando una información útil dada la escasez de estudios sobre prevalencia de antecedentes familiares de esta enfermedad y la ausencia total de ellos en Asturias.
La tasa de respuesta obtenida, un 83%, la consideramos alta y dentro de límites razonables, ya que además solo un 2,94% de las pérdidas fueron negativas explícitas a participar, correspondiendo el resto a la aplicación de los criterios de exclusión.
Una limitación que se puede plantear a nuestros resultados es en qué medida la muestra seleccionada a partir de la población de las 2 zonas básicas donde se ha llevado a cabo el estudio es representativa de la población de nuestra área sanitaria, y de la asturiana en general. Pues bien, las zonas objeto del estudio pertenecen a la ciudad de Gijón donde constituyen el 16,18% de su población. Se trata de una ciudad de composición sociodemográfica muy homogénea (con características acentuadamente urbanas) que representa a su vez el 91,5% de la población del área sanitaria y el 28,2% de la población asturiana. Es este importante peso relativo el que nos hace considerar a nuestros resultados extrapolables en buena medida al conjunto de la población de nuestra área y de la comunidad autónoma10,11.
Según nuestros resultados un 15,8% de la población entrevistada tiene algún antecedente familiar de CCR, cifra algo mayor a la encontrada por De Jong y Vasen en Países Bajos12 (11,2%). En cuanto los antecedentes de primer grado, el 8,8% encontrado supone también una mayor prevalencia con respecto a ese estudio. Esta cifra se puede considerar similar a las de otros trabajos disponibles en la bibliografía13,14, aunque en ellos no se especifica hasta qué grado fueron preguntados los participantes. Hay que tener también en cuenta las diferencias metodológicas con dichos estudios.
Conocer la prevalencia de AF de CCR permite estimar la población susceptible de realización de pruebas de detección precoz, a edades más tempranas que la población general. Este dato puede contribuir a la organización del programa de cribado que se pretende llevar a cabo en nuestra comunidad autónoma.
Al observar las tasas de realización de pruebas de detección precoz en entrevistados con antecedentes familiares de CCR, éstas no aumentan a medida que se incrementa el riesgo de presentar tal enfermedad, lo cual puede tener su explicación en que solo un 11% de las colonoscopias y un 7,1% de las pruebas de SOH se habían realizado por tener AF y el resto por motivos clínicos.
En el momento de la realización de este estudio, Asturias no cuenta con un programa de detección precoz poblacional, aunque sí existen recomendaciones2,7 en cuanto a las pruebas a realizar en grupos de riesgo por AF. Sin embargo, sí que existe un programa para individuos de alto riesgo6, con la colonoscopia como prueba de elección, a pesar de lo cual encontramos una baja tasa de realización de la misma, probablemente porque este grupo de alto riesgo no está claramente definido. Los médicos deberían estar familiarizados con las opciones de cribado disponibles y conocer sus riesgos potenciales, para ofrecerlas a los individuos susceptibles de ellas9,15. Además, en gran parte de los sujetos del estudio con AF tal dato no constaba en su historia, pese a que se considera prioritario identificar a las personas que pertenecen a grupos de mayor riesgo de CCR9,16–18.
La gran aceptabilidad (90,7%) en la población candidata a la realización de la SOH va a favor de la viabilidad del programa de cribado. La menor aceptabilidad de la colonoscopia (66,7%) con respecto a la SOH en todos los subgrupos, se podría explicar teniendo en cuenta el motivo principal de este rechazo (incomodidad o miedo a la prueba). De todos modos, esta aceptabilidad podría aumentar en aquellos casos en que la SOH fuese positiva. Dado que el motivo predominante de rechazo de la SOH fue la creencia de que el diagnóstico precoz no modifica la evolución de la enfermedad, parece conveniente informar a la población sobre la importancia del mismo, punto en el que ya no solo intervienen los profesionales, sino también las autoridades competentes.
Pese a la gran aceptabilidad de la SOH encontrada en nuestro estudio, la experiencia de participación en los programas de cribado de CCR puestos en marcha hasta el momento en España y las tasas de seguimiento obtenidas son bajas e inferiores a las de otros programas de prevención del cáncer3,16,17, aspecto que se debe tener en cuenta ya que el cribado de CCR se considera coste-efectivo19, pero esto disminuye al hacerlo la adherencia18. En un reciente estudio realizado en nuestro país que tenía como objetivo identificar las barreras y facilitadores de la participación en un programa de cribado de CCR de base poblacional en Cataluña, la intención de participar fue un factor determinante de la participación, además de los conocimientos sobre la enfermedad y su detección temprana20.
Otro elemento clave para el adecuado funcionamiento de un programa de cribado16,18 es contar con una base de datos que incluya a la población diana y que permita acceder a ella. En este estudio casi un 17% de la muestra resultó inaccesible por diferentes motivos. Considerando las dificultades relacionadas con el medio por el que se contactó con los participantes (carta postal y teléfono), parecen necesarias otras vías de conexión, además de un plan funcional que dé facilidades a la hora de realizar y recoger resultados de la prueba. Además, se requiere un plan de comunicación que coordine el acercamiento entre atención primaria, especializada y salud pública haciendo llegar a la población mensajes claros. Y, finalmente, es imprescindible asegurar la continuidad asistencial, el tratamiento y seguimiento de las lesiones detectadas.
La ausencia de diferencias encontradas en nuestro estudio en cuanto a aceptabilidad de las pruebas en función de las variables sociodemográficas clásicas (edad, sexo, país de origen, nivel de estudios) abre una puerta a futuras investigaciones sobre su influencia.
FinanciaciónEl trabajo no contó con una financiación específica salvo con el apoyo en materiales de oficina y de recursos de la Gerencia de Atención Primaria Área Sanitaria V de Asturias, y de la Unidad Docente de Medicina Familiar y Comunitaria de Asturias.
Responsabilidades éticasProtección de personas y animales. Los autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datos. Los autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informado. Los autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
A los centros docentes de El Coto y El Llano seleccionados en el estudio por su desinteresada colaboración y a Adolfo Suárez González, por su asesoramiento y apoyo durante las fases iniciales de la investigación.