Revisar el protocolo de solicitud de sangre oculta en heces (SOH) en pacientes sintomáticos como prueba de derivación a colonoscopia, utilizando un punto de corte de 15μg Hb/g heces en 3 muestras consecutivas y comparar su utilidad con las recomendaciones actuales de un punto de corte de 10μg Hb/g heces en una muestra.
Material y métodosEstudio observacional retrospectivo centrado en las peticiones de la prueba de SOH en pacientes sintomáticos en Atención Primaria. Las muestras fueron analizadas en el servicio de laboratorio durante el año 2017. En el análisis de datos se incluyeron 715 pacientes con la prueba de SOH positiva y 925 pacientes con resultado negativo. Se realizó un análisis descriptivo de los resultados de SOH, motivo de solicitud y colonoscopia, junto con el estudio de la utilidad diagnóstica de la prueba SOH para los puntos de corte de 10 y 15μg Hb/g heces en la misma población.
ResultadosLa tasa de positividad de la prueba fue del 22,8% y la tasa de detección de cáncer colorrectal fue del 11%. El número de muestras no modifica la precisión diagnóstica. El valor predictivo negativo es superior con el punto de corte de 10μg Hb/g heces.
ConclusionesLa selección correcta de pacientes y del punto de corte óptimo aumentan la tasa de detección de cáncer colorrectal. El cambio de protocolo de 10μg Hb/g heces y la recogida de una muestra para pacientes sintomáticos desde Atención Primaria mejoran la utilidad de la prueba SOH.
To review referral protocol in symptomatic patients from primary care of using 15μgHb/g faeces threshold with three consecutive samples in faecal occult blood (FOB) test. To compare test utility using current recommendations of 10μgHb/g faeces threshold and one sample.
Material and methodsA retrospective observational study was designed, including FOB samples of symptomatic patients from primary care. Samples were analyzed at the biochemistry laboratory in 2017. Seven hundred and fifteen patients tested positive and 925 patients negative. Exclusion criteria were secondary care request and patients under the age of 18. Descriptive analysis was performed of FOB results and clinical data about request and colonoscopy. FOB test's diagnostic utility was studied for different threshold (10 and 15μgHb/g faeces) in the same population.
ResultsFOB positivity rate was 22.8% and cancer detection rate was 11%. However, the number of samples does not modify diagnostic precision. Negative predictive value is higher with 10μgHb/g faeces threshold.
ConclusionsCorrect patient selection and optimal threshold increase cancer detection rate. The protocol with 10μgHb/g faeces threshold and one sample collection for symptomatic patients from primary care improves the FOB test's purpose.
En España el cáncer es una de las principales causas de morbimortalidad. El cáncer colorrectal (CCR) es el más frecuente en la población española (44.937 casos detectados en el 2019 con una incidencia acumulada a 5 años del 13,7%) y el segundo tumor responsable del mayor número de muertes (15.410 muertes en el 2017 por CCR)1. En nuestra área fue el cáncer con mayor incidencia (526 casos nuevos en el 2018), siendo el segundo con mayor mortalidad y el segundo en incidencia acumulada a 5 años (1.495 casos)2.
Aunque las cifras de mortalidad son elevadas, la supervivencia de estos pacientes ha aumentado en los últimos años en todos los países europeos, principalmente en relación con los avances en el tratamiento3.
Es importante tener en cuenta que no existen síntomas específicos de enfermedad intestinal4. El estudio «Quantitative faecal immunochemical tests to guide referral for colorectal cancer in primary care», realizado por el National Institute for Health and Care Excellence (NICE) de Inglaterra, considera que los síntomas más comúnmente encontrados tienen un valor predictivo de CCR del 3-4%5. Ante un paciente con síntomas compatibles con CCR, sin sangrado rectal, diferentes guías de práctica clínica han definido los criterios por los que está indicado realizar la prueba de sangre oculta en heces (SOH) en Atención Primaria o, por el contrario, derivar a Atención Hospitalaria para la realización de colonoscopia5,6.
Debido a que los síntomas son poco específicos, frecuentemente el CCR se encuentra avanzado en el diagnóstico. Por ello, es necesario conocer la utilidad de pruebas, con elevado valor predictivo negativo (VPN), que favorezcan su diagnóstico precoz para aumentar la supervivencia7–9. La determinación de SOH está ampliamente instaurada como prueba de cribado de CCR en pacientes asintomáticos10, pero cada vez más estudios ponen en evidencia si es el mejor método de cribado para el estudio de los pacientes con sintomatología compatible con CCR dentro de los criterios establecidos.
Ante un paciente con síntomas compatibles con CCR, se han definido los criterios clínicos por los que está indicado realizar la prueba de SOH o, por el contrario, derivar a Atención Hospitalaria para la realización de colonoscopia. Estos últimos que derivan por vía clínica a colonoscopia son: masa rectal/abdominal palpable sospechosa, rectorragia junto con pérdida de peso, cambios de hábitos intestinales o ausencia de síntomas perianales y anemia ferropénica sin causa justificable5,6,11–15.
La prueba de SOH presenta un elevado VPN, fundamental para la selección de pacientes candidatos a colonoscopia6,8,16–18. Se han publicado diferentes estudios sobre el punto de corte óptimo y el número de muestras para la indicación de la colonoscopia en pacientes sintomáticos. Lee et al., en su metaanálisis16, evidenciaron la heterogeneidad entre los estudios publicados. En él, evaluaron las diferencias encontradas entre el número de muestras analizadas por paciente concluyendo que el aumento en el número de muestras no afectaba a los resultados de sensibilidad (S), especificidad (E) y valores predictivos de la prueba. Identificar el punto de corte óptimo repercute directamente en el número de casos detectados, por lo que es necesario verificar el valor adecuado para la realización de colonoscopia por área geográfica16,18–20.
Actualmente las guías clínicas y los documentos de consenso indican la realización de la determinación de SOH en pacientes sintomáticos desde Atención Primaria, siempre que no pertenezcan a grupos de riesgo candidatos a colonoscopia, mediante el análisis de una única muestra y un punto de corte de 10μg Hb/g heces (50ng/mL)6.
El objetivo del estudio es revisar nuestro protocolo de solicitud de SOH en pacientes sintomáticos, como prueba de derivación a colonoscopia (punto de corte de 15μg Hb/g heces en 3 muestras consecutivas) y comparar la utilidad de la prueba con las recomendaciones actuales (punto de corte de 10μg Hb/g heces en una muestra).
Material y métodosEl estudio se llevó a cabo siguiendo como criterios de inclusión: pacientes procedentes de Atención Primaria con determinación de sangre oculta en heces positiva, fuera del protocolo de cribado poblacional y sintomatología compatible con CCR. Los criterios de exclusión fueron pacientes procedentes de Atención Hospitalaria y con edad inferior a 18 años.
Diseño del estudioSe realizó un estudio retrospectivo y observacional de todas las peticiones de SOH recibidas en el servicio de Análisis clínicos y Bioquímica durante el año 2017 de acuerdo con los criterios de inclusión y exclusión. Para la recopilación de datos, se siguieron los protocolos de trabajo adecuados establecidos en nuestro hospital para el acceso a la historia clínica y la información se almacenó empleando una base de datos anonimizada.
Las instrucciones para el paciente dentro de este protocolo contemplaron la recogida correcta de 3 muestras para la determinación de SOH durante 3 días consecutivos sin necesidad de modificar la dieta ni tratamiento habitual.
La determinación de SOH se llevó a cabo empleando el equipo automatizado OC-sensor DIANA® (inmunoturbidimetría por aglutinación de látex) de la casa comercial Palex Medical®. Este método se basa en una reacción de aglutinación mediante anticuerpos específicos contra hemoglobina humana y no requiere de restricciones dietéticas ni medicamentosas. El punto de corte recomendado para la realización de la colonoscopia fue de 15μg Hb/g heces (75ng/mL). Estos pacientes fueron derivados a la consulta de Digestivo para evaluación y realización de la colonoscopia si procediera tras su evaluación clínica.
Tamaño muestralEl cálculo del tamaño muestral se basó en el aumento de la sensibilidad de la determinación de SOH respecto a los criterios NICE de detección de CCR. Teniendo en cuenta que la prevalencia de la enfermedad es del 15% y la sensibilidad por los criterios NICE para CCR es del 60%, se fijó como criterio obtener una sensibilidad del 80%, para lo que se obtuvo un tamaño de muestra de 1.641 sujetos, con una potencia estadística del 80% y un nivel de riesgo del 5%. Se incluyeron 715 pacientes con prueba de SOH positiva derivados a colonoscopia y 926 pacientes con resultado negativo.
Análisis estadísticoEl análisis se realizó con los programas Excel® y SPSS para Windows versión 15.0 (SPSS Inc. Chicago, EE.UU.).
Se llevó a cabo un análisis descriptivo de los resultados obtenidos de la prueba de SOH, del motivo de solicitud y de los resultados de la colonoscopia. Además, se estimó la precisión diagnóstica de la prueba SOH para los puntos de corte de 50ng/mL (10μg Hb/g heces) y 75ng/mL (15μg Hb/g heces) en la misma población.
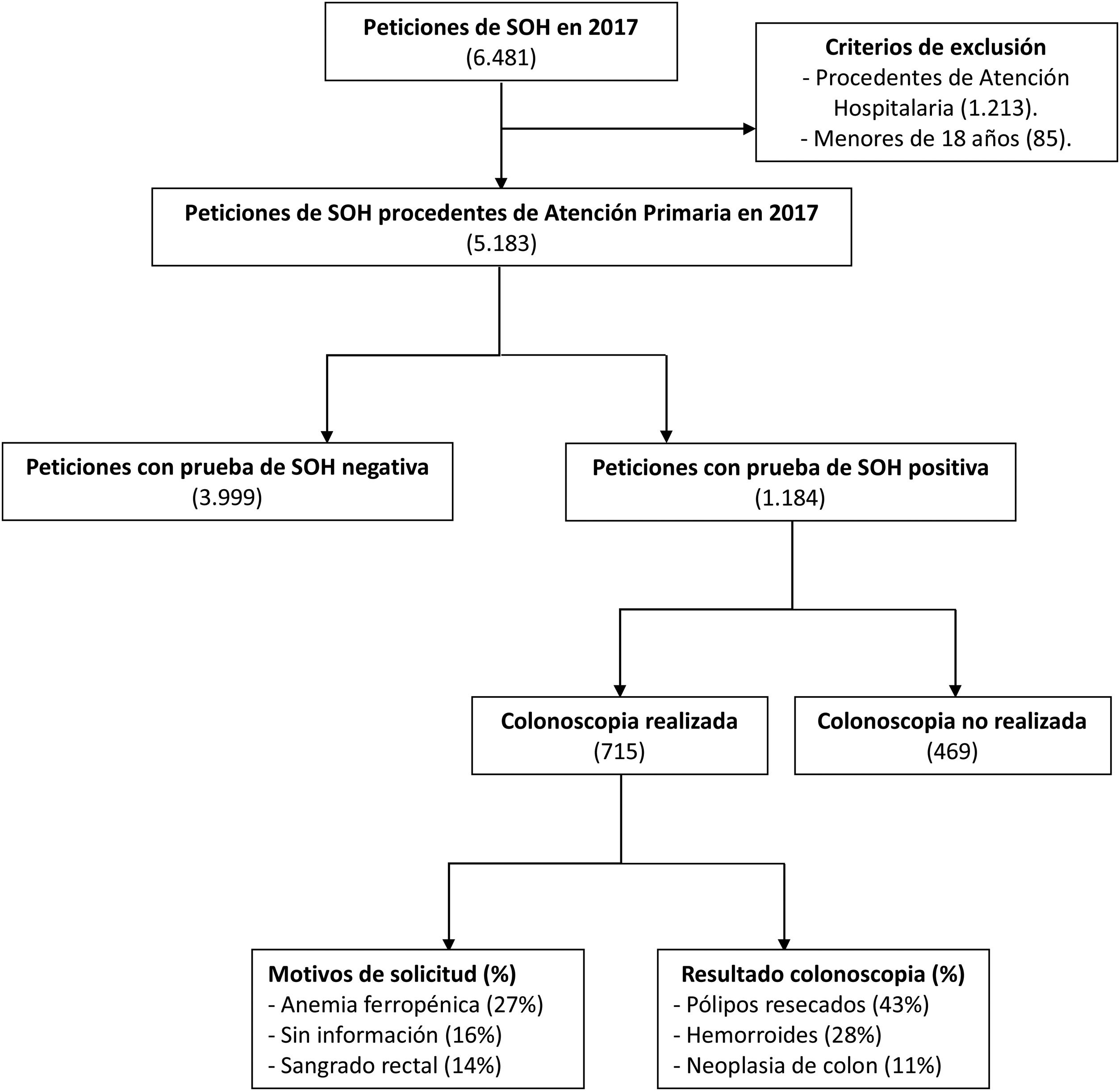
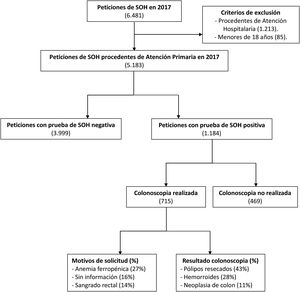
ResultadosEn el año 2017 se analizaron 6.481 peticiones de SOH, de la cuales 5.183 procedieron de Atención Primaria. Se obtuvieron 1.184 pacientes con resultado positivo que fueron remitidos a Atención Hospitalaria. Solo 715 completaron la realización de colonoscopia y fueron incluidos en el estudio (fig. 1). La tasa de positividad fue del 22,8% y la tasa de detección de CCR del 11%.
Diagrama de flujo de pacientes a estudio.
Se realizó un estudio retrospectivo y observacional de todas las peticiones de SOH recibidas en nuestro servicio durante el año 2017 (6.481). Se obtuvieron 1.184 pacientes con valores positivos procedentes de Atención Primaria y fueron remitidos a Atención Hospitalaria, de los cuales 715 completaron la realización de colonoscopia.
La media de edad de los pacientes estudiados fue de 60,7 años (rango 18-99), con un 48,2% (790) varones y un 51,8% (851) mujeres.
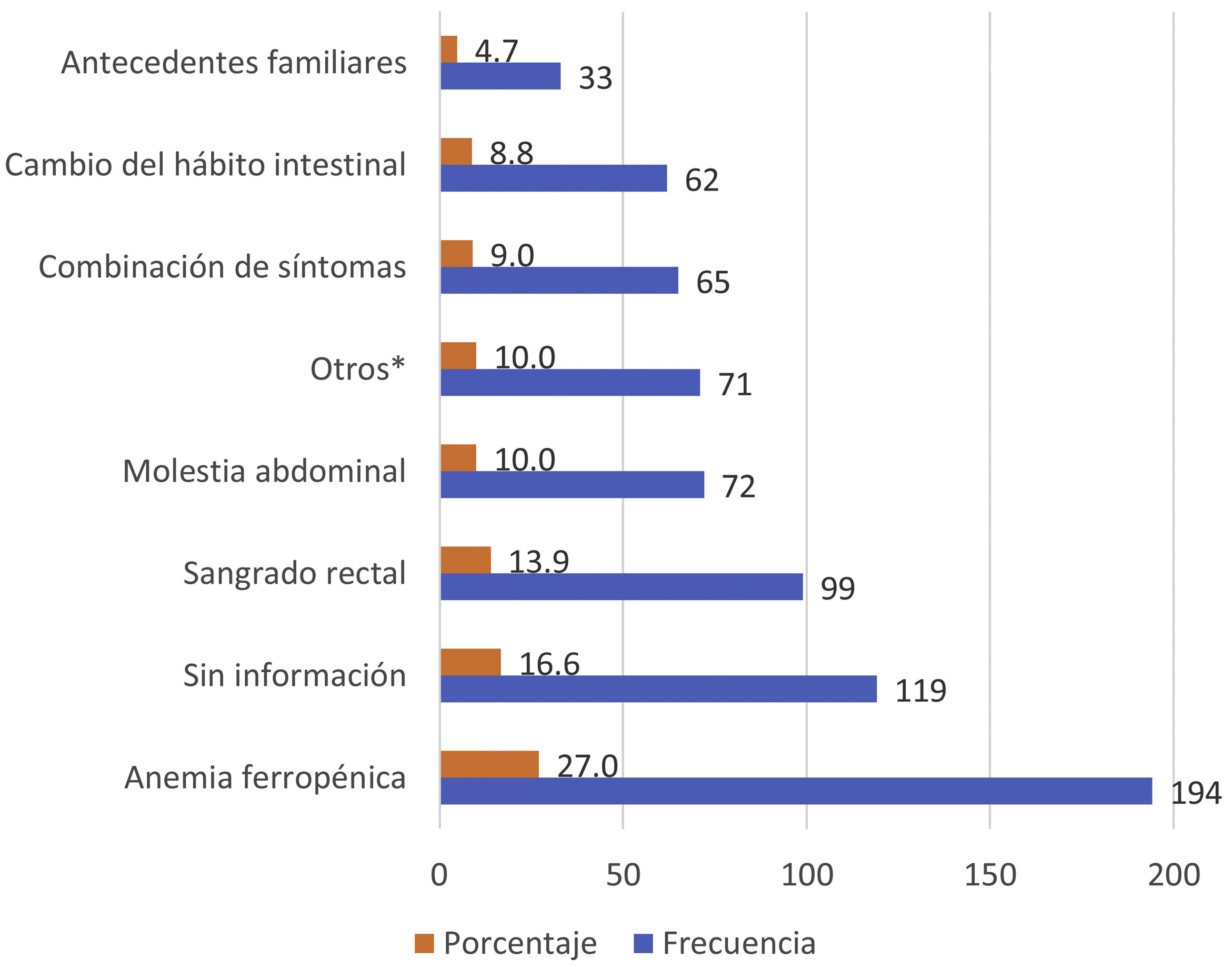
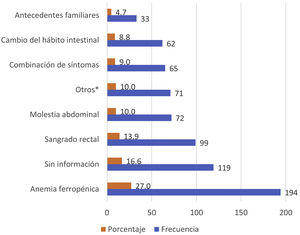
Los motivos de solicitud de SOH más frecuentes en nuestro estudio se recogen en la figura 2. La anemia ferropénica, el sangrado rectal y el dolor abdominal fueron los principales motivos de solicitud, suponiendo casi el 50% de las peticiones solicitadas. En el 16,4% no se identificó el motivo de solicitud de SOH y el 4,72% se solicitaron por antecedentes familiares sin especificar sintomatología.
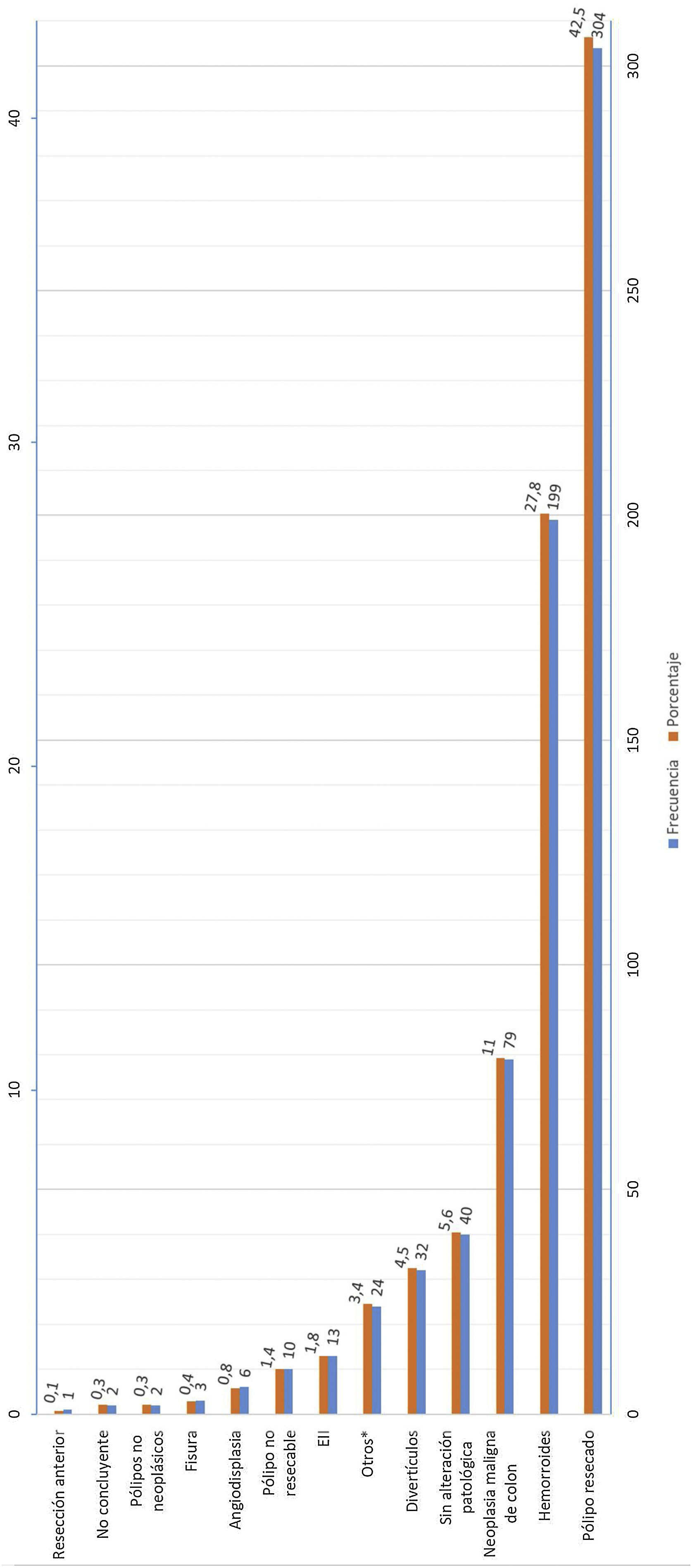
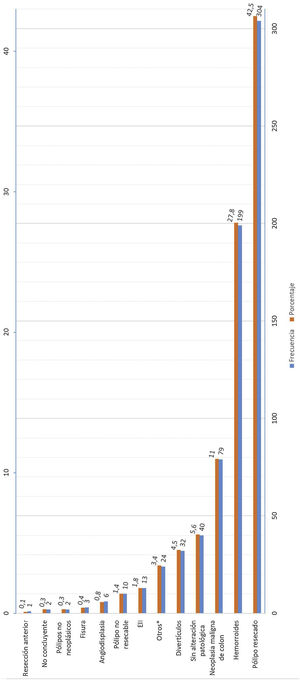
La figura 3 muestra el resultado de la colonoscopia y el estudio anatomopatológico de los hallazgos encontrados en la prueba.
En la tabla 1 se muestran los valores estimados de sensibilidad, especificidad, VPP y VPN para los diferentes puntos de corte estudiados, teniendo en cuenta el número de muestra (1.ª, 2.ª y 3.ª) y para la media aritmética de las 3. Los resultados se han evaluado en función del sexo, en el conjunto de los pacientes y en grupos de edad (<50 años, 50-69 años, >69 años).
Resultados de evaluación de la prueba a los diferentes puntos de corte estudiados, de cada una de las 3 muestras recogidas, así como de la media de los 3 resultados
| Punto de corte 10μg Hb/g heces | |||||||
|---|---|---|---|---|---|---|---|
| Variable | Edad | Sexo | Todos los pacientes | ||||
| <50 años | 50-69 años | >69 años | Hombres | Mujeres | |||
| n | 734 | 380 | 527 | 790 | 851 | 1.641 | |
| Primera muestra | Sa | 75,0 (58-87) | 100 (20-100) | 97,7 (88-100) | 92,5 (80-97) | 83,3 (68-92) | 88,2 (79-94) |
| Ea | 76,1 (73-79) | 82,3 (78-86) | 55,8 (51-60) | 67,6 (64-71) | 74,7 (72-78) | 71,31 (69-73) | |
| VPP | 35,6 | 50 | 28,1 | 33,5 | 36,8 | 35,2 | |
| VPN | 94,5 | 100 | 99,3 | 98,1 | 96,2 | 97,2 | |
| Segunda muestra | Sa | 93,75 (80-98) | 100 (21-100) | 92,9 (81-97) | 95,0 (83-99) | 91,4 (78-97) | 93,3 (85-97) |
| Ea | 73 (70-76) | 82,2 (78-86) | 54,51 (50-89) | 65,1 (62-68) | 73,9 (71-77) | 69,67 (67-72) | |
| VPP | 38,2 | 49,8 | 26,5 | 32,5 | 38,2 | 35,2 | |
| VPN | 98,5 | 100 | 97,7 | 98,7 | 98,0 | 98,3 | |
| Tercera muestra | Sa | 81,2 (65-91) | 100 (21-100) | 90,5 (78-96) | 92,5 (80-97) | 80,0 (64-90) | 86,7 (77-93) |
| Ea | 75,8 (72-79) | 83,3 (79-87) | 54,1 (50-59) | 66,1 (63-69) | 75,4 (72-78) | 70,9 (69-74) | |
| VPP | 37,2 | 51,4 | 25,8 | 32,5 | 36,5 | 34,5 | |
| VPN | 95,8 | 100 | 97,0 | 98,0 | 95,5 | 96,8 | |
| Media de las 3 muestras | Sa | 100 (89-100) | 100 (21-100) | 97,8 (88-100) | 100 (92-100) | 97,1 (85-99) | 98,7 (93-100) |
| Ea | 67,9 (64-71) | 77,0 (73-81) | 45,4 (41-50) | 57,5 (54-61) | 68,3 (65-71) | 63,1 (61-66) | |
| VPP | 35,5 | 43,5 | 24,0 | 29,3 | 35,1 | 32,1 | |
| VPN | 100 | 100 | 99,1 | 100 | 99,3 | 99,6 | |
| Punto de corte 15μg Hb/g heces | |||||||
|---|---|---|---|---|---|---|---|
| Variable | Edad | Sexo | Todos los pacientes | ||||
| <50 años | 50-69 años | >69 años | Hombres | Mujeres | |||
| n | 734 | 380 | 527 | 790 | 851 | 1.641 | |
| Primera muestra | Sa | 75,0 (58-87) | 100 (20-100) | 95,3 (85-99) | 92,5 (80-97) | 80,6 (65-90) | 86,8 (77-93) |
| Ea | 78,3 (75-81) | 84,4 (80-88) | 58,9 (54-63) | 70,0 (67-73) | 77,3 (74-80) | 73,8 (72-76) | |
| VPP | 37,9 | 53,1 | 29,0 | 35,2 | 38,5 | 36,9 | |
| VPN | 94,7 | 100 | 98,6 | 98,1 | 95,7 | 96,9 | |
| Segunda muestra | Sa | 90,6 (76-97) | 100 (21-100) | 85,7 (72-93) | 90,0 (77-96) | 85,7 (71-94) | 88,0 (79-94) |
| Ea | 75,8 (72-79) | 83,8 (80-87) | 85,1 (54-62) | 67,6 (64-71) | 76,6 (74-79) | 72,3 (70-74) | |
| VPP | 39,8 | 52,1 | 26,5 | 32,9 | 39,3 | 35,9 | |
| VPN | 97,9 | 100 | 85,8 | 97,5 | 96,8 | 97,2 | |
| Tercera muestra | Sa | 78,1 (61-89) | 100 (21-100) | 85,7 (72-93) | 90,0 (77-96) | 74,3 (58-86) | 82,7 (73-90) |
| Ea | 79,1 (76-82) | 85,7 (82-89) | 59,4 (55-64) | 69,4 (66-73) | 79,3 (76-82) | 74,7 (72-77) | |
| VPP | 39,8 | 55,3 | 27,1 | 34,3 | 38,8 | 36,5 | |
| VPN | 95,3 | 100 | 95,9 | 97,5 | 94,6 | 96,1 | |
| Media de las 3 muestras | Sa | 90,9 (76-97) | 100 (21-100) | 93,3 (82-98) | 93,0 (81-98) | 91,7 (78-97) | 92,4 (84-97) |
| Ea | 70,1 (67-74) | 81 (77-85) | 53,4 (49-58) | 63,1 (60-66) | 72,4 (69-75) | 67,9 (66-70) | |
| VPP | 35,6 | 48,1 | 26,1 | 30,8 | 37,0 | 33,7 | |
| VPN | 97,8 | 100 | 97,8 | 98,1 | 98,0 | 98,1 | |
En esta tabla se recogen los valores estimados de S, E, VPP y VPN para los diferentes puntos de corte estudiados (10μg Hb/g heces y 15μg Hb/g heces), el número de muestra (1.a, 2.a y 3.a) y para la media aritmética de las tres. Se han recogido resultados en función de la edad, el sexo y del conjunto de los pacientes.
El comportamiento encontrado en cada uno de los análisis fue similar en ambos puntos de corte. Además, se obtiene una mayor sensibilidad en la media de las 3 muestras.
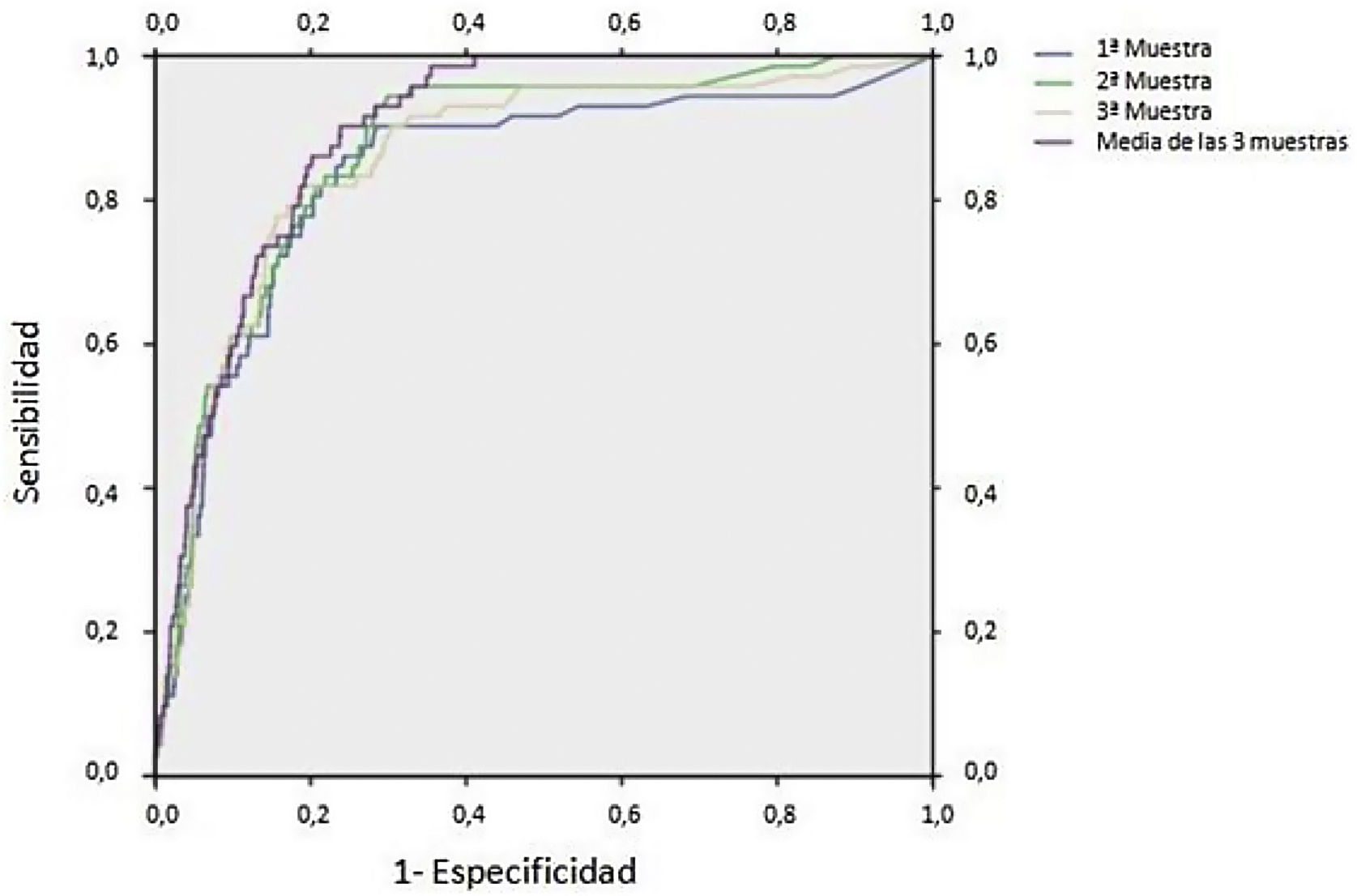
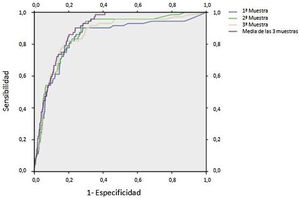
En la figura 4 se representan las curvas ROC para el protocolo de recogida de 3 muestras mostrando la mayor sensibilidad con la media de las 3 muestras y la mayor especificidad con la primera muestra recogida del paciente. En el área bajo la curva (AUC) se observa un solapamiento entre las 3 muestras independientes, encontrándose diferencias con su media (tabla 2).
Resultados de curva ROC. Área bajo la curva (AUC) obtenida con la curva ROC e intervalo de confianza correspondiente en función del número de muestra
| Variables resultado de contraste | AUC | Intervalo de confianza al 95% | |
|---|---|---|---|
| Límite inferior | Límite superior | ||
| Primera muestra SOH | 0,839 | 0,786 | 0,891 |
| Segunda muestra SOH | 0,870 | 0,832 | 0,909 |
| Tercera muestra SOH | 0,859 | 0,815 | 0,903 |
| Media de las 3 muestras | 0,895 | 0,870 | 0,920 |
A diferencia del cribado poblacional de CCR, existe una importante variabilidad en la bibliografía sobre el estudio de pacientes sintomáticos en cuanto a la selección de participantes, los resultados de la colonoscopia, las prevalencias en poblaciones, así como en los valores de SOH en este grupo de riesgo15,16,19. Las diferencias más importantes se encuentran en las tasas de positividad de SOH y la tasa de detección de CCR, justificado por el cambio en el punto de corte. En nuestro estudio, que presenta un punto de corte de 15μg Hb/g heces en 3 muestras, obtenemos un 22,8% de pacientes con SOH positiva y una tasa de detección de CCR del 11%. Sin embargo, en otros estudios el porcentaje de detección es superior al aumentar la sensibilidad aplicando un punto de corte menor11,14,21. En cuanto a los valores estimados de S, E y VPN con un punto de corte de 10μg Hb/g heces, nuestro estudio presenta unos valores muy similares a otros estudios encontrados en la bibliografía, lo que es especialmente destacable para S y VPN18. Asimismo, los resultados independientes al punto de corte, como la distribución de sexos o los motivos de solicitud, resultan similares a los publicados por otros autores16,18,22.
Además del cambio en el punto de corte, se debe considerar la alta heterogeneidad de los síntomas encontrados y la complejidad del manejo clínico de estos pacientes, influyendo todos estos factores en la variabilidad de los resultados obtenidos. Recientemente se han publicado estudios que estiman scores de predicción de CCR asociando la determinación de SOH con otros parámetros, como la edad y el sexo, que permiten establecer un modelo predictivo de enfermedad y poder priorizar la realización de colonoscopia de forma diferente a las vías actuales. La utilidad de estos modelos predictivos ayuda a obtener indicaciones de realización de colonoscopia con mayores sensibilidades y especificidades23–25. En nuestros resultados obtenemos un alto porcentaje de pacientes con hemorroides sin más hallazgos (27,8%) tras la realización de colonoscopia, lo que resulta muy similar a estudios publicados por otros grupos12. La aplicación de estos modelos predictivos podría ser una buena opción para optimizar los recursos en la realización de la colonoscopia y el seguimiento de estos pacientes26.
Limitaciones del estudioEl presente estudio muestra como limitaciones el carácter retrospectivo del mismo, que impide la selección de los pacientes para realización de colonoscopia, y la imposibilidad de extrapolar los resultados a estrategias de cribado, ya que el estudio ha sido realizado en pacientes que presentaban síntomas y no en asintomáticos.
Aplicabilidad prácticaAl contrastar los resultados de los motivos de solicitud de SOH con las recomendaciones de las principales guías de práctica clínica5,6 se observa una correspondencia parcial de los criterios clínicos recomendados para la realización de la prueba con la práctica clínica habitual por diferentes hallazgos, como que la suma de anemia ferropénica y rectorragia constituyen más del 40% de los motivos de solicitud de SOH, siendo ambos criterios de derivación directa a colonoscopia. Sin embargo, la presencia de masa abdominal o rectal también constituye un criterio para derivación directa y solamente encontramos un 0,17% de pruebas solicitadas por este síntoma, lo que indica que la práctica clínica es correcta en este caso. La correcta selección de los pacientes y solicitud de la prueba de SOH, mediante el cumplimiento de las guías de práctica clínica, es crucial para obtener el máximo beneficio de la realización de estas pruebas y conseguir la detección precoz de la enfermedad teniendo en cuenta la baja especificidad de los síntomas5,12.
Aunque la comparación de las AUC de las curvas ROC pone de manifiesto que la diferencia es mínima entre la estrategia de recoger una única muestra o 3, la combinación de muestras consecutivas recogidas en días diferentes presenta la mayor sensibilidad a expensas de una menor especificidad (tabla 1), siendo similar a lo observado en otros estudios27,28. Por lo tanto, podemos aplicar el protocolo de solicitud de SOH para pacientes sintomáticos recomendado actualmente en las guías de práctica clínica y solicitar una única muestra6. Esto mejoraría, además, la falta de adherencia descrita en la bibliografía en relación con la recogida completa en los protocolos de tres muestras29,30.
La utilidad diagnóstica de la prueba depende del punto de corte elegido. Se debe tener en cuenta que su disminución originará un mayor número de positivos, lo que podría aumentar el número de colonoscopias a realizar, aunque también se espera incrementar el porcentaje de detección de CCR. Resulta muy importante la selección correcta de los pacientes a estudio y del punto de corte adecuado para la prueba de SOH en Atención Primaria. La sospecha de CCR en pacientes sintomáticos es fundamental para la correcta derivación según vías clínicas. Esto pone en evidencia la necesidad de pruebas con un elevado VPN, como la prueba de SOH, que, junto con la sospecha clínica, permiten detectar y seleccionar a los pacientes que precisan la derivación por vía clínica a colonoscopia. En todos los casos analizados en nuestro trabajo, el mayor VPN se obtiene con el punto de corte de 10μg Hb/g heces. Se ha contado con el consentimiento de los pacientes y/o se han seguido los protocolos de los centro de trabajo sobre tratamiento de la información de los pacientes.
ConclusiónPor todo lo anterior, es válido el cambio de protocolo con punto de corte de 10μg Hb/g heces y recogida de una única muestra para pacientes sintomáticos desde Atención Primaria.
FinanciaciónLa presente investigación no ha recibido ayudas específicas provenientes de agencias del sector público, sector comercial o entidades sin ánimo de lucro.
Contribución de los autoresMPPP, AMLM, LRJ y MCLL diseñaron el estudio. MPPP y AMLM recogieron y analizaron los datos. LRJ realizó el análisis estadístico y MCLL supervisó el proyecto. Todos los autores participaron en la redacción y revisión del artículo y aprobaron la versión final del manuscrito.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.