El dolor lumbar, así como otras alteraciones musculoesqueléticas (cervicalgia, artrosis, etc.), son causa muy frecuente de consulta tanto en atención primaria como en otras especialidades hospitalarias y suelen asociarse con una alta discapacidad funcional y laboral. La lumbalgia aguda puede presentar diferentes componentes nociceptivos, neuropáticos y nociplásticos, lo que lleva a considerarlo como un dolor de tipo mixto. La importancia del concepto de dolor mixto obedece a que el alivio sintomático de dichas patologías requiere un enfoque terapéutico multimodal a diversas dianas farmacológicas. Desde hace varias décadas se reconoce el papel antinociceptivo del complejo de vitaminas B, específicamente de la combinación de tiamina, piridoxina y cianocobalamina (TPC). Asimismo, hay evidencia acumulada que indica una acción analgésica adyuvante en el dolor lumbar. El objetivo de la presente revisión es presentar la evidencia existente y los últimos hallazgos sobre los efectos terapéuticos de la combinación TPC en el dolor lumbar. Asimismo, se analizan algunos de los mecanismos de acción más relevantes implicados que pueden explicar dichos efectos. La evidencia revisada indica que el uso combinado de TPC tiene un efecto adyuvante analgésico en el dolor mixto, específicamente en el dolor lumbar y otras alteraciones musculoesqueléticas con componentes nociceptivos y neuropáticos. Dicho efecto puede ser explicado por una acción antiinflamatoria, antinociceptiva, neuroprotectora y neuromoduladora de la combinación TPC sobre el sistema descendente del dolor.
Low back pain, as well as other musculoskeletal disorders (neck pain, osteoarthritis, etc.), are a very frequent cause of consultation both in primary care and in other hospital specialties and are usually associated with high functional and work disability. Acute low back pain can present different nociceptive, neuropathic and nonciplastic components, which leads to consider it as a mixed type pain. The importance of the concept of mixed pain is due to the fact that the symptomatic relief of these pathologies requires a multimodal therapeutic approach to various pharmacological targets. The antinociceptive role of the B vitamin complex has been recognized for several decades, specifically the combination of Thiamine, Pyridoxine and Cyanocobalamin (TPC). Likewise, there is accumulated evidence that indicates an adjuvant analgesic action in low back pain. The aim of the present review is to present the existing evidence and the latest findings on the therapeutic effects of the TPC combination in low back pain. Likewise, some of the most relevant mechanisms of action involved that can explain these effects are analyzed. The reviewed evidence indicates that the combined use of PCT has an adjuvant analgesic effect in mixed pain, specifically in low back pain and other musculoskeletal disorders with nociceptive and neuropathic components. This effect can be explained by an anti-inflammatory, antinociceptive, neuroprotective and neuromodulatory action of the TPC combination on the descending pain system.
Las patologías musculoesqueléticas representan uno de los problemas de salud pública de mayor impacto en los países occidentales; constituyen una de las causas más frecuentes de consulta médica y son la fuente principal de dolor crónico en todo el mundo1–4. Además, se afirma que la carga global de estas enfermedades en los individuos y la sociedad aumentarán drásticamente en los años venideros debido al envejecimiento de la población5. Así, la prevalencia de la lumbalgia, la artritis reumatoide y la artrosis ha aumentado en un 17,3, 23,8 y 32,9%, respectivamente, desde 2005 a 2015 en la población mundial6. En España, por ejemplo, la prevalencia de la cervicalgia, lumbalgia y la combinación de ambas también experimentó un aumento entre 2009 y 20127.
Dentro de estas patologías, el dolor de espalda, y más específicamente el dolor lumbar, es uno de los más prevalentes y representa el segundo lugar de morbilidad dentro de las enfermedades musculoesqueléticas, sólo antecedido por la artrosis8. El dolor lumbar se define como un síndrome musculoesquelético cuyo principal síntoma es la presencia de dolor localizado en el segmento final de la columna vertebral (zona lumbar), en el área comprendida entre la reja costal inferior y la región sacra, y que en ocasiones puede comprometer la región glútea, provocando disminución funcional8.
La lumbalgia es bien conocida como una de las principales causas de discapacidad global asociándose a un alto impacto económico, lo cual supone un gran reto para los sistemas sanitarios de todo el mundo9. En atención primaria, es la segunda causa más frecuente de visita al médico de familia10 y su prevalencia se estima en más del 70% a lo largo de toda la vida11,12. En España, se calcula que en aproximadamente el 80-85% de los pacientes con lumbalgia, esta es de tipo inespecífico, sin poderse identificar su causa13,14. Dos de cada 3 pacientes que experimentan episodios agudos de dolor lumbar finalmente evolucionan a dolor lumbar crónico15. Otros estudios muestran que la tasa de recurrencia del dolor lumbar puede oscilar entre el 24 y el 80% de los casos16. En España, la lumbalgia crónica afecta al 14,3% de los hombres y al 22,8% de las mujeres, y la cervicalgia al 9,6% de la población masculina y al 21,9% de la femenina17. Además, el dolor lumbar crónico se asocia con frecuencia a comorbilidades, como depresión, trastornos de pánico, ansiedad y trastornos del sueño, entre muchas otras18. Al mismo tiempo, es la causa más frecuente de incapacidad y absentismo laboral en pacientes menores de 45 años, y una de las 5 razones más frecuentes de consulta a nivel de atención primaria17.
El dolor lumbar se puede categorizar según su etiología como patología espinal (p. ej., secundaria a fractura vertebral, espondiloartrosis, etc.), síndrome radicular (p. ej., secundario a compresión de la raíz dorsal por discopatía), y el más frecuente, dolor lumbar inespecífico, en el cual no es posible identificar la causa del dolor19. En la mayoría de los casos, el dolor lumbar puede tener componentes tanto neuropáticos como nociceptivos, por lo que se ha catalogado como un dolor de tipo mixto9,20. Basado en esto, el enfoque terapéutico analgésico actual intenta incorporar los diferentes mecanismos de acción que subyacen al dolor; por ello, tiene sentido combinar analgésicos con diferentes mecanismos de acción para lograr un resultado adecuado. Las guías NICE consideran el uso de antiinflamatorios no esteroideos (AINE) a las dosis más bajas y durante el menor tiempo posible dado el perfil de tolerabilidad/seguridad, pero no contemplan el uso de opioides débiles en los casos agudos (a menos que el AINE esté contraindicado, no se tolere o sea ineficaz) y tampoco recomiendan únicamente paracetamol para el manejo de la lumbalgia. Tampoco se recomienda el uso rutinario de opioides clásicos dada la relación de costo/beneficio, en donde los posibles riesgos de sobredosis y posible adicción sobrepasan los beneficios11,21.
Se han publicado diversas guías prácticas para el tratamiento de la lumbalgia crónica21–25. La mayoría de dichas guías recomienda un enfoque multimodal para el manejo de la lumbalgia crónica, combinando terapias farmacológicas con enfoques no farmacológicos. Sin embargo, estas pautas generalmente no incluyen recomendaciones específicas para el tratamiento de los componentes neuropáticos de este tipo de dolor, ya que hasta hace poco era poco conocido su papel en la fisiopatología del dolor lumbar26 Además, las pautas disponibles para el tratamiento del dolor neuropático generalmente se centran en enfermedades distintas de la lumbalgia, como la neuralgia posherpética, la neuropatía diabética dolorosa27–30 y la ciática o dolor radicular31.
Durante los últimos 30 años, se han estudiado los efectos analgésicos de las vitaminas del complejo B en pacientes con dolor lumbar y en diferentes alteraciones osteomusculares, inflamatorias y de origen neuronal (p. ej., neuropatía periférica). Particularmente, la tiamina (vitamina B1), piridoxina (vitamina B6) y cianocobalamina (vitamina B12) (en conjunto TPC) han sido evaluadas en el tratamiento del dolor causado por polineuropatías, enfermedades reumáticas, lumbalgia, tonsilectomías y enfermedades degenerativas de la columna vertebral32–42. Estos estudios se han enfocado en analizar sus efectos a dosis terapéuticas en combinación con AINE43–45. Diversas publicaciones indican que la suplementación específica con la combinación de vitaminas B1, B6 y B12 a dosis elevadas interactúa sinérgicamente para mejorar la neuropatía, el control motor, el dolor nociceptivo y el dolor neuropático46–49.
Teniendo en cuenta la alta incidencia y prevalencia de dolor lumbar en la población general, y sobre todo el papel que puede tener el uso de terapias coadyuvantes analgésicas para el manejo de afecciones musculoesqueléticas, el objetivo de la presente revisión es presentar la evidencia disponible sobre los efectos antinociceptivos del complejo B, especialmente los efectos de la combinación de TPC en el dolor lumbar y en enfermedades musculoesqueléticas asociadas, como ejemplos de dolor de tipo mixto. Para esto, se presentarán algunos de los mecanismos de acción descritos para dichas vitaminas y su utilidad en la práctica clínica.
El complejo B en el dolorAlgunas de las vitaminas B no solo participan en importantes funciones fisiológicas de todo el organismo, sino que también poseen funciones específicas a nivel neuronal50. Estas vitaminas denominadas «neurotróficas» juegan un papel relevante tanto en el sistema nervioso central como periférico, sobre todo en procesos metabólicos, de mielinización y regeneración neuronal51. De hecho, pacientes con un déficit crónico de estas vitaminas presentan alteraciones en el sistema somatosensorial, los cuales se hacen evidentes en diferentes pruebas neurofisiológicas52,53.
El papel de las vitaminas B en el alivio del dolor se lleva estudiando desde hace muchas décadas. Así, se sabe que el dolor o las alteraciones sensoriales pueden ser efectivamente tratados con las vitaminas B cuando este va asociado a deficiencia de dichas vitaminas, como es el caso del beriberi (por deficiencia de vitamina B1)54,55, la polineuropatía alcohólica o diabética por malabsorción54,56 o en casos de mielopatía por déficit de vitamina B1257. Asimismo, en un estudio clásico en pacientes con cefalea crónica y dolor facial se encontró que el 65% de los pacientes presentaban una deficiencia subclínica de una o más vitaminas B, y los síntomas mejoraban con la suplementación vitamínica58.
Adicionalmente, se ha reportado que la cefalea tensional en niños se asocia a deficiencias en los niveles séricos de vitamina B1259. Igualmente, se ha asociado el déficit de vitaminas B con algunas condiciones inflamatorias que se asocian con dolor, como las enfermedades reumáticas. Este es el caso de la artritis, en el que se ha evidenciado un exceso de hidrólisis de piridoxal 5-fosfato durante la inflamación, dado por una actividad elevada de fosfatasa alcalina y por una reducción en los niveles de albúmina60. De igual manera, en algunas condiciones autoinmunes, se ha visto que el uso del metotrexato puede reducir los niveles séricos de ácido fólico y vitamina B1261. Dichas condiciones autoinmunes suelen asociarse a cuadros de dolor de tipo mixto (nociceptivo, inflamatorio y neuropático) y también de dolor funcional (actualmente denominado como dolor nociplástico, como por ejemplo la fibromialgia). Por esta razón, es probable que una disminución en la concentración de estas vitaminas incremente los niveles de dolor, facilitando su progresión a un estado crónico.
Por otro lado, uno de los factores de riesgo que se han visto asociados al padecimiento de alteraciones neurológicas y musculoesqueléticas es la edad. La absorción de la vitamina B12 en el íleon necesita de la acción de enzimas pépticas, que liberen en el estómago la vitamina B12 de las proteínas de la dieta. Esta escisión se lleva a cabo principalmente por la pepsina que requiere del ácido gástrico del estómago para su activación a partir de pepsinógeno, su precursor. Así, situaciones de aclorhidria, bien sea por edad avanzada, el uso prolongado de inhibidores de la bomba de protones, bloqueantes de H2 u otros factores, puede ser causa de una situación deficitaria de vitamina B1262. Otras causas importantes de déficit de vitamina B12 son síndromes de malabsorción (asociados con anemia perniciosa) y gastritis atrófica63. Asimismo, fármacos de amplio uso como la metformina, la colestiramina y el p-amino salicilato pueden generar malabsorción debido a su efecto sobre los receptores de la membrana de los enterocitos o la mucosa del íleon62,64, por lo que podría ser relativamente frecuente la deficiencia de las vitaminas del complejo B en la población general. No obstante, a pesar de perder la capacidad de liberar la cianocobalamina, el organismo sigue presentando la función de absorber la vitamina B12 cristalina que se encuentra en los suplementos vitamínicos62.
Dicho esto, la evidencia reciente indica que las vitaminas B pueden aliviar los síntomas de ciertas afecciones neurológicas y procesos dolorosos sin que haya un déficit vitamínico demostrado. En este sentido, la combinación de B1, B6 y B12 (TPC) se ha administrado en pacientes con diversos síndromes dolorosos, alcanzando buenos resultados incluso como monoterapia, pero sobre todo cuando el complejo vitamínico se administra junto con un AINE (p, ej., diclofenaco) en pacientes con dolor de espalda65–68; como coadyuvante profiláctico en cefalea69,70 o dolor por procesos degenerativos de la columna vertebral44,45,71. También se ha administrado el complejo B en procesos dolorosos debidos a neuralgia o polineuropatía32,35,37,39,41,42,47,54,72, siendo en polineuropatía uno de los tratamientos más utilizados habitualmente (incluyendo la monoterapia con benfotiamina)73,74.
Por otro lado, las vitaminas del complejo B también se han utilizado como coadyuvante junto al tratamiento con gabapentina o pregabalina en diversos estudios tanto básicos como clínicos en diferentes patologías37,75,76. Así, en el estudio preclínico realizado por Liu et al. en 2016, se analizó el efecto de la tiamina sobre la eficacia de la pregabalina para reducir el dolor neuropático causado por ligamento del nervio espinal en un modelo en rata. Como resultado, pudieron concluir que tanto la tiamina como la pregabalina generaron efectos antinociceptivos, pero que el tratamiento combinado con ambas moléculas resultó tener un mayor efecto en la disminución del dolor comparado con su administración por separado76. Asimismo, un ensayo clínico multicéntrico aleatorizado realizado por Mimenza y Aguilar en el 2017 determinó la eficacia y seguridad de la gabapentina en comparación con el tratamiento combinado entre esta y algunas vitaminas del complejo B en pacientes con neuropatía diabética moderada y severa. De acuerdo con los resultados obtenidos, fue posible concluir que la administración conjunta de tiamina con cianocobalamina logra reducir la dosis analgésica requerida de gabapentina hasta en un 50% si se compara con el uso de gabapentina sola, lo cual indica un claro efecto sinérgico. Asimismo, se reportaron menos efectos adversos relacionados con la gabapentina. Teniendo en cuenta los mecanismos de acción de la pregabalina tanto a nivel iónico (canales de calcio de alto umbral) como en sistemas de neurotransmisión77, este efecto sinérgico nos podría indicar que las vitaminas B tienen otros mecanismos de acción analgésicos diferentes o complementarios a muchos de estos fármacos neuromoduladores.
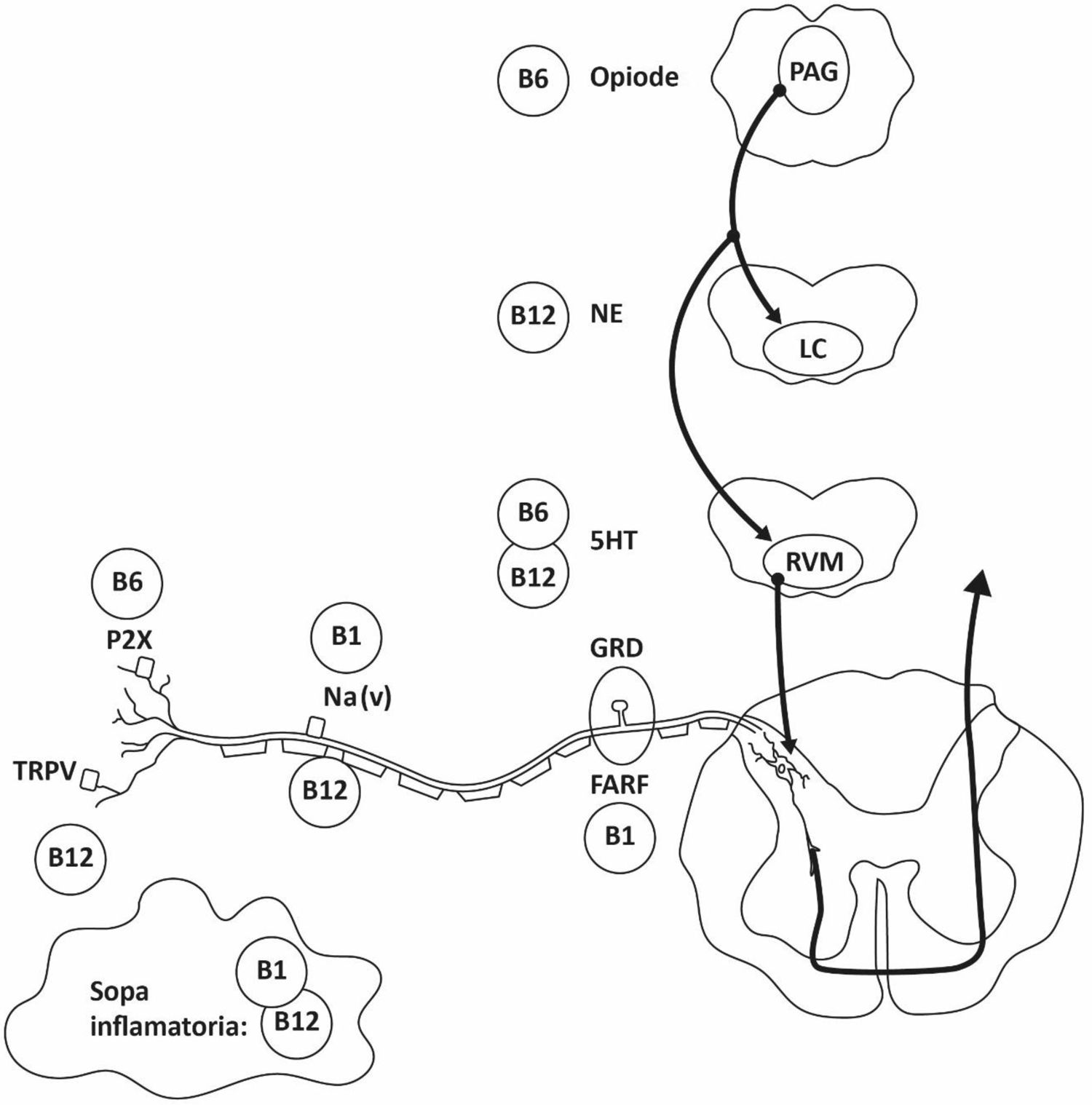
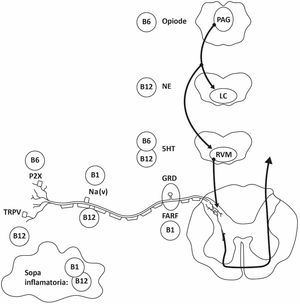
Mecanismos de acción antiinflamatorios y antinociceptivos del complejo BEl efecto analgésico de la combinación de las vitaminas B1, B6 y B12 ha sido explicado a través de sus múltiples mecanismos de acción que incluyen: modular la respuesta inflamatoria y antioxidante (evaluada en modelos murinos de edema por xileno y granuloma por cuerpo extraño)78,79, mejorar la producción de diferentes neurotransmisores que participan en la vía modulatoria descendente del dolor80 y la activación de receptores de adenosina (vía fosfatasa ácida resistente al fluoruro) en neuronas nociceptivas del ganglio de la raíz dorsal81 (fig. 1).
Principales mecanismos de acción de las vitaminas B a nivel periférico y central. En el esquema se representa el aferente primario (neurona de primer orden del ganglio de la raíz dorsal), la transmisión de la información nociceptiva a la segunda neurona (ubicada en el asta posterior de la médula espinal) y el sistema modulador descendente del dolor desde el tallo cerebral hasta la médula espinal. Los efectos antinociceptivos de las vitaminas B están representados a cada nivel de dicha vía.
5-HT: serotonina; FARF: fosfatasa ácida resistente al fluoruro; GDR: ganglio de la raíz dorsal; LC: locus coeruleus; Na(v): canales de sodio voltaje dependientes; NE: norepinefrina; P2X: receptor purinergico dependiente de ATP tipo P2X; PAG: sustancia gris periacueductal; RVM: núcleo rostral ventromedial de la médula oblonga; TRPV1: receptor de potencial transitorio V1 o receptor vaniloide.
Por su lado, la vitamina B1 y la vitamina B6 se encuentran involucradas no solo en la producción de mielina y en la conducción nerviosa51 (factores esenciales para la mejoría del dolor neuropático), sino también en la modulación de canales de sodio voltaje dependientes reduciendo la excitabilidad neuronal82. En este sentido, el dolor severo y la alodinia se pueden presentar producto de una lesión en los axones periféricos y/o en los somas de los ganglios de la raíz dorsal, mediante la generación de estados de hiperexcitabilidad neuronal y sensibilización central83–87.
Los canales de sodio voltaje dependientes, necesarios para la conducción nerviosa, juegan un papel importante en la modulación de esta excitabilidad una vez se ha producido la lesión88–91. Varios estudios en modelos animales84,88 y en humanos92,93 han demostrado que las corrientes de sodio se alteran significativamente en estas neuronas tras lesiones de los nervios periféricos. En un estudio realizado por Song et al., en el 2009, se investigó los efectos de la tiamina en la hiperexcitabilidad mediada por canales de sodio de las neuronas del ganglio de la raíz dorsal en modelos in vivo e in vitro. En dicho estudio se encontró que la administración de esta vitamina reduce la hiperexcitabilidad de estas neuronas, así como la hiperalgesia térmica. Es así como se demostró que la reducción de los potenciales de acción es causada por los cambios en la conductabilidad de las corrientes de sodio en las neuronas lesionadas. Asimismo, se evidenció que este efecto no es causado por la cinética de dichos canales, sino que este se encuentra relacionado con un mecanismo de acción diferente al descrito por otros neuromoduladores como la carbamazepina82.
Por otro lado, la vitamina B6 también se encuentra relacionada con el sistema serotoninérgico, con la activación del sistema opioide endógeno (o de sus vías de señalización intracelular) y de la vía del óxido nítrico, siendo capaz de disminuir el umbral del dolor94–96. La piridoxina, además de presentar una acción neuroprotectora al servir como cofactor para la formación de mielina, también se relaciona con la síntesis de dopamina, serotonina y GABA, influyendo en los sistemas de neuromodulación centrales51. Asimismo, la piridoxina se ha asociado con la reducción de la actividad nociceptiva evocada en neuronas talámicas y en el asta dorsal de la médula espinal en modelos animales87,97, al igual que con un efecto antiinflamatorio al bloquear posiblemente la síntesis de prostaglandina E279,96. Algunos estudios indican que los efectos antiinflamatorios y analgésicos de la piridoxina pueden estar mediados por el receptor P2X que se encuentran presentes en el músculo liso vascular, el corazón y el sistema nervioso central y periférico98. Este receptor y sus formas homoméricas (P2X(3)) y heteroméricas (P2X(2/3)) pertenecen a la familia de los receptores de membrana purinérgicos P2 situados en las neuronas aferentes primarias de los ganglios de las raíces dorsales que activan el efecto nociceptivo. Su activación junto con la acción de mediadores inflamatorios y agonistas directos contribuyen a la aparición del dolor agudo y su cronicidad99,100. Se ha demostrado que la vitamina B6 y sus derivados presentan un efecto antagónico sobre varias isoformas de los receptores P2X como P2X1, P2X2 y P2X3, explicando así su capacidad antinociceptiva, al igual que la selectividad sobre el sistema aferente del dolor y la reducción de la hiperexcitabilidad central98,101.
El papel antinociceptivo de la vitamina B12 se atribuye en parte a su participación en los procesos de síntesis de mielina y regeneración neuronal al inducir crecimiento axonal y diferenciación de las células de Schwann, mejorando la función nerviosa102–105. Además, interviene en la metilación en el metabolismo del ADN y en la activación de la trascripción de genes, incrementando la síntesis de proteínas necesarias para la regeneración de nervios105,106. Asimismo, la cianocobalamina participa en la formación de purinas y pirimidinas, esenciales para la replicación celular y regula el factor neurotrófico derivado del cerebro (BDNF). Adicionalmente, aumenta la velocidad de conducción, lo cual mejora el proceso regenerativo en los nervios periféricos107,108. Basados en evidencia histológica y morfológica de pacientes con neuropatía diabética, estudios en modelos animales de diabetes inducida por estreptozotocina y neuropatía por acrilamida han demostrado que la administración de altas dosis de vitamina B12 por un periodo prolongado promueve la síntesis y regeneración de mielina, mejorando la función neuronal en la neuropatía periférica102,109–112. De igual manera, diferentes estudios han propuesto que existe un efecto en la respuesta modulatoria del dolor a través de su acción sobre la disponibilidad y efectividad de noradrenalina y serotonina113, así como una reducción en los efectos del receptor de capsaicina (TRPV1), disminuyendo así la señalización del dolor114,115.
Por otra parte, estudios en modelos murinos han demostrado la reducción de la segunda fase inflamatoria mediada por enzimas COX en las pruebas de dolor, por lo que podría presentar propiedades inhibitorias de COX tanto a nivel central como periférico78. De igual manera, esta vitamina presenta efectos sinérgicos cuando se combina con opiáceos para el alivio del dolor, resultando en una marcada reducción de la tolerancia y dependencia a la morfina78,95,115–117. Por otro lado, se ha sugerido que la vitamina B12 podría incrementar la efectividad y disponibilidad de la noradrenalina y la 5-hidroxitriptamina en el sistema inhibitorio descendente118 así como la regeneración de nervios lesionados mediante la incorporación de leucina en la fracción proteica del nervio ciático en modelos in vivo112. En diferentes estudios realizados en modelos de neuropatía por acrilamida y lesión del nervio ciático, se observó un aumento significativo del número de regeneraciones de fibras motoras con la administración de cianocobalamina a altas dosis112, así como una mejoría en la densidad neuronal en la superficie del músculo de la pantorrilla, al emplear una combinación de cianocobalamina, L-metilfolato (derivado de la vitamina B9) y piridoxina 5-fosfato (vitamina B6)119. Asimismo, se ha observado que la cianocobalamina inhibe las descargas ectópicas espontáneas de las neuronas del ganglio de la raíz dorsal en un modelo de compresión crónica del ganglio de la raíz dorsal en ratas, potenciando un efecto antialodínico y analgésico de las señales de dolor periférico105,120.
En consecuencia, todos estos mecanismos de acción relacionados con efectos antinociceptivos y posiblemente antiinflamatorios y neuroprotectores del complejo de vitaminas B pueden reforzar los efectos de los AINE y de algunos analgésicos como paracetamol y morfina en diversos procesos dolorosos, particularmente en aquellos tipos de dolor que tienen un componente mixto37,73,75,76,95,117,121. Tal como se ha mencionado anteriormente, tener múltiples mecanismos de acción permite lograr efectos sinérgicos a nivel analgésico, lo cual no se logra con la mezcla de medicamentos del mismo tipo. Un claro ejemplo de esto es lo que ocurre con el uso combinado de AINE o el incremento de su dosis más allá de la dosis recomendada, lo cual no incrementa su efecto analgésico pero sí sus efectos adversos122.
Usos clínicos del complejo B en síndromes dolorosos de tipo mixtoDolor de espaldaDesde hace algunos años se considera que el dolor lumbar tiene componentes tanto nociceptivos como neuropáticos, y por ende se podría considerar como un dolor de tipo mixto20,26. El término dolor mixto fue empleado hace más de 20 años por Grond et al., basados en la fisiopatología del dolor crónico, describiendo dicha condición en un grupo de pacientes con cáncer123. En una revisión sistemática de Romanò et al., se reportaba que entre un 20 y 55% de los pacientes con dolor lumbar crónico tenían una probabilidad muy alta (≥90%) de tener un componente neuropático (es decir, secundario a una lesión del sistema somatosensorial)124. Recientemente, se ha postulado que el dolor mixto, no sólo es la manifestación clínica de mecanismos nociceptivos y neuropáticos que actúan de forma simultánea, sino que incluso puede tener solapado componentes fisiopatológicos de difícil estudio como los del dolor nociplástico (definido por la Asociación Internacional para el Estudio del Dolor, IASP en sus siglas en inglés, como un dolor que emerge de una alteración en la función nociceptiva a pesar de no encontrarse evidencia de daño tisular o neuronal)26. La importancia del concepto de dolor mixto aplicado a alteraciones como el dolor lumbar, la osteoartritis, la ciática y diferentes desórdenes musculoesqueléticos, radica en que la aproximación terapéutica no sólo debe emplear un blanco terapéutico, sino que deben utilizarse fármacos o terapias con diferentes mecanismos de acción (antiinflamatorio, neuromodulador y antinociceptivo) para lograr un control del dolor más efectivo (terapias multimodales)124. En un estudio transversal en un grupo de pacientes en España (n=5.024), se encontró que tanto en atención primaria como en consulta de ortopedia la mayoría de pacientes presentaban dolor de tipo mixto, y en el 80% de los casos se asociaba precisamente con alteraciones de la columna vertebral125.
Tal como se ha comentado anteriormente, las vitaminas del complejo B, en especial la combinación TPC, tienen múltiples mecanismos de acción, y por ende pueden tener un papel importante como terapia complementaria o adyuvante en dolores de tipo mixto, como por ejemplo el dolor lumbar de origen no específico, así como en alteraciones osteomusculares e inflamatorias de la región dorsal. Diferentes estudios clínicos han encontrado que las vitaminas B, en combinación con diclofenaco, tienen un efecto terapéutico mayor que la monoterapia con AINE, e incluso podrían tener un papel en monoterapia (tabla 1). En uno de los primeros estudios, mediante un ensayo clínico aleatorizado doble ciego y multicéntrico, se encontró que en pacientes con enfermedades reumáticas degenerativas de la columna, el uso de diclofenaco con vitamina B1, B6 y B12 fue más eficaz (mayor reducción del dolor según la escala Hoppe) que la utilización de diclofenaco solo. Asimismo, se encontró un efecto dosis-dependiente (y por ende menores requerimientos de diclofenaco) en un modelo animal referido en el mismo artículo71,126. En un estudio piloto con 50 pacientes con lumbalgia aguda, también se encontró que la combinación de vitaminas B (TPC) tenía un mejor efecto terapéutico que el diclofenaco sólo, medido por escalas de intensidad de dolor y escalas funcionales127.
Resumen de estudios clínicos del uso de vitaminas B en el dolor de espalda
| Tipo de estudio | Número de pacientes | Patología a tratar | Intervención | Principal efecto | Referencia |
|---|---|---|---|---|---|
| Ensayo clínico aleatorizado. Estudio piloto. | 50 | Dolor lumbar agudo | Diclofenaco (25mg)+B1 (100mg), B6 (100mg), B12 (200μg) 3 dosis/día vía oral vs. diclofenaco | Mayor reducción en el dolor medido por VAS y pruebas funcionales en el grupo tratado con la combinación. Recuperación más rápida | 127 |
| Estudio multicéntrico, aleatorizado, doble ciego | 189 | Enfermedad reumática degenerativa de la columna vertebral | Diclofenaco (50mg)+B1 (100mg), B6 (100mg), B12 (0,5mg) 3 dosis/día vía oral vs. diclofenaco | Mayor recuperación del dolor por la escala Hoppe en el grupo tratado con la combinación | 126 |
| Estudio observacional (6 meses), aleatorizado, doble ciego | 53 | Síndrome vertebral agudo | Diclofenaco (sólo en la fase aguda)+B1 (100mg), B6 (200mg), B12 (200μg) 3 dosis/día vía oral vs. placebo | La recaída fue menor en el grupo tratado con vitaminas B en comparación con el placebo | 67 |
| Estudio experimental, controlado, aleatorizado, doble ciego | 60 | Dolor lumbar agudo no específico | 500μg de metilcobalamina intramuscular 3 veces por semanas por 2 semanas vs. placebo | Menores niveles de dolor evaluado por VAS y escalas funcionales | 131 |
| Estudio aleatorizado, doble ciego | 60 | Lumbago y ciática de origen mecánico | 1.000μg de vitamina B12, intramuscular, diario por 2 semanas vs. placebo | Menores niveles de dolor por VAS y cuestionario de discapacidad funcional | 130 |
| Ensayo clínico aleatorizado, multicéntrico, doble ciego | 256 | Dolor lumbar agudo | Diclofenaco (50mg)+B1 (50mg), B6 (50mg), B12 (250μg) 3 dosis/día vía oral vs. diclofenaco | Menores niveles de dolor por VAS, y menor tiempo de recuperación en el grupo tratado con la combinación | 45 |
| Ensayo clínico controlado | 123 | Dolor lumbar agudo | Diclofenaco (25mg)+B1 (50mg), B6 (50mg), B12 (250μg) 3 dosis/día vía oral vs. diclofenaco | Menor tiempo de recuperación y mayor reducción de la escala VAS en el grupo tratado con la combinación | 44 |
| Ensayo clínico aleatorizado multicéntrico, doble ciego | 418 | Dolor lumbar agudo | Diclofenaco (25mg)+B1 (50mg), B6 (50mg), B12 (250μg) 3 dosis/día vía oral vs. diclofenaco | Reducción del dolor por VAS y cuestionario Hoppe en el grupo de combinación. No diferencias en el tiempo de recuperación | 43 |
| Estudio controlado, abierto | 38 | Radiculopatía lumbosacra de origen vertebral de un mes o más | Diclofenaco (75mg)+benfotiamina (100mg), B6 (100mg), cianocobalamina 0,2mg, 2 dosis/día vía oral vs. diclofenaco | Reducción en el dolor por VAS y en escalas de dolor neuropático en el grupo combinación | 36 |
| Estudio clínico controlado, aleatorizado, doble ciego | 372 | Dolor lumbar agudo | Diclofenaco (50mg)+B1 (50mg), B6 (50mg), B12 (1mg), 2 dosis/día vía oral vs. diclofenaco | Reducción en el número de pacientes que se recuperaron y reducción de la escala VAS en el grupo combinación | 66 |
Una mejor evidencia sobre los efectos del complejo TPC como terapia adyuvante en el dolor lumbar proviene inicialmente de 3 ensayos clínicos aleatorizados doble-ciego realizados entre los años 1988 y 2008. En dichos estudios se evaluó la eficacia analgésica de una combinación de dosis fija de diclofenaco+complejo vitamínico B (TPC) frente a diclofenaco sólo, en pacientes con lumbalgia aguda o enfermedades de columna vertebral con cambios degenerativos y dolor. En esos 3 estudios se evaluó el número de pacientes sin dolor a los 3 y a los 7 días, y en uno de ellos a los 24 días del tratamiento, así como diversos parámetros de evaluación del dolor. Los resultados mostraron una diferencia estadísticamente significativa a favor de la combinación diclofenaco/TPC en la reducción de la intensidad del dolor. Asimismo, un número significativamente más alto de los pacientes tratados con diclofenaco y vitamina B experimentaron un inicio más rápido del alivio del dolor en comparación con los pacientes tratados con diclofenaco solo43–45.
Los anteriores resultados fueron corroborados en un estudio de mayor tamaño que incluyó 372 pacientes con lumbalgia66. En dicho estudio, se encontró que el 46,5% de los pacientes que recibieron la combinación presentaron recuperación total a los 3 días, frente al 29,7% de los pacientes tratados con diclofenaco solo (p<0,05). La diferencia en la puntuación de la Escala Análoga Visual al dolor (VAS, por sus siglas en inglés) a favor de la combinación AINE/TPC frente a AINE fue estadísticamente significativa en el día 3 de tratamiento (24,5mm vs. 20,7mm; p=0,044) y también se observó un mayor porcentaje de pacientes con mejoría en la puntuación VAS (63,1% para el grupo AINE/TPC frente al 43,8% para el grupo AINE). Se observó una diferencia de 3cm en pruebas funcionales (Finger to Floor Distance [FFD]) a favor de la combinación al tercer y al quinto día de tratamiento (p<0,001). Una evaluación posterior del mismo grupo observó que la recuperación de la movilidad (mediante escalas funcionales FFD y Schober test) también era mucho mayor en el grupo tratado con la combinación de diclofenaco y complejo vitamínico B128. Asimismo, en un estudio observacional, se encontró que la tasa de recaída de dolor lumbar durante 6 meses de evaluación fue mucho menor en el grupo de pacientes que tomaban la combinación TPC con diclofenaco, en comparación con el grupo diclofenaco solo67. Otros estudios demuestran el papel adyuvante de las vitaminas B junto con AINE en el manejo de radiculopatía lumbosacra, un efecto que fue evaluado por escalas funcionales, VAS y escalas para dolor neuropático36,129.
Con respecto a la monoterapia con vitamina B, 2 estudios reportan efectos beneficiosos de la administración intramuscular de vitamina B12 en el dolor lumbar agudo130 y metilcobalamina en el dolor lumbar crónico inespecífico131. Estudios recientes en animales de experimentación muestran además un potencial papel del ácido fólico en modelos de dolor neuropático132; sin embargo, sus efectos clínicos como monoterapia están por determinarse, así como el de las otras vitaminas del complejo B.
El mejor nivel de evidencia sobre el papel de las vitaminas B como adyuvante analgésico es derivado de un metaanálisis publicado por nuestro grupo este año65. En dicho metaanálisis, se tomaron en cuenta los ensayos clínicos publicados a la fecha en pacientes con dolor lumbar agudo, y además se hizo un análisis de sensibilidad según la calidad y potencial sesgo de los estudios. En dicho metaanálisis se concluye que existe un efecto analgésico superior para la combinación de diclofenaco con el complejo B (TPC) sobre la terapia convencional (monoterapia con diclofenaco) en pacientes con dolor lumbar agudo, o exacerbaciones agudas de la afección crónica, con o sin enfermedad degenerativa de la columna lumbar, pero sin discopatía. Asimismo, el efecto sinérgico de dicha combinación permite a los pacientes reanudar antes sus actividades laborales, contribuyendo a reducir la carga económica de la enfermedad asociada a la incapacidad que genera la lumbalgia. Además, la terapia combinada se asoció con una menor intensidad del dolor y una mayor satisfacción del paciente en una etapa temprana de la enfermedad, con menos reacciones adversas gastrointestinales, probablemente debido a una reducción en las dosis acumuladas de diclofenaco65.
Otras enfermedades osteomusculares y síndromes dolorososA pesar de que el dolor lumbar es una de las enfermedades osteomusculares más comunes, existen otro tipo de patologías que también se caracterizan por presentar dolor agudo o crónico, deterioro funcional y discapacidad, y que también podrían considerarse como un dolor de tipo mixto. Entre ellas destacan la osteoartritis, el dolor posquirúrgico, desórdenes musculoesqueléticos, desórdenes de la articulación temporo-mandibular o dolor articular crónico, entre muchas otros26. Al igual que para el dolor lumbar, el tratamiento empleado para su analgesia comprende un número reducido de medicamentos, incluyendo opioides, analgésicos simples, relajantes musculares y los AINE, los cuales presentan efectos secundarios indeseados, limitando su uso y su administración por periodos prolongados133–135. Asimismo, se ha postulado el papel de los cannabinoides como neuromodulador analgésico, si bien su uso clínico en el dolor osteomuscular todavía se encuentra en estudio136.
Con el fin de optimizar la intervención analgésica en las patologías osteomusculares y evaluar el potencial adyuvante, varios estudios se han centrado en el análisis de las terapias combinadas de las vitaminas B (TPC) con este tipo de medicamentos, para evaluar su potencial como analgésico adyuvante. En el caso de pacientes con osteoartritis severa de rodilla y fractura de miembros inferiores, se han reportado niveles de analgesia más elevados evaluados mediante las escalas VAS y Likert en pacientes que recibían la combinación TPC con diclofenaco en comparación con monoterapia con AINE36,40,137. Magaña-Villa et al. realizaron un estudio que tuvo como objetivo caracterizar el efecto analgésico y la seguridad de la monoterapia con diclofenaco y la combinación entre este medicamento y el complejo de vitaminas B (TPC) en pacientes con osteoartritis severa de rodilla. En este estudio aleatorizado doble ciego, se evaluaron 48 pacientes con un dolor mayor o igual a 7 en la escala VAS, cuyo resultado determinó que la terapia combinada mostró mejores resultados analgésicos tras 12horas de la administración parenteral137. Un efecto similar se evidencia en un estudio prospectivo, aleatorizado y doble ciego realizado por Ponce-Monter et al. en el 2012, en el que se evaluó la eficacia del diclofenaco como monoterapia y en combinación con TPC intramuscular en 122 pacientes quirúrgicos y con dolor agudo producto de fractura de miembros inferiores. La terapia combinada entre diclofenaco y vitaminas del complejo B resultó ser más efectiva en la reducción de este tipo de dolor en comparación con la monoterapia de diclofenaco, según la escala VAS40. Sin embargo, en un estudio piloto con 14 pacientes con fracturas de miembros inferiores, no se encontró diferencias significativas, posiblemente debido al tamaño insuficiente de la muestra138.
En el caso de la combinación de paracetamol con el complejo vitamínico B, un estudio comparativo, doble ciego y aleatorizado determinó su eficacia analgésica en cirugía pediátrica ambulatoria (circuncisión, hernioplastia inguinal, orquidopexia y tonsilectomía). Los tratamientos con paracetamol solo y la combinación de este con vitaminas B resultaron igualmente efectivos en cuanto al alivio de dolor, necesidad de rescate, tiempo de alta y seguridad. No obstante, en el postoperatorio inmediato y en el momento del alta se observó mejor puntuación en la escala de dolor en el grupo que recibió tratamiento adyuvante con las vitaminas B34. A pesar de que este estudio no evaluó sus efectos a nivel osteomuscular, sí permite reconocer el papel potencial adyuvante de las vitaminas B en el manejo del dolor postoperatorio, como ejemplo de dolor mixto.
Por último, en pacientes que presentan fibromialgia, la deficiencia de vitamina B, en especial la B12 y el ácido fólico, se ha asociado con la severidad de los síntomas relacionados con esta patología, en especial, con el dolor musculoesquelético139,140. Asimismo, aquellos pacientes con niveles elevados de homocisteína en el líquido cefalorraquídeo y bajos niveles de cianocobalamina en el cerebro han reportado mayor dolor muscular asociado a la fibromialgia140,141, a diferencia de aquellos a los que se les administró dosis mayores y más frecuentes de estas vitaminas142,143. Finalmente, en el síndrome miofascial (caracterizado por la existencia de puntos sensibles de los músculos que provocan dolor a la presión) se ha reportado una correlación entre los niveles séricos de vitamina B12 y las escalas para evaluar dolor muscular en este tipo de pacientes, de tal manera que menores niveles de dicha vitamina se asocian a mayor dolor144.
ConclusionesLa patología musculoesquelética, en general, y el dolor de espalda, en particular, tienen una alta incidencia y prevalencia en nuestro medio. Las opciones terapéuticas deben enfocarse a ofrecer la mejor optimización del control analgésico y de la rehabilitación funcional de estos pacientes. Según las diversas guías clínicas, los AINE son la primera línea de tratamiento en las presentaciones aguda y subaguda, por encima de los analgésicos simples y otras opciones. Dado que la mayoría de los procesos osteomusculares tienen un componente etiológico basado en el concepto actual de dolor tipo mixto (con componentes nociceptivos, neuropáticos y nociplásticos), es necesario un enfoque terapéutico multimodal basado en diferentes mecanismos de acción (antiinflamatorio, neuromodulador y antinociceptivo).
La evidencia disponible indica que el uso combinado del complejo de vitaminas B1, B6, B12 (TPC) junto con un AINE presenta un efecto adyuvante analgésico beneficioso significativo en la funcionalidad y el dolor osteomuscular, específicamente en la lumbalgia. Esta combinación reduce la dosis total de AINE, haciendo que la terapia combinada complejo B+AINE pueda ser una medida de gran impacto clínico. Los beneficios del complejo TPC pueden estar relacionados con el tratamiento de una carencia basal de vitaminas del complejo B y también pueden ser explicados por sus acciones antiinflamatorias, neuroprotectoras (ayudando a la regeneración neuronal y la mielinización) y neuromoduladoras sobre el sistema descendente del dolor. En el caso de otras patologías musculoesqueléticas asociadas a dolor tipo mixto se requieren más ensayos clínicos que confirmen los beneficios de esta combinación.
FinanciaciónNinguna.
Conflicto de interesesSe ha recibido asesoría científica por parte del medical advisor Francesca Pajuela Lorenzo del Laboratorio Almirall.