El diagnóstico correcto de hipotiroidismo gestacional requiere determinar los intervalos de referencia trimestrales locales de la TSH. En su ausencia las guías recomiendan utilizar como límites superiores 2,5-3,0-3,0μU/ml para el 1.°-2.°-3.° trimestre. Nuestro objetivo es calcular el rango de referencia para nuestra población.
Material y métodosEstudio observacional de base poblacional realizado en gestantes sanas de 11 centros de salud de la provincia de Huelva incluidas consecutivamente durante el año 2016 en el proceso de embarazo. Excluimos las gestantes con antecedentes de enfermedad tiroidea o médica, malos antecedentes obstétricos, embarazo gemelar, autoinmunidad tiroidea y TSH en valores extremos (<0,4μU/ml o>10μU/ml), así como las que durante el estudio iniciaron tratamiento con levotiroxina por disfunción tiroidea.
ResultadosSeleccionamos 186 gestantes de 30,7 años (IC 95%: 29,8-31,6) e IMC de 23,6 (IC 95%: 23,2-24,0) que mayoritariamente se hicieron la 1.ª analítica con anterioridad a la 11.ª semana de gestación. Fueron válidas para el análisis 145-105-67 gestantes en el 1.°-2.°-3.° trimestre, respectivamente, tras excluir sucesivamente abortos (18,9%), autoinmunidad (6,5%), hipo/hipertiroidismos (2,2%) y tratamientos con levotiroxina durante el 2.°/3.° trimestre (18,6%). El percentil 97,5 de la TSH para el 1.°-2.°-3.° trimestre, respectivamente, fue de 4,68-4,83-4,57μU/ml. Durante el estudio se detectaron 80 gestantes con disfunción tiroidea (55,2%), recibiendo 33 de ellas tratamiento con levotiroxina (22,7%); con los nuevos criterios la prevalencia de disfunción tiroidea se reduciría al 6,2% y la necesidad de tratamiento al 4,1%.
ConclusiónEl rango de normalidad de TSH de nuestra población difiere del propuesto en las guías. Un 18,6% de las gestantes fueron tratadas innecesariamente.
The correct diagnosis of hypothyroidism during pregnancy requires knowledge of the local trimester-specific thyrotropin (TSH) reference ranges. When these are not available, the guidelines recommend upper limits of 2.5, 3.0, and 3.0μU/ml for the 1st, 2nd, and 3rd trimesters, respectively. The aim is to establish the reference range for our local population.
Material and methodsA population-based observational study was performed on healthy pregnant women from 11 healthcare centres in the province of Huelva. Women were recruited consecutively during 2016 through the pregnancy process. Women were excluded who had a history of thyroid or medical disease, a poor obstetric history, multiple pregnancy, thyroid autoimmunity, and extreme TSH values (<0.4μU/ml or>10μU/ml), as well as women treated with levothyroxine for thyroid dysfunction.
ResultsThe study included a total of 186 pregnant women, with a mean age of 30.7 years (95% CI: 29.8-31.6) and a body mass index (BMI) of 23.6 (95% CI: 23.2-24.0). Most of them had the first laboratory tests performed before week 11 of pregnancy. Valid subjects for analysis were 145, 105, and 67 pregnant women in the 1st, 2nd, and 3rd trimesters, respectively, after excluding those due to abortion (18.9%), autoimmunity (6.5%), hypo/hyperthyroidism (2.2%), and levothyroxine treatment during the 2nd/3rd trimester (18.6%). The 97.5% TSH percentile for the 1st, 2nd, and 3rd trimester was 4.68, 4.83, and 4.57μU/ml, respectively. Thyroid dysfunction was identified in 80 women (55.2%), 33 of whom received treatment with Levothyroxine (22.7%). With the new criteria, thyroid dysfunction prevalence would be reduced to 6.2%, and the need for treatment to 4.1%.
ConclusionThe reference range for TSH in our population differs from that proposed by the guidelines. Unnecessary treatment was being given to 18.6% of pregnant women.
Durante los últimos años, diferentes sociedades científicas han emitido recomendaciones para el screening, diagnóstico, tratamiento y seguimiento de la disfunción tiroidea durante el embarazo1,2 lo que ha repercutido significativamente en la evaluación habitual de las gestantes tanto en atención primaria como hospitalaria. Muchas de estas recomendaciones se han basado en datos observacionales que relacionan la disfunción tiroidea durante la primera fase de la gestación, con eventos adversos durante el embarazo3, el parto4, el periodo neonatal5 o el deterioro cognitivo durante la infancia6,7. Sin embargo los ensayos clínicos con levotiroxina que han intentado prevenir los eventos adversos detectados en los estudios observacionales no han logrado de forma consistente disminuir estas complicaciones8–10. De hecho, aunque hay unanimidad en tratar el hipotiroidismo clínico gestacional (HCG), no hay el mismo consenso para el tratamiento de las gestantes eutiroideas con hipotiroidismo subclínico gestacional (HSG)11. La diferente precisión diagnóstica, la precocidad del tratamiento y la presencia de autoinmunidad asociada, son factores que se han implicado en la disparidad de resultados y en la heterogeneidad de las recomendaciones12,13.
Para realizar el diagnóstico correcto de hipotiroidismo gestacional es necesario disponer de unos criterios claros sobre el límite superior de la normalidad de la tirotropina (TSH), que difiere según el procedimiento técnico utilizado y características poblacionales tales como la etnicidad, el estado de yododeficiencia, el índice de masa corporal (IMC) o la presencia de autoinmunidad14. La interpretación de los biomarcadores de función tiroidea se dificulta además durante la gestación, dado que esta comporta una serie de cambios funcionales que repercuten en la fisiología de la glándula tiroidea, especialmente el incremento de la concentración sérica de la proteína trasportadora de tiroxina (TBG), cuya síntesis es estimulada por los estrógenos, y la reducción de los niveles de TSH debido al estímulo ligero de los receptores tiroideos por la β-HCG15,16. Hasta ahora las guías habían recomendado que en ausencia de intervalos de referencia específicos por trimestre, este límite fuera de 2,5μU/ml para el 1.° trimestre (1.° T) y de 3,0μU/ml para los trimestres segundo (2.° T) y tercero (3.° T)1,2, si bien recomendaciones recientes basadas en estudios observacionales publicados en diferentes poblaciones, sugieren que el descenso de la TSH durante la gestación no es tan pronunciado y han elevado el umbral de referencia a 4μU/ml, próximo al de la población adulta sana15,16. De hecho, los estudios realizados en España en la última década van en esta línea, aunque la variabilidad reportada es habitual17–23.
Es evidente que al usar un punto de corte de la TSH inferior al recomendable, la población gestante con alguna disfunción tiroidea podría aumentar innecesariamente con todo lo que esto supone (diagnosticar de patológicos casos que no lo son, tratar inadecuadamente, gastos analíticos, de seguimiento durante y posgestación, etc.). Por tanto, una evaluación correcta de la función tiroidea durante la gestación requiere de intervalos de referencia locales por trimestre específicos15, obtenidos con la metodología habitualmente empleada en cada laboratorio24, lo que ha sido el objetivo principal de nuestro estudio.
MetodologíaDiseñoEstudio observacional descriptivo longitudinal de base poblacional realizado en gestantes sanas de 11 centros de salud de la provincia de Huelva. El objetivo principal fue definir los límites de normalidad de la TSH en gestantes de nuestra área sanitaria durante los 3 trimestres del embarazo. Secundariamente hemos analizado la adecuación del diagnóstico y tratamiento de la disfunción tiroidea gestacional tras definir los nuevos límites.
Población y muestraPara obtener una muestra representativa de la población diana se seleccionaron prospectiva y consecutivamente todas las gestantes incluidas en el proceso de embarazo que no cumplían criterios de exclusión y que dieron su consentimiento por escrito para participar en el estudio, desde febrero del año 2016 hasta completar el tamaño muestral prefijado. Participaron 11 centros de salud pertenecientes al Distrito Sanitario de Atención Primaria «Huelva-Costa», asignados al laboratorio de análisis clínicos de referencia en el Hospital Juan Ramón Jiménez de Huelva. La captación la realizó durante la primera visita del Programa de Embarazo el Médico de Familia de la paciente o la matrona asignada al centro con anterioridad a la semana 12 de gestación. La participación en el estudio no conllevó ningún cambio en el procedimiento habitual del proceso de embarazo, ya que el screening de disfunción tiroidea gestacional está incluido protocolizadamente en el mismo.
Se consideraron criterios de exclusión:
- •
Antecedente de enfermedad tiroidea: hipotiroidismo franco o subclínico gestacional o no, tratado en la actualidad o con anterioridad con hormona tiroidea; antecedente de autoinmunidad tiroidea o la presencia de bocio actual determinado por palpación.
- •
Antecedente de enfermedad médica: hipertensión arterial, diabetes mellitus o gestacional, obesidad (IMC>30) o delgadez (IMC<18).
- •
Malos antecedentes obstétricos: abortos reiterados, macrosomas, infertilidad tratada.
- •
Embarazo gemelar.
- •
Criterios de exclusión analíticos: anticuerpos antiperoxidasa (AcTPO) positivos en el 1.° T o la TSH actual en niveles extremos (<0,4μU/ml o>10μU/ml).
Todas las gestantes incluidas recibieron suplementos con ácido fólico durante el 1.° T y se les recomendó una dieta con alto contenido en yodo, añadiéndose suplementos de yodo en las que no realizaban dieta adecuada. A todas las gestantes se les realizó una analítica entre la 9.ª-11.ª semana, 26.ª-28.ª semana y 34.ª-36.ª semana para determinar los parámetros habituales de seguimiento del embarazo junto con su función tiroidea (TSH, T4 libre y T3 libre si TSH<0,4μU/ml con T4L<0,93ng/dl) y, al menos en el primer trimestre AcTPO. Se recomendó a todos los médicos participantes en el estudio no iniciar tratamiento con levotiroxina hasta que la TSH fuera superior a 4μU/ml, si bien la práctica habitual de nuestra área sanitaria era iniciar el tratamiento sustitutivo con levotiroxina al superar los límites recomendados en las guías de referencia para laboratorios que carecieran de límites de referencia locales (TSH>2,5μU/ml en el 1.° T y TSH>3μU/ml en el 2.° T/3.° T)1. Se excluyeron del estudio con posterioridad a su inclusión las gestantes que durante el seguimiento del embarazo y tras realizarse la 1.ª o 2.ª analítica, dejaron de cumplir criterios clínicos por presentar enfermedad médica u obstétrica que precisase tratamiento (levotiroxina, progesterona, hipotensores…), incluyéndose en el análisis estadístico solo la información previa a ser excluidas.
Se calculó el tamaño muestral requerido en 120 gestantes siguiendo las recomendaciones de la Internacional Federation of Clinical Chemistry (IFCC) y el NCCLS para obtener estimaciones no paramétricas fiables de los percentiles de normalidad 2,5 y 97,524,25, incrementándola en un 50% para compensar las pérdidas que se produjeran por tratamiento durante el 2.° T/3.° T, lo que hizo necesario reclutar unas 15 gestantes por cada centro participante.
Procedimiento de laboratorioLas hormonas TSH y T4L y los AcTPO fueron determinados mediante electroquimioluminiscencia en los autoanalizadores Cobas® 8000 módulo e602 de Roche Diagnostics. Los intervalos de referencia empleados en nuestro laboratorio para no gestantes son los siguientes: TSH de 0,27-4,2μU/ml y T4L de 0,93-1,70ng/dl. Para la valoración de los resultados de los AcTPO se emplearon los límites recomendados por el fabricante, considerándose como positivos valores iguales o superiores a 32UI/ml.
Análisis estadísticoPara el análisis de los datos se utilizó el programa estadístico SPSS® v.15.0. Para comprobar la normalidad de la distribución de la TSH y T4L se empleó el test de Kolmogorov-Smirnov. Las variables se expresan como media (intervalo de confianza [IC] del 95%) o mediana (amplitud intercuartílica) en función del tipo de distribución. Para evaluar la asociación entre los valores de los test de función tiroidea y las diferentes variables independientes estudiadas (edad, semana gestacional, IMC, raza y presencia de autoinmunidad) se empleó el test de correlación de Pearson, y para comparar las diferencias entre las distribuciones de la TSH y T4L en los 3 trimestres el test de Friedman. El valor de significación estadística se estableció para una p<0,05. Se definió el intervalo de referencia para cada uno de los test de función tiroidea como el intervalo comprendido entre los percentiles 2,5-97,5 siguiendo las recomendaciones de la IFCC, para lo que previamente se realizó la normalización de la distribución de los niveles de la T4L y TSH mediante su transformación logarítmica25.
Se calculó la incidencia de autoinmunidad tiroidea, hipotiroidismo subclínico gestacional, HCG e hipotiroxinemia gestacional de acuerdo con los límites de referencia actualmente propuestos y con los que derivaron de la investigación realizada. Se calculó el porcentaje de sobrediagnóstico y de sobretratamiento (porcentaje de gestantes diagnosticadas y tratadas respectivamente de disfunción tiroidea con los limites actualmente recomendados, que no lo hubieran sido con los nuevos límites obtenidos).
Aspectos éticosSe aplicaron los principios éticos de la investigación en seres humanos que se recogen en la declaración de Helsinki, actualizada en la asamblea general de Seúl (octubre 2008). Además, se respetó la confidencialidad y secreto de la información de carácter personal siguiendo la ley de protección de datos 15/1999 (BOE 1999, n.° 298). También se ha respetado la autonomía del paciente siguiendo la Ley 418/2002 básica reguladora de la autonomía del paciente y de derechos y obligaciones en materia de información y documentación clínica.
Al tratarse de un estudio de investigación realizado en situación de práctica clínica, no se efectuaron intervenciones en los pacientes diferentes a las que habitualmente reciben para el seguimiento de su embarazo, ya que la determinación de la función tiroidea durante el embarazo está consensuada y protocolizada. No obstante, para el uso y análisis de sus datos personales a todas las gestantes se les solicitó consentimiento para su participación. Se solicitó aprobación por el Comité Ético de Investigación Clínica del centro, así como autorización para la realización a la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS) recibiendo la calificación de No-EPA. El estudio no ha recibido financiación específica.
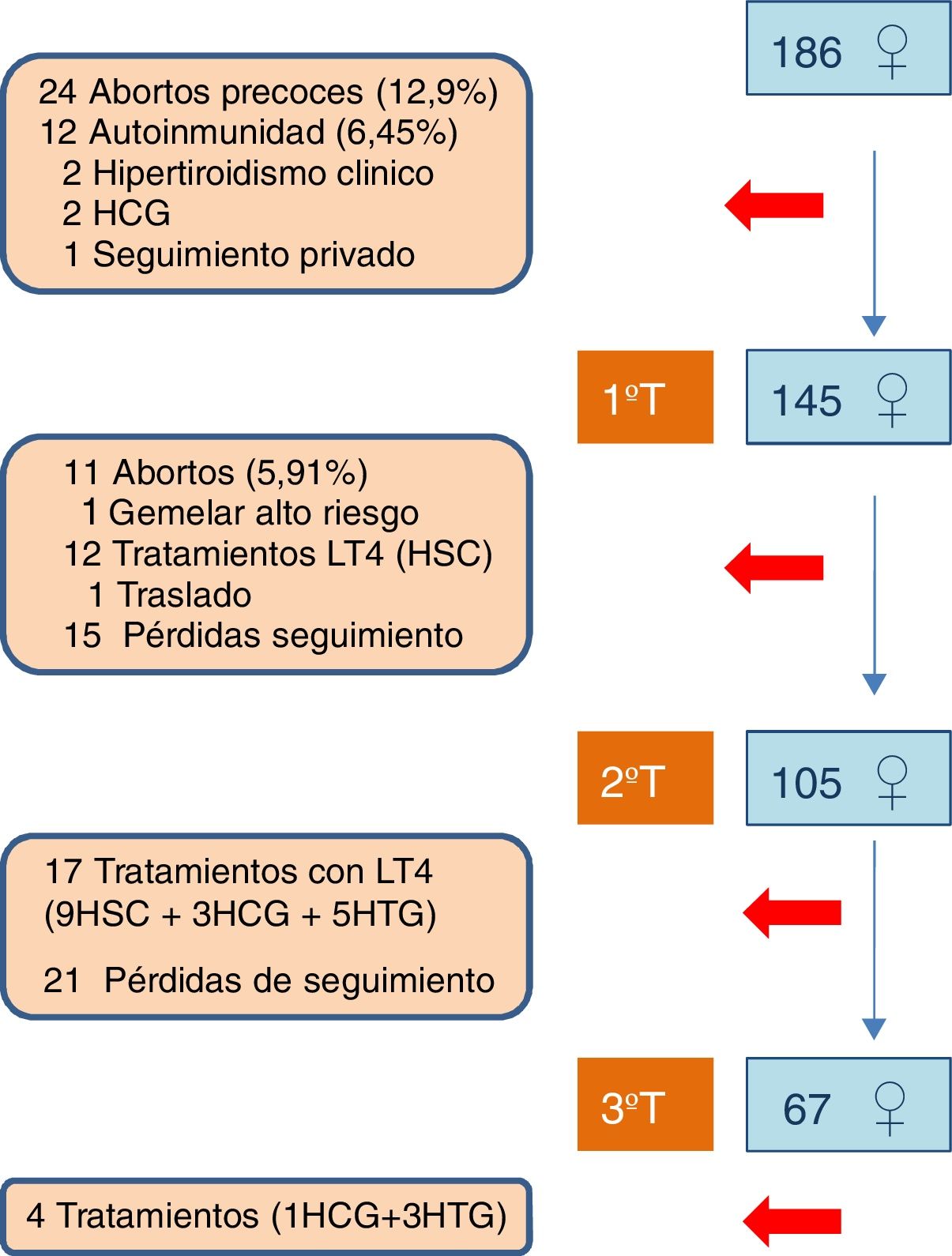
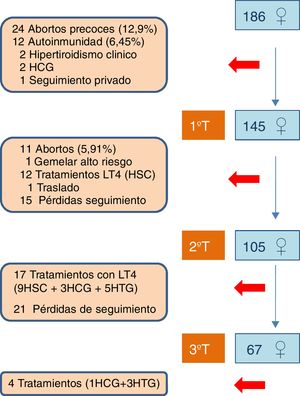
ResultadosSeleccionamos prospectivamente 186 gestantes de 30,7 años de edad media (IC 95%: 29,8-31,6), IMC medio de 23,6 (IC 95%: 23,2-24,0) y en el 97,3% de raza blanca. Fueron válidas para el análisis 145, 105 y 67 gestantes en el 1.°, 2.° y 3.° T, respectivamente, tras excluir sucesivamente las gestantes que abortaron precozmente o en el 2.° T (18,9%), que presentaron anticuerpos anti-TPO (6,45%), hipotiroidismo o hipertiroidismo clínico en el 1.° T (2,2%), o que iniciaron tratamiento con levotiroxina en el 2.° T o 3.° T por hipotiroidismo clínico, subclínico o hipotiroxinemia gestacional (18,6%). Hubo 15 pérdidas de seguimiento en el 2.° T y 21 en el 3.° T de gestantes a las que no se incluyó función tiroidea en la analítica (fig. 1).
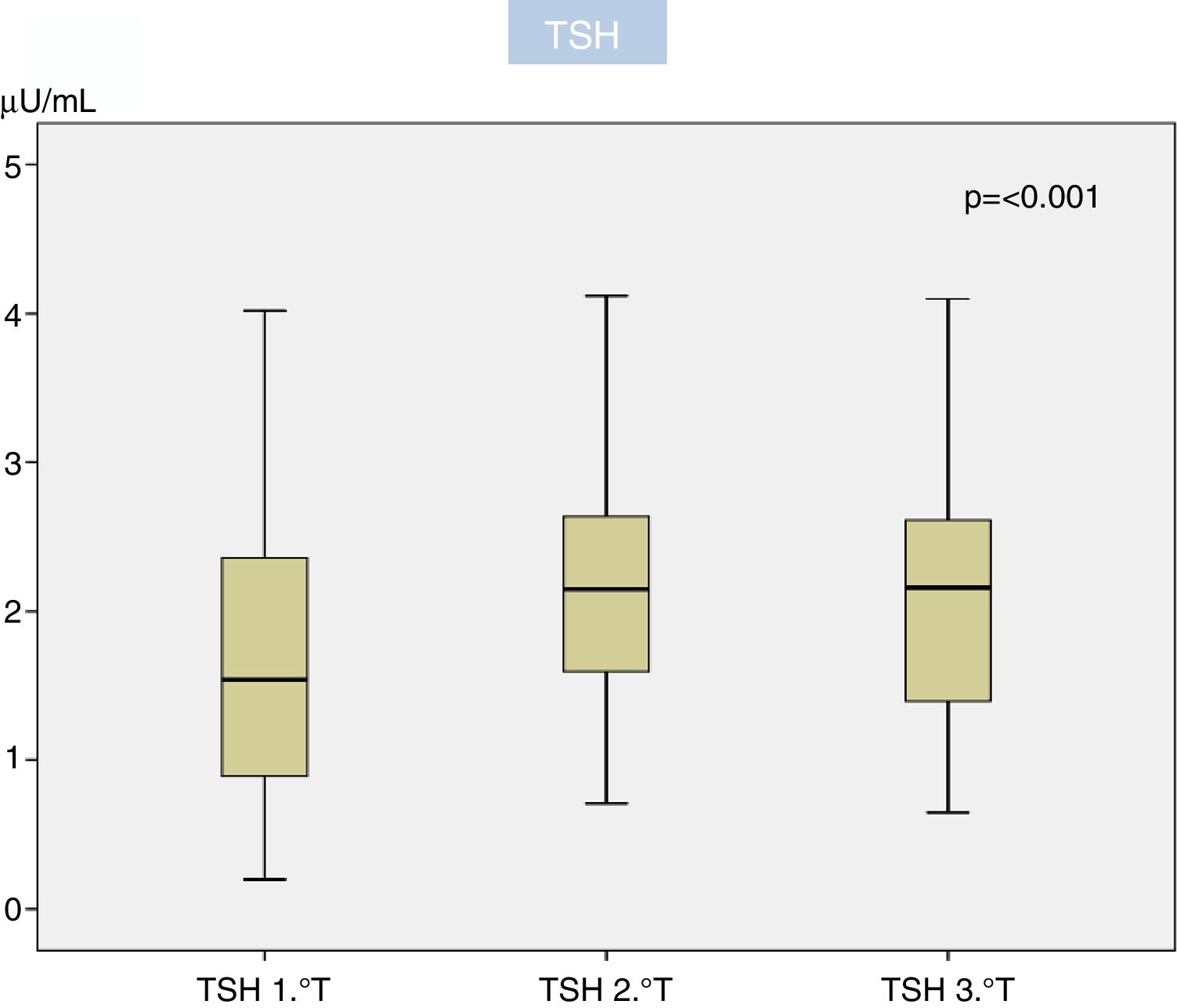
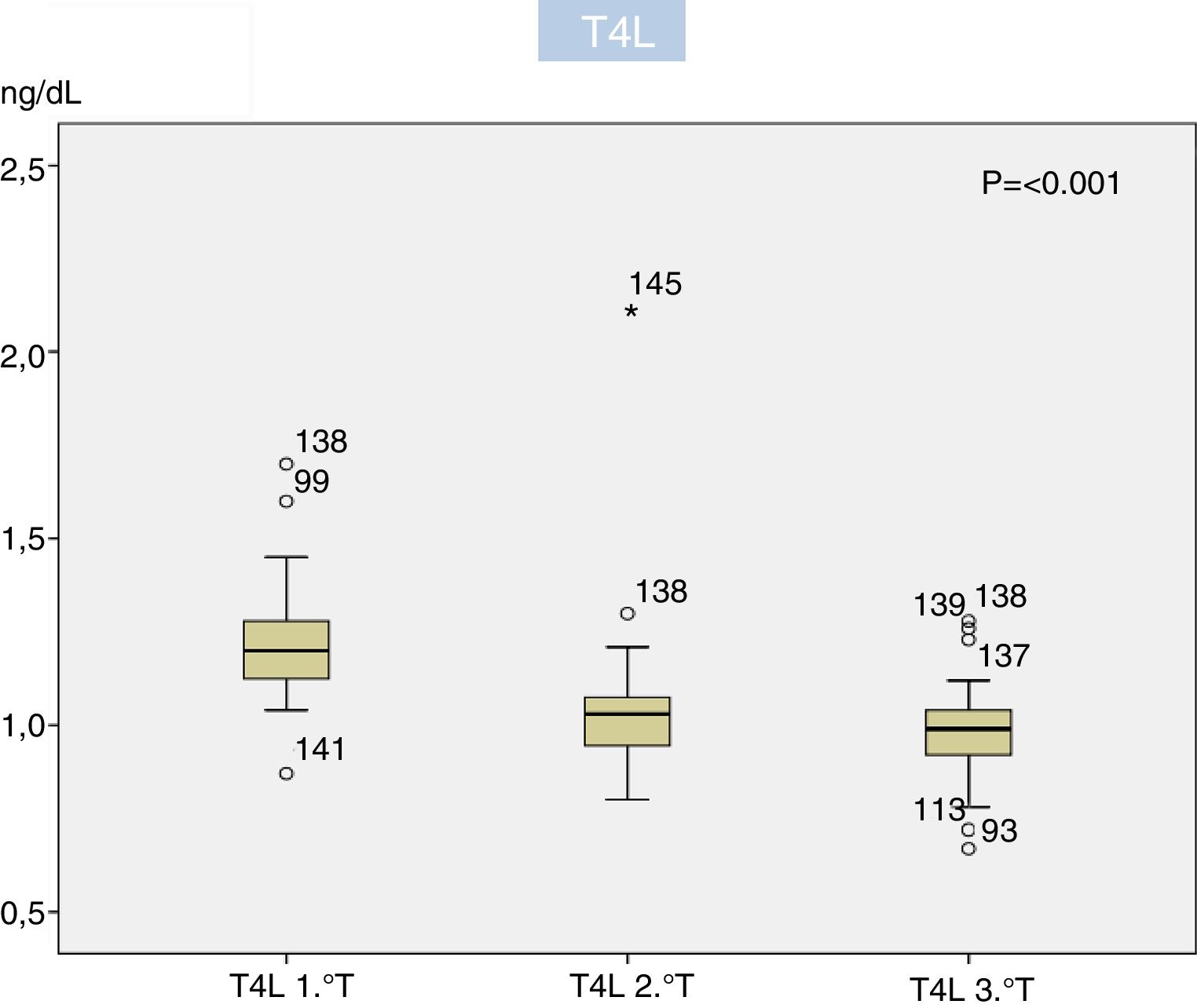
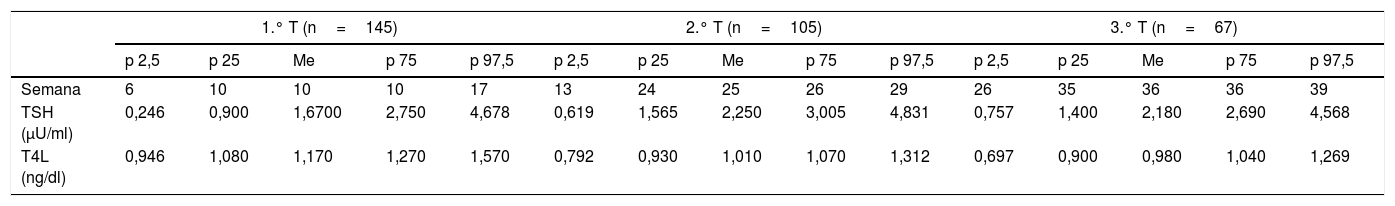
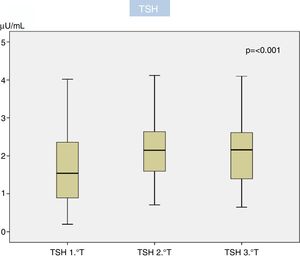
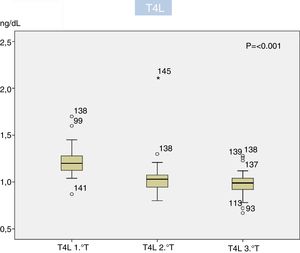
El 95,2% de las gestantes se hicieron la extracción del 1.° T con anterioridad a las 11s de gestación, las del 2.° T antes de las 28s (94,0%) y las del 3.° T antes de la 32s (92,1%). Los valores de TSH (μU/ml) y T4L (ng/dl) en cada trimestre vienen recogidos en la tabla 1. El valor mediano de TSH creció de forma significativa al avanzar la gestación (p<0,001), en tanto que el de T4L disminuyó también significativamente (p<0,001) (figs. 2 y 3). El percentil 97,5 encontrado de TSH para el 1.° T, 2.° T y 3.° T fue de 4,68μU/ml, 4,83μU/ml y 4,57μU/ml (tabla 1). No encontramos correlación entre el nivel de TSH y la edad de la gestante, su IMC o semana de extracción, así como tampoco entre edad y semana de extracción con el nivel de T4; el IMC sí se correlacionó significativamente con el nivel de T4L en el 1.° T (p<0,05) si bien la fuerza de la asociación fue débil (r=0,178) y desapareció en el 2.°/3.° T.
Valores de hormonas tiroideas en los 3 trimestres del embarazo
| 1.° T (n=145) | 2.° T (n=105) | 3.° T (n=67) | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| p 2,5 | p 25 | Me | p 75 | p 97,5 | p 2,5 | p 25 | Me | p 75 | p 97,5 | p 2,5 | p 25 | Me | p 75 | p 97,5 | |
| Semana | 6 | 10 | 10 | 10 | 17 | 13 | 24 | 25 | 26 | 29 | 26 | 35 | 36 | 36 | 39 |
| TSH (μU/ml) | 0,246 | 0,900 | 1,6700 | 2,750 | 4,678 | 0,619 | 1,565 | 2,250 | 3,005 | 4,831 | 0,757 | 1,400 | 2,180 | 2,690 | 4,568 |
| T4L (ng/dl) | 0,946 | 1,080 | 1,170 | 1,270 | 1,570 | 0,792 | 0,930 | 1,010 | 1,070 | 1,312 | 0,697 | 0,900 | 0,980 | 1,040 | 1,269 |
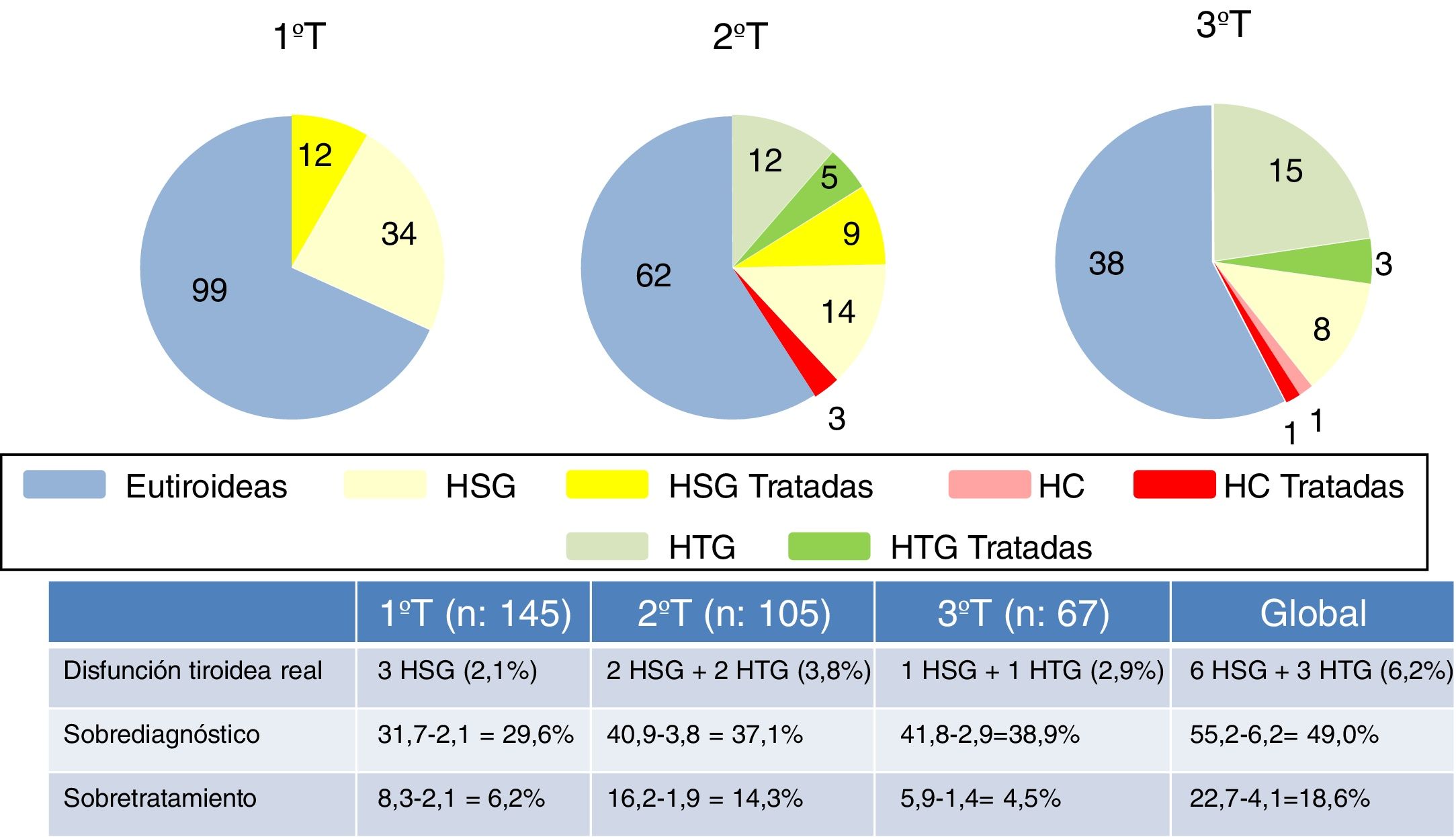
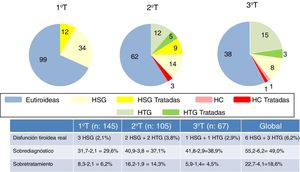
A lo largo del embarazo un 55,2% de las gestantes fue diagnosticada en algún momento de disfunción tiroidea clínica o subclínica en uno o varios trimestres: 4 HCG (2,8%), 55 HSG (37,9%) y 21 HTG (14,5%); con los nuevos criterios solo se habría detectado disfunción tiroidea en el 6,2% de las gestantes, 6 HSG (4,1%) y 3 HTG (2,1%), lo que implica un índice total de sobrediagnóstico del 49,0%. Al terminar el 1.° T se habían detectado 46 HSG (31,7%), iniciando tratamiento con levotiroxina 12 gestantes (8,27%). La media de la TSH con la que se inició tratamiento fue de 4,55μU/ml (IC 95%: 3,75-5,35μU/ml). Con los nuevos criterios solo 3 de ellas habrían sido subsidiarias de tratamiento por HSG. Tras el 2.° T se detectaron 23 HSG (21,9%) con los antiguos criterios, iniciando tratamiento 9 de ellas (8,57%), y 3 HCG (2,85%) que también iniciaron tratamiento. La media de la TSH con la que se instauró fue de 4,65μU/ml (IC 95%: 3,84-5,46μU/ml). Cinco gestantes con HTG de las 17 detectadas también iniciaron tratamiento. Con los nuevos criterios solo 2 HSG deberían haberlo recibido y de los 3 HCG solo uno tendría una HTG. Al final del 3.° T se detectaron 2 HCG (3%) y 8 HSG (11,9%) iniciándose tratamiento en solo una de las gestantes con HCG; con los nuevos criterios solo habría sido necesario en una con HSG. De nuevo recibieron tratamiento otras 3 gestantes con HTG entre las 18 detectadas.
En total recibieron tratamiento 21 gestantes con HSG, 4 con HCG y 8 por HTG sin claros fundamentos (22,7%), que con los nuevos criterios se habrían limitado a 6 por HSG (4,1%). Los índices de sobrediagnóstico y sobretratamiento de cada trimestre se reflejan en la figura 4.
DiscusiónNuestro estudio pone de manifiesto una vez más la necesidad de determinar el rango local de normalidad de la TSH durante la gestación estratificado por trimestres, ya que los valores suministrados por el laboratorio o las referencias genéricas de las guías difieren de la situación local, lo que tiene gran trascendencia en el cribado y el control de la disfunción tiroidea gestacional para evitar una clasificación incorrecta. En nuestro caso, tras excluir las gestantes con enfermedad que pudiera condicionar disfunción tiroidea, hemos encontrado un nivel superior de la TSH para el 1.° T de 4,678μU/ml, para el 2.° T de 4,831μU/ml y para el 3.° T de 4,568μU/ml, muy superior al que veníamos usando (2,5μU/ml), y más acorde con el recientemente propuesto por algunas guías15,16.
Los resultados son similares a los que se han publicado en otras provincias españolas, donde si bien la variabilidad es la norma, el límite superior de la TSH para el 1.° T oscila entre 3,6 y 5,7μU/ml18-23. Tan solo el estudio realizado en Aragón que reportó un límite del 1.° T algo inferior (2,65μU/ml)17 se escapa de este intervalo. En cambio los resultados publicados en Cataluña (5,76μU/ml)18, El Bierzo (3,59μU/ml)19, Cartagena (3,71μU/ml)20, Jaén (4,18μU/ml)21, Asturias (4,15μU/ml)22, Valladolid (4,05μU/ml)23 y los nuestros, son claramente superiores a 2,5μU/ml. Son muchas las razones que pueden explicar esta variabilidad empezando por la técnica analítica, las diferencias étnicas, la edad gestacional, la presencia de autoinmunidad tiroidea y el estado de yododeficiencia14. El mencionado estudio de Aragón17 incluyó además gestantes con enfermedad de base sistémica o tiroidea, y no excluyó a las que recibían tratamiento con levotiroxina, circunstancias ambas que pueden haber disminuido los valores de TSH detectados durante la gestación.
En nuestro caso, con una población mayoritariamente de raza blanca, con edad gestacional similar en el 1.° T y anterior a la 11.ª semana de gestación, y tras excluir las gestantes con autoinmunidad tiroidea, que habían recibido, recibían o iniciaron tratamiento con levotiroxina al principio del 2.°/3.° T, pensamos que la principal explicación a este hallazgo puede ser la deficiencia nutricional de yodo. Este dato no es constatable en nuestro estudio al no haberse evaluado la yoduria, si bien se excluyeron por medios clínicos las gestantes con bocio, circunstancia habitualmente asociada a deficiencia de yodo. Tampoco disponemos de estudios locales que evalúen el nivel de yododeficiencia en la población general ni en las embarazadas, pero es razonable pensar que debe ser deficitario de forma similar al de áreas sanitarias próximas a la nuestra26. Aunque es cierto que en las gestantes en que se sospechó déficit nutricional de yodo se estimuló activamente dicha ingesta o se prescribieron suplementos de yodo a lo largo del embarazo, los efectos beneficiosos de la suplementación yodada sobre la función tiroidea materna parecen depender más del inicio pregestacional que de las dosis o formas de incrementar la ingesta de yodo en la mujer gestante27. Es recomendable, no obstante, y a la luz de nuestros resultados efectuar una evaluación poblacional del estado nutricional de yodo en nuestra área sanitaria.
Hemos encontrado una progresiva elevación de la TSH durante el embarazo, lo que concuerda con los estudios fisiológicos28,29 y los datos de estudios nacionales revisados17,18,21, si bien el valor mediano de TSH durante el 3.° T es algo menor que en el anterior. Al tratarse de un estudio realizado en situación de práctica clínica habitual, un 8,3% de las gestantes durante el 2.° T y un 14,3% durante el 3.° T iniciaron tratamiento con levotiroxina, mayoritariamente por sospecha de HSG con los criterios antiguos (TSH>2,5μU/ml en el 1.° T o>3μU/ml en el 2.° T/3.° T con T4>0,94ng/dl). Sus valores de TSH se tuvieron en cuenta para la evaluación de la TSH durante los trimestres previos a iniciar el tratamiento sustitutivo, pero no para los siguientes trimestres. Como consecuencia de esto el estudio ha perdido cierta potencia para estimar el límite de la TSH en el 2.° T y en el 3.° T, parcialmente compensado al aumentar el tamaño de la muestra inicial. Este proceso de selección explica también la reducción del nivel de la TSH en el 3.° T, debido a que las gestantes con TSH alta han tendido a estar infrarrepresentadas, ya que al iniciar tratamiento con levotiroxina eran excluidas progresivamente del análisis. En cualquier caso, y a la luz de las recientes investigaciones5,9,10, la detección y el tratamiento de la disfunción tiroidea gestacional debe realizarse precozmente en el 1.° T o incluso en el periodo pregestacional, para obtener resultados favorables en el desenlace del parto y en el desarrollo neurocognitivo del feto, lo que era el objetivo principal de nuestro estudio y al que creemos hemos dado respuesta.
Una consecuencia directa de nuestro estudio ha sido el análisis retrospectivo de la población estudiada a la luz de los nuevos criterios diagnósticos locales definidos a partir de nuestros datos. Más de la mitad de las gestantes (55,2%) recibió un diagnóstico analítico de disfunción tiroidea en alguno de los 3 trimestres con los criterios antiguos, siendo el sobrediagnóstico progresivamente mayor conforme avanzaba el embarazo, predominando los diagnósticos erróneos de HSG al principio y los de HTG al final del embarazo. De hecho las 2 gestantes excluidas para el análisis del 1.° T por HCG, con los nuevos criterios pasarían a tener «solo» una HTG. Aplicando los nuevos criterios solo habrían presentado disfunción tiroidea exclusivamente subclínica el 6,2% de las gestantes, una prevalencia más acorde con la descrita en la literatura22,23. La recomendación de no iniciar tratamiento hasta alcanzar un umbral de TSH>4μU/ml, evitó probablemente pero no siempre, que el tratamiento innecesario fuera mayor. Con los nuevos criterios solo 6 (4,1%) de las gestantes deberían haber sido tratadas por HSG; aun así recibieron tratamiento 33 gestantes (22,8%), la mayoría por HCG o HSG (17,3%) pero también por HTG (5,5%), lo que implica un sobretratamiento en 27 de ellas (18,6%).
Nuestro estudio confirma igualmente el descenso significativo de la T4 a lo largo de la gestación acorde con los estudios consultados17,18,21, de significado incierto y probable origen multifactorial28,29. Utilizando el percentil 2,5 de los resultados de nuestro trabajo solo 2 gestantes habrían presentado HTG en el 2.° T y una en el 3.° T, en contraste con las 17 y 18 que se detectaron respectivamente en dichos trimestres, lo cual es de gran importancia si tenemos en cuenta que 9 de ellas recibieron tratamiento de dudosa utilidad.
El porcentaje de gestantes con autoinmunidad tiroidea (6,4%) encontrado ha sido menor que el de otros trabajos publicados en nuestro país17,18,22,23,30, pero similar al de áreas sanitarias próximas20,21, lo que probablemente refleja la influencia de la etnicidad en la autoinmunidad y los criterios de selección rigurosos de nuestra muestra que impidieron la participación de pacientes con disfunción tiroidea conocida previa.
ConclusionesEl rango de normalidad de la TSH durante el 1.° T en las gestantes sanas sin autoinmunidad tiroidea de nuestra área sanitaria es de 0,246-4,678μU/ml, superior al recomendado hasta ahora para el diagnóstico de disfunción tiroidea durante la gestación. La utilización de los rangos de referencia recomendados en las guías provoca errores de clasificación y tratamientos innecesarios en las gestantes, lo que no solo incrementa la sobrecarga asistencial y el coste sanitario, sino que puede generar riesgos añadidos a la gestación y además repercutir psicológicamente en la gestante.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
A Carmen Marín Sánchez (CS Molino de la Vega), M. Soledad Gómez Rodríguez (CS La Orden y CS Casa del Mar), Rocío Pujazón Rodríguez (CS Isla Chica y CS Rosales), Juan Diego González (CS Lepe y CS Cartaya), Carmen Cartés (CS Moguer), María Suárez Pérez (CS Gibraleón) y Amalia Filella Sierpes (CS Bollullos).