Describir los resultados de la implantación del programa piloto, en la comunidad de Castilla y León, del cribado de cáncer colorrectal (CCR) mediante la detección de sangre oculta en heces utilizando una prueba inmunológica cuantitativa de aglutinación en látex (TSOHi).
MétodosPoblación diana de 4.930 personas entre 50-69 años de la zona básica de salud de Medina del Campo. A los que presentaron TSOHi positivo se les realizó colonoscopia. Se calcularon tasas de participación, positividad, aceptación de colonoscopia, detección de lesiones, porcentajes y valor predictivo positivo (VPP) de la prueba.
ResultadosLa tasa de participación fue de 2.241 personas (46.33%). Los TSOHi positivos fueron 138 (6,15%). La tasa de aceptación de la colonoscopia fue del 99,27%. Se detectaron 12 pacientes con CCR (el 91,66% en estadios precoces), 42 con adenoma de alto riesgo (AAR) y 34 con adenoma de bajo riesgo (ABR). Las tasas de detección fueron para el CCR de 5,35‰, para el AAR de 18,74‰, para el ABR de 15,17‰ y del 39,26‰ para todo tipo de adenoma. El VPP fue del 8,69% para el CCR, del 30,43% para el AAR y del 24,63% para el ABR.
ConclusionesEl programa de detección de CCR es factible en nuestro contexto. Los indicadores del TSOHi son superiores a los de otros estudios realizados con pruebas clásicas. Las altas tasas de detección de CCR y de todo tipo de adenoma justificarían por sí solas el estudio. Estas, junto con la precocidad del diagnóstico de CCR, harían posible anticipar una reducción de la mortalidad.
To describe the results of implementing a pilot screening program, in the Castilla y León, for colorectal cancer (CRC) with the faecal occult blood test (iFOBT) using a quantitative immunological latex agglutination assay.
MethodsThe study population included 4930 persons between 50-69 years from the Basic Health Area of Medina del Campo. Colonoscopy was performed on those who had a positive iFOBT. The rates of participation were calculated, positivity, acceptance of colonoscopy, detection of lesions, percentages and predictive positive value (PPV) of the test.
ResultsA total of 2241 (46.33%) people took part. There were 138 (6.15%) positive iFOBT. The rate acceptance of the colonoscopy was 99.27%. CRC was detected in 12 patients (91.66% in early stages), a high risk adenoma (HRA) in 42, and a low risk adenoma (LRA) in 34. The rates of detection were for CRCwas 5.35‰, 18.74‰ for HRA, 15.17‰ for LRA, and 39.26‰ for all kinds of adenoma. The PPV was 8.69% for CCR, 30.43% for HRA and 24.63% for LRA.
ConclusionsThe CRC screening program is feasible in our context. The iFOBT indicators are superior to those of other studies performed using the classic test. The high rates of detection of CRC, and all kinds of adenoma would be enough to justify the study. These together with the diagnosis of CRC in the early stages could lead to a reduction of the mortality.
El cáncer colorrectal (CCR) ocupa el segundo lugar en incidencia y en mortalidad en los países desarrollados1. Sigue una tendencia temporal ascendente, con un incremento medio del 2,6% anual2. La supervivencia del CCR ha mejorado en los últimos años, siendo a los 5 años del 49,5% para el de colon y del 43% para el de recto. Estando relacionada con la precocidad en el diagnóstico, siendo del 95-100% a los 5 años en casos localizados y del 5-15% si hay metástasis3.
La prevención secundaria contempla las estrategias de cribado o screening y tiene como objetivo identificar individuos asintomáticos con lesiones precancerosas o en una fase inicial4.
Se han propuesto diferentes herramientas para el cribado del CCR. La detección de sangre oculta en heces (SOH) es la más utilizada. Existen diversos métodos, siendo el más empleado el del guayacol; recientemente han aparecido varios métodos inmunológicos de detección de SOH basados en la detección de hemoglobina humana mediante anticuerpos específicos (TSOHi). Este tipo de pruebas posee diversas ventajas en relación con la del guayacol: mayor sensibilidad y especificidad5, mayor aceptación, un mayor índice de participación6, y mayor efectividad7.
El cribado poblacional realizado en el Reino Unido con SOH mediante el método del guayacol ha demostrado una participación del 49,6% en varones y del 54,4% en mujeres, siendo la tasa de positividad del 2,5 y del 1,5%, respectivamente; la detección de adenomas avanzados del 43 y del 29%, y la del CCR del 11,6 y del 7,8%8. La mayoría de los tumores (71%) correspondía a lesiones precoces (estadio 0-II), siendo estos resultados muy similares a anteriores9,10, siendo posible anticipar una reducción de la mortalidad por CCR del 16%11.
En España la prevención del CCR es una prioridad acordada en la Estrategia del Cáncer del Sistema Nacional de Salud y fue aprobada por el Consejo Interterritorial (en octubre de 2009)12. Se recomienda un cribado poblacional con SOH entre los 50 y 69 años.
En nuestro entorno se han realizado múltiples cribados poblacionales, la mayoría utilizando TSOH clásicos y TSOHi cualitativos, presentando unas tasas de positividad entre 1,6 y el 3%, similar a los estudios internacionales13,14.
En España, en el año 2010 se comienzan a utilizar de forma piloto los TSOHi cuantitativos15,16. La finalidad de nuestro estudio es describir los resultados del proyecto piloto, en Castilla y León, de detección de SOH mediante TSOHi cuantitativo, haciendo una aproximación a la prevalencia del adenoma en nuestra población.
Material y métodosEl programa de cribado de CCR mediante TSOHi cuantitativo de la Junta de Castilla y León se implantó, de forma piloto, en nuestra zona básica de salud (ZBS) en marzo de 2010, fundamentado en los objetivos del «III Plan de Salud de Castilla y León», las recomendaciones de la Unión Europea17 y la «Estrategia Nacional del Cáncer»18.
La población diana estaba constituida por 4.930 personas de edades entre los 50 y 69 años. Se obtuvo utilizando el registro de tarjetas sanitarias de la ZBS que supuso 4.730 personas, a las que se invitó a participar mediante una carta personalizada remitida a su domicilio. A los que se añadieron 200 captadas activamente en consulta y no incluidas previamente en el registro, por las lógicas variaciones poblacionales a lo largo del tiempo del estudio.
El estudio se realizó durante 15 meses, los comprendidos entre marzo de 2010 y junio de 2011. Los datos han sido analizados con el programa estadístico SPSS versión 19.0, se ha analizado la asociación de las variables cualitativas mediante el test de la ji al cuadrado de Pearson, y si los valores esperados eran menores de 5 el test exacto de Fischer o el test razón de verosimilitud. Las comparaciones de valores cuantitativos se han realizado con la prueba t de Student para muestras independientes. Se ha realizado la prueba de Kolmogorov-Smirnov para comprobar la normalidad de variables.
Los pacientes que aceptaron la invitación acudieron al centro de salud (CS) donde se excluyeron aquellos con otros factores de riesgo de CCR diferentes a la edad. Se aportó material e instrucciones para la realización de la prueba a 2.241 pacientes que sería recogida en el CS en un lugar determinado para tal fin. Si el resultado era positivo se les informaría por teléfono en un plazo inferior a 3 semanas, en caso contrario había sido negativo. Los casos positivos debían acudir al CS donde su médico les informaría de la conveniencia de la colonoscopia, explicaría la exploración y recomendaciones de la preparación correcta y el paciente pudiera tomar una decisión informada y firmara la autorización.
La prueba de cribado utilizada fue la de OC sensor μ®: prueba inmunológica de detección específica de hemoglobina humana (SOHi) mediante inmunoturbidimetría de aglutinación en látex con lectura de reacción en términos de diferencia de densidad óptica a una longitud de onda de 660nm, con un punto de corte positivo superior a 100 ng/ml de hemoglobina (sensibilidad del 76,5% y especificidad del 95,3%)19.
La colonoscopia se realizó en el servicio de Digestivo del Hospital de Medina del Campo, en un plazo inferior al mes. Se intentó realizar una colonoscopia completa, se realizó polipectomía recuperando el mayor número posible de las mismas. Se tomaron biopsias en todos los casos de lesiones sospechosas de CCR o de pólipos no susceptibles de tratamiento endoscópico.
Los pólipos adenomatosos se clasificaron según los criterios de la OMS20 en 2 grupos: ABR y AAR. Se consideraron AAR cuando se cumplía al menos uno de los siguientes criterios: tamaño mayor o igual a 10mm, presencia de componente velloso y/o displasia de alto grado o carcinoma in situ. Se consideró pólipo maligno o adenoma con carcinoma invasivo cuando el tejido neoplásico infiltraba la submucosa. Los CCR se clasificaron según el TNM21 en 2 grupos, uno de lesiones en estadios precoces (0-II) y otro de lesiones en estadios avanzados (III-IV).
Se realizó el estudio descriptivo de los valores obtenidos. Los indicadores utilizados: tasa de cobertura, se definió como el porcentaje de invitaciones válidas tanto por carta como por captación activa del total de invitaciones; tasa de participación, se calculó como el porcentaje de participantes con pruebas realizadas del total de personas con invitación; tasa de positividad de la prueba correspondía al porcentaje de personas con resultado positivo, con respecto al número de participantes con prueba realizada; tasas de detección de lesiones precursoras y cánceres invasivos se expresaron en tanto por mil, y estaban representadas por el número de personas con lesiones precursoras y/o cánceres con respecto al total de participantes con prueba realizada. También se calculó el VPP del TSOHi como indicador de calidad del programa.
ResultadosLa población diana fue de 4.930 personas: 4.730 mediante carta personalizada y 200 mediante captación activa.
Fueron devueltas 94 cartas. Definitivamente el número de participantes fue de 4.836, cobertura del 98,09%, muy parecida a la de otros trabajos13,14.
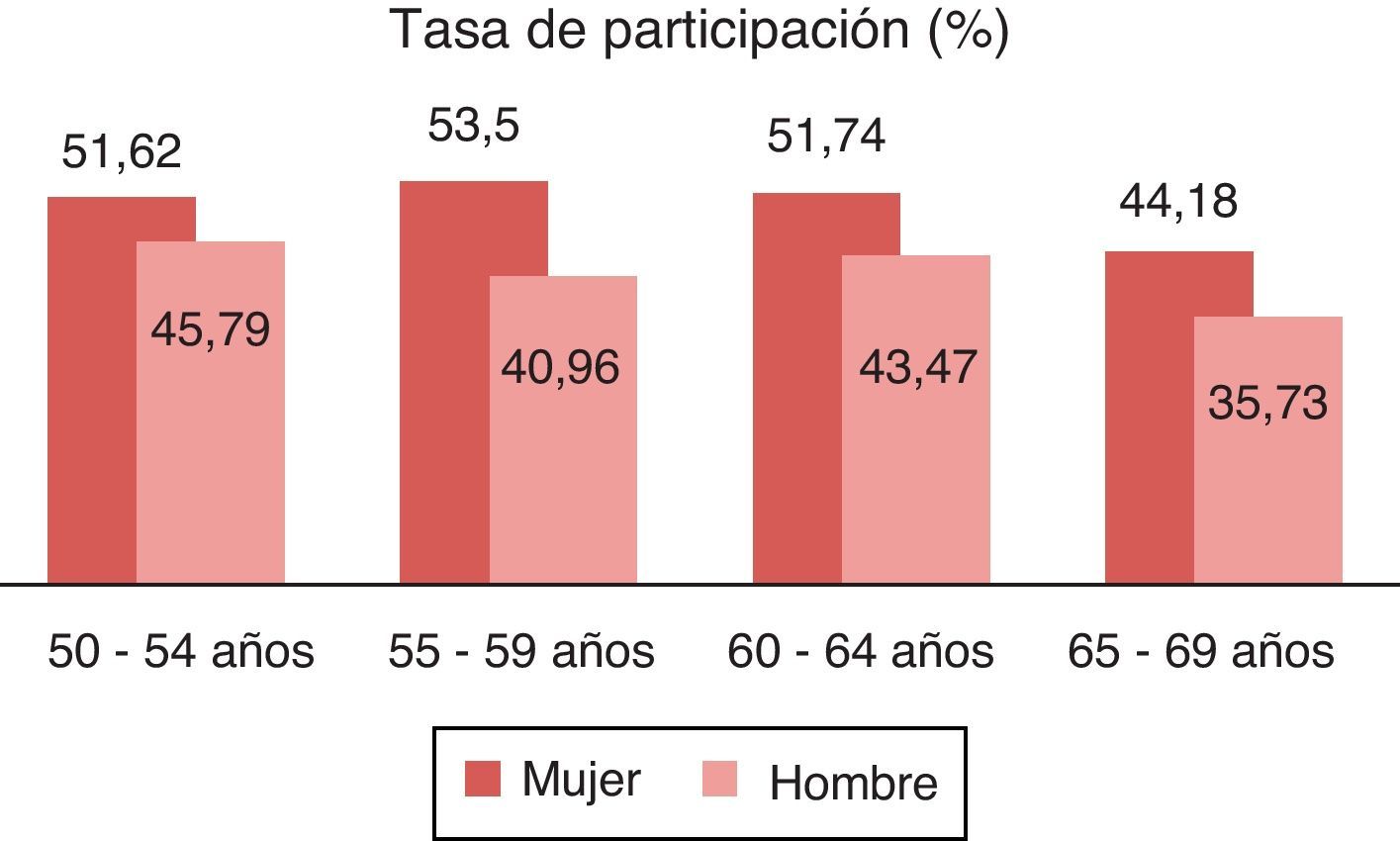
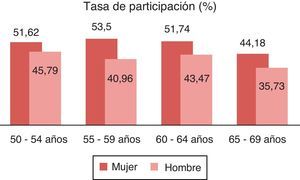
De los 4.836 participantes, 2.394 eran varones y 2.442 mujeres. Realizaron el cribado 2.241 personas, la tasa de participación fue del 46,33%, de ellos 1.007 eran varones (44,93%) y 1.234 mujeres (55,06%), superior a la de otros trabajos13,15,22. Se constata que la participación de las mujeres es superior a la de los hombres (p<0,001) y que la participación es de más jóvenes en mujeres que en hombres (valor p=0,0003). La tasa de participación por edades se muestra en la figura 1.
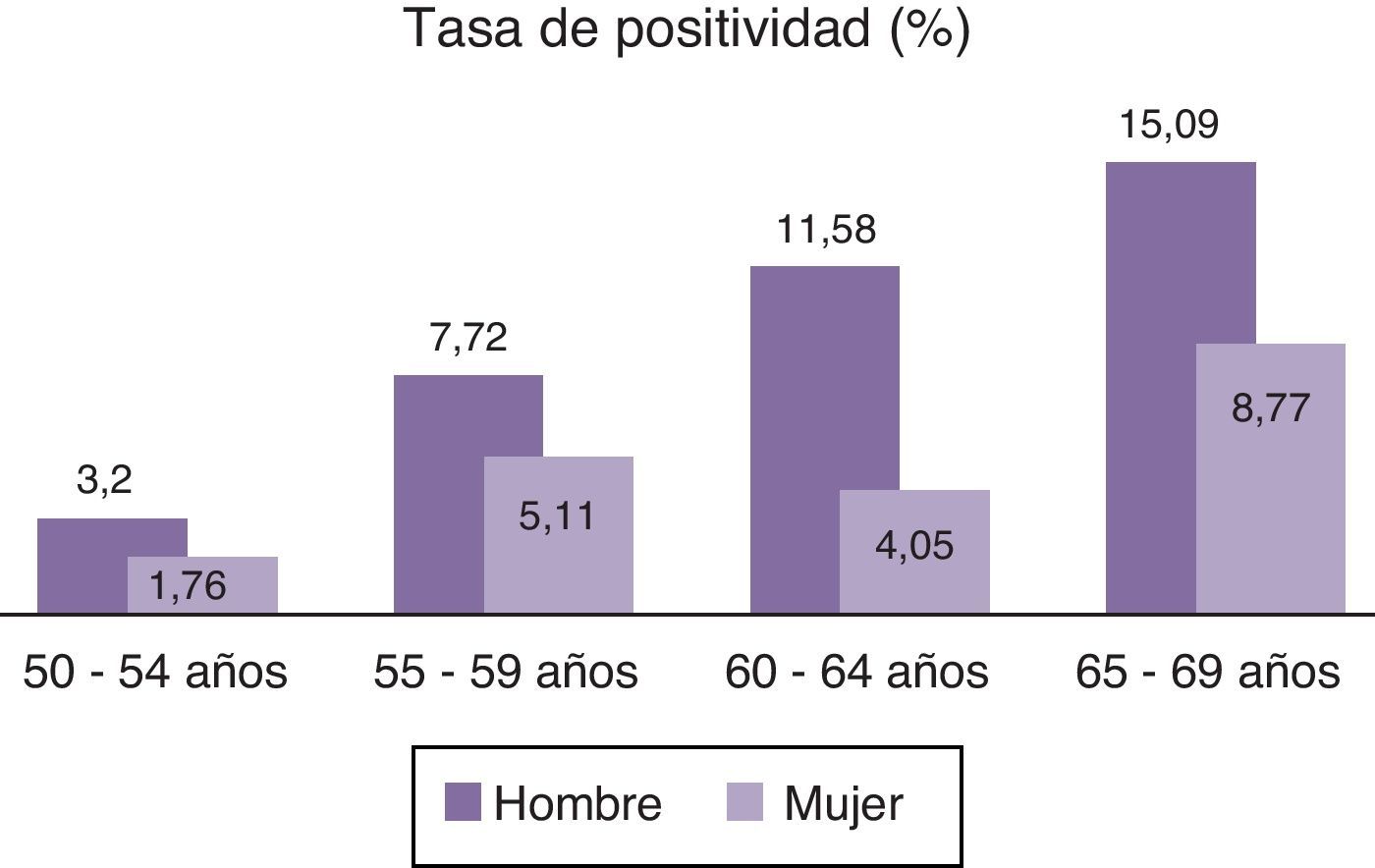
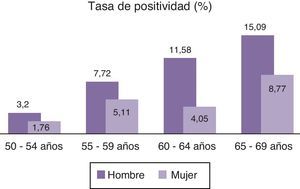
Resultaron positivas 138 TSOHi, encontrándose los valores positivos entre 100 y 2.630, media de 564,29 y desviación estándar de 547,86. La tasa de positividad fue del 6,15%, una alta tasa si lo comparamos con otros trabajos15,22. De las pruebas positivas 83 fueron hombres y 55 mujeres siendo las tasas de positividad respectivamente de 8,24 y 4,45%, resultados que casi triplican los de otros estudios realizados con TSO clásicos8,9,13, y que duplican los de TSOHi15. Las tablas de positividad por edades y sexos se muestran en la figura 2.
Realizaron la colonoscopia 137 pacientes, con una tasa de aceptación del 99,27% (tabla 1).
Resultados de la colonoscopia
| 88 pacientes presentaban lesiones polipoides |
| 12 con alta probabilidad de malignidad |
| 1 con malignidad incierta |
| 75 con alta probabilidad de benignidad |
| 38 pacientes presentaban lesiones diverticulares |
| 7 como única lesión |
| 3 asociadas a enfermedad inflamatoria |
| 2 eran sugerentes de enfermedad de Crohn |
| Uno era indicativo de colitis ulcerosa |
| Un paciente presentaba diverticulitis aguda |
| 27 se asociaban a otras enfermedades |
| 30 pacientes presentaban pólipos hiperplásicos |
| 8 como lesión única |
| 22 asociados a otras enfermedades |
| 44 pacientes presentaban hemorroides |
| 12 como lesión única |
| 32 asociados a otras enfermedades |
| 17 pacientes presentaban colonoscopia normal |
| 1 sangrado que obligó a ingreso hospitalario |
Los resultados anatomopatológicos de las muestras enviadas fueron los siguientes:
- •
Qince diagnosticadas como cáncer (3 del mismo paciente).
- •
Se analizaron 226 pólipos no cancerígenos: 189 tubulares (83,6%), 31 tubulovellosos (13,7%) y 6 vellosos (2,7%). En el 74,8%(169) de los casos el grado de displasia era leve-moderada y un 25,2%(57) presentaban displasia grave. El tamaño oscilaba entre 2 y 30mm presentando una media de 7,5±4,8mm. En relación con la displasia, sería de 6,5±3,9mm para la leve-moderada y de 10,1±6,3mm en la displasia severa (p=0,001, prueba t de Student).
- •
Se informaron de otras enfermedades:
- ∘
Seis colitis inespecíficas.
- ∘
Dos angiodisplasias.
- ∘
Un hamartoma.
- ∘
Un leiomioma.
- ∘
Se dispuso de información completa de 137 colonoscopias con sus respectivos estudios anatomopatológicos cuyos resultados finales fueron:
- •
Doce pacientes fueron diagnosticados de cáncer (8,75%).
- •
Presentaban adenomas 76 (55,57%): 34 ABR (24,81%) y 42 AAR (30,65%).
- •
Presentaban enfermedad no neoplásica 32 (23,35%): 8 pólipos hiperplásicos, 7 enfermedad diverticular, 3 enfermedad inflamatoria, una angiodisplasia de colon, 12 hemorroides, un sangrado.
- •
17 pacientes no presentaban enfermedad.
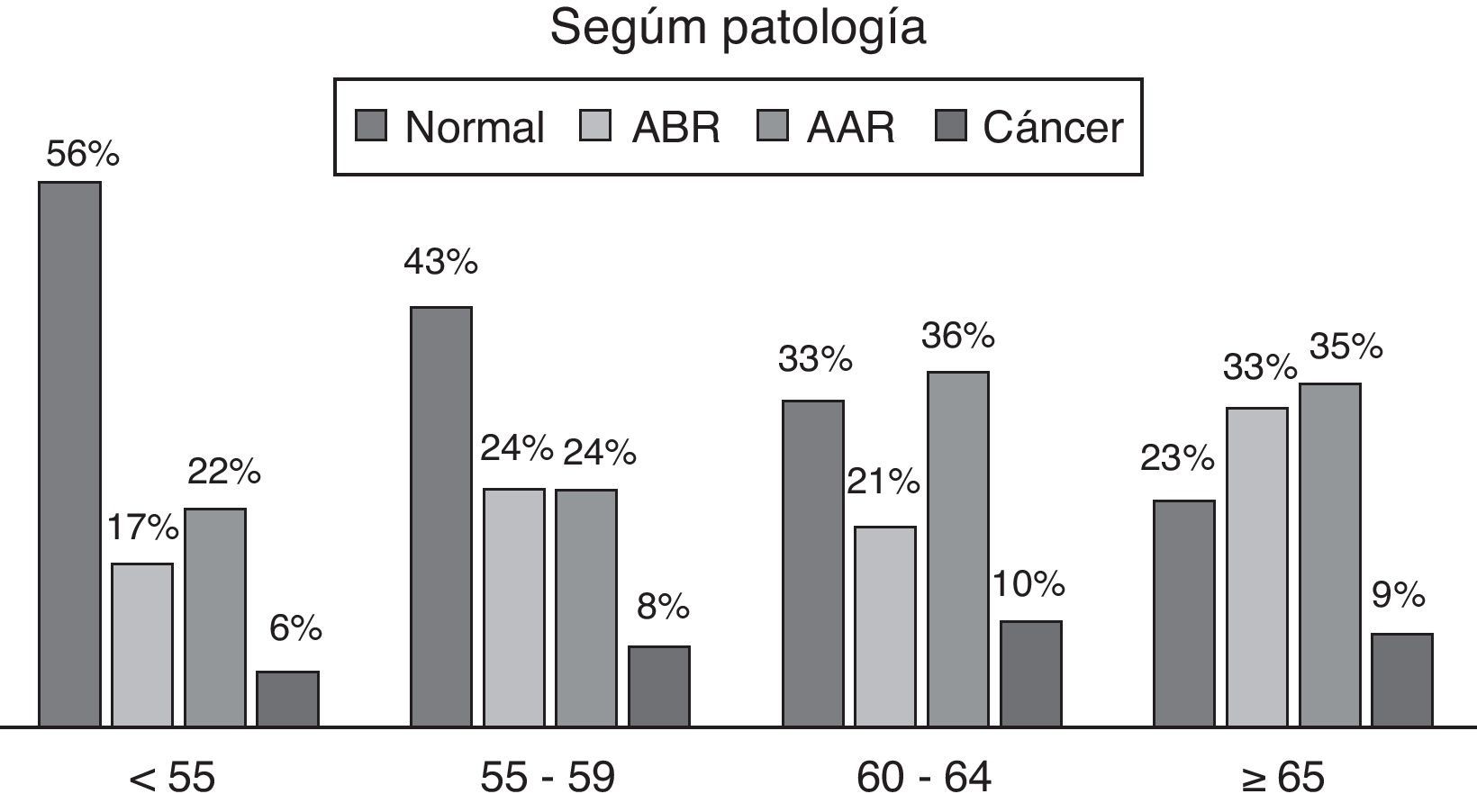
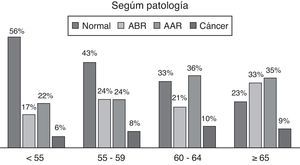
En los resultados por edades de las diferentes enfermedades, normal significa no tener ningún proceso neoplásico ni adenomatoso (fig. 3).
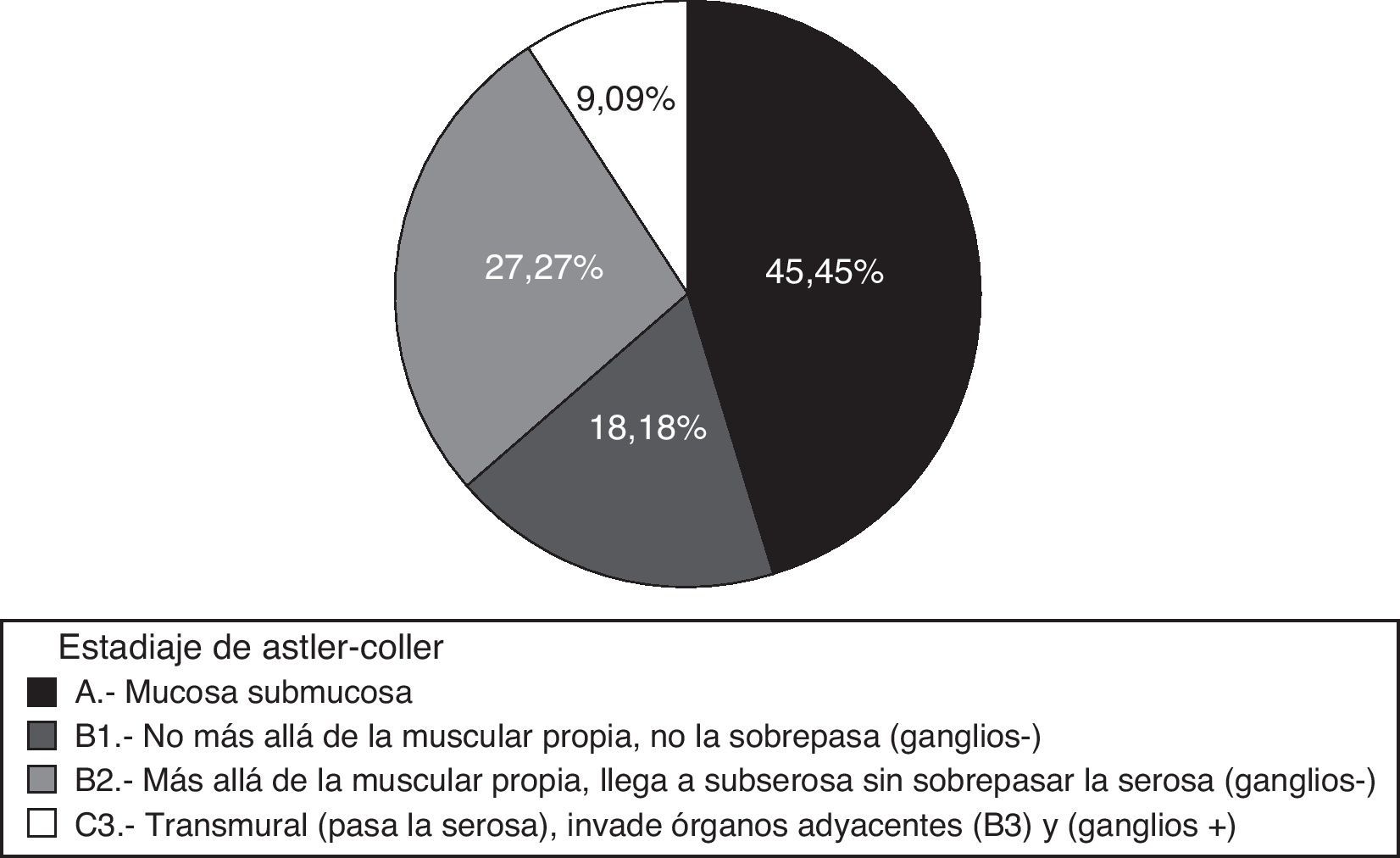
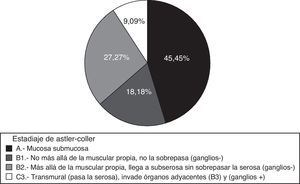
Los pacientes con cáncer se encontraban en los siguientes estadios de Astler y Coller: 3 en A, 2 en B1, 6 en B2 y 1 en C3. Según la clasificación TNM, 5 pacientes estaban en estadio i (41,66%); 6 en estadio ii (50%) y uno en estadio iii (8,33%); por tanto, 11 pacientes estaban en estadios precoces i-iii (91,66%), cifra muy superior a la de otros estudios que rondan el 71%9,10, siendo posible anticipar una reducción de la mortalidad11 (fig. 4).
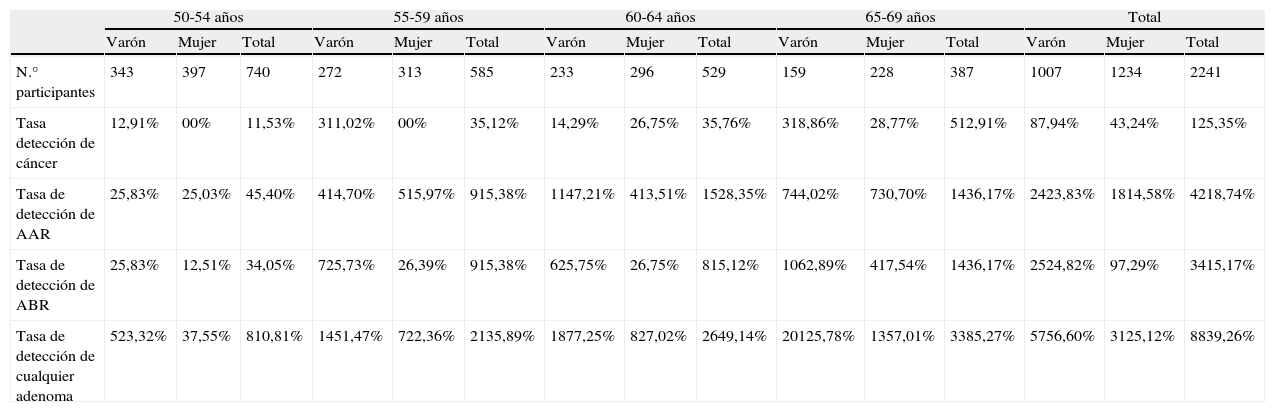
La tasa de detección de cáncer fue del 5,35‰, de ABR del 15,17‰, de AAR del 18,74‰ y para cáncer y cualquier tipo de adenoma del 39,26‰. Valores todos ellos más elevados que en otros estudios tanto de SOH por el método del guayacol13, como de los TSOHi16 (tabla 2). El VPP fue para cáncer del 8,69%, para el AAR del 30,43%, para el cáncer y AAR del 39,13%, para el ABR del 24,63%, y para todo tipo de adenoma incluido el cáncer del 63,76%.
Tasa de detección por edades
| 50-54 años | 55-59 años | 60-64 años | 65-69 años | Total | |||||||||||
| Varón | Mujer | Total | Varón | Mujer | Total | Varón | Mujer | Total | Varón | Mujer | Total | Varón | Mujer | Total | |
| N.° participantes | 343 | 397 | 740 | 272 | 313 | 585 | 233 | 296 | 529 | 159 | 228 | 387 | 1007 | 1234 | 2241 |
| Tasa detección de cáncer | 12,91% | 00% | 11,53% | 311,02% | 00% | 35,12% | 14,29% | 26,75% | 35,76% | 318,86% | 28,77% | 512,91% | 87,94% | 43,24% | 125,35% |
| Tasa de detección de AAR | 25,83% | 25,03% | 45,40% | 414,70% | 515,97% | 915,38% | 1147,21% | 413,51% | 1528,35% | 744,02% | 730,70% | 1436,17% | 2423,83% | 1814,58% | 4218,74% |
| Tasa de detección de ABR | 25,83% | 12,51% | 34,05% | 725,73% | 26,39% | 915,38% | 625,75% | 26,75% | 815,12% | 1062,89% | 417,54% | 1436,17% | 2524,82% | 97,29% | 3415,17% |
| Tasa de detección de cualquier adenoma | 523,32% | 37,55% | 810,81% | 1451,47% | 722,36% | 2135,89% | 1877,25% | 827,02% | 2649,14% | 20125,78% | 1357,01% | 3385,27% | 5756,60% | 3125,12% | 8839,26% |
La tasa de participación se encuentra en valores superiores a los de otros estudios8,13,15,22,23. Esto puede explicarse porque nuestra ZBS ya había participado en otros cribados poblacionales de CCR así como por el método TSOHi utilizado que según las publicaciones tiene una tasa superior de aceptación y participación6.
La tasa de participación en las mujeres (50%) es superior a la de los hombres (42%), pudiéndose explicar porque estas están más acostumbradas a participar en otros programas preventivos.
La tasa de participación por edades supera en todos los casos el 40%, llegando en las mujeres a superar el 50% en todos los tramos salvo entre los 65-69 años.
Una elevada participación es clave para conseguir reducir la morbimortalidad asociada a este tumor10.
El TSOHi utilizado ha presentado una alta tasa de positividad (6.15%), superior a la obtenida con tests clásicos6,8,9,13,24 y similares o superiores a los que utilizan pruebas inmunológicas22,25,26. Las tasas de positividad son superiores en los hombres a las de las mujeres en todos los tramos de edad. La mayor tasa de positividad tanto en hombres como en mujeres se da entre los 64 y los 69 años, valores que en muchos casos triplican los de otras franjas etarias.
La alta tasa de positividad puede elevar el número de colonoscopias, de efectos adversos y probablemente eleve también el número de adenomas y cánceres detectados.
La tasa de aceptación de la colonoscopia fue muy alta, del 99.27. Probablemente se haya conseguido gracias a la buena información dada al paciente en la consulta del médico y la rápida realización de la colonoscopia.
De los 137 pacientes que realizaron la colonoscopia, presentan enfermedad no neoplásica 49 (35,76%), cáncer 12 (8,75%) y adenomas 76 (55,57%; 34 ABR [24,81%] y 42 AAR [30,65%]).
Las elevadas tasas de detección de cáncer del 5,35‰, casi el doble que en estudios de nuestro entorno13,15,24–26, y de cualquier tipo de adenoma del 39,26‰, justificarían por sí solas la realización del estudio.
Estos datos y la alta positividad podrían corresponder a una mayor incidencia de adenomas en nuestra población.
Al analizar las tasas de detección por grupos de edad y sexo, observamos que son superiores en hombres que en mujeres para todo tipo de adenoma y cáncer, mostrando una tendencia importante de aumento de las tasas con la edad para todo tipo de adenoma.
Los VPP de la prueba para cáncer, AAR y cáncer y AAR son superiores a los de otros trabajos13,15,19,24,27–30. Los VPP de ABR y todo tipo de adenoma que son respectivamente del 24,63 y del 63,76%, llegan casi a duplicar los de otros trabajos realizados con pruebas clásicas13.
Destaca la precocidad en el diagnóstico de las lesiones cancerígenas, de los 12 pacientes con cáncer, 11 (91,66%) se encontraban en estadios precoces i-ii, cifra muy superior a la de otros estudios que rondan del 60-71%9,10,15, siendo posible anticipar una reducción de la mortalidad11.
Como conclusión podemos decir que la implantación del programa preventivo de CCR en nuestra población ha sido positiva gracias a la coordinación de los diferentes niveles de salud y asistenciales implicados, lo que ha asegurado la continuidad de todo el proceso así como por el compromiso adquirido por los profesionales sanitarios, que han proporcionado los estándares de calidad establecidos en el programa.
Sería interesante intentar aumentar la tasa de participación de la población mediante la sensibilización de la misma a través de campañas en los medios de comunicación y la motivación de los profesionales sanitarios mediante campañas y cursos de formación.
Dado que el 91,66% de los pacientes con cánceres se encontraban en estadios i-ii de la OMS, animamos a la implantación del programa de cribado de CCR porque sería una manera de disminuir la mortalidad gracias a un diagnóstico precoz.
Las altas tasas de positividad y de detección de cánceres y de AAR justifican por sí solas el estudio realizado. Pudieran explicarse por una mayor incidencia de todo tipo de adenoma en nuestra población. Sería interesante hacer estudios en nuestra ZBS de posibles causas que justifiquen estas altas tasas.
También sería conveniente realizar estudios con mayor población que pudieran proporcionar datos sobre su eficacia, efectividad, seguridad, aceptabilidad, así como coste-efectividad.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes y que todos los pacientes incluidos en el estudio han recibido información suficiente y han dado su consentimiento informado por escrito para participar en dicho estudio.
Derecho a la privacidad y consentimiento informadoLos autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.