Se presenta el caso de un paciente varón de 84 años, con fractura osteoporótica de la primera vértebra lumbar, bajo tratamiento durante los últimos 5 años con privación androgénica por adenocarcinoma prostático. Se resalta la posición clave del médico de atención primaria en la prevención de la osteoporosis secundaria a hipogonadismo en estos pacientes.
A 84 year-old patient, in therapy with androgen deprivation during the last 5 years due a prostate cancer, is presented with a osteoporotic fracture of the first lumbar vertebra. The pivotal role of the primary care physician, in the prevention of the osteoporosis secondary to the hypogonadism in these patients, is highlighted.
El riesgo de recibir un diagnóstico de cáncer de próstata a lo largo de la vida de un paciente varón se acerca a un 17%, mientras que el riesgo de morir a causa de este baja hasta alrededor de un 3%, lo que señala que un manejo conservador de dicha enfermedad puede resultar apropiado para muchos de estos pacientes1,2.
Dentro de un contexto amplio del manejo conservador de esta enfermedad tienen un papel específico, dentro de sus indicaciones de uso, como parte de las terapias por privación androgénica, los agonistas de la hormona liberadora de luteotropina (LHRH), acrónimo de Luteinizing Hormone Releasing Hormone, en inglés, de los que cabe destacar el hipogonadismo que provocan, implícito en su mecanismo de acción.
En España, la causa más frecuente de osteoporosis (OP) en el varón es el hipogonadismo, seguida de la corticoterapia crónica y el enolismo. La OP masculina conlleva una morbimortalidad similar o superior a la de la mujer. La incidencia de fracturas vertebrales radiológicas en varones menores de 65 años se estima en un 20%, llegando en los varones mayores de 65 años hasta el 25%3.
Caso clínicoPaciente varón de 84 años, que acude a la consulta de urgencias de nuestro centro de atención primaria por dolor lumbar, consecutivo a caída vertical posterior, sobre ambos glúteos, desde una postura de bipedestación, de 9 días de evolución y que no mejora con el tratamiento con ibuprofeno, 600mg/8h, paracetamol 1g/8h y omeprazol 20mg/24h, que se instauró en la consulta a domicilio ese mismo día. Manifiesta que el dolor ha ido en aumento y le impide conciliar el sueño.
Entre sus antecedentes destacamos hipertensión arterial, diabetes mellitus y enfermedad de Parkinson. En tratamiento con amlodipino, 5mg/día, insulina insulatard 22UI/día, y carvidopa/levodopa 25/100mg., 3 veces al día. Además está desde hace 5 años en tratamiento con privación androgénica continuada, por adenocarcinoma prostático, instaurado por su urólogo en forma de inyectables trimestrales de triptorelina, 11,25mg. Los últimos valores de testosterona sérica son de 0,57nmol/l (límites de referencia: 9,9-27,8) y del antígeno prostático específico (PSA) 0,97ug/l (límites de referencia: 0,5-4).
Está pendiente de una próxima revisión urológica, para valoración clínico-terapéutica.
En la exploración física constatamos un paciente con buen estado general, consciente y orientado. Inquieto por la incapacidad de encontrar una posición antiálgica adecuada. Sin temblor de reposo. La palpación de las apófisis espinosas lumbares es dolorosa, en especial la correspondiente a la primera vértebra lumbar (L1). También lo es la palpación de la musculatura paravertebral lumbar. La movilidad de la columna vertebral es dolorosa y está muy limitada.
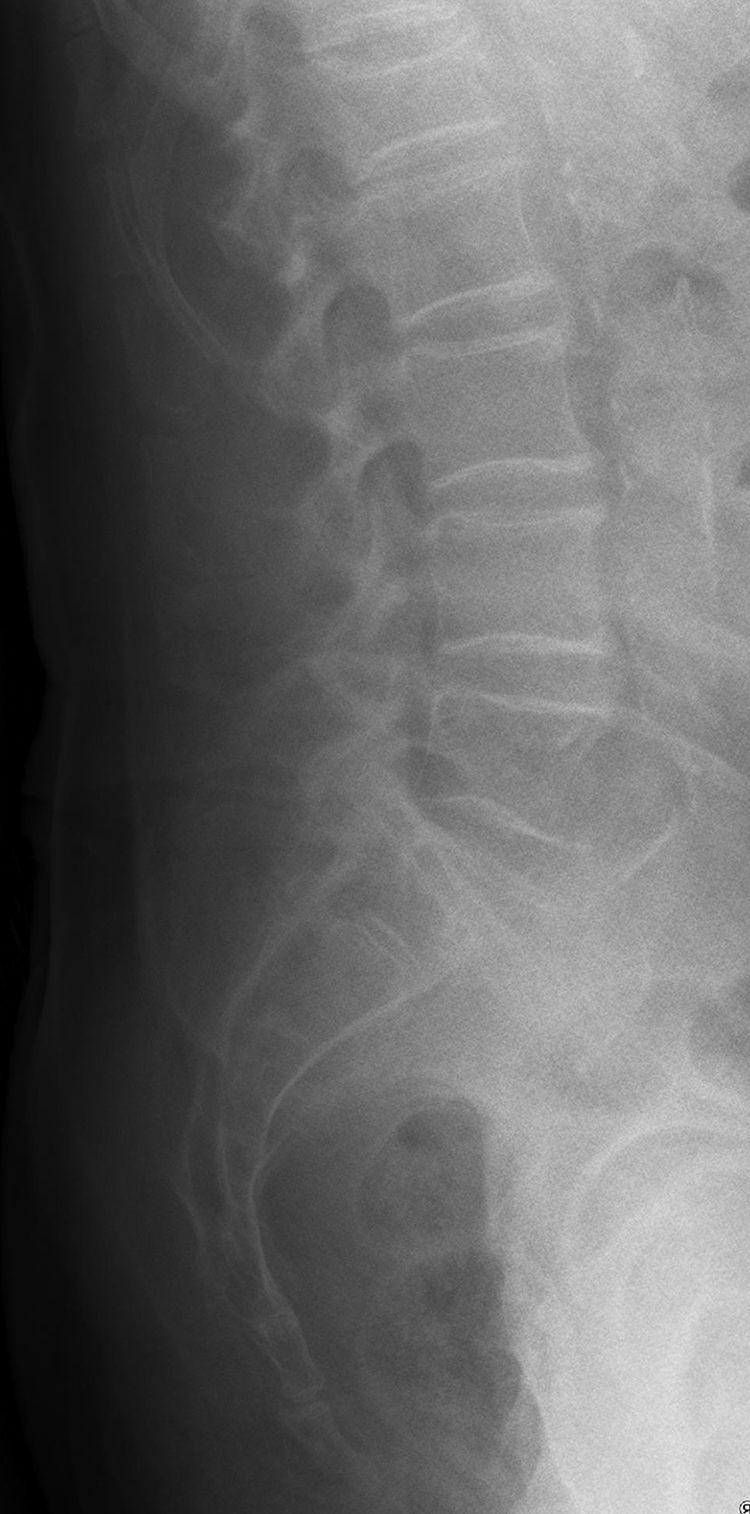
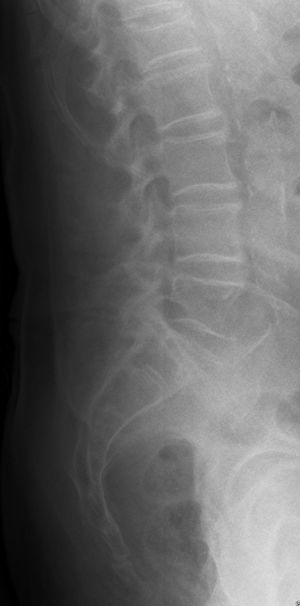
En la radiografía convencional de columna lumbar se evidencia, en el perfil, una disminución de la altura del cuerpo vertebral de L1, compatible con fractura por aplastamiento (fig. 1), acompañada de osteopenia de la misma L1 y del resto de cuerpos vertebrales.
Con el diagnóstico de fractura L1 osteoporótica o por fragilidad ósea, dado que fue ocasionada por un traumatismo de bajo impacto, caída estando de pie a nivel del suelo, seguimos lo recomendado en el reciente consenso de la Sociedad Española de Reumatología sobre osteoporosis3 respecto al tratamiento de la fractura vertebral aguda. En este caso, dado que el dolor había alcanzado una intensidad relevante y habían fracasado los analgésicos convencionales, comenzamos terapia con opioides, en concreto parche transdérmico de fentanilo, 12μg/h, aumentando la dosis a 25μg/h a la semana siguiente. Además, el reposo relativo junto con la utilización de un corsé lumbar y la terapia de rehabilitación nos han permitido que, al cabo de 3 meses, el paciente vuelva a su estado funcional previo a la caída, con la retirada progresiva de la terapia con opioides y del corsé lumbar, junto con la instauración de tratamiento continuado, diario, de 1.000mg de calcio y de 800 UI de vitamina D3, por vía oral, previa constatación analítica de unos valores normales de calcio sérico, 2,30mmol/l (límites de referencia: 2,15-2,51) y relativamente bajos de vitamina D, calcidiol (25OH VITD) 59nmol/l (límites de referencia ≥ 75 hasta sospecha de intoxicación ≥ 500).
Al mes de haber empezado el tratamiento recibimos el resultado de la densitometría mineral ósea (DMO), que nos confirmó la sospecha inicial de osteoporosis previa del paciente, por los valores por debajo de 2,5 T-score, tanto en cuello femoral como en columna lumbar.
Comentar también que valoramos en la fase aguda la terapia con calcitonina, que descartamos a tenor de la buena respuesta a los opioides y que valoramos también la terapia a largo plazo con fármacos antirresortivos, que descartamos por la edad, las comorbilidades y la baja tasa de adhesión a dichos tratamientos.
DiscusiónLa terapia por privación androgénica se ha venido utilizando estos últimos años en diversos escenarios de la enfermedad, como el que se puede ver en el trabajo de Crook et al.4, en el que se analiza la supresión androgénica intermitente, en ciclos de 8 meses, frente a la terapia continuada convencional, con un seguimiento medio de de 6,9 años, en pacientes con elevación del PSA, después de un año o más de haber finalizado la radioterapia para carcinoma prostático localizado.
Una revisión exhaustiva y detallada sobre todos estos conceptos y otros parámetros en relación con el diagnóstico, la evaluación, el tratamiento y el seguimiento del cáncer de próstata, la podemos encontrar en las recientes Guidelines on prostate cancer publicadas en febrero del año 2012 por la Asociación Europea de Urología5.
Con respecto a la terapia por privación androgénica, dicha guía europea nos indica que la terapia con los agonistas LHRH, en concreto la buserelina, goserelina, leuprorelina y triptorelina, que bloquean el receptor de la hormona luteinizante en la hipófisis anterior, con la supresión subsecuente de la secreción de testosterona a nivel testicular, se ha venido usando en el cáncer de próstata avanzado durante más de 15 años y en la actualidad es la principal forma de privación androgénica.
Se trata de análogos sintéticos de LHRH, administrados como inyectables depot a intervalos de 1, 2, 3 o 6 meses. Producen una elevación transitoria de la hormona luteinizante con el consiguiente aumento de la secreción de testosterona −fenómeno «repunte de testosterona» o «llamarada», como se le suele describir− que comienza a los 2-3 días de la primera inyección y suele durar unos 5 días. Este fenómeno es de especial importancia cuando se está ante un estadio avanzado de la enfermedad, con posibles complicaciones inmediatas como el aumento del dolor óseo, la retención aguda de orina, la insuficiencia renal obstructiva, la compresión de la médula espinal o los episodios cardiovasculares mortales por síndrome de hipercoagulabilidad.
No obstante, de una manera paulatina, con la estimulación continuada del receptor de la hormona luteinizante, este se autorregula a la baja, con la supresión consecuente de la secreción pituitaria de LH y los niveles de testosterona disminuyen a niveles de castración en las primeras 2-4 semanas de inicio del tratamiento.
Cabe recordar aquí la existencia de andrógenos de origen suprarrenal, que son convertidos a dihidrotestosterona en las células prostáticas y que escapan por tanto a la acción de los agonistas LHRH, que actúan vía testosterona, y que pueden ser bloqueados por los fármacos denominados antiandrógenos, principalmente la flutamida y la bicalutamida, que se unen al receptor androsterónico de la próstata bloqueándolo. De ahí el concepto de bloqueo androgénico completo, cuando se usan agonistas LHRH y antiandrógenos conjuntamente.
Una variante interesante, ya apuntada al inicio de la discusión, es la de la administración intermitente de privación androgénica, de cara a evitar la proliferación de un clon celular de carcinoma prostático independiente del estímulo androgénico. Este clon celular parecería estar en la base de la agresividad tumoral y en el peor pronóstico que esta conlleva en determinados pacientes6.
Los numerosos efectos deletéreos colaterales de la privación androgénica son bien conocidos.
La pérdida de la libido, junto a la disfunción eréctil que la acompaña, es un efecto colateral que va unido indefectiblemente al uso de los agonistas LHRH. Los sofocos son también queja común a muchos de dichos pacientes. Suelen aparecer a los 3 meses de inicio del tratamiento y pueden persistir en el tiempo.
Otro tipo de efectos colaterales también han sido descritos, como obesidad, sarcopenia, síndrome metabólico y problemas cardiovasculares7.
Pero el efecto colateral relativo al aumento de las fracturas óseas no metastásicas8 debemos abordarlo aquí con una mayor amplitud. Está demostrada una pérdida acelerada de la DMO en los primeros 6-12 meses de la terapia por privación androgénica. Esta es el resultado de un recambio óseo elevado, que está en relación con el tiempo de duración del tratamiento9.
Antes de iniciar una terapia de privación androgénica a largo plazo, se debería aconsejar a todos los pacientes una serie de medidas generales orientadas a conservar o mejorar su DMO, como todo aquello referente a los estilos de vida: cesación tabáquica, disminución de la ingesta enólica, aumento de la actividad física, normalización del índice de masa corporal, así como la ingesta de suplementos de calcio y vitamina D.
Sería deseable también una evaluación de la DMO que, en caso de hallar unos valores por debajo 2,5 T-score, o de 1 T-score con presencia de factores de riesgo de osteoporosis asociados10, al inicio del tratamiento o a lo largo del mismo, debería hacernos plantear el añadir un fármaco antirresortivo.
Los autores creemos que el caso que presentamos aquí y la breve discusión que lo acompaña resaltan con claridad el hecho de que, una vez el urólogo ha considerado adecuado el inicio de terapia con agonistas LHRH para el tratamiento del cáncer de próstata de un paciente, el médico de familia debe valorar la posibilidad de fracturas por osteoporosis secundarias a hipogonadismo a corto y a medio plazo. Y conjuntamente con el paciente, y los especialistas en urología y reumatología, tomar las medidas preventivas que se consideren más pertinentes, dentro de un contexto clínico concreto.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.