Atención primaria es el primer punto de contacto de la mayoría de los pacientes tras el inicio de los síntomas de una enfermedad inflamatoria intestinal (EII). Establecer un proceso diagnóstico inicial ante síntomas compatibles y unos criterios y vías de derivación pactadas, en función del grado de sospecha y de la situación del paciente, puede disminuir los retrasos diagnósticos. Una vez derivado el paciente al especialista de Digestivo y establecido el diagnóstico de EII, se estructura un plan de tratamiento y seguimiento. El manejo del paciente debe ser compartido con la participación del médico de familia en el diagnóstico y el tratamiento de las patologías concomitantes o intercurrentes, el reconocimiento de los brotes o de las complicaciones (de la EII o de los tratamientos), las tareas de educación del paciente o el control de la adherencia.
Con el objetivo de realizar una guía integral sobre el manejo de la EII dirigida a médicos de atención primaria se ha elaborado este documento de posicionamiento colaborativo entre la Sociedad Española de Médicos de Atención Primaria (SEMERGEN) y el Grupo Español de Trabajo en Enfermedad de Crohn y Colitis Ulcerosa (GETECCU).
Primary Care is the first point of contact for most patients after the onset of symptoms of inflammatory bowel disease (IBD). Establishing an initial diagnostic process based on compatible symptoms and agreed criteria and referral pathways, depending on the degree of suspicion and the patient's situation, can reduce diagnostic delays. Once the patient is referred to the Digestive specialist and the diagnosis of IBD is established, a treatment and follow-up plan is structured. The management of the patient must be shared with the participation of the family practitioners in the diagnosis and treatment of concomitant or intercurrent pathologies, the recognition of flare-ups or complications (of IBD or treatments), education tasks or adherence control.
With the purpose of developing a comprehensive guide on the management of IBD aimed at Primary Care doctors, we have developed this positioning document collaboratively between the Spanish Society of Primary Care Physicians (SEMERGEN) and the Spanish Working Group on Crohn's Disease and Ulcerative Colitis (GETECCU).
La colitis ulcerosa (CU) y la enfermedad de Crohn (EC) son enfermedades inflamatorias inmunomediadas de origen desconocido que se desarrollan en individuos predispuestos genéticamente y en las que el papel de la microbiota es cada vez más relevante. Múltiples estudios han descrito un aumento progresivo de la incidencia, con diferencias geográficas, que se ha relacionado con la occidentalización, la industrialización y los cambios en el estilo de vida1. La incidencia de la enfermedad inflamatoria intestinal (EII) en España en 2017 fue de 16,2 casos por cada 100.000 habitantes, con una prevalencia en alza de alrededor del 0,5% de la población2.
Atención primaria (AP) es el primer punto de contacto de la mayoría de los pacientes tras el inicio de los síntomas, y depende de los médicos de familia iniciar el proceso diagnóstico y la decisión de derivar al especialista de Aparato Digestivo para completar el estudio y confirmar el diagnóstico. Se debe tener en cuenta que, a pesar del incremento de la incidencia de la EII, el número estimado de pacientes con EII por médico de familia (calculando el número de médicos de AP obtenidos de la página del Ministerio de Sanidad y la prevalencia de la EII) durante su vida profesional será de entre 5 y 83. Por ello, si lo comparamos con otras patologías digestivas con síntomas iniciales similares mucho más prevalentes, como el síndrome del intestino irritable, la enfermedad celíaca, la intolerancia a la lactosa o la dispepsia, la EII sigue siendo una patología poco frecuente en AP.
Dado que no hay síntomas/signos ni determinaciones analíticas patognomónicos de EII, necesitamos desarrollar y validar algoritmos o herramientas de cribado en los pacientes con síntomas compatibles o sugestivos de EII, incorporando la calprotectina fecal (CF) en la práctica clínica habitual4. Es necesario establecer criterios y vías de derivación pactadas (con carácter normal o preferente) en función del grado de sospecha y de la situación del paciente para evitar o disminuir los retrasos diagnósticos.
Una vez derivado el paciente al especialista de Digestivo y realizado el diagnóstico de EII, se estructura un plan de tratamiento y seguimiento. En los últimos 20años se han formado unidades multidisciplinares de EII en la mayoría de hospitales y se ha establecido un programa de certificación de unidades de EII (CUE)5 para intentar homogeneizar y mejorar la calidad asistencial. Las unidades, que incluyen enfermeros, cirujanos o radiólogos especializados en EII, no han tenido en cuenta a AP y la coordinación y comunicación entre primaria y especializada es subóptima, como reflejan dos estudios realizados en nuestro medio6,7. En el manejo de la EII hay una tendencia al «hospitalocentrismo», en el que muchas de las patologías concomitantes, intercurrentes y comorbilidades, que deberían tratarse en AP, se acaban tratando en las unidades de EII o derivando a otros servicios del hospital8. La derivación desde AP no transfiere todo el cuidado del paciente al especialista3, sino que se debería realizar una atención compartida definiendo los aspectos de cuidado de cada especialidad para lograr mejorar los resultados9.
Los médicos de familia tienen una visión integral del paciente y deben manejar las patologías concomitantes o intercurrentes, detectar los síntomas sugestivos de las manifestaciones extraintestinales relacionadas con la EII, conocer los tratamientos utilizados en los pacientes con EII y los posibles efectos secundarios, y reconocer los brotes de actividad y su tratamiento, en determinados casos. Además, tienen un papel fundamental en las tareas de educación del paciente, sobre todo al principio de la enfermedad, del control de la adherencia al tratamiento o del manejo de las alteraciones de la esfera psicológica, entre otros problemas asociados a la EII. Sin embargo, en un estudio sobre el grado de conocimiento y confort en el manejo de los pacientes con EII por los médicos de familia, el resultado fue subóptimo: el 37% se sentían incómodos en general con estos pacientes, cifra que aumentaba al 71% y al 91% con el manejo de inmunomoduladores o biológicos, respectivamente; además, el 70% desearían tener herramientas de apoyo10. En la revisión realizada para la realización de estas recomendaciones no se han encontrado publicadas guías de diagnóstico y planes de acción en EII diseñadas específicamente para AP, a diferencia de otras patologías, como el asma o la diabetes3.
Recientemente se ha publicado una encuesta realizada a 222 médicos de AP y 157 especialistas en EII sobre el manejo de los pacientes con EII7. Entre otros resultados, solo el 34 y el 44%, respectivamente, describían la relación entre los dos colectivos como buena, el nivel medio de satisfacción de cada especialidad respecto a la otra era de 5 sobre 10, y la percepción del apoyo y soporte entre colectivos no llegaba a 5. Además, a pesar de que los especialistas en EII opinaban que la importancia de la AP en el diagnóstico era de 9 sobre 10, solo el 30% de los médicos de familia tenían protocolos o consensos de diagnóstico, derivación o tratamiento. La relación entre AP y Digestivo/unidades de EII es heterogénea debido a las desigualdades estructurales, organizativas y presupuestarias en nuestro territorio y a la falta de protocolos y estándares de actuación. Existen diferentes grados de integración, probablemente en relación con iniciativas personales o propias de hospitales/centros de salud. La coordinación y la comunicación entre el médico de familia y el especialista en EII deberían mejorar mediante vínculos y vías de información bidireccional, programas de formación, protocolos adaptados y sistemas de acceso a las unidades de EII. La forma de establecer esta relación debe ser consensuada entre los diferentes equipos y adaptarse a cada circunstancia.
Con el objetivo de realizar una guía integral sobre el manejo de la EII dirigida a médicos de AP se ha elaborado este documento de posicionamiento de manera colaborativa entre la Sociedad Española de Médicos de Atención Primaria (SEMERGEN) y el Grupo Español de Trabajo en Enfermedad de Crohn y Colitis Ulcerosa (GETECCU).
Bloque 1. Diagnóstico y derivación del paciente con EII¿Cómo podemos mejorar el diagnóstico precoz?El tiempo de diagnóstico comprende tres intervalos: desde el comienzo de los síntomas hasta la primera visita médica en AP, desde la primera visita hasta la derivación al gastroenterólogo, y desde la derivación hasta el diagnóstico de la EII11,12. El tiempo hasta el diagnóstico puede demorarse debido al retraso en la solicitud de consulta de AP por parte del paciente, tiempos de respuesta asistencial prolongados debido a las listas de espera y dificultad a la hora de realizar el diagnóstico diferencial con otras entidades, como los trastornos funcionales o enfermedades infecciosas entéricas. La media de tiempo de diagnóstico en nuestro medio fue de 3,5meses (5,6 en la EC y 2,7 en la CU)2. Estos datos son similares a un estudio italiano de 2017, con un retraso diagnóstico de 3meses (7meses para la EC y 2meses para la CU), pero observando que hasta en el 14% de pacientes el tiempo de diagnóstico fue superior a 24meses13. En una revisión sistemática reciente sobre el tiempo de diagnóstico se confirmó que el retraso era mayor en la EC que en la CU, estimado en ocasiones entre uno o dos años, posiblemente porque en la CU la localización se limita al colon y es más probable que los pacientes que experimentan rectorragias acudan al médico12.
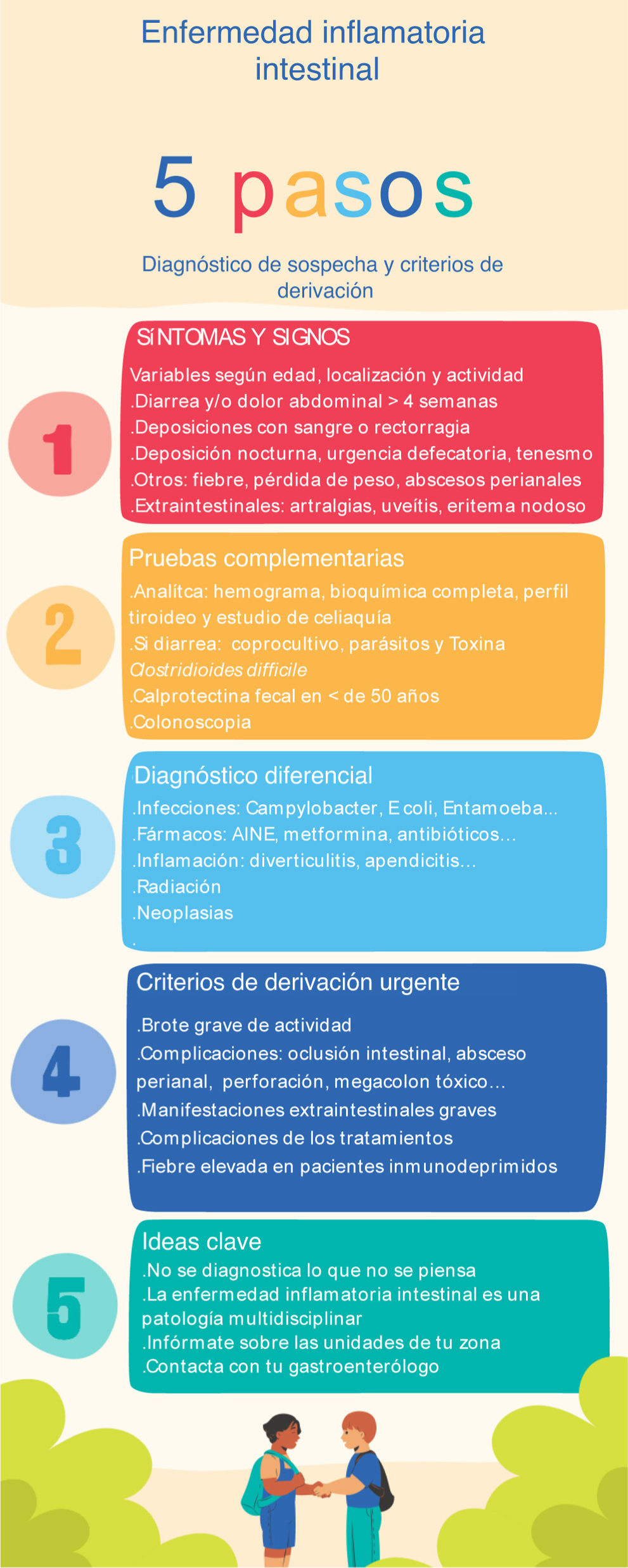
Disminuir el tiempo de diagnóstico de la EII nos va a permitir diagnosticar al paciente en fases más iniciales de la enfermedad, con menor inflamación y con una mejor respuesta al tratamiento14. Es difícil determinar cuál es el tiempo de diagnóstico admisible, porque dependerá de cada paciente y de la situación clínica. El tiempo de diagnóstico es muy dependiente de la edad del paciente, del tipo de EII, de la extensión, de la actividad de la enfermedad y de los síntomas de presentación. La falta de reconocimiento de los síntomas por parte del médico y la atribución de estos a procesos más frecuentes, como los infecciosos o el síndrome del intestino irritable, pueden retrasar el inicio del estudio y la derivación al especialista. Los tiempos de respuesta asistencial se definen como aquellos periodos que el paciente espera para que sea atendido por un especialista o para la realización de pruebas complementarias. El intervalo desde la derivación del médico de AP hasta el gastroenterólogo se cuantifica generalmente en meses, y es de especial relevancia, ya que se ha objetivado como el intervalo que más influye en el tiempo del diagnóstico11. La sospecha de la EII por el médico de AP debería recortar los tiempos de respuesta asistencial gracias a la derivación precoz y preferente al especialista y a la realización de las pruebas diagnósticas por parte del gastroenterólogo de forma, también, preferente. Para ello, es necesario disponer en la consulta de AP de formatos como infografías, guías cortas, check list o apps donde se recojan de forma esquemática los signos y síntomas de sospecha, las pruebas complementarias a realizar, así como criterios para la derivación precoz3. La sistematización de estas herramientas puede ayudar, tanto a AP como a especialistas, a mejorar el diagnóstico de los pacientes (fig. 1).
Proceso diagnósticoLos síntomas digestivos (diarrea, dolor abdominal o rectorragia) no son específicos de la EII y aparecen en otras enfermedades más prevalentes, como el síndrome del intestino irritable, la enfermedad celiaca, la intolerancia a la lactosa o la patología anal benigna (fisuras y hemorroides). La EII puede debutar de distintas maneras, y debe sospecharse ante la presencia crónica o recurrente de algunos de los signos o síntomas que se refieren en la tabla 111. Los cuadros agudos no excluyen la EII, pero tenemos que descartar otras causas. En la historia clínica se debe interrogar sobre enfermedades asociadas, el uso de fármacos que puedan provocar síntomas como la diarrea (antiinflamatorios no esteroideos [AINE], antibióticos, metformina, colchicina, etc.), el uso de drogas (alcohol, cocaína), viajes a zonas endémicas de parasitosis y posibilidad de intoxicaciones o infecciones alimentarias15. En pacientes con CU son característicos la diarrea con sangre (mezclada con las heces), los esputos rectales de moco y sangre, el tenesmo y la urgencia defecatoria. Los síntomas de la EC son más heterogéneos, pero suelen incluir diarrea de más de 4semanas con dolor abdominal y pérdida de peso. En la EC ileal la diarrea no suele contener sangre y el tenesmo y la urgencia serán menos marcados. El dolor se refiere a nivel de la fosa iliaca derecha, y en ocasiones se puede palpar un efecto masa en la exploración a nivel abdominal. En la EC de colon la presentación es similar a la CU. Hay pacientes que presentan un síndrome general, con pérdida de peso, y afectación sistémica, con anemia o anorexia11.
Síntomas de sospecha de EII y estudio inicial
| ¿Cuándo sospechar una EII? | ¿Qué pruebas realizar antes de derivar al hospital? |
|---|---|
| Síntomas:• Diarrea > 4 semanas• Diarrea nocturna• Deposiciones con sangre o rectorragia• Tenesmo rectal y urgencia deposicional• Pérdida de peso, astenia y anorexia• Dolor abdominal o de predominio en fosa iliaca derecha• Pérdida de peso, retraso de crecimiento y maduración sexual en niñosExploración física:• Enfermedad perianal: fístula, fisura, absceso perianal• Aftas y úlceras orales recurrentes• MEI: articulares (artritis seronegativa, sacroileítis o espondilitis anquilopoyética) cutáneas (eritema nodoso, pioderma gangrenoso), oculares (uveítis, epiescleritis), hepáticas (colangitis esclerosante primaria) | Analítica: hemograma, bioquímica con función renal y hepática, albúmina, sideremia, vitaminaB12 y fólico, PCR, Ac anti-transglutaminasa, IgA, TSH y T4Estudio microbiológico en heces:• Coprocultivo, parásitos y toxina Clostridioides difficileCF si edad <50 añosColonoscopia si edad > 50 años |
CF: calprotectina fecal; MEI: manifestaciones extraintestinales; PCR: proteína C reactiva.
Elaboración propia, adaptado de Martín-de-Carpi et al.11.
El estudio inicial desde AP debe englobar una analítica con hemograma, bioquímica completa, proteínaC reactiva (PCR), perfil tiroideo y un estudio de celiaquía con anticuerpos anti-transglutaminasa e IgA. Si la clínica es de diarrea se debe descartar etiología infecciosa con estudio microbiológico en heces (tabla 1), y en el caso de síntomas rectales hay que tener en cuenta las proctitis infecciosas por enfermedades de transmisión sexual.
Utilidad de la calprotectina fecal en el diagnóstico de la EIIEn base a las recomendaciones de GETECCU, la CF es un buen marcador de inflamación intestinal. En este grupo de pacientes podría diferenciar entre patología funcional y orgánica, lo que permite evitar derivaciones y realizar colonoscopias innecesarias4. El valor de la CF para discriminar síntomas digestivos funcionales y orgánicos ha sido analizado en numerosos estudios. Un metaanálisis que incluyó 2.475 pacientes determinó una sensibilidad y una especificidad del 83% y del 84%, respectivamente, para diferenciar enfermedad orgánica de funcional16. El principal inconveniente de la CF en este contexto es su baja precisión para detectar cáncer colorrectal (CCR). Por este motivo, en una población de estudio en riesgo de CCR (p.ej., paciente de >50años o con antecedentes familiares de CCR) la CF no será la prueba adecuada y serán candidatos a estudio con colonoscopia. Se recomienda solicitar la CF en caso de sospecha clínica en pacientes de <50años sin antecedentes familiares de CCR. En una publicación reciente se ha observado que la detección por AP de niveles elevados de CF se asocia a un menor tiempo en el diagnóstico de EII, comparado con aquellos en los que no se recoge CF17. Es importante conocer aspectos de cómo recoger la muestra de heces y saber interpretar los resultados (tabla 2). El marcador de CF no es específico de la EII y puede estar elevado en otras situaciones de inflamación, como diverticulitis o colitis infecciosas y en pacientes bajo tratamiento con AINE (por poder provocar lesiones entéricas) o inhibidores de la bomba de protones. Se recomienda la suspensión de los AINE las dos semanas previas a la determinación de CF4. Desafortunadamente, no todos los centros de primaria disponen de este marcador. Una encuesta reciente a médicos de AP en nuestro medio detectó que una tercera parte no tenían acceso7. Creemos que la CF debería ser una prueba disponible en los centros de AP como ayuda al diagnóstico en aquellos pacientes con síntomas, signos y/o resultados analíticos sospechosos.
Interpretación de la determinación de la CF en el diagnóstico diferencial de clínica digestiva
| CF <100 μg/g: inflamación poco probable, no sugestivo de EII, no indicar exploraciones invasivasCF 100-150 μg/g: sugestivo de poca inflamación, interpretación con cautela, considerar condiciones alternativas, repetición en 4-8 semanasCF > 150 μg/g: sugestivo de inflamación, solicitar derivación o colonoscopia |
CF: calprotectina fecal; EII: enfermedad inflamatoria intestinal.
Elaboración propia, adaptado de Guardiola et al.4.
El diagnóstico de certeza de la EII se va a basar en los datos clínicos y de la exploración física, resultados analíticos y endoscópicos, anatomía patológica y pruebas de imagen. Sin embargo, el diagnóstico precoz de la EII va a ser un factor determinante en la respuesta al tratamiento y precisa de un alto grado de sospecha para iniciar el proceso diagnóstico18. Para mejorar la sospecha diagnóstica del médico de AP y su derivación temprana al gastroenterólogo se han propuesto varias herramientas simples que incluyen señales de alarma, permitiendo una derivación más oportuna y un diagnóstico más rápido. El estudio de Danese et al.19 se basa en recoger síntomas digestivos de pacientes con EC de reciente diagnóstico, síndrome de intestino irritable y población control sana. Después del análisis multivariado se observaron 8 síntomas, conocidos como Red Flags o síntomas de alarma, para identificar pacientes con EC: presencia de fístulas complejas o abscesos perianales, antecedente de un familiar de primer grado con EII, diarrea nocturna, pérdida de peso o fiebre en los últimos 3meses, dolor abdominal de más de 3meses y ausencia de urgencia rectal. Cada síntoma se puede puntuar entre 2-5 puntos, y si el paciente presenta un índice de Red Flags superior o igual a 8, sugiere una gran probabilidad de presentar una EC. En un intento de validar este índice recientemente se ha publicado un estudio italiano con 112 pacientes derivados de AP con una sensibilidad y especificidad mucho menores, del 50 y del 58%, respectivamente. Al añadir la determinación de CF por encima de 250μg/g al índice de Red Flags, la sensibilidad y la especificidad alcanzaron un 100% y un 72%, respectivamente, con un valor predictivo negativo del 100%20. Otro de los estudios en relación con el cribado de casos con riesgo de EII es el IBD-REFEER, que, a diferencia del anterior estudio, engloba tanto la EC como la CU, y además tiene la ventaja de que es aplicable en población pediátrica. Utiliza criterios clínicos mayores y menores (siendo uno de ellos CF elevada). Si el paciente presenta un síntoma de los criterios mayores o dos síntomas de los criterios menores se debería derivar a Digestivo para descartar una EII. Este índice presenta una sensibilidad y una especificidad del 98% y del 96%, respectivamente21. En espera de índices de validación en nuestro medio, se sugieren los criterios de derivación del paciente con sospecha de EII de debut que se muestran en la tabla 3.
Criterios de derivación del paciente con sospecha de EII
| Síntomas y/o exploración física (tabla 1), junto con: |
|---|
| • Estudio microbiológico en heces negativo |
| • Estudio celiaquía negativo y perfil tiroideo normal |
| • Anemia y/o trombocitosis |
| • Elevación PCR >10 mg/l |
| • CF >150 μg/g |
CF: calprotectina fecal; PCR: proteína c reactiva.
Elaboración propia.
Los médicos de familia no solo deben realizar una derivación adecuada cuando tienen la sospecha de EII, sino que también tienen que reconocer signos y síntomas que puedan identificar la recidiva de la enfermedad en un paciente ya diagnosticado de EII o las posibles complicaciones asociadas. Hay que tener presente que cuando un paciente con EII acude a consultas de AP no siempre tiene una recidiva de la EII, por lo que es imprescindible realizar un diagnóstico diferencial con otras enfermedades, como las infecciones entéricas, la patología del canal anal, problemas funcionales digestivos, efectos adversos farmacológicos, enfermedades digestivas concomitantes o patología intercurrente. Ante el aumento en la frecuencia deposicional, la disminución de la consistencia de las heces, el dolor abdominal o la aparición de sangrado en heces en un paciente con EII se debe realizar una anamnesis, exploración física, revisar la trayectoria de la enfermedad, el tratamiento y las comorbilidades, y se realizará una analítica con biomarcadores, como la CF y la PCR, y un coprocultivo, incluyendo la detección de Clostridioides difficile, aun en ausencia de antibioterapia previa22.
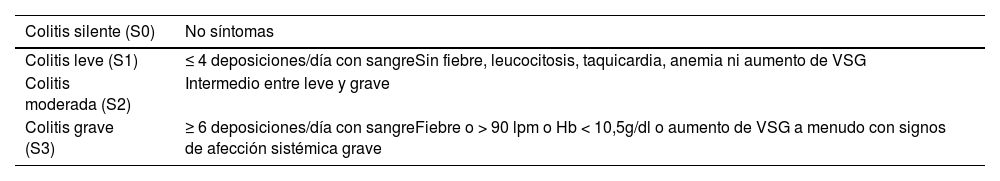
Si se sospecha un brote de actividad o una complicación, se debe valorar la gravedad para decidir la actitud a tomar y el tratamiento a seguir. Para evaluar la gravedad del brote existen diferentes escalas, como la clasificación de Montreal en la CU (tabla 4) o el índice de Harvey Bradshaw en la EC (tabla 5). En función de la gravedad y de la disponibilidad de valoración por Digestivo, el médico de AP puede realizar el tratamiento del brote, iniciar un tratamiento mientras es valorado por su especialista, remitir a la unidad/especialista de EII para que decida el cambio de tratamiento o remitir directamente a urgencias.
Clasificación de Montreal para la gravedad de la colitis ulcerosa23
| Colitis silente (S0) | No síntomas |
|---|---|
| Colitis leve (S1) | ≤ 4 deposiciones/día con sangreSin fiebre, leucocitosis, taquicardia, anemia ni aumento de VSG |
| Colitis moderada (S2) | Intermedio entre leve y grave |
| Colitis grave (S3) | ≥ 6 deposiciones/día con sangreFiebre o > 90 lpm o Hb < 10,5g/dl o aumento de VSG a menudo con signos de afección sistémica grave |
Hb: hemoglobina; lpm: latidos por minuto; VSG: velocidad de sedimentación globular.
Índice de Harvey Bradshaw para la enfermedad de Crohn24
| Variables | Puntos |
|---|---|
| 1. Estado general | 0 Muy bueno1 Regular2 Malo3 Muy malo4 Malísimo |
| 2. Dolor abdominal | 0 No1 Ligero2 Moderado3 Intenso |
| 3. Número de deposiciones líquidas diarias (n puntos) | |
| Masa abdominal | 0 No1 Dudosa2 Definida3 Definida y dolorosa |
| Complicaciones | 1 Artralgia1 Uveítis1 Eritema nodoso1 Aftas1 Pioderma gangrenoso1 Fístula anal1 Otras fístulas1 Abscesos |
Puntuación: < 6 leve; 6-12 moderado; > 12 grave.
Se debe derivar de forma urgente (a la unidad de EII si tiene acceso abierto, o a urgencias) a los pacientes con un brote grave de CU o EC, complicaciones de la EC, como la oclusión intestinal o el absceso perianal, manifestaciones extraintestinales (MEI) graves, como el pioderma gangrenoso o la uveítis, o sospecha de efectos adversos o complicaciones asociadas a los tratamientos, como la fiebre elevada en los pacientes inmunodeprimidos. Los pacientes que están en tratamiento con un fármaco inmunosupresor, un biológico o un inhibidor de JAK-quinasa que presentan actividad por pérdida de eficacia del tratamiento o una complicación asociada se deben valorar por el especialista de EII para decidir la intensificación o el cambio de tratamiento.
En los pacientes con CU que están en tratamiento con mesalazina y presentan un brote leve-moderado se debe comprobar el cumplimiento del tratamiento y la dosis pautada. En un brote de proctitis ulcerosa se puede iniciar u optimizar el tratamiento con un supositorio de mesalazina de 1g diario, y si no hay respuesta, asociar mesalazina oral. En la CU izquierda y la pancolitis se puede optimizar la dosis de mesalazina oral y rectal25,26 (en muchos casos los brotes coinciden con una falta de adherencia al tratamiento pautado). Si no se consigue la respuesta o el paciente estaba con dosis altas de mesalazina, se debería derivar a Digestivo. Si hay un retraso en la consulta se pueden asociar corticoides orales de acción tópica, como la beclometasona dipropionato, o prednisona oral, en función de la gravedad27. En un brote leve-moderado de EC se puede iniciar el tratamiento con budesonida oral en la afectación ileal o ileocólica, o con prednisona oral en las formas colónicas28,29 si hay un retraso en la valoración por el especialista (ver apartado «Tratamientos utilizados en la enfermedad inflamatoria intestinal, Corticoides»). Por último, en un paciente con EC que acude a su médico por dolor o supuración perianal se debe realizar una exploración de la región anal, perianal y perineal describiendo el número de orificios externos y su localización, establecer si hay supuración y evaluar la presencia de abscesos (que es un motivo de derivación a urgencias para drenaje y contacto posterior con la unidad/especialista). Ante la presencia de una fístula no complicada se puede iniciar tratamiento con metronidazol 500mg/8-12h o ciprofloxacino 500mg/12h y derivar al especialista para el proceso diagnóstico y el tratamiento de la fístula30,31.
¿Cómo derivar los pacientes desde primaria a la unidad de EII?Modelos de derivaciónUna vez detectada la sospecha de EII por el médico de AP, se puede realizar la derivación al especialista, que solicitará la colonoscopia (si se tiene acceso directo a endoscopias se podrá solicitar la colonoscopia y derivar al especialista una vez confirmado el diagnóstico). La forma de derivación desde AP a Digestivo es muy heterogénea, dependiendo del lugar en el que el médico de AP realice su trabajo. No hay uniformidad en la accesibilidad a las pruebas, en la forma de establecer contacto con atención especializada, ni en los tiempos de demora. Todo ello supone una barrera para la derivación y el seguimiento de estos pacientes, así como una importante insatisfacción por parte de los profesionales de AP32.
Se ha visto que el acceso abierto a la atención especializada es el preferido por los pacientes con EII y por el médico de AP, y que el conocimiento personal entre los médicos de AP y los gastroenterólogos aumenta la calidad asistencial, por lo que deberían ser objetivos de mejora. Es fundamental conocer, al menos nominalmente, a los gastroenterólogos de EII y cómo acceder a las unidades de referencia de EII de la zona.
En el programa CUE de GETECCU uno de los indicadores para la acreditación de las unidades consiste en tener un circuito de visitas prioritario desde AP a las unidades de EII para los pacientes de reciente diagnóstico y los brotes de actividad33.
ComunicaciónEn la era informática, una buena opción es la e-consulta. El médico de AP realiza una e-consulta dirigida al gastroenterólogo a través de la historia clínica electrónica del paciente y el receptor evalúa el caso determinando la necesidad de más información o pruebas por parte del médico de AP, estableciendo la actitud diagnóstica, la derivación a la unidad de EII, la consulta de otras especialidades o el inicio de algún tratamiento. Todo ello realizado de manera electrónica o citando al paciente presencialmente en un tiempo ajustado acorde a la gravedad de la patología34. Para ello es imprescindible que los médicos de familia presenten una información resumida del caso, de fácil lectura, que permita filtrar y priorizar adecuadamente a los pacientes. Si no estuviese disponible la e-consulta, la comunicación podría establecerse a través de correo electrónico o telefónica, aunque esta vía es mucho más complicada por problemas de accesibilidad. Por último, el contacto puede hacerse mediante el circuito habitual utilizando el parte interconsulta con derivación normal o preferente, con los problemas conocidos de falta de interacción entre profesionales, demoras excesivas, derivaciones inadecuadas, mal control del paciente o malestar de los profesionales, tanto de AP como de atención especializada.
Bloque 2. Manejo del paciente con EII. Papel de la atención primariaTratamientos utilizados en la enfermedad inflamatoria intestinalEs importante que el médico de familia conozca los tratamientos utilizados en los pacientes con EII y reconozca los posibles efectos secundarios. El tratamiento de la EII es individualizado y depende de varios factores, incluyendo la localización, la gravedad de la enfermedad, la edad y las comorbilidades del paciente, así como la respuesta previa con las terapias específicas.
SalicilatosDisponemos de diferentes formulaciones de mesalazina, tanto para su uso por vía oral como rectal. Los ensayos clínicos no han demostrado diferencias en eficacia o seguridad con las diferentes formulaciones orales, por lo que se han de tener en cuenta las preferencias del paciente a la hora de elegir comprimidos o microgránulos35. La dosis de mesalazina oral adecuada para la inducción de la remisión del paciente con brote leve-moderado de CU es 2,4g/día, siendo óptima >3g/día, en una dosis única diaria36. La administración de mesalazina tópica puede realizarse mediante supositorios, espuma o suspensión rectal (enemas). La elección de una u otra depende de la extensión de la enfermedad: la suspensión rectal puede alcanzar hasta el ángulo esplénico, la espuma alcanza el sigma/colon descendente, mientras que los supositorios alcanzan solo el recto. En la proctitis ulcerosa la indicación de primera línea en el brote es el supositorio de 1g/24h, antes de acostarse, pudiendo pasar a 3g a la semana de mantenimiento, en función de la tolerancia26. Para una mejor adherencia existen vídeos explicativos acerca del uso de la mesalazina tópica dentro de la página web (GEducaEII) https://www.youtube.com/watch?v=oWyfExo8Zj8&t=271s.
La mesalazina suele ser bien tolerada. Los efectos adversos recogidos más frecuentemente son leves, y consisten en dolor abdominal, náuseas y vómitos. No existen diferencias en la seguridad entre el uso de dosis bajas o altas de mesalazina, y se recomienda la monitorización anual de la función renal y de las enzimas hepáticas37.
CorticoidesExisten dos tipos de corticoides: los corticoides orales sistémicos, con gran biodisponibilidad y una toxicidad significativa, y los corticoides orales de acción tópica, con baja disponibilidad sistémica. La dosis habitual para el manejo de un brote moderado de EII es de 1mg/kg/día (o 40-60mg/día) de prednisona oral (o equivalente). El descenso de los esteroides sistémicos, una vez alcanzada la remisión, se suele realizar reduciendo 10mg cada semana hasta llegar a 20mg/día, y después 5mg cada semana. No se deben suspender bruscamente los esteroides en pacientes que lleven más de 7-10días de tratamiento. Los corticoides orales de acción tópica son la budesonida, indicada en la inducción a la remisión del brote leve-moderado de EC ileal, a dosis de 9mg/día en una dosis única y con un descenso progresivo una vez conseguida la remisión, y el dipropionato de beclometasona, indicado en el brote leve-moderado de CU, a dosis de 5mg al día durante un mes (en ocasiones pueden utilizarse 10mg/día durante 1mes y 5mg durante 2-4 semanas más)28,29. La falta de respuesta a los corticoides a dosis plenas se conoce como corticorrefractariedad. La corticodependencia se produce cuando los corticoides no pueden reducirse de 10mg/día de prednisona o 3mg/día de budesonida sin reaparición de síntomas, en los 3primeros meses de tratamiento, o cuando se produce una recidiva clínica antes de los 3meses de haber suspendido los corticoides38. En estos casos hay que buscar una alternativa de tratamiento para evitar el uso excesivo de corticoides, y nunca deben plantearse como tratamiento de mantenimiento en pacientes con EII, dado que tienen un importante número de efectos secundarios: hipertensión arterial, retención hídrica, facies de «luna llena», acné, hirsutismo, estrías cutáneas, intolerancia a la glucosa, insomnio, labilidad emocional, infecciones, cataratas, glaucoma, atrofia suprarrenal, retraso del crecimiento en niños o pérdida de densidad mineral ósea, entre otros. Se recomienda el control de la glucemia y de las cifras de presión arterial en pacientes con diabetes mellitus e hipertensión arterial previas. Hay que prestar especial atención a los pacientes con psicopatología de base, por si los esteroides los descompensaran. Debe vigilarse el efecto de los esteroides sobre la densidad mineral ósea, recomendando coadministrarlos siempre con suplementos de calcio y de vitaminaD39.
Inmunosupresores no selectivosInmunosupresores tiopurínicos: azatioprina y mercaptopurina. Están indicados en la corticodependencia, y de forma concomitante a los anti-TNF, para prevenir la inmunogenicidad. La dosis de azatioprina es de 2,5-3mg/kg/día en una sola toma (puede dividirse si hay mala tolerancia). Hay que limitar la exposición solar y utilizar protección solar alta de forma rutinaria debido a su relación con el carcinoma de piel no melanoma. Desde el inicio del tratamiento se puede presentar una cierta disminución del número de leucocitos (linfocitos) y el volumen corpuscular medio aumenta. Los efectos adversos son muy frecuentes y conllevan su retirada en el 15% al 20% de los pacientes (tabla 6). Las recomendaciones analíticas de seguimiento incluyen un control analítico con hemograma y perfil hepático a las 2semanas, al mes, cada 3meses el primer año, y cada 4-6meses durante todo el periodo de tratamiento40.
Consideraciones sobre los efectos adversos de los inmunosupresores tiopurínicos
| Idiosincráticos (no dependientes de la dosis). Aparición precoz, antes de 3 meses de inicio del tratamiento. Cese rápido tras suspender el fármaco |
| Intolerancia digestiva. 10-15%. Mejora fraccionando la dosis, con la administración posprandial y el cambio a 6-MP puede ser una alternativa |
| Pancreatitis aguda. Suele ser leve. No se considera cambiar a 6-MP |
| Síndrome pseudogripal (con fiebre y artralgias). Puede considerarse el cambio a 6-MP |
| Dosis dependientes. Pueden aparecer en cualquier momento. Necesidad de controles periódicos para su prevención y detección |
| Toxicidad medular (1-3%) |
| • Si se presenta una neutropenia leve: <1,5×109 se recomienda reducir la dosis al 50%. Con neutropenia moderada <1×109 se suspende el tratamiento |
| • Si se presenta una linfopenia moderada: <1×109 se recomienda reducir la dosis al 50%. Con linfopenia grave <0,5×109 se suspende el tratamiento |
| Hepatotoxicidad (1-2%) |
| • Puede cursar con patrón de citólisis o de colestasis |
| • Las elevaciones leves y transitorias de transaminasas son frecuentes y sin consecuencias clínicas, se recomienda dividir la dosis a cada 12horas o disminuirse y reintroducir |
| • La hiperplasia nodular regenerativa es una forma infrecuente de hepatotoxicidad tardía por lesión endotelial que se manifiesta como hipertensión portal o trombocitopenia |
6-MP: mercaptopurina.
Metotrexato. Puede utilizarse por vía subcutánea semanal en la EC corticodependiente o asociado a anti-TNF. Su uso es muy inferior al de los tiopurínicos. Los efectos adversos son el aumento de infecciones, el riesgo de teratogenicidad, que lo contraindica en mujeres y hombres que desean descendencia (hay que retirarlo 3meses antes si hay deseo gestacional), la hepatotoxicidad y la toxicidad pulmonar, con riesgo de fibrosis pulmonar. Para la monitorización se aconseja un control analítico mensual durante los 3primeros meses y posteriormente cada 3-4meses, con una elastografía hepática cada 2años a partir del quinto año29.
Fármacos biológicos: Anticuerpos monoclonalesTienen indicación en la inducción y el mantenimiento de la remisión, la corticorresistencia, la corticodependencia, la enfermedad perianal o las manifestaciones extraintestinales, especialmente cuando otros enfoques no han sido suficientes. Los fármacos biológicos se clasifican en función de su mecanismo de acción (tabla 7). Antes del inicio de un fármaco biológico se debe actualizar el calendario vacunal y realizar cribado para tuberculosis (Mantoux y/o IGRA). Se recomienda una revisión con IGRA cada 12-24meses durante el tratamiento.
Clasificación de los fármacos biológicos
| Anti-TNF | Fármacos: infliximab, adalimumab, golimumabMecanismo de acción: bloquean la acción del TNF-alfa, una citoquina proinflamatoria |
| Anticuerpos anti-integrina | Fármacos: vedolizumabMecanismo de acción: bloquean la migración de las células inflamatorias al tejido intestinal |
| Anticuerpos anti-IL-12/IL-23 | Fármaco: ustekinumabMecanismo de acción: bloquea la acción de las citoquinas IL-12 e IL-23, que desempeñan un papel pro-inflamación |
| Anticuerpos anti-IL-23 | Fármacos: risankizumab, mirikizumabMecanismo de acción: bloquean la IL-23 |
Anti-TNF: anti factor de necrosis tumoral; IL: interleucina.
Los efectos adversos con los tratamientos anti-TNF incluyen infecciones (sobre todo en terapia combinada con inmunosupresores), reacciones de hipersensibilidad tras la infusión, reacciones en el punto de inyección en la administración subcutánea, artralgias, hepatitis autoinmune y la aparición de reacciones paradójicas como la psoriasis inducida o fenómenos lupus-like. Los nuevos biológicos, como vedolizumab, ustekinumab, risankizumab y mirikizumab, han aportado un mejor perfil de seguridad con efectos secundarios leves, como cefalea, náuseas, artralgias, faringitis, fatiga o prurito, que rara vez son causa de suspensión del tratamiento. Los fármacos biológicos no tienen interacciones farmacológicas destacables41.
Inhibidores de la JAK-quinasaSon moléculas pequeñas de síntesis química que inhiben los receptores JAK, que modulan diversas respuestas inflamatorias e inmunológicas. Actualmente están aprobados tres inhibidores JAK: tofacitinib, filgotinib y upadacitinib; los dos primeros para CU, y el último, para CU y EC. Están indicados para pacientes con actividad de moderada a grave con respuesta insuficiente, pérdida de respuesta o intolerantes al tratamiento convencional o a un medicamento biológico. Se debe descartar la tuberculosis latente antes y durante el tratamiento. Se ha documentado un aumento en el riesgo de herpes zóster, por lo que se recomienda la vacunación con dos dosis de la vacuna recombinante inactivada Shingrix®, si es posible, antes de iniciar el tratamiento. En pacientes de más de 65años, riesgo vascular elevado o antecedentes de neoplasia se puede usar como alternativa al fallo del resto de tratamientos biológicos. En el seguimiento se vigilarán las posibles citopenias, especialmente linfopenia y el metabolismo lipídico42.
Fármacos para otras indicaciones en pacientes con EIIAINE. El uso de pautas cortas con dosis bajas es seguro, siendo los inhibidores selectivos de la COX-2 los que con menor probabilidad se han asociado a eventos adversos. La recomendación general es evitar su utilización a largo plazo o con dosis elevadas, especialmente en pacientes con EII activa43.
Probióticos. No existe evidencia que respalde el uso de probióticos, ni en inducción ni en el mantenimiento de pacientes con EII. La única indicación aprobada es para la profilaxis de reservoritis con un probiótico específico (formulación De Simone) que lleva una mezcla de Lactobacillus, Bifidobacterium y Streptococcus thermophilus44.
Heparina de bajo peso molecular. Indicada en la profilaxis del tromboembolismo venoso en pacientes ingresados con un brote de EII y un mes tras el alta de una cirugía mayor. No hay evidencia de tromboprofilaxis en pacientes ambulatorios con enfermedad activa45.
Alopurinol. Es un inhibidor de la xantino-oxidasa y aumenta la toxicidad de las tiopurinas cuando se utilizan a la vez. En caso de necesitar realizar tratamiento con alopurinol y tiopurinas se debe reducir la dosis de tiopurinas a un 25-33% de la dosis original, para evitar la aparición de efectos adversos graves40.
Antibióticos. No hay estudios comparativos entre distintos antibióticos que nos permitan determinar cuáles son más apropiados en el contexto de una EII. Tampoco hay evidencia de que el uso de antibióticos pueda desencadenar un brote o presentar un riesgo adicional en pacientes con EII.
Embarazo y EIIAnticoncepciónLa opción anticonceptiva más segura y eficaz es la anticoncepción reversible de acción prolongada, que puede incluir un dispositivo intrauterino hormonal, no hormonal o un implante anticonceptivo. Esto es preferible al anticonceptivo por vía oral, ya que la inflamación activa del intestino, la resección o el tránsito intestinal rápido pueden disminuir su eficacia. Si hay que usar la vía oral emplearíamos un anticonceptivo con dosis bajas de estrógeno, dado el riesgo de tromboembolismo venoso, o un anticonceptivo que solo contenga progestágenos. No hay contraindicación para la contracepción de emergencia46,47.
FertilidadLa EII afecta con mucha frecuencia a pacientes en edad reproductiva, por lo que es importante la información de aspectos como la fertilidad, el riesgo genético o la influencia de la enfermedad en el embarazo. Las mujeres con EII tienen la misma tasa de fertilidad que los controles equiparados por edad, aunque puede disminuir en la enfermedad activa o con el antecedente de cirugía pélvica previa. También pueden influir el menor deseo de maternidad, por miedo a transmitir la enfermedad o al efecto de los tratamientos, la falta de deseo sexual o la dispareunia48. En relación con la terapia de reproducción asistida o la congelación de óvulos, no hay datos que sugieran que los medicamentos para la EII tengan ningún efecto, ni que las hormonas utilizadas en el tratamiento actúen sobre la enfermedad49. Los hijos de padres con EII tienen una predisposición genética a desarrollar la enfermedad. Si uno padece EC o CU, la probabilidad es del 5% y del 3%, respectivamente, y si lo tienen ambos progenitores, del 30%46.
Preconcepción, embarazo y lactanciaLa visita preconcepcional y el asesoramiento previo se asocian con mejores resultados en el embarazo. Es importante que la paciente sepa que debe estar en remisión, idealmente de 3-6meses, antes de la concepción. Esto reduce el riesgo de brote en el embarazo y el posparto, así como el riesgo de aborto, de bajo peso y de parto prematuro50. Hay que establecer, junto con su gastroenterólogo, un plan de tratamiento que mantenga la inactividad de la enfermedad y pueda tomar durante el embarazo. La paciente debe ser consciente de los riesgos de interrumpir la medicación pautada, y el cumplimiento debe ser reforzado desde AP. La mayoría de los medicamentos pueden utilizarse, excepto el metotrexato, que debe ser suspendido 3meses antes, en ambos sexos. Los corticoides estarían indicados a corto plazo en un brote. Los medicamentos biológicos pueden utilizarse durante todo el embarazo47. Se desaconseja el uso de los inhibidores JAK por falta de estudios de seguridad. En los casos en que se considere un embarazo de riesgo, deberá contar con un abordaje multidisciplinar46. Se solicitarán los controles analíticos y de ecografía habituales del programa de embarazo, añadiendo los parámetros de seguimiento de la enfermedad, como la CF, y teniendo en cuenta que las pacientes con EII tienen más riesgo de sufrir déficit de hierro o vitaminaB12. Durante el embarazo se recomienda la vacuna de la gripe, neumococo y hepatitisB si hay factores de riesgo, y la vacuna de difteria, tétanos y tosferina entre las semanas 28 y 36 (idealmente en la 32). Se recomienda también la vacuna del SARS-CoV-2 durante el embarazo o la lactancia51.
Las pacientes pueden tener un parto vaginal, salvo que tengan enfermedad perineal activa, en la que se suele recomendar una cesárea para reducir el riesgo de lesión47. Se debe aconsejar la lactancia materna, pudiendo administrarse los mismos fármacos que están permitidos durante la gestación. Si la madre ha recibido tratamiento biológico durante el embarazo, se deben evitar las vacunas de virus vivos durante los primeros 12meses51.
Vacunación en pacientes con EIIEl cribado de infecciones y el programa de vacunación forman parte de los estándares de calidad de las unidades de EII33. Se recomienda evaluar el estado de inmunización de los pacientes con EII en el momento del diagnóstico antes de iniciar el tratamiento inmunosupresor (siempre que sea posible) y administrar las vacunas apropiadas para evitar las infecciones prevenibles. En las últimas décadas existe un incremento de tratamientos biológicos e inmunosupresores, y las recomendaciones de las pautas de vacunación varían en función del grado de inmunosupresión y seguridad de las vacunas, debiendo tener en cuenta que las vacunas de virus vivos están contraindicadas en pacientes bajo tratamiento inmunosupresor. Desafortunadamente, las tasas de vacunación son subóptimas52. La disponibilidad de un check list (o listado de comprobación) en un formato breve, con indicaciones precisas de vacunas obligatorias y/o recomendadas adaptadas a la situación de inmunosupresión o no de cada paciente, especificando marcas, dosis y pautas, puede mejorar la prescripción, el cumplimiento, la información a los pacientes y la adherencia. El registro de vacunas administradas debe constar en la historia clínica electrónica y durante el seguimiento debe mantenerse actualizado el programa de vacunación. Este check list u hoja de vacunación puede ser pautado desde la unidad de EII y ser entregado al paciente para contactar con su centro de primaria o servicio de preventiva (según protocolo de cada unidad de EII) para su administración. Recientemente se han publicado las recomendaciones de GETECCU (<https://geteccu.org/formacion/documentos-de-posicionamiento>) sobre el cribado y la vacunación en pacientes con EII, donde se puede consultar toda esta información51.
Dieta en los pacientes con EIILa dieta ha sido propuesta como un posible factor ambiental desencadenante de la EII en individuos genéticamente susceptibles. Algunos estudios relacionan el desarrollo de la EII con dietas a base de carnes, grasas y azucares refinados. Aunque es conocido el papel protector de la fibra en el desarrollo de la EII, durante los brotes de la enfermedad es aconsejable hacer una dieta pobre en residuos (eliminar la fibra insoluble), sobre todo en formas estenosantes de la EC o en brote de CU grave o extensa. Los alimentos ricos en fibra insoluble son los alimentos integrales, los preparados que contienen salvado de cereales y vegetales como espárragos, alcachofas, etc. La fibra soluble contenida en frutas y legumbres produce menos residuo y es fermentada por la flora del colon, por lo que puede producir un aumento del dolor abdominal y sensación de flatulencia durante brotes, y debe limitarse únicamente si produce estas molestias53. Los pacientes con EC sin patrón estenosante no deben limitar la dieta con fibra. En pacientes con EC patrón estenosante recomendar modificar la textura de los alimentos con fibras cocinándolos, licuándolos y masticándolos bien, lo que permitirá una mejor tolerancia a la dieta saludable (tabla 8). De forma general, se debe recomendar que sigan una dieta mediterránea, rica en frutas y verduras frescas, grasas monoinsaturadas, hidratos de carbono complejos y grasas magras, y baja en alimentos ultraprocesados, que a menudo contienen azúcar agregado, exceso de sal y otros aditivos alimentarios54. Se pueden consultar diferentes modelos de dietas en función de si los pacientes están o no en brote en la web de GETECCU en <https://educainflamatoria.com/dietas-y-nutricion/>. No hay evidencia consistente que respalde la retirada del gluten en pacientes con EII en ausencia de un diagnóstico de enfermedad celíaca o sospecha de sensibilidad al gluten. Los pacientes con EII solo deben limitar el consumo de lácteos durante los brotes si reiteradamente aumenta su diarrea. La mayoría de los pacientes que son intolerantes a la leche pueden tolerar otros derivados lácteos, como el yogur o quesos curados, cuyo contenido en lactosa es mucho menor. Se deben evitar las dietas de carácter restrictivo54.
Recomendaciones y tipos de dieta según situaciones de la EII
| EII estenosante | SÍ: fibra soluble, cocida o al vapor, fruta pelada, verdura triturada o chafada, masticar bienNO: fibra celulósica indigerible, manzanas sin pelar, brócoli, lechuga, maíz, salvado de cereales, espárragos, alcachofas |
| Nutrición enteral | • Malnutrición o precirugía• EC patrón inflamatorio• CU brote grave no complicado (sin afectación sistémica o megacolon) |
| Nutrición parenteral | • EC penetrante (absceso/flemón)• Fístulas externas muy productivas• Síndrome del intestino corto• Malnutrición grave• CU brote grave con megacolon• Intolerancia a la vía oral |
EC: enfermedad de Crohn; EII: enfermedad inflamatoria intestinal; CU: colitis ulcerosa.
Elaboración propia, adaptada de recomendaciones AGA54.
Se debe valorar en los pacientes con EII si hay evidencia de signos de desnutrición mediante la evaluación de signos y síntomas, incluyendo pérdida de peso involuntaria, edemas y pérdida de grasa y de masa muscular. No se recomienda valorar la desnutrición basándose en el nivel de proteínas o albúmina por su baja especificidad para el estado nutricional y la alta sensibilidad debido a la inflamación. En casos de desnutrición, se recomienda derivar al dietista o al servicio de nutrición para valoración.
Manifestaciones extraintestinales y patología asociada a la EIILas MEI están presentes hasta en la mitad de los pacientes con EII, son más frecuentes en la EC y especialmente en aquellos con enfermedad perianal y afectación colónica, con una actividad paralela a la de la propia enfermedad, salvo en el caso de la espondiloartropatía axial, la uveítis, el pioderma gangrenoso y la colangitis esclerosante primaria (CEP), que presentan un curso independiente55.
Manifestaciones articulares. EspondiloartropatíasSon las MEI más frecuentes. Pertenecen al grupo de las espondiloartritis (SpA) y se dividen en formas axiales y periféricas, pudiendo aparecer antes o después del diagnóstico de la EII56. Es esencial establecer criterios de derivación, predominantemente clínicos, entre los profesionales de AP, Digestivo y Reumatología (tabla 9)57.
Criterios de derivación a Reumatología por sospecha de espondiloartritis en pacientes con EII
| Dolor lumbar crónico (duración más de tres meses) con inicio antes de los 45 años |
|---|
| Dolor lumbar inflamatorio, definido como dolor lumbar y 4 de los 5 criterios siguientes: |
| • Pacientes ≤ 40 años |
| • Comienzo insidioso |
| • Mejoría con el ejercicio |
| • No mejoría con el reposo |
| • Dolor nocturno (con mejoría al levantarse) |
| Manifestaciones periféricas (artritis, entesitis o dactilitis) |
| Sacroileítis en pruebas de imagen (solo si ya se hubieran solicitado, no imprescindible para cribado) |
| HLAB27+ (si disponible, no imprescindible para cribado) |
Elaboración propia, adaptado de Sanz Sanz et al.57.
Espondiloartritis axial. Incluye desde una lumbalgia inflamatoria, con o sin sacroileítis, a una espondilitis anquilosante verdadera. Son menos frecuentes que la SpA periférica, no hay diferencias por sexos y siguen un curso independiente de la actividad de la EII. La sacroileítis puede estar presente radiológicamente en el 20-50% de los pacientes con un porcentaje bajo de progresión, siendo el síntoma típico el dolor lumbar de ritmo inflamatorio, y la mayoría son HLA B27 negativos. La espondilitis anquilosante se presenta en forma de dolor lumbar de ritmo inflamatorio con rigidez matutina espinal de más de 30minutos de duración, persistencia en el tiempo (más allá de los 3meses de duración) y el HLA-B27 puede ser positivo entre el 25 y el 75% de los pacientes con EII. La sospecha se deriva de la clínica y el diagnóstico se realiza mediante resonancia magnética lumbar. Su manejo debe realizarse conjuntamente con Reumatología. La fisioterapia intensiva y los AINE a corto plazo son eficaces. El uso de inhibidores de la COX-2 puede ser una alternativa. La sulfasalazina y el metotrexato no tienen eficacia. Los anti-TNF son el tratamiento de elección para los pacientes intolerantes o refractarios a los AINE, y los inhibidores JAK pueden considerarse como alternativa36,55,58.
Espondiloartritis periférica. El diagnóstico es clínico y se basa en signos de inflamación y la exclusión de otras formas de artritis específicas. La erosión no suele estar presente en las pruebas de imagen (a diferencia de la artritis reumatoide y las conectivopatías). Hay una mayor prevalencia en el sexo femenino y en las formas colónicas. Se han identificado empíricamente dos tipos diferentes. El tipo1, o pauciarticular, afecta a menos de cinco articulaciones, principalmente grandes y de forma asimétrica; los síntomas suelen ser agudos y autolimitados, y generalmente se correlacionan con brotes de EII. El tipo2, o poliarticular, afecta a más de cinco articulaciones pequeñas de miembros superiores, con una distribución simétrica. Los síntomas persisten durante meses y suele tener un curso independiente de la actividad de la EII. Suele responder al tratamiento de la EII.
El reposo, el ejercicio físico, los AINE y las inyecciones intraarticulares de corticoides pueden controlar los síntomas. Los corticoides orales pueden ser eficaces, pero a la dosis más baja y el menor tiempo posible. El metotrexato, la sulfasalazina (único aminosalicilato indicado) y los anti-TNF son eficaces en los casos resistentes56.
Manifestaciones dermatológicasEl eritema nodoso es la MEI cutánea más frecuente. Se caracteriza por la presencia de nódulos cutáneos rojos o violáceos subcutáneos, de 1 a 5cm, en las superficies extensoras de las extremidades; la región pretibial es la más frecuente, y pueden ser dolorosos. El curso clínico se suele asociar a los brotes, y el tratamiento es el de la EII, además del reposo y la analgesia59.
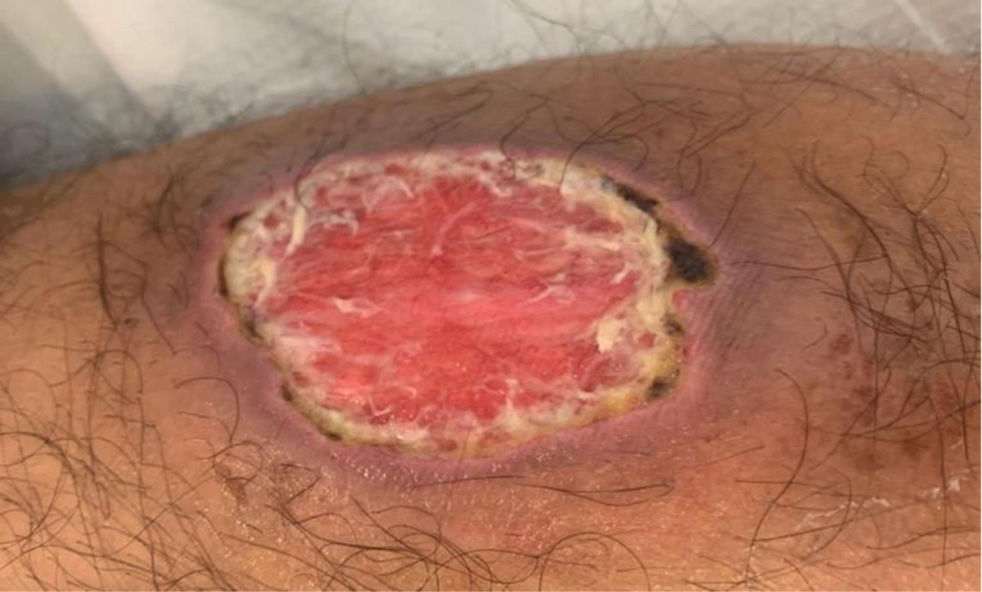
El pioderma gangrenoso se caracteriza por la aparición de una pústula o nódulo en la piel que rápidamente se transforma en una úlcera de bordes violáceos, que puede extenderse por un fenómeno de patergia (fig. 2). Suele aparecer en las extremidades inferiores o en los bordes del estoma. Puede tener un curso independiente al de la EII, y es recomendable la derivación precoz a dermatología. El tratamiento se realiza con tacrolimus tópico, corticoides o fármacos biológicos60.
La hidradenitis supurativa es una enfermedad que afecta a la unidad foliculopilosebácea de diferentes localizaciones, con un curso variable, desde formas leves con pápulas, pústulas y nódulos inflamatorios, hasta cuadros graves con abscesos profundos, fístulas cutáneas y formación de cicatrices61. Los pacientes con EII (más frecuente en EC) tienden a ser más jóvenes, fumadores y con otras comorbilidades asociadas62. El diagnóstico es clínico, y el curso, recurrente. En estadios leves, el resorcinol tópico al 15% (2aplicaciones al día), los corticoides intralesionales (acetónido de triamcinolona o betametasona) y la clindamicina tópica pueden ser útiles. En casos moderados-graves están indicadas la clindamicina y la rifampicina (300mg de cada fármaco cada 12h durante 10semanas), el adalimumab o la acitretina oral. No se recomienda el drenaje quirúrgico de rutina. El manejo del dolor puede hacerse con frío seco local, lidocaína al 5%, diclofenaco en gel al 1% y drenaje de los abscesos.
Existen otras patologías menos frecuentes, como el síndrome de Sweet o la EC metastásica cutánea58.
Por último, están las manifestaciones cutáneas asociadas o inducidas por los tratamientos utilizados en la EII. Entre ellas hay que tener en cuenta los tumores cutáneos no melanómicos asociados a los fármacos tiopurínicos (en estos pacientes se recomienda limitar la exposición solar y utilizar protección solar de forma rutinaria) o el eccema inducido y la psoriasis paradójica por anti-TNF59.
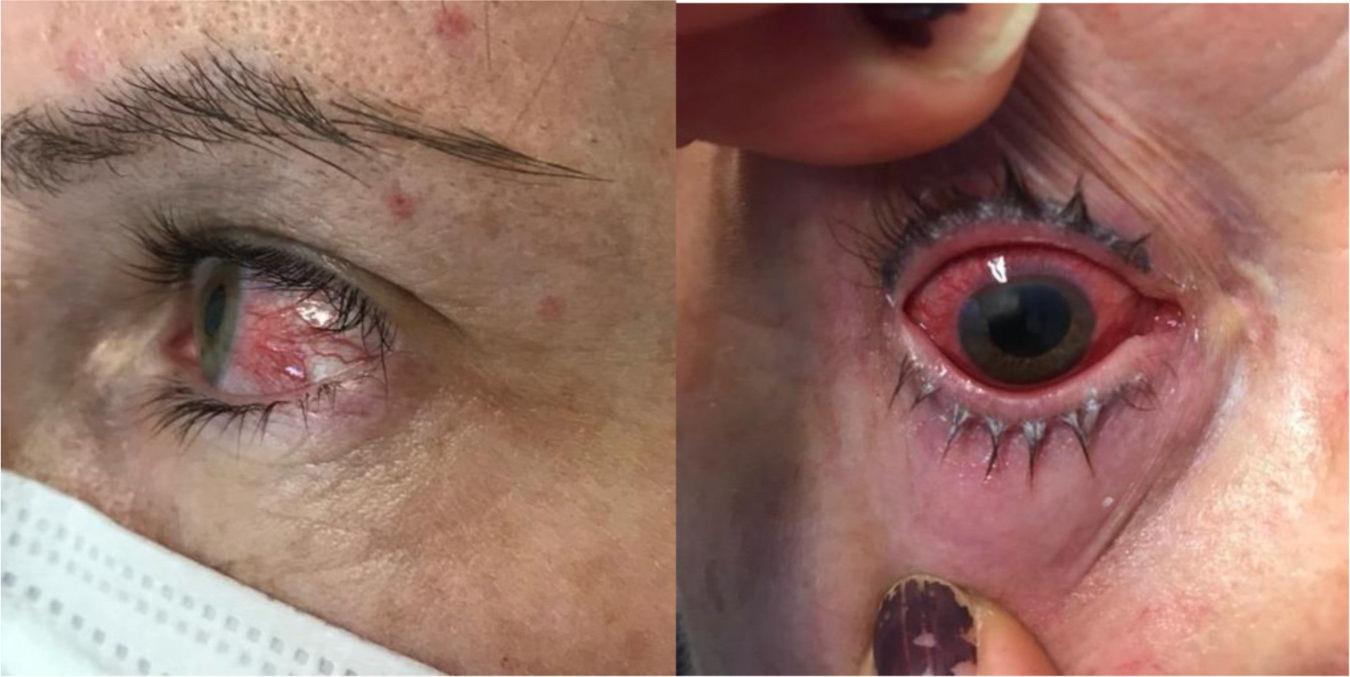
Manifestaciones ocularesLas MEI oculares más comunes son el ojo seco, la blefaritis, la epiescleritis y la uveítis anterior (fig. 3). La escleritis y la uveítis intermedia/posterior son menos frecuentes, pero potencialmente más graves, y constituyen una urgencia oftalmológica. La uveítis en la EC suele ser bilateral, asociada con SpA, más frecuente en mujeres, y puede cursar con ojo rojo, dolor ocular, visión borrosa, fotofobia y cefalea. El tratamiento de la uveítis dependerá del tipo y de la actividad de la EII. Las gotas de corticoides serán el tratamiento inicial en la uveítis anterior, mientras que los corticoides intravítreos o sistémicos se utilizarán en las uveítis intermedias, posteriores o panuveítis. Los anti-TNF están indicados cuando persiste la inflamación ocular o hay actividad de la EII. Las cataratas, la hipertensión ocular o el glaucoma pueden ser complicaciones asociadas al uso de corticoides63.
Manifestaciones hepatobiliaresEn los pacientes con EII es frecuente detectar elevación de las enzimas hepáticas, que puede ser persistente entre el 5 y el 16%. En este caso se deben evaluar causas virales, autoinmunes, metabólicas o farmacológicas. La enfermedad hepática esteatósica asociada a disfunción metabólica se considera la más frecuente y con mayor riesgo de enfermedades cardiovasculares (ECV), siendo importante su cribado y prevención desde AP, al margen de la presencia o no de otros factores de ECV clásicos64.
La CEP es la enfermedad hepática específica más común de la EII (2%), sobre todo con afectación colónica extensa, y casi el 75% de los pacientes con CEP tienen una EII asociada65. Se caracteriza por inflamación, fibrosis y destrucción de la vía biliar, produciendo colestasis, estenosis de los conductos biliares y fibrosis hepática, que puede progresar a cirrosis. Suele ser asintomática en fases tempranas. En fases avanzadas puede cursar con prurito, astenia, ictericia y dolor en hipocondrio derecho, que pueden ser intermitentes y confundirse con brotes de actividad. Suele cursar con una elevación crónica de los niveles de fosfatasa alcalina de 3 a 5 veces. El diagnóstico se realiza por colangioRMN ±biopsia hepática. La CEP progresa independientemente de la EII, confiriéndole un peor pronóstico. En el tratamiento se utiliza el bezafibrato, de primera línea, y la resincolestiramina para el prurito biliar y el ácido ursodesoxicólico (15-20mg/kg/día) para mejorar la analítica hepática, pero estos fármacos no modifican la evolución de la enfermedad66. La CEP incrementa cuatro veces el riesgo de cáncer colorrectal en el paciente con EII, recomendándose una colonoscopia de cribado anual, y el riesgo de neoplasia de vesícula, aconsejando una ecografía abdominal anual55.
El daño hepático inducido por fármacos puede afectar al 10% de los pacientes en tratamiento con metotrexato y entre el 3 y el 15% en el caso de la azatioprina. La hepatotoxicidad por azatioprina suele ser dosis-dependiente y se resuelve al disminuir o retirar el fármaco, aunque también puede provocar daños más graves, como la enfermedad venooclusiva, la peliosis hepática o la hiperplasia nodular regenerativa67.
Enfermedades cardiovasculares y metabólicasLa inflamación crónica de la EII se considera un factor de riesgo cardiovascular independiente y se asocia a arterioesclerosis precoz, eventos trombóticos o alteraciones del ritmo, en especial la fibrilación auricular. Es importante detectar y optimizar los factores de riesgo cardiovascular. Se debe solicitar un electrocardiograma en pacientes con un brote de actividad y taquicardia para descartar una fibrilación auricular68.
Los pacientes con EII, especialmente durante la fase activa de la enfermedad, tienen el doble de riesgo de desarrollar trombosis venosa profunda (TVP), por lo que es fundamental instaurar profilaxis precoz durante los ingresos hospitalarios médicos o por cirugía mayor. Si se produce un evento trombótico debe iniciarse anticoagulación con heparina de bajo peso molecular, para después continuar con anticoagulación oral durante al menos 3meses (salvo si hay un episodio previo, en donde habría que valorar mantenerla de forma indefinida)69. Desde AP es importante informar al paciente acerca de los factores de riesgo de TVP, incluyendo los viajes de larga distancia y los anticonceptivos orales estrogénicos.
La diabetes mellitus tiene una mayor prevalencia en pacientes con EII y se considera un factor de riesgo para el desarrollo de complicaciones70. La prevalencia de sobrepeso/obesidad parece ser similar o ligeramente superior, con un efecto deletéreo sobre la EII por ser el tejido adiposo capaz de producir citoquinas proinflamatorias. Recientemente se ha publicado un documento de consenso sobre el manejo de la obesidad en pacientes con EII71.
Enfermedades pulmonaresLa afectación respiratoria suele ser poco frecuente. Incluye la inflamación de las vías respiratorias, la afectación parenquimatosa, los embolismos pulmonares y las secundarias a la medicación (sulfasalazina, 5-aminosalicilatos, metotrexato, azatioprina o anti-TNF).
Se ha objetivado un aumento de riesgo de bronquiectasias, enfermedad pulmonar intersticial y enfermedad pulmonar granulomatosa en los pacientes con EII55.
Manifestaciones hematológicasLa anemia es la manifestación más frecuente, y se debe evaluar periódicamente dado su impacto en la calidad de vida. Puede ser multifactorial, siendo el déficit de hierro y la anemia por enfermedad crónica las causas más prevalentes en la EII, seguidas del déficit de vitaminaB12 y ácido fólico o las de origen farmacológico. En presencia de inflamación, el criterio de anemia por proceso crónico es una ferritina >100μg/l y un índice de saturación de transferrina <20%. Con hipoalbuminemia la ferritina puede ser falsamente normal. Los pacientes con anemia ferropénica deben recibir tratamiento con hierro hasta normalizar la hemoglobina y los depósitos de hierro. El hierro oral se recomienda en pacientes con anemia leve y sin actividad clínica, y el hierro intravenoso, en los pacientes con anemia moderada/grave, con actividad clínica o intolerancia previa al hierro oral. Se debe monitorizar cada 3-6meses el primer año después de la suplementación. La leucopenia y la trombocitopenia pueden estar presentes, secundarias al uso de inmunosupresores72.
Manifestaciones neurológicasLa más frecuente es la neuropatía periférica y sensitiva, que suele deberse a déficit de vitaminaB12 o al tratamiento prolongado con metronidazol. Las enfermedades desmielinizantes pueden empeorar, y son una contraindicación para el uso de anti-TNF55.
Manifestaciones urinarias y renalesLos aminosalicilatos pueden provocar nefritis intestinal de forma excepcional, por lo que es importante monitorizar la función renal de forma periódica. Existe un riesgo incrementado de litiasis renal (7-10%), especialmente en la EC. La amiloidosis renal es una complicación rara pero grave, asociada a la EC, cuya manifestación más frecuente es la proteinuria73.
Déficit de vitaminas y mineralesLos pacientes con EII tienen un riesgo elevado de presentar deficiencia de vitaminas y minerales (especialmente vitaminaD, vitaminaB12, hierro, calcio y zinc). Por otro lado, la localización, la extensión o la resección quirúrgica afectarán de forma específica a algunos de ellos (vitaminaB12 al íleon terminal; hierro y calcio al intestino delgado). Hay que controlar los brotes, recomendar una dieta equilibrada y corregir los déficits según las alteraciones individuales. Se recomienda un control analítico cada 6-12meses que incluya reactantes de fase aguda, albúmina, perfil ferropénico (especialmente si hay anemia), ácido fólico (especialmente si el paciente toma sulfasalazina o metotrexato), vitaminaB12 (si hay resección o afectación del íleon) e iones (calcio, fósforo, magnesio y potasio) en caso de diarrea crónica55.
Osteopenia, osteoporosisEn la EII existe un riesgo incrementado de osteopenia, de osteoporosis (15%) y de fracturas (40%) con respecto a la población general. Entre los factores que influyen en la reducción de la densidad mineral ósea destacan la inflamación sistémica, el uso de corticoides, la EC, el tabaco, la malabsorción de vitaminaD y calcio, la baja actividad física o la malnutrición. Se recomienda densitometría ósea de cribado en los pacientes que cumplan factores de riesgo (tabla 10), recomendando su repetición a los 2-3años si es normal. El tratamiento incluye medidas higiénico-dietéticas. Se debe suplementar calcio y vitaminaD en pacientes en tratamiento con corticoides, con osteopenia o con riesgo de baja densidad mineral ósea. Ante un elevado riesgo de fractura o empeoramiento, los bifosfonatos pueden ser útiles74.
Indicaciones de densitometría en el paciente con enfermedad inflamatoria intestinal
| Al menos uno de los siguientes criterios: |
| • Antecedente de fracturas vertebrales |
| • Mujeres posmenopáusicas |
| • Tratamiento prolongado con corticoesteroides orales |
| • Varones mayores de 50 años |
| • Hipogonadismo |
Elaboración propia, adaptado de Chaparro et al.75.
Aproximadamente un tercio de los pacientes con EII presentan síntomas de ansiedad o depresión y alteraciones del sueño, incrementándose hasta el 60-80% durante los brotes, con mayor posibilidad de recaída y peor calidad de vida. En niños y adolescentes la enfermedad tiene un impacto negativo en su actividad cotidiana y en la de sus padres76. Desde AP es importante valorar de una forma abierta y empática de qué modo la EII puede afectar a la esfera psicológica, identificando las comorbilidades psicológicas asociadas, derivando a Salud Mental en aquellos casos en los que sea preciso e introduciendo la figura del trabajador social para resolver dudas legales y ofrecer información en cuanto a los recursos sociales disponibles77.
La EII se asocia a una alta prevalencia de disfunción sexual. La naturaleza crónica e intermitente, sus manifestaciones clínicas, como el dolor abdominal, la incontinencia fecal o la enfermedad perianal, las cirugías y los estomas o los trastornos afectivos pueden tener un impacto en la salud sexual. Recientemente se ha publicado un documento de posicionamiento sobre sexualidad y EII78.
FatigaLa fatiga tiene una prevalencia del 40-60% en la enfermedad inactiva y del 80% en la enfermedad activa. Afecta negativamente a la calidad de vida relacionada con la salud independientemente de la actividad de la enfermedad. Es importante descartar déficits nutricionales (hierro y vitaminas) y explorar comorbilidades como el dolor, la ansiedad y los trastornos del sueño. Debe recomendarse una dieta completa y equilibrada, y la realización de ejercicio físico gradual, aeróbico de moderada intensidad79.
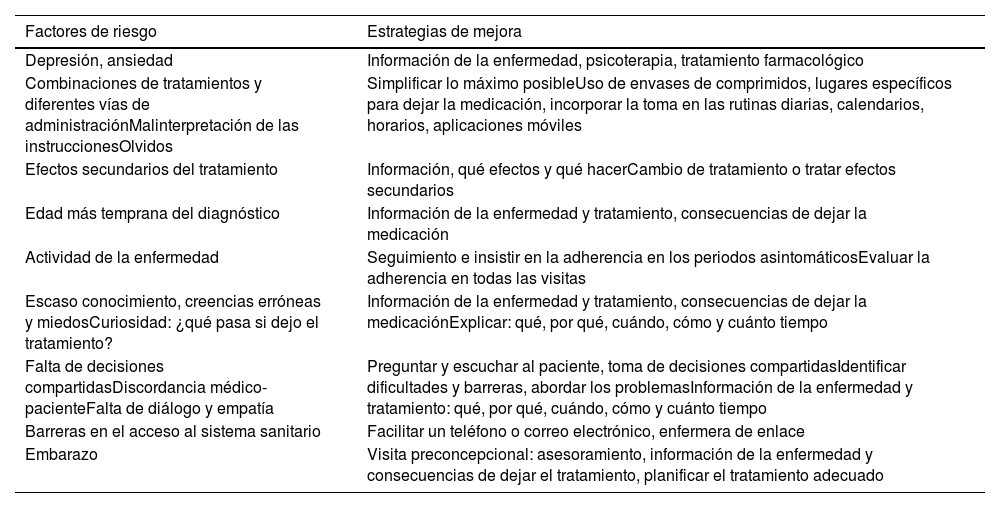
Información de la enfermedad, autocuidado y control de la adherenciaLa EII es una enfermedad crónica, por lo que los pacientes van a tener que seguir una serie de cuidados, seguimiento y tratamiento durante toda la vida. Esto puede hacer que los pacientes se cansen, frustren y abandonen el tratamiento80. Los médicos de familia pueden colaborar en la información sobre la enfermedad, la medicación o los efectos secundarios, y fomentar el empoderamiento del paciente, el autocuidado y los cambios en el estilo de vida, que favorecen los síntomas subjetivos y mejoran la calidad de vida81. La falta de adherencia puede afectar a la calidad de vida, con más hospitalizaciones, mayor coste y peor pronóstico de la enfermedad. Por ello, reconocer y mejorar esta adherencia se convierte en un objetivo principal del tratamiento82. Hay diferentes factores que pueden desencadenar una mala adherencia y posibles soluciones que se revisan en la tabla 11. El abordaje debe ser individualizado y multidisciplinar (gastroenterólogo, farmacéutico, médico de familia, enfermero o psicólogo)83.
Factores que pueden desencadenar mala adherencia y estrategias de mejora
| Factores de riesgo | Estrategias de mejora |
|---|---|
| Depresión, ansiedad | Información de la enfermedad, psicoterapia, tratamiento farmacológico |
| Combinaciones de tratamientos y diferentes vías de administraciónMalinterpretación de las instruccionesOlvidos | Simplificar lo máximo posibleUso de envases de comprimidos, lugares específicos para dejar la medicación, incorporar la toma en las rutinas diarias, calendarios, horarios, aplicaciones móviles |
| Efectos secundarios del tratamiento | Información, qué efectos y qué hacerCambio de tratamiento o tratar efectos secundarios |
| Edad más temprana del diagnóstico | Información de la enfermedad y tratamiento, consecuencias de dejar la medicación |
| Actividad de la enfermedad | Seguimiento e insistir en la adherencia en los periodos asintomáticosEvaluar la adherencia en todas las visitas |
| Escaso conocimiento, creencias erróneas y miedosCuriosidad: ¿qué pasa si dejo el tratamiento? | Información de la enfermedad y tratamiento, consecuencias de dejar la medicaciónExplicar: qué, por qué, cuándo, cómo y cuánto tiempo |
| Falta de decisiones compartidasDiscordancia médico-pacienteFalta de diálogo y empatía | Preguntar y escuchar al paciente, toma de decisiones compartidasIdentificar dificultades y barreras, abordar los problemasInformación de la enfermedad y tratamiento: qué, por qué, cuándo, cómo y cuánto tiempo |
| Barreras en el acceso al sistema sanitario | Facilitar un teléfono o correo electrónico, enfermera de enlace |
| Embarazo | Visita preconcepcional: asesoramiento, información de la enfermedad y consecuencias de dejar el tratamiento, planificar el tratamiento adecuado |
Vivir con una EII tiene un gran impacto. A los síntomas de la enfermedad, a la cronicidad y a la imprevisibilidad de los brotes se puede añadir la percepción de un estigma social que repercute en la autoestima y que puede afectar a las relaciones sociales e interpersonales, favoreciendo el aislamiento84. También pueden verse condicionadas las relaciones íntimas y la función sexual78. En este sentido cobran especial importancia la implementación de estrategias de afrontamiento y las campañas de visibilidad en medios de comunicación y redes sociales, llevadas a cabo, en muchas ocasiones, por organizaciones de pacientes. Los principales motivos por los que las personas con EII recurren a las asociaciones de pacientes son: disponer de información contrastada, fiable y accesible, en un lenguaje adaptado a sus necesidades; conectar con personas con una experiencia similar, para aprender de ellas y ofrecer ese mismo apoyo a otras; y evitar situaciones de soledad no elegida buscando soporte emocional, lo que favorece el desarrollo de herramientas de afrontamiento como son el empoderamiento y la resiliencia85. Pertenecer a una red de apoyo social contribuye a afrontar los retos diarios que supone vivir con una patología crónica, puede disminuir los efectos del estrés psicológico, se ha relacionado de forma directa con una mejora en la calidad de vida, favorece la normalización y la participación en actividades de ocio inclusivo y puede suponer un ahorro de costes sanitarios. Los programas de soporte a través de acompañamiento o mentoría promueven el desarrollo de conductas de autocuidado, autogestión de la propia salud y mejora de la adherencia terapéutica86. Además, pueden proporcionar apoyo psicosocial a familiares y cuidadores de las personas con EII87. Por todo ello, es primordial que los profesionales informen a sus pacientes sobre los beneficios que las asociaciones de pacientes podrían reportarles en el afrontamiento de la EII, como un recurso complementario y de apoyo a la atención sanitaria.
FinanciaciónEl presente trabajo no ha recibido soporte económico.
Consideraciones éticasEl presente trabajo se realizó en plena conformidad con los principios establecidos en la Declaración de Helsinki referente a la investigación médica en seres humanos en su última versión, y de acuerdo con la normativa aplicable sobre Buenas Prácticas Clínicas.
Contribución de los autoresTodos los autores han participado en la conceptualización del proyecto, la redacción y/o la revisión crítica del manuscrito. Todos los autores han dado la aprobación a la versión final del manuscrito a presentar.
Conflicto de interesesDaniel Ginard ha participado como consultor y/o ponente con AbbVie, Adacyte, Biogen, FAES Farma, Ferring, Fresenius Kabi, Janssen, Lilly, Sandoz, Pfizer y Takeda.
Iria Bastón ha participado como consultora y/o ponente con AbbVie, Janssen, Takeda, Pfizer y Adacyte.
Marta Piqueras ha participado como consultora y/o ponente con FAES Farma, Takeda, AbbVie y Janssen.
Pilar Nos ha participado como consultor y/o ponente con FAES Farma, Ferring, Tillotts, AbbVie, Janssen, Lilly, Sandoz, Pfizer, Kern y Takeda.
Míriam Mañosa ha participado como consultor y/o ponente con Dr. Falk, Ferring, Tillotts, AbbVie, Janssen, Lilly, MSD, Pfizer y Takeda.
Manuel Barreiro-de Acosta ha participado como consultor y/o ponente con Pfizer, MSD, Takeda, AbbVie, Kern, Janssen, Fresenius Kabi, Biogen, Sandoz, Ferring, FAES Farma, Shire Pharmaceuticals, Dr. Falk, Chiesi, Gebro Pharma, Adacyte y Tillotts.
Francisco Rodríguez-Moranta ha participado como consultor y/o ponente con FAES Farma, Ferring, Tillotts, AbbVie, Janssen, Lilly, MSD, Pfizer y Takeda.
Yamile Zabana ha participado como consultora y/o ponente con AbbVie, Adacyte, Almirall, Amgen, FAES Farma, Ferring, Fresenius Kabi, Janssen, Lilly, MSD, Otsuka, Pfizer, Sanofi, Shire, Takeda, Galapagos, Boehringer Ingelheim y Tillotts.
Ana Gutiérrez ha participado como consultora y/o ponente con AbbVie, Adacyte Therapeutics, Celltrion, Galapagos, Janssen, Kern Farma, MSD, Pfizer, Takeda, Tillotts y Lilly.
El resto de los autores no declaran conflicto de intereses.
Este artículo ha sido elaborado conjuntamente por Gastroenterología y Hepatología, Gastroenterología y Hepatología (English Edition), Medicina de Familia. SEMERGEN y publicado conjuntamente por Elsevier España S.L.U. Los artículos son idénticos, salvo pequeñas diferencias estilísticas y ortográficas acordes con el estilo de cada revista. Se puede utilizar cualquiera de las dos citas al citar este artículo.