La enfermedad renal crónica (ERC) es un problema de salud pública. La Atención Primaria (AP) es clave en su detección y estratificación, mediante el filtrado glomerular estimado (FGe) y el grado de albuminuria, para un correcto manejo. Nuestro objetivo ha sido valorar la prevalencia de pacientes atendidos en AP con ERC y su estratificación.
Material y métodosHemos analizado la prevalencia de ERC en pacientes mayores de 18 años y su estratificación según las guías Kidney Disease-Improving Global Outcomes, a través de los controles bioquímicos solicitados desde AP durante 5 años. Cuando un mismo paciente disponía de varios controles bioquímicos se seleccionó el control con mejor FGe.
ResultadosEntre 2010 y 2014 se solicitaron desde AP de nuestra área de salud 304.523 analíticas pertenecientes a 97.470 pacientes, con una edad media de 53,4±19,4 años; el 57,2% eran mujeres. La prevalencia de FGe<60mL/min/1,73m2 fue del 7,6%. Del total de analíticas, solo el 16,6% disponían de alguna cuantificación de albuminuria o proteinuria, correspondientes al 15,2% de los pacientes. La albuminuria fue cuantificada en el 15,4% de los controles con FGe ≥ 60 mL/min/1,73m2. En aquellos con FGe entre 30-59mL/min/1,73m2 (estadios G3a-3b) la determinación de albuminuria o proteinuria fue del 27,1%, y en los que tenían un FGe<30mL/min/1,73m2 (estadios G4-5) fue del 23,4%. En los diabéticos ascendía al 37,7% y era del 23,5% en los pacientes con glucemia basal alterada.
ConclusionesLa determinación de albuminuria sigue siendo poco solicitada. Solo uno de cada 6 pacientes atendidos en AP puede ser correctamente estratificado, aunque es algo superior en pacientes con FGe disminuido y diabéticos.
Chronic kidney disease (CKD) is a public health problem, and Primary Care (PC) plays a key role in its detection and classification based on estimated glomerular filtration rate (eGFR), as well as the level of albuminuria for its proper management. The aim of this study was to analyse the prevalence and classification of CKD in patients attended in PC.
Material and methodsAn analysis was made of CKD prevalence and classification according to the Kidney Disease-Improving Global Outcomes guidelines in PC patients. All biochemical analyses requested from PC on patients 18 years and older over a 5-year period were collected. When several analyses were available on a patient, the biochemistry result with the best eGFR was selected.
ResultsBetween 2010 and 2014, PC requested 304,523 biochemical analyses on 97,470 adult patients, with a mean age of 53.4±19.4 years, of which 57.2% were women. CKD prevalence was 7.6%. Urine protein results were present in only 16.6% of analyses, and only 15.2% patients had a urine protein result. Urine albumin was measured 15.4% of biochemical controls with eGFR≥60mL/min/1.73m2, in 27.1% of patients with eGFR between 30-59mL/min/1.73m2 (G3a-3b stages), and in 23.4% of patients with eGFR<30mL/min/1.73m2 (G4-5 stages). Urine albumin was tested in 37.7% of diabetics and in 23.5% of impaired fasting glucose.
ConclusionsRequests for the measurement of urine proteins/albumin in PC patients are low, leading to only one in 6 PC patients being classified correctly. The measurement of urine proteins/albumin is higher in CKD and diabetic patients.
La enfermedad renal crónica (ERC) ha sido reconocida en los últimos años como un problema de salud pública1. En este cambio conceptual ha sido fundamental establecer una definición y una clasificación consensuadas, basadas en el filtrado glomerular estimado (FGe) mediante el uso de ecuaciones y en la excreción urinaria de albúmina o proteínas2. La introducción del FGe junto con los niveles de creatinina sérica en los informes bioquímicos de laboratorio de manera automatizada ha permitido detectar precozmente a los pacientes con disminución del mismo3,4. Sin embargo, la presencia de albuminuria, clave en la estratificación de los pacientes con ERC5 por la implicación que esta tiene en la progresión de la ERC o en la aparición de eventos cardiovasculares para cualquier estadio de FGe6,7, independientemente de otros factores8, puede pasar desapercibida. La albuminuria puede ser la primera manifestación de daño renal en múltiples enfermedades renales antes de la disminución del FGe, siendo el prototipo la nefropatía diabética. Las guías recomiendan la determinación del cociente albúmina/creatinina (CAC) en muestra aislada de orina por su facilidad de recogida y su correlación con la medida en orina de 24h y la aparición de eventos renales y cardiovasculares2.
El objetivo de nuestro estudio ha sido analizar la prevalencia de pacientes atendidos en Atención Primaria (AP) con FGe disminuido y la medición de proteinuria o albuminuria tanto en la población general como en los pacientes con FGe disminuido y en aquellos con alteraciones de perfil glucémico.
Material y métodosPara el estudio se han recogido todos los controles bioquímicos solicitados desde AP, realizados en el laboratorio general del Servicio de Análisis Clínico del Hospital San Pedro de Alcántara de Cáceres, desde enero de 2010 hasta diciembre de 2014 (5 años). Los criterios de selección fueron: analíticas con un perfil básico procedentes de centros de salud de AP. Los criterios de exclusión fueron: pacientes menores de 18 años, analíticas con un código de identificación distinto del Código de Identificación Personal (CIP), único para cualquier usuario atendido en el Servicio Extremeño de Salud, y aquellas procedentes de centros de salud de AP fuera de nuestra área de referencia.
Cuando un mismo paciente, identificado mediante su CIP, disponía de varios controles analíticos se consideraron 2 escenarios tanto para el FGe como para la proteinuria. El primero recogía el mejor resultado, mientras que el segundo recogía el peor de los controles.
La ERC fue estratificada según las guías Kidney Disease: Improving Global Outcomes (KDIGO)2 en función del FGe mediante la ecuación Chronic Kidney Disease-Epidemiology Collaboration (CKD-EPI) en 6 estadios: G1>90mL/min/1.73m2; G2 entre 89-60mL/min/1.73m2; G3a entre 59-45mL/min/1.73m2; G3b entre 44-30mL/min/1.73m2; G4 entre 29-15mL/min/1.73m2; y G5<15mL/min/1.73m2, y la excreción urinaria de proteínas o albúmina (de acuerdo con el CAC o sus valores equivalentes según Lamb et al.9) en 3 grados: A1<30mg/g; A2 entre 30-300mg/g; y A3>300mg/g, o equivalentes. Se consideró ERC la presencia de un FGe estadio G3a o superior y/o proteinuria grado A2 o superior.
Se analizó el porcentaje de pacientes en los que se solicitaba proteinuria o albuminuria en función de los distintos estadios de FGe y en función de los niveles de glucemia basal. Se consideró que un pacientes era normoglucémico cuando los niveles de glucemia basal eran<100mg/dL, con glucemia basal alterada (GBA) si estaban entre 100 y 125mg/dL y diabético si eran≥126mg/dL.
El estudio contó con el permiso del Comité Ético del Complejo Hospitalario de Cáceres.
Análisis estadísticoLas variables continuas se expresan por la media y la desviación estándar o por la mediana y el rango intercuartílico cuando la distribución fue no normal. La normalidad de las variables cuantitativas se determinó con las pruebas de Kolmogorov-Smirnov y homocedasticidad. Las variables cualitativas se expresan según la tasa bruta (frecuencia). Las prevalencias de las variables analizadas se expresan según las tasas brutas para el global de la muestra y separadas por quinquenios y género. Las variables cuantitativas fueron analizadas mediante el test de la t de Student para muestras independientes o ANOVA en función del número de grupos a comparar. Las variables cualitativas se analizaron mediante el test de Chi cuadrado. El nivel de significación establecido fue del 95% (p<0,05). El análisis estadístico se realizó con el programa SPSS versión 18.0 para Windows (SPSS Inc., Chicago, IL, EE. UU.).
ResultadosEl Área de Salud de Cáceres da asistencia sanitaria directa a 196.363 habitantes (48% de la población de la provincia de Cáceres) en 26 centros de salud. El laboratorio de análisis clínicos del Hospital San Pedro de Alcántara es referencia para 18 de los centros de salud, con una población de referencia de 164.103 habitantes (83,6% del área de salud y 40,2% de la provincia).
Entre el 1 de enero de 2010 y el 31 de diciembre de 2014 (5 años) dicho laboratorio realizó 529.877 controles bioquímicos con el perfil básico a usuarios mayores de 18 años. Se excluyeron 615 analíticas por pertenecer a usuarios de otras áreas de salud, 5.025 por presentar una codificación distinta al CIP, 3 por no disponer de la edad, 165.366 por provenir de consultas externas hospitalarias, 26.607 pertenecientes a pacientes hospitalizados, 5.105 procedentes de urgencias, 9.373 de pacientes en terapia renal sustitutiva, 1.491 procedentes de otros centros de salud y 11.769 de otras procedencias diversas. Finalmente, se incluyeron en el estudio 304.523 analíticas de los 18 centros de salud de referencia.
Mediante el CIP, identificamos a 97.470 usuarios únicos (59,4% de la población de referencia del laboratorio, 49,6% de la población del Área de Salud de Cáceres y 23,8% de la provincia de Cáceres). La edad media fue 53,4±19,4 años (rango 18-104). Eran mayores de 65 años 28.886 pacientes (29,6%), y 10.835 (11,1%) eran mayores de 80 años. El 57,2% eran mujeres.
La media de analíticas por usuario fue de 3,1±3,6, con una mediana de 2 (rango intercuartílico 1-4), rango 1-46. La distribución del número de analíticas por usuario fue: una, 32%, 2, 22%, 3, 15,4%, 4, 10,6%, 5, 7,2%, 6, 4,6%, 7, 2,9%, 8, 1,8%, 9, 1,1%, 10 o más, 2,4%.
Filtrado glomerular estimado mediante CKD-EPILa media del FGe del total de analíticas fue 86,7±21,2mL/min/1,73m2. En el caso de varios controles analíticos realizados a un mismo individuo, seleccionando el mejor (primer escenario) o el peor FGe (segundo escenario), las medias del FGe fueron 93,6±20,4 y 84,3±22mL/min/1,73m2, respectivamente.
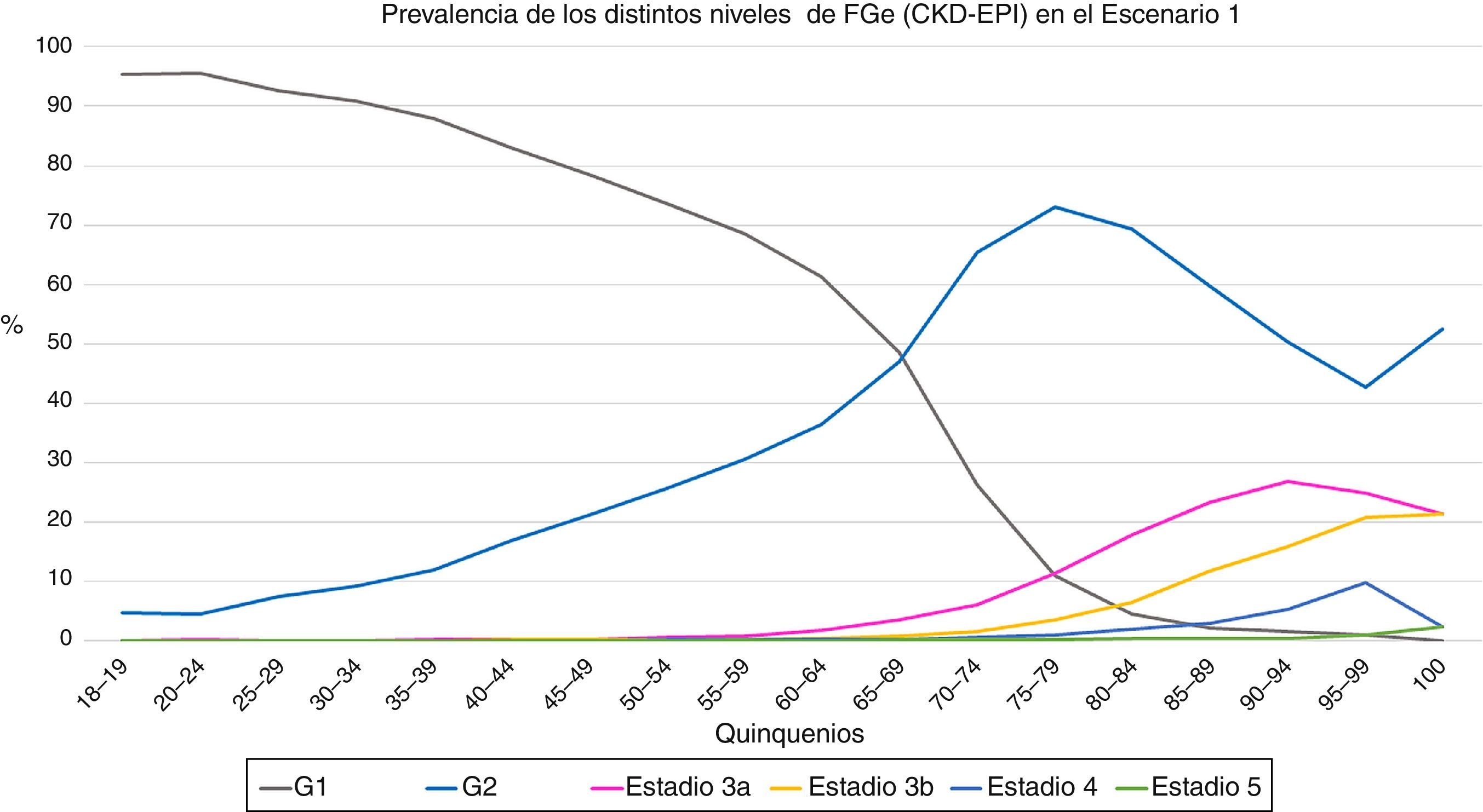
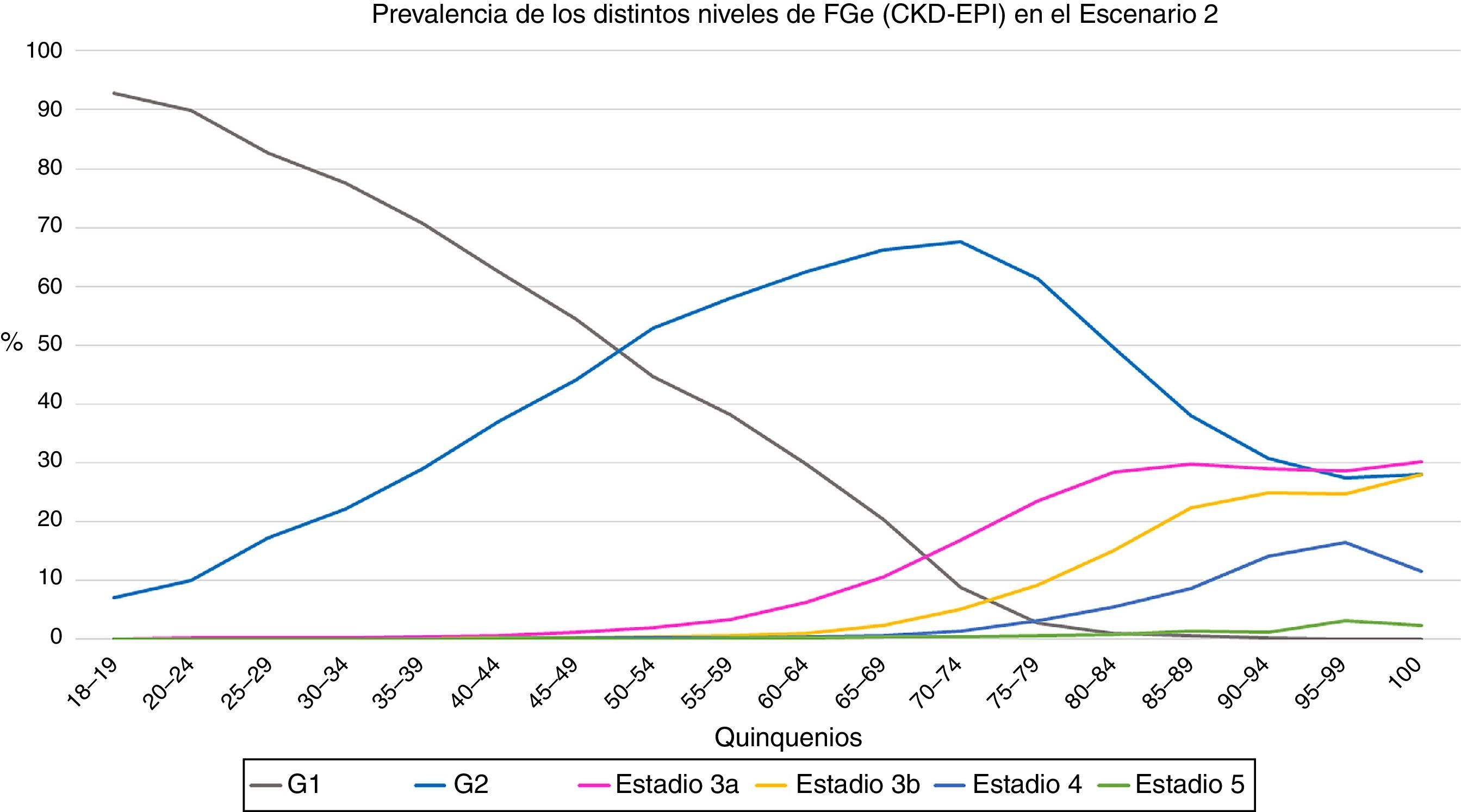
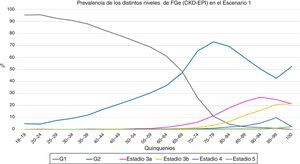
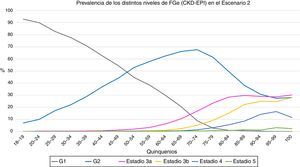
En el primer escenario, la prevalencia de FGe<60mL/min/1,73m2 fue de un 6,3%; un 5,8% para hombres y un 6,8% para mujeres (p<0,001). En el segundo escenario, la prevalencia de FGe<60mL/min/1,73m2 se situó en 13,1%; un 11,5% para los hombres y un 14,2% para las mujeres (p<0,001). En las figuras 1 y 2 se muestran las prevalencias de los distintos estadios de FGe en cada uno de los quinquenios.
Evolución de la prevalencia de los distintos niveles de filtrado glomerular estimado (CKD-EPI) en función de los quinquenios en el primer escenario. G1 = categoria de filtrado glomerular > 90 ml/min (con o sin ERC), G2 categoria de filtrado glomerular 60-89 ml/min (con o sin ERC), estadios 3 y superiores incluyen enfermedad renal crónica.
Evolución de la prevalencia de los distintos niveles de filtrado glomerular estimado (CKD-EI) en función de los quinquenios en el segundo escenario. G1 = categoria de filtrado glomerular > 90 ml/min (con o sin ERC), G2 categoria de filtrado glomerular 60-89 ml/min (con o sin ERC), estadios 3 y superiores incluyen enfermedad renal crónica.
Del total de analíticas solicitadas desde AP, solo 50.561 (16,6%) disponían de alguna medición de la excreción urinaria de proteínas (bien albuminuria, bien proteinuria), correspondientes a 26.802 pacientes (27,5%). La medición más solicitada fue el CAC en 50.202 analíticas (99,3%), seguido por la determinación de proteinuria aislada o el cociente proteinuria/creatinina en 1.350 analíticas (2,7%), la albuminuria en 24h en 388 analíticas (0,8%) y la proteinuria en 24h en 377 analíticas (0,7%). En 1.736 controles bioquímicos (3,4%) se solicitó la medición simultánea de proteínas y albúmina en orina, bien en muestra aislada, bien de 24h. En dichos casos se consideró para la estratificación el valor más elevado.
La prevalencia de proteinuria grado A2 en el primer escenario fue del 7,5%, mientras que en el segundo escenario ascendió al 11,8%. Entre géneros, en el primer escenario las prevalencias fueron del 8,3% en hombres y del 6,7% en mujeres (p<0,001), mientras que en el segundo escenario las prevalencias alcanzaron el 12% en hombres y el 11,6% en mujeres (p<0,001).
La prevalencia de proteinuria grado A3 en el primer escenario fue del 1,6%, y ascendió al 2,5% en el segundo escenario. Las prevalencias en función del género fueron para los hombres del 2 y del 3,1%, y para las mujeres, del 1,2 y del 2% en el primer y segundo escenarios, respectivamente.
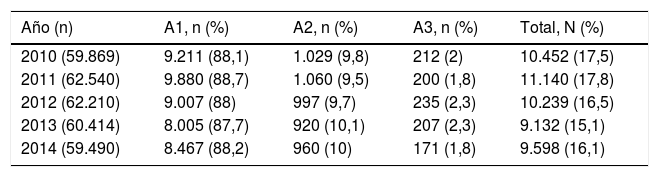
El número anual de analíticas que disponían de alguna medición de la albúmina o la proteinuria para su estratificación se muestra en la tabla 1. En el análisis estadístico no hubo diferencias en la distribución de los grados de proteinuria entre los años recogidos.
Distribución anual del número de analíticas con cuantificación de la proteinuria y su distribución por niveles
| Año (n) | A1, n (%) | A2, n (%) | A3, n (%) | Total, N (%) |
|---|---|---|---|---|
| 2010 (59.869) | 9.211 (88,1) | 1.029 (9,8) | 212 (2) | 10.452 (17,5) |
| 2011 (62.540) | 9.880 (88,7) | 1.060 (9,5) | 200 (1,8) | 11.140 (17,8) |
| 2012 (62.210) | 9.007 (88) | 997 (9,7) | 235 (2,3) | 10.239 (16,5) |
| 2013 (60.414) | 8.005 (87,7) | 920 (10,1) | 207 (2,3) | 9.132 (15,1) |
| 2014 (59.490) | 8.467 (88,2) | 960 (10) | 171 (1,8) | 9.598 (16,1) |
A1: cociente albúmina/creatinina<30mg/g o equivalente; A2: cociente albúmina/creatinina 30-299mg/g o equivalente; A3: cociente albúmina/creatinina≥300mg/g o equivalente.
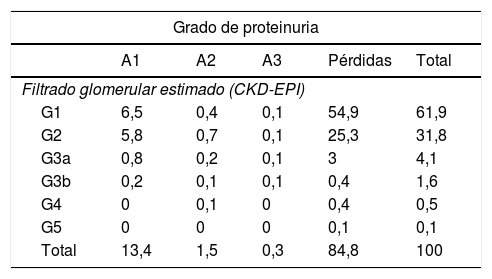
Si clasificamos los 97.470 pacientes, de acuerdo con los criterios KDIGO, en función del mejor FGe en caso de varios controles bioquímicos, vemos como el 84,8% de los pacientes carece de cuantificación de proteinuria, siendo mayoritariamente pacientes con FGe≥60mL/min/1,73m2, donde el grado de la albuminuria es necesario para establecer el diagnóstico de ERC (tabla 2).
Distribución de los 97.470 pacientes en función del filtrado glomerular estimado mediante CKD-EPI y el grado de proteinuria
| Grado de proteinuria | |||||
|---|---|---|---|---|---|
| A1 | A2 | A3 | Pérdidas | Total | |
| Filtrado glomerular estimado (CKD-EPI) | |||||
| G1 | 6,5 | 0,4 | 0,1 | 54,9 | 61,9 |
| G2 | 5,8 | 0,7 | 0,1 | 25,3 | 31,8 |
| G3a | 0,8 | 0,2 | 0,1 | 3 | 4,1 |
| G3b | 0,2 | 0,1 | 0,1 | 0,4 | 1,6 |
| G4 | 0 | 0,1 | 0 | 0,4 | 0,5 |
| G5 | 0 | 0 | 0 | 0,1 | 0,1 |
| Total | 13,4 | 1,5 | 0,3 | 84,8 | 100 |
A1: cociente albúmina/creatinina<30mg/g o equivalente; A2: cociente albúmina/creatinina 30-299mg/g o equivalente; A3: cociente albúmina/creatinina≥300mg/g o equivalente; CKD-EPI: Chronic Kidney Disease-Epidemiology Collaboration.
Los valores representan porcentajes. Las tonalidades de gris agrupan a los pacientes en función del riesgo de progresión de la enfermedad renal o de tener un evento cardiovascular: riesgo bajo (blanco), riesgo moderadamente incrementado, riesgo alto y riesgo muy alto (gris oscuro).
La prevalencia de ERC, bien por la presencia de FGe disminuido, bien por la presencia de albuminuria elevada, fue del 7,6%.
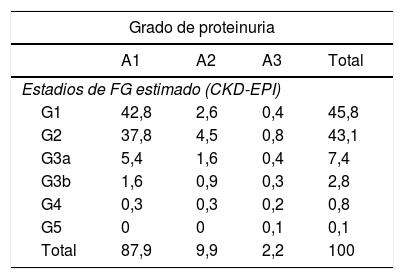
Si seleccionamos únicamente a los 14.837 pacientes con FGe y cuantificación de albuminuria o proteinuria, quedándonos en el caso de varios controles bioquímicos con aquel con mejor FGe y los distribuimos de acuerdo con la clasificación KDIGO para la valoración del pronóstico de la ERC, la afectación renal ascendería al 19,4%. Presentarían un riesgo de progresión muy elevado el 2,5%, alto el 4,4% y moderado el 12,5% (tabla 3).
Pronóstico de la enfermedad renal crónica en función del estadio de filtrado glomerular estimado y el grado de proteinuria según las guías KDIGO sobre enfermedad renal crónica
| Grado de proteinuria | ||||
|---|---|---|---|---|
| A1 | A2 | A3 | Total | |
| Estadios de FG estimado (CKD-EPI) | ||||
| G1 | 42,8 | 2,6 | 0,4 | 45,8 |
| G2 | 37,8 | 4,5 | 0,8 | 43,1 |
| G3a | 5,4 | 1,6 | 0,4 | 7,4 |
| G3b | 1,6 | 0,9 | 0,3 | 2,8 |
| G4 | 0,3 | 0,3 | 0,2 | 0,8 |
| G5 | 0 | 0 | 0,1 | 0,1 |
| Total | 87,9 | 9,9 | 2,2 | 100 |
A1: cociente albúmina/creatinina<30mg/g o equivalente; A2: cociente albúmina/creatinina 30-299mg/g o equivalente; A3: cociente albúmina/creatinina≥300mg/g o equivalente; CKD-EPI: Chronic Kidney Disease-Epidemiology Collaboration; KDIGO: Kidney Disease: Improving Global Outcomes.
Los valores representan porcentajes. Las tonalidades de gris agrupan a los pacientes en función del riesgo de progresión de la enfermedad renal o de tener un evento cardiovascular: riesgo bajo (blanco), riesgo moderadamente incrementado, riesgo alto y riesgo muy alto (gris oscuro).
- a)
En función del FGe
Los controles bioquímicos de pacientes con FGe<30mL/min/1,73m2 (G4-5) disponían de medición de albuminuria o proteinuria en el 23,4% de los casos; cuando el FGe estaba entre 59 y 30mL/min/1,73m2 (G3a-3b), en el 27,1%, y si el FGe era≥60mL/min/1,73m2 (G1-2), en el 15,4%. Y la prevalencia de proteinuria grado A2 fue del 7,1, 5,1 y 1,2%, mientras que la prevalencia de proteinuria grado A3 fue del 5,3, 1,3 y 0,2%, respectivamente (p<0,001).
- b)
En función de la glucemia
En las analíticas de pacientes normoglucémicos, solo el 12,4% disponían de cuantificación de proteinuria; ascendía al 23,5% en el caso de analíticas con GBA, y en el caso de analíticas de diabéticos, al 37,7%.
En el total de las analíticas analizadas, la prevalencia de proteinuria grado A2 y A3 aumentó en función de los niveles de glucemia de la analítica. Mientras que en normoglucémicos la prevalencia de proteinuria grado A2 era del 7%, en pacientes con GBA aumentaba al 9,5% y en diabéticos al 17,7% (p<0,001). Y la prevalencia de proteinuria grado A3 pasaba de un 1,3% en pacientes normoglucémicos al 1,8% en pacientes con GBA y alcanzaba el 4,1% en pacientes diabéticos (p<0,001).
- c)
Relación de la proteinuria con la glucemia y el FGe
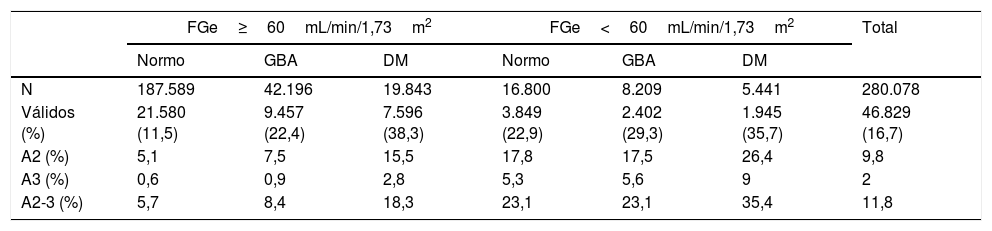
Si distribuimos las analíticas en función del FGe disminuido y la presencia de normoglucemia, GBA o diabetes, vemos que el porcentaje de analíticas con medición de proteinuria es mayor en los pacientes con FGe disminuido y en los diabéticos. La presencia de albuminuria y proteinuria se va incrementando desde el 5,7% en las analíticas de pacientes con normoglucemia y FGe conservado hasta alcanzar el 35,4% en las analíticas de diabéticos con FGe disminuido (tabla 4).
Porcentaje de albuminuria y proteinuria en función del filtrado glomerular estimado y el rango de glucemia
| FGe≥60mL/min/1,73m2 | FGe<60mL/min/1,73m2 | Total | |||||
|---|---|---|---|---|---|---|---|
| Normo | GBA | DM | Normo | GBA | DM | ||
| N | 187.589 | 42.196 | 19.843 | 16.800 | 8.209 | 5.441 | 280.078 |
| Válidos (%) | 21.580 (11,5) | 9.457 (22,4) | 7.596 (38,3) | 3.849 (22,9) | 2.402 (29,3) | 1.945 (35,7) | 46.829 (16,7) |
| A2 (%) | 5,1 | 7,5 | 15,5 | 17,8 | 17,5 | 26,4 | 9,8 |
| A3 (%) | 0,6 | 0,9 | 2,8 | 5,3 | 5,6 | 9 | 2 |
| A2-3 (%) | 5,7 | 8,4 | 18,3 | 23,1 | 23,1 | 35,4 | 11,8 |
A2: cociente albúmina/creatinina entre 30-299mg/g o equivalente; A3: cociente albúmina/creatinina≥300mg/g o equivalente; DM: diabetes mellitus; FGe: filtrado glomerular estimado; GBA: glucemia basal alterada; Normo: glucemia basal<100mg/dL.
En normoglucémicos, el FGe disminuido multiplicaba por 4 la prevalencia de albuminuria elevada. En pacientes con GBA, el FGe disminuido multiplicaba por 3 la prevalencia de albuminuria elevada. Mientras que en diabéticos, el FGe disminuido multiplica por 2 la presencia de albuminuria elevada.
El impacto de la diabetes sobre la presencia de albuminuria elevada depende del FGe. Si en pacientes con FGe≥60mL/min/1,73m2 la prevalencia de albuminuria elevada se multiplica por 3 al comparar sujetos normoglucémicos con los diabéticos, en pacientes con FGe<60mL/min/1,73m2, la prevalencia de albuminuria elevada se incrementa solo 1,5 veces.
DiscusiónNuestro trabajo recoge los controles bioquímicos solicitados a pacientes mayores de 18 años, durante 5 años, por médicos de AP pertenecientes a 18 de los 26 centros de salud del Área de Salud de Cáceres. La población general perteneciente a estas zonas básicas de salud suponen el 83,6% del Área de Salud de Cáceres y el 40,2% de la provincia de Cáceres.
A lo largo de estos años, hemos recogido para el análisis más de 300.000 controles bioquímicos, pertenecientes a cerca de un 60% de la población de referencia, lo que supone un 23,8% de los habitantes de la provincia de Cáceres y un 8,9% de la población extremeña, con un predominio de la representación del género femenino, en probable relación con la mayor frecuentación de las mujeres y el aumento de la demanda asistencial con la edad a los centros de salud10. Y con un importante grado de envejecimiento.
Evaluación de la función renal y prevalencia de afectación renalNuestros datos muestran una prevalencia de ERC del 7,6%, si tenemos en cuenta la presencia de FGe disminuido y/o proteinuria elevada. Si consideramos únicamente los datos del FGe, la prevalencia de pacientes atendidos en AP con FGe reducido estaría entre el 6,3% en el primer escenario y el 13,1% en el segundo. Esto implica que a lo largo del seguimiento de nuestro estudio más de un 10% de los pacientes atendidos en AP presentan un FGe disminuido, con el consiguiente reto asistencial.
Los resultados de prevalencia de FGe disminuido en el primer escenario son similares a los de otros estudios sobre prevalencia de ERC publicados en España, como los que muestra el estudio EPIRCE a nivel nacional, con una prevalencia del 6,8%11, los publicados en el Área de Salud de Plasencia (Cáceres) con nuestra misma sistemática12, y los extraídos del estudio Intervención Multidisciplinar en Atención Primaria –IMAP–, de Hernandez et al., que identifican un 7,9% de pacientes con ERC13. Y en el segundo escenario serían concordantes con los publicados por Salvador Gonzalez et al. en población atendida en AP de 60 años o más, donde detectan una prevalencia de ERC del 15,1%14. Sin embargo, estarían por debajo de los reportados en pacientes atendidos en AP por el estudio EROCAP, donde la prevalencia de ERC fue del 21,3%15, o en el estudio PREV-ICTUS, que fue del 33,9%16. Esta discrepancia podría deberse a la selección de los pacientes; en el primero, el 30% eran diabéticos, el 66%, hipertensos, el 48%, dislipidémicos, y el 24% habían presentado un evento cardiovascular, mientras que en el segundo, los pacientes tenían una edad de 60 años o superior, más del 70% eran hipertensos, más del 25% eran diabéticos y habían experimentado un evento cardiovascular más de un 25%.
En cuanto a la determinación de proteinuria, nuestro trabajo muestra, en primer lugar, la baja implantación que tiene en los controles rutinarios solicitados desde AP, puesto que únicamente se solicita en una de cada 6 analíticas y a lo largo de 5 años solamente un 25% de los pacientes disponía de alguna medición. No obstante, es cierto que en su determinación se siguen las recomendaciones dadas por las guías, puesto que en la mayoría de los casos se solicita el CAC, siendo excepcional la solicitud en orina de 24h, al ser una prueba sencilla y con un elevado valor predictivo de riesgo cardiovascular, además de ser coste-eficaz2,9,17. En este sentido, consideramos que su realización debería implementarse de manera rutinaria en los controles solicitados por los médicos de AP, en especial en pacientes hipertensos o diabéticos18,19.
Nuestros datos muestran una prevalencia de albuminuria o proteinuria elevada en aquellos pacientes en los que se determina su cuantificación, del 9,1% en el primer escenario y del 14,3% en el segundo escenario. Son superiores a los reportados en estudios poblacionales como el estudio EPIRCE, donde la prevalencia de albuminuria o proteinuria fue del 2,8%11, o el estudio HERMEX, donde fue del 5,5%20. Pero se asemejan a los obtenidos por Gomez-Marcos et al. en pacientes hipertensos, donde la prevalencia fue del 9,2%21, o en población mayor de 65 años del estudio HERMEX, donde la prevalencia fue del 10,9%22. El estudio MICREX mostró una prevalencia de albuminuria en pacientes hipertensos del 12,4% y en diabéticos del 21,4% (en diabéticos sin hipertensión, del 15,5%, y con hipertensión, del 33,8%)23. Nuestros datos pueden sobrestimar la prevalencia de albuminuria o proteinuria encontrada en estudios poblacionales porque observamos que las solicitudes realizadas desde AP son escasas, solo uno de cada 6 controles analíticos y solo en uno de cada 4 pacientes a lo largo de 5 años, lo que nos orienta a pensar que la solicitud del CAC se realiza en pacientes seleccionados. En nuestra muestra, la solicitud de proteinuria alcanza el 25% en las analíticas de pacientes con FGe disminuido o con GBA y sube al 37% en las analíticas de pacientes diabéticos. Esta selección de pacientes puede contribuir a que nuestros datos sobre prevalencia de proteinuria no puedan considerarse poblacionales, sino más bien representativos de población en riesgo, de ahí que se aproxime más a la prevalencia reportada en estudios realizados en población hipertensa o diabética.
Cuando analizamos las peticiones de albuminuria o proteinuria desde AP en función del FGe o del rango de glucemia vemos que el porcentaje de solicitudes es mayor en aquellos controles con FGe disminuido o con alteraciones en el perfil glucémico. Sin embargo, a pesar de este incremento, solo el 37% de los diabéticos y el 26,7% de los pacientes con FGe disminuido disponen de alguna medición de la proteinuria. Y como recogen Gomez-Marcos et al., la estratificación del riesgo cardiovascular en un paciente se ve modificada por el número y el tipo de pruebas realizadas para conocerlo21.
La prevalencia de proteinuria en las analíticas con FGe conservado y normoglucemia es del 5,7%, un porcentaje similar al encontrado a nivel poblacional por el estudio HERMEX, mientras que en las analíticas con criterio de diabetes y FGe disminuido asciende al 35,4%, similar al encontrado en el estudio MICREX para diabéticos hipertensos. Situaciones intermedias, como analíticas con criterios GBA o diabetes con FGe conservado o analíticas con FGe disminuido con normoglucemia o GBA, presentan prevalencias intermedias.
Nuestro trabajo presenta una serie de limitaciones debido a la naturaleza del mismo, puesto que al estar realizado sobre los controles bioquímicos, no disponemos de datos clínicos, que harían más precisos los resultados. También la definición de diabetes mellitus basada en los niveles de glucemia basal puede pasar por alto a pacientes diabéticos tratados, pero, por otro lado, detectaría a pacientes diabéticos no diagnosticados previamente. En cuanto a la prevalencia de FGe disminuido, al aportar los resultados obtenidos en 2 escenarios, intentamos evitar el posible sesgo debido a episodios de fracaso renal agudo o a la progresión de la enfermedad renal durante los 5 años de recogida de los datos. Creemos que las limitaciones de nuestro estudio se ven corregidas en parte por recoger los controles bioquímicos de cerca de 100.000 pacientes atendidos en AP. Esto nos da una visión global de la función renal que presentan los pacientes atendidos por los médicos de AP en su práctica clínica diaria.
ConclusionesLa ERC es una afección frecuente en los pacientes atendidos en AP. En la mayoría de los casos su diagnóstico se establece por la presencia de un FGe disminuido. La determinación del grado de proteinuria es una medida poco implantada en la práctica habitual del médico de AP, a pesar de que es una prueba sencilla y fundamental para la correcta estratificación de la ERC. Su determinación se incrementa en pacientes con FGe disminuido o diabéticos, pero solo uno de cada 3 pacientes diabéticos y uno de cada 4 pacientes con FGe disminuido disponen de la misma. Consideramos que es necesario tomar medidas encaminadas a concienciar sobre la necesidad de su medición, dado que se trata de una prueba sencilla y que permite detectar sujetos en riesgo de que su enfermedad renal progrese o de desarrollar un evento cardiovascular.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.