Los tumores de colisión son neoplasias poco frecuentes, compuestas de 2 estirpes celulares histológicamente diferentes en la misma localización. Normalmente, están formados por colisión entre carcinomas y sarcomas/linfomas.
Se presenta el caso de un varón de 81 años que fue diagnosticado de una masa en la cabeza del páncreas tras presentar ictericia. Se realizó una duodenopancreatectomía cefálica, y el análisis histológico evidenció un tumor de colisión entre un adenocarcinoma ductal infiltrante y un carcinoma indiferenciado con células gigantes tipo osteoclasto.
Estos tumores suelen diagnosticarse posteriormente a la cirugía y, en lo que se refiere al pronóstico, este puede variar según el grado y el estadio de cada estirpe histológica en el momento del diagnóstico.
Los tumores de colisión son neoplasias poco frecuentes (se estima que representan menos del 0,2% de las neoplasias pancreáticas) que se desarrollan cuando coinciden 2 tumores histológicamente diferentes de forma sincrónica en el mismo órgano, sin mezclarse y sin que exista una zona de transición entre ellos. Esto los diferencia de los tumores mixtos o compuestos, los cuales poseen zonas de transición entre ellos y es posible evidenciar histológicamente el origen común de los mismos. Los tumores de colisión han sido descritos en varios órganos, tales como esófago, estómago, colon, riñones, pulmón, tiroides, piel, mama, páncreas, ovario y útero1.
En el caso de las neoplasias pancreáticas, el origen histológico más frecuente es el adenocarcinoma (ADC), con una incidencia de 10 casos por cada 100.000 habitantes, el cual implica hasta un 95% de las neoplasias pancreáticas. Existen casos aislados de carcinomas indiferenciados de páncreas con células gigantes tipo osteoclasto2; sin embargo, no existe evidencia previa de tumores de colisión compuestos por estas 2 entidades tumorales.
Reporte de casoUn varón de 81 años de edad, hipertenso, consultó por ictericia indolora, sin historia de fiebre ni síndrome general. En la analítica presentó bilirrubina total de 8,6 mg/dl a expensas de bilirrubina directa 7,4 mg/dl. Se realizó ecografía de abdomen que evidenció un conducto colédoco dilatado de 11,6 mm con dilatación retrógrada de la vía biliar intrahepática. Se completaron estudios con una tomografía axial computarizada (TAC) toracoabdominopélvica con contraste intravenoso y una colangiorresonancia magnética nuclear, que objetivaron una masa hipovascular en proceso uncinado del páncreas de 24 × 25 mm que obstruía el conducto de Wirsung y el colédoco, sin presentar afectación vascular ni extensión a distancia (fig. 1).
Durante el ingreso presentó ictericia progresiva, precisando la descompresión de la vía biliar con colangiopancreatografía retrógrada endoscópica (CPRE), colocándose una prótesis plástica y realizándose cepillado para la toma de biopsias. La anatomía patológica del cepillado fue negativa para malignidad, pero, dados los hallazgos radiológicos, se decidió realizar una duodenopancreatectomía cefálica (DPC) con antrectomía y reconstrucción en Y de Roux transmesocólica.
El informe macroscópico remitido por anatomía patológica describió una lesión blanquecina de bordes mal definidos en la cabeza del páncreas de 3 × 2,5 × 2 cm, que asociaba formaciones quísticas de aspecto mucoide. En la pieza quirúrgica se objetivó infiltración duodenal y dilatación de la vía biliar, con márgenes de resección libres de afectación tumoral.
El estudio microscópico tras la resección de la pieza quirúrgica mostró 2 áreas de diferente morfología histológica en colisión; la primera de ellas, un carcinoma indiferenciado de células gigantes, con células anaplásicas, mitosis atípicas multipolares y evidente hiperploidía; en segundo lugar, identificó una región adyacente formada por células compatibles con adenocarcinoma (ADC) ductal de páncreas (fig. 2). No presentaba invasión linfovascular, aunque sí perineural, aislándose 12 ganglios linfáticos negativos para malignidad, siendo calificada la neoplasia como pT2N0.
A) Hematoxilina-Eosina (HE), 20×. Colisión tumoral. B) HE, 400×. ADC ductal páncreas bien diferenciado. Ductos aberrantes y formación de estroma desmoplásico, tinción focal con citoqueratina de amplio espectro y negativa para citoqueratina 7 y 19. (C9: HE, 400×). Células gigantes multinucleadas tipo osteoclasto y mitosis explosiva central, CD68+.
La inmunohistoquímica mostró positividad intensa para CD68 del tumor de células gigantes tipo osteoclasto (fig. 3A) y positividad del ADC para CK7 y CK19 (fig. 3B). En ambos casos el índice de proliferación Ki-67 fue de un 10–15% y la expresión de p53 mostró un patrón salvaje.
El paciente evolucionó favorablemente y fue dado de alta a su domicilio al décimo día posoperatorio. Sin embargo, a los 30 días de seguimiento requirió un nuevo ingreso hospitalario por fiebre, objetivándose un absceso hepático en la TAC de abdomen. Se realizó tratamiento conservador inicial con antibioticoterapia, pero tras TAC de control con crecimiento del absceso, se intentó sin éxito una punción radiológica que, además, asoció un cuadro séptico por manipulación del absceso. Finalmente, presentó una evolución favorable con el tratamiento conservador con antibioticoterapia y fue dado de alta al vigesimonoveno día del ingreso.
Valorado por oncología médica tras el alta hospitalaria, se planteó tratamiento adyuvante con gemcitabina en monoterapia 1.000 mg/m2 los días 1, 8 y 15 de cada 28 días durante 6 meses, que, finalmente, no se administró debido al tiempo transcurrido desde la cirugía y la presencia de un absceso no completamente resuelto. Actualmente, tras 7 meses de seguimiento, el paciente se encuentra asintomático.
DiscusiónLos tumores de colisión pancreáticos son raras entidades que no muestran ningún síntoma o hallazgo radiológico específico que los diferencie clínica o radiológicamente de otras neoplasias pancreáticas. Su diagnóstico es normalmente accidental en el análisis anatomopatológico posoperatorio, lo cual dificulta la individualización preoperatoria del tratamiento.
Según la clasificación histológica WHO, los tumores de colisión se componen de al menos 2 entidades tumorales, desarrollándose simultáneamente en la misma localización3,4. La localización más común de este tipo de neoplasias es el estómago y el esófago5. Varias colisiones anatomopatológicas a nivel pancreático han sido descritas, siendo las más frecuentes las colisiones entre ADC con tumores neuroendocrinos (TNE) o sarcomas6.
El origen de estas neoplasias es poco conocido, pero existen varias hipótesis al respecto. La primera de ellas es que pueden originarse diferentes tumores de una célula endodérmica totipotente que sea capaz de diferenciarse en diferentes estirpes celulares7. Esta teoría se basa en hallazgos de tumores de colisión, donde se comparten mutaciones entre componentes distintos indicando un ancestro tumoral común8. Otra de ellas es la hipótesis de la existencia de un microambiente predisponente. De este modo, la existencia de un primer tumor genera alteraciones de la vascularización pancreática, inflamación local y factores de crecimiento, facilitando la aparición de otro tumor adyacente9. Otra posibilidad es que puede producirse una predisposición genética en forma de una disfunción múltiple de genes de supresión tumoral que genere, como consecuencia, diferentes neoplasias coexistentes10. Finalmente, otro factor a tener en cuenta es la acción de carcinógenos que generan alteraciones epigenéticas y mutaciones somáticas que inducen la formación de diferentes neoplasias o bien, la existencia de síndromes como el de la neoplasia endocrina múltiple (MEN-1) o el Von Hippel-Lindau11, que ya de por sí aumentan el riesgo de generar neoplasias pancreáticas múltiples aumentado la incidencia de este tipo de tumores.
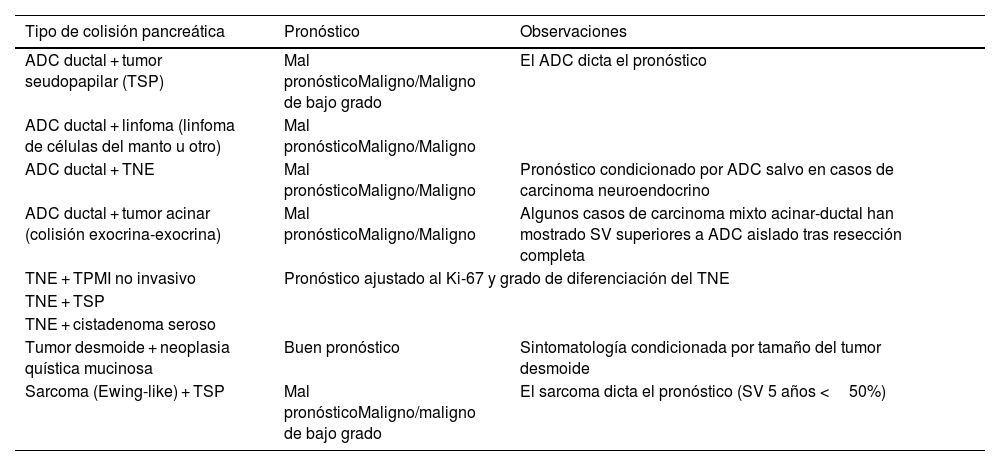
El pronóstico individual puede variar según el grado y el estadio de cada estirpe histológica en el momento del diagnóstico, así como de la posibilidad de resección completa (tabla 1).
Pronóstico de los distintos tipos de tumores de colisión reportados en la literatura
| Tipo de colisión pancreática | Pronóstico | Observaciones |
|---|---|---|
| ADC ductal + tumor seudopapilar (TSP) | Mal pronósticoMaligno/Maligno de bajo grado | El ADC dicta el pronóstico |
| ADC ductal + linfoma (linfoma de células del manto u otro) | Mal pronósticoMaligno/Maligno | |
| ADC ductal + TNE | Mal pronósticoMaligno/Maligno | Pronóstico condicionado por ADC salvo en casos de carcinoma neuroendocrino |
| ADC ductal + tumor acinar (colisión exocrina-exocrina) | Mal pronósticoMaligno/Maligno | Algunos casos de carcinoma mixto acinar-ductal han mostrado SV superiores a ADC aislado tras resección completa |
| TNE + TPMI no invasivo | Pronóstico ajustado al Ki-67 y grado de diferenciación del TNE | |
| TNE + TSP | ||
| TNE + cistadenoma seroso | ||
| Tumor desmoide + neoplasia quística mucinosa | Buen pronóstico | Sintomatología condicionada por tamaño del tumor desmoide |
| Sarcoma (Ewing-like) + TSP | Mal pronósticoMaligno/maligno de bajo grado | El sarcoma dicta el pronóstico (SV 5 años <50%) |
ADC: adenocarcinoma; SV: supervivencia; TNE: tumores neuroendocrinos; TPMI: tumor papilar mucinoso intraductal; TSP: tumor pseudoolapilar
Niu et al. estudiaron una serie de 10 casos de tumores de colisión pancreáticos10. De esos 10 casos, la mayor parte eran tumores de colisión entre neoplasias papilares mucinosas intraductales con otras neoplasias (ADC, TNE y colangiocarcinomas) y mostraban mal pronóstico con una media de supervivencia de 10 meses. Por otro lado, Serafini et al. refieren que los tumores de colisión de neoplasias endocrinas y exocrinas de páncreas tienen mejor pronóstico12, por lo que son necesarios más estudios para establecer conclusiones.
ConclusiónLos tumores de colisión son neoplasias muy infrecuentes cuyo diagnóstico se efectúa posoperatoriamente mediante el análisis histológico de la pieza de resección. Una adecuada evaluación de las pruebas radiológicas, una evaluación histomorfológica precisa y un análisis inmunohistoquímico apropiado son esenciales para el diagnóstico.
En general, la presencia de un tumor de colisión no suele conferir ventaja pronóstica; el paciente carga con la morbilidad de 2 neoplasias, y se debe asumir el pronóstico de la estirpe histológica de mayor riesgo.
Consentimiento informadoLos autores declaran que se obtuvo el consentimiento informado por escrito de los pacientes para la publicación de estos informes de casos y de las imágenes que los acompañan. No se incluyen datos identificativos.
FinanciaciónLos autores declaran que la publicación de este caso clínico no recibió ninguna subvención específica de organismos de financiación de los sectores público, comercial o sin ánimo de lucro.
Conflicto de interesesLos autores declaran que no hubo conflicto de intereses.