El exantema cutáneo y la mucositis inducida por Mycoplasma pneumoniae (MIRM) es una manifestación cada vez más reconocida, caracterizada por compromiso mucoso predominante y evolución generalmente favorable. Presentamos el caso de un adolescente con un cuadro respiratorio inicial que evolucionó a mucositis oral, conjuntivitis y lesiones genitales, con diagnóstico confirmado de MIRM mediante pruebas inmunológicas. Se revisan las características clínicas y epidemiológicas que permiten diferenciar esta entidad de otras dermatosis graves, como el síndrome de Stevens-Johnson.
Mycoplasma pneumoniae-induced skin rash and mucositis (MIRM) is an increasingly recognized manifestation, characterized by predominantly mucosal involvement and a generally favorable outcome. We present the case of an adolescent with an initial respiratory illness that progressed to oral mucositis, conjunctivitis, and genital lesions. The diagnosis of MIRM was confirmed by immunological testing. The clinical and epidemiological characteristics that differentiate this entity from other serious dermatoses such as Stevens-Johnson syndrome are reviewed.
Mycoplasma pneumoniae (M. pneumoniae) es un patógeno frecuente en la neumonía adquirida en la comunidad, especialmente en escolares y adultos jóvenes, responsable de aproximadamente el 10% de los casos1. En una minoría de pacientes, puede generar complicaciones extrapulmonares, entre ellas manifestaciones mucocutáneas1,2. Una de ellas es el exantema cutáneo y la mucositis, la cual se caracteriza por un compromiso predominante de mucosas, mayormente con evolución favorable, lo que lo diferencia de entidades graves como el síndrome de Stevens-Johnson2,3. Presentamos un caso confirmado de MIRM y realizamos una revisión breve de sus características clínicas y epidemiológicas.
Reporte de casoVarón de 27 años, sin antecedentes patológicos conocidos. Siete días antes de su ingreso presentó odinofagia de intensidad leve a moderada, asociada a tos seca intermitente y sensación de ardor ocular. Dos días después, ante la persistencia de los síntomas, un médico particular prescribió amoxicilina/ácido clavulánico 500/125 mg cada 8 horas.
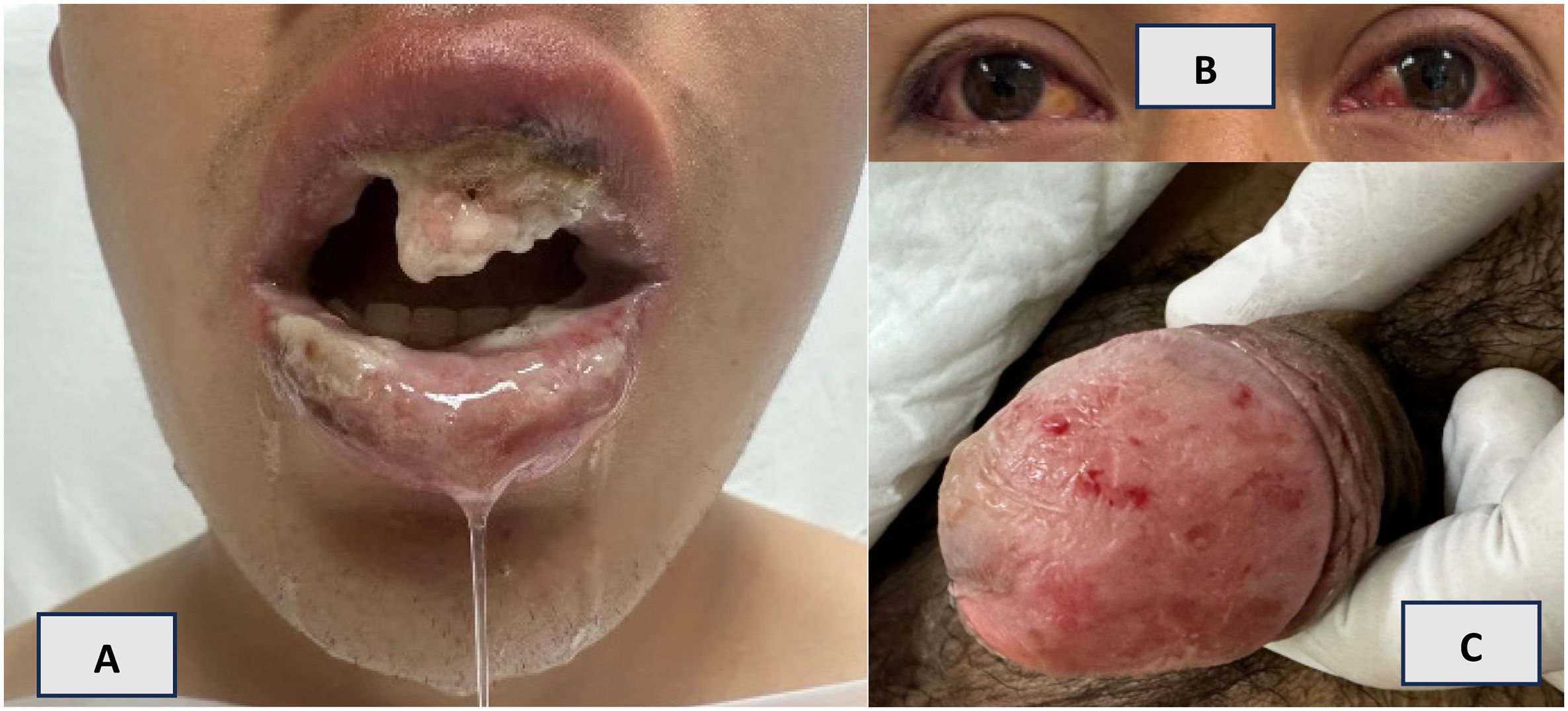
A las 48 horas, el paciente desarrolló lesiones aftosas en la cavidad oral e hiperemia conjuntival, por lo que se le indicó tratamiento con ampicilina benzatínica (1.000 mg) más ampicilina sódica (200 mg diarios) durante 2 días. Pese a ello, las lesiones progresaron; se observaron aftas orales con sangrado, dolor intenso y secreción blanquecina asociadas a trismus y odinofagia marcada. Asimismo, se evidenciaron lesiones ulcerativas en el glande (sin disuria ni secreción uretral) y erosiones lineales en la mucosa anal (fig. 1).
En los estudios iniciales destacó leucocitosis leve sin neutrofilia, proteína C reactiva 107 mg/l (V.N 0–5 mg/l), velocidad de sedimentación globular 41 mm/h (V.N 0–15 mm/h), creatinina 1,33 mg/dl (V.N 0,7–1,3 mg/dl), urea 49 mg/dl (V.N 7–20 mg/dl) y pruebas de función hepática dentro de rangos normales. Se decidió su hospitalización para tratamiento y ampliación diagnóstica.
Durante la estancia hospitalaria se realizó TC de tórax no contrastada, evidenciando en el hemitórax derecho opacidad en vidrio esmerilado, engrosamiento de septos interlobulillares y discreta consolidación con broncograma aéreo. La baciloscopia para Mycobacterium tuberculosis fue negativa. En el estudio serológico se obtuvo IgG positiva para VHS-1, IgG e IgM negativas para VHS-2, ELISA VIH negativo, serología negativa para virus de Epstein–Barr y citomegalovirus, e IgM con valor en 4,3 S/CO (>1,1 positivo) e IgG en 98,6 U/ml (>18 positivo) para M. pneumoniae. No se realizaron frotis uretral ni anal para enfermedades de transmisión sexual.
El paciente recibió metilprednisolona, 1 g intravenosa diario durante 3 días, seguida de prednisona, 50 mg diarios por 7 días, inmunoglobulina humana (5 g) 6 frascos diarios durante 4 días, antibiótico de amplio espectro con cefepima por 7 días, clorfeniramina 10 mg intravenosa, lubricante ocular con hipromelosa y ciprofloxacino en colirio para hemorragia subconjuntival, además de soporte nutricional con dieta blanda y fórmula enteral. La indicación de terapia inmunomoduladora se sustentó en la extensa afectación mucocutánea y la imposibilidad de deglución.
La evolución fue favorable, con mejoría progresiva de las lesiones y normalización de parámetros de laboratorio. Fue dado de alta tras 2 semanas de hospitalización, asintomático y con resolución casi completa de las lesiones cutáneas y mucosas.
DiscusiónLa bacteria M. pneumoniae se ha identificado como una causa destacada de infecciones en las vías respiratorias superiores e inferiores, tanto en niños como en adultos. Luego de la inclusión de la vacuna antineumocócica conjugada 13-valente (PCV13) en los programas nacionales de inmunización en varios países, este patógeno ha pasado a ser una causa principal de neumonía adquirida en la comunidad en la población pediátrica4.
Aunque la infección por M. pneumoniae suele manifestarse como una enfermedad leve y autolimitada, en determinados casos puede evolucionar con manifestaciones extrarrespiratorias graves y potencialmente letales. Estas incluyen complicaciones cardiovasculares, dermatológicas, gastrointestinales, hematológicas, musculoesqueléticas, urogenitales y oftalmológicas5,6.
En el ámbito dermatológico, la afectación mucosa es más prominente que las lesiones cutáneas. La mucosa oral se encuentra comprometida en 94–100% de los casos, seguida de la ocular (82–92%) y la urogenital (63–78%). También pueden observarse lesiones a nivel anal y oroesofágico. En cuanto a las lesiones cutáneas, pueden estar ausentes en hasta un 34% de los pacientes o ser limitadas en alrededor del 47%, con morfología polimórfica y, raramente, extensa7.
El mecanismo fisiopatológico de la afectación mucocutánea implica mimetismo molecular, donde antígenos del patógeno comparten similitudes con los del huésped, desencadenando una respuesta autoinmune tipo IV mediada por linfocitos T citotóxicos. Asimismo, la formación de inmunocomplejos y la posible acción como superantígeno favorecen la liberación de citocinas proinflamatorias (IL-6, TNF-α e IFN-γ) que inducen daño tisular8.
El diagnóstico de infección por M. pneumoniae asociada a exantema mucocutáneo requiere la integración de métodos microbiológicos y serológicos. Aunque el cultivo es el estándar de referencia, su baja disponibilidad y lentitud limitan su uso. La PCR se considera la técnica más sensible (sensibilidad aproximada 90–95%, especificidad mayor al 95%) y permite detectar el patógeno en muestras respiratorias o de lesiones mucocutáneas; sin embargo, puede dar falsos positivos por colonización asintomática o persistencia de ADN bacteriano tras la resolución de la infección9. Las pruebas serológicas, en especial IgM específica, tienen sensibilidad de 70–90% y especificidad de 80–95%, pero la reactividad cruzada con otras infecciones respiratorias y con enfermedades autoinmunes puede generar falsos positivos. La detección simultánea de IgM e IgG específicas sugiere infección en fase aguda o subaguda. La biopsia cutánea, aunque no se realiza de rutina, puede mostrar dermatitis linfocítica y necrosis epidérmica focal9.
El diagnóstico diferencial debe incluir otras causas infecciosas como adenovirus, enterovirus y Chlamydophila pneumoniae, así como enfermedades autoinmunes como la enfermedad de Behçet, caracterizada por úlceras orales y genitales recurrentes, uveítis y lesiones cutáneas tipo seudofoliculitis. En este contexto, algunas infecciones de transmisión sexual también pueden cursar con manifestaciones mucocutáneas y sistémicas, como la uretritis gonocócica o por clamidia, el linfogranuloma venéreo, la sífilis secundaria o la infección primaria por VHS-28. Sin embargo, en el presente caso no se documentaron síntomas urinarios (disuria, secreción uretral) ni lesiones genitales específicas. El patrón clínico fue más compatible con una afectación mucocutánea asociada a infección por M. pneumoniae que con una uretritis de transmisión sexual.
De particular relevancia es el síndrome de Stevens-Johnson (SSJ), dado que puede simularse clínicamente y presenta alta morbimortalidad. La erupción cutánea y mucositis inducida por M. pneumoniae (MIRM) suele mostrar un compromiso mucoso intenso con lesiones cutáneas limitadas o ausentes, mientras que el SSJ se caracteriza por lesiones cutáneas extensas, necrosis epidérmica y afectación sistémica grave, generalmente desencadenada por fármacos8 (tabla 1).
Cuadro comparativo entre mucositis inducida por Mycoplasma pneumoniae y el síndrome de Stevens-Johnson
| Característica | MIRM (Mycoplasma pneumoniae) | Síndrome de Stevens-Johnson |
|---|---|---|
| Etiología | Infección por M. pneumoniae | Reacción adversa a fármacos (alopurinol, sulfas, anticonvulsivantes, AINE) |
| Inicio | Coincide o sigue a síntomas respiratorios | 1–3 semanas tras el inicio del fármaco desencadenante |
| Compromiso mucoso | Muy prominente (oral, ocular, genital) | Presente, pero asociado a lesiones cutáneas extensas |
| Lesiones cutáneas | Ausentes o limitadas, polimórficas | Máculas purpúricas, ampollas y necrosis epidérmica difusa |
| Histopatología | Dermatitis linfocítica, necrosis epidérmica focal | Necrosis epidérmica difusa y queratinocitos apoptóticos |
| Pronóstico | Generalmente favorable con antibióticos y soporte | Potencialmente letal, requiere manejo especializado |
| Recurrencias | Poco frecuentes | Poco frecuentes, pero posibles si hay reexposición |
En este caso, la presencia de IgM e IgG positivas para M. pneumoniae, junto con la exclusión de causas más frecuentes de exantema, apoya la relación etiológica entre la infección y el cuadro mucocutáneo. El tratamiento de estas formas atípicas incluye macrólidos como primera línea (azitromicina o claritromicina) y, en casos graves, se puede considerar el uso de corticosteroides sistémicos para controlar la respuesta inflamatoria excesiva. El pronóstico suele ser favorable con tratamiento oportuno, aunque retrasos en el diagnóstico pueden conllevar a complicaciones severas10.
Este caso resalta la importancia de considerar M. pneumoniae en el diagnóstico diferencial de lesiones mucocutáneas atípicas, así como la necesidad de comprender las limitaciones de las pruebas diagnósticas y actuar de forma temprana para optimizar la evolución clínica y los desenlaces del paciente.
Responsabilidades éticasEl presente trabajo no ha implicado experimentación en animales. Sin embargo, sí ha involucrado la participación de sujetos humanos, motivo por el cual fue aprobado por el Comité Ético Local, bajo el número de registro PI N.° 3 CIYE-O.C.I.Y D-RALL-ESSALUD-2025.
Consentimiento informadoLos autores confirman haber cumplido con todas las normas éticas relevantes para la publicación, así como haber obtenido el consentimiento informado del paciente participante.
FinanciaciónLos autores declaran que no han recibido ayudas específicas de parte del sector público, sector privado o entidades sin ánimo de lucro.
Conflicto de interesesLos autores declaran no tener conflictos de intereses.