El objetivo del presente estudio fue analizar las diferencias entre la cetoacidosis diabética (CAD) entre la diabetes tipo 2 (DM2) en comparación con la diabetes tipo 1 (DM1) en una cohorte española.
Material y métodosEste estudio de cohortes retrospectivo incluyó todas las CAD entre 2010 y 2024 en un hospital terciario español. Se recopilaron variables clínicas y analíticas para establecer diferencias entre la CAD en DM2 y DM1. Se realizaron modelos de regresión logística para evaluar la mortalidad por CAD a los 30 días del evento.
ResultadosSe incluyeron 249 sujetos (52,2% mujeres) con una edad media 50,2±19,9 años. Ochenta y nueve pacientes (35,7%) eran DM2 y 160 (64,3%) DM1. Se observó una mayor proporción de eventos cardiovasculares desencadenantes en el grupo DM2 (12,5 frente al 3,2%; p=0,005) y un perfil gasométrico más favorable con mayor pH, bicarbonato y menores títulos de cuerpos cetónicos (p<0,05). Sin embargo, la mortalidad a 30 días fue del 13,5% en DM2 y del 1,3% en DM1 (p<0,001). Los modelos de regresión logística mostraron que los eventos cardiovasculares, una menor puntación en la escala de Glasgow y mayores cifras de urea se asociaron a la mortalidad (p<0,05) independientemente de la edad y del tipo de diabetes
ConclusiónLa CAD en la DM2 se asocia a mayor riesgo de mortalidad debido a la gravedad de sus desencadenantes a pesar de tener un perfil gasométrico más favorable que en la DM1. Es necesario identificar los episodios de forma precoz para evitar complicaciones.
The aim of this study was to analyze the differences in diabetic ketoacidosis (DKA) between type 2 diabetes (T2D) and type 1 diabetes (T1D) in a Spanish cohort.
Materials and methodsThis retrospective cohort study included all cases of DKA between 2010 and 2024 in a Spanish tertiary hospital. Clinical and laboratory variables were collected to identify differences between DKA in T2D and T1D. Logistic regression models were used to evaluate 30-day mortality following a DKA event.
ResultsA total of 249 subjects (52.2% female) with a mean age of 50.2±19.9 years were included. Eighty-nine patients (35.7%) had T2D, and 160 (64.3%) had T1D. A higher proportion of cardiovascular precipitating events was observed in the T2D group (12.5% vs. 3.2%; P=.005), along with a more favorable blood gas profile, characterized by higher pH, bicarbonate levels, and lower ketone body concentrations (P<.05). However, 30-day mortality was 13.5% in T2D and 1.3% in T1D (P<.001). Logistic regression models identified cardiovascular events, lower Glasgow Coma Scale scores, and higher urea levels as predictors of mortality (P<.05), independent of age and diabetes type.
ConclusionDKA in T2D is associated with a higher risk of mortality due to the severity of precipitating factors, despite a more favorable blood gas profile compared to T1D. Early identification of episodes is essential to prevent complications.
La diabetes mellitus (DM) es una enfermedad metabólica caracterizada por la presencia de hiperglucemia crónica y alteraciones en el metabolismo de los hidratos de carbono1. La prevalencia de la DM y sus complicaciones específicas hacen de la enfermedad uno de los principales problemas sociosanitarios en la actualidad1. La cetoacidosis diabética (CAD) es una complicación metabólica aguda, grave y potencialmente mortal de la DM2 que ha presentado una incidencia al alza recientemente en probable relación con la pandemia COVID-193,4. Los criterios diagnósticos de la CAD se conforman por la triada de hiperglucemia, acidosis metabólica y cetosis2. La fisiopatología subyacente es una deficiencia absoluta o relativa de insulina, un aumento de las hormonas contrarreguladoras y una resistencia periférica a la insulina5. Si bien la mayoría de casos de CAD se observan en personas con diabetes tipo 1 (DM1), también puede ocurrir como complicación aguda en la diabetes tipo 2 (DM2)5. Suele estar precipitada por factores como: la omisión de insulina, infecciones, enfermedad cardiovascular aguda, consumo de drogas, alcohol u otros tóxicos2.
La tasa anual promedio de CAD es de 6,3 por cada 1.000 personas con diabetes6, con una tasa de mortalidad por ingresos hospitalarios por CAD del 3-5%7. Su gravedad se clasifica según la escala de la Asociación Estadounidense de Diabetes (ADA) en leve, moderada y grave2. Sin embargo, cabe destacar que actualmente se desconoce si la gravedad de la CAD según los parámetros clínicos y bioquímicos difiere en los pacientes con DM1 y DM28. Según los resultados arrojados por la literatura hasta ahora, parece que en los pacientes con DM2 esta complicación se asocia con peores resultados clínicos y una mayor morbimortalidad9. Esta diferencia puede atribuirse a factores como la mayor edad, los eventos precipitantes, comorbilidades, el uso de fármacos como los inhibidores del cotransportador 2 de sodio-glucosa (iSGLT2)10,11, entre otros. Sin embargo, la evidencia científica disponible al respecto es limitada.
El objetivo de este estudio es estudiar las diferencias en el perfil clínico y los parámetros analíticos de la CAD, así como identificar los posibles factores pronósticos que influyen en la gravedad de sus complicaciones y en la mortalidad, en los pacientes adultos con DM2 en comparación con aquellos con DM1.
Material y métodosSe realizó un estudio de tipo cohortes retrospectivo. Este estudio de seguimiento incluyó todas las personas diagnosticadas de CAD entre el 1 de enero de 2010 y el 1 de abril de 2024 en el servicio de urgencias de un hospital terciario de Madrid (España).
Se incluyeron todas las personas mayores de 15 años que acudieron a urgencias y que cumplieron los criterios de CAD, definidos como la presencia de los 3 componentes siguientes: glucosa >200mg/dl (11,1mmol/l) en el momento de la presentación o un diagnóstico previo de diabetes; concentraciones plasmáticas de β-hidroxibutirato de 3,0mmol/l o cetonas en orina superiores a 2+ en una prueba estándar de cetonas en orina; y un pH<7,3 o un bicarbonato sérico <15,0mmol/l10,11. Se excluyeron las personas con diagnóstico médico de CAD que no cumplían los criterios arriba reflejados. También se excluyeron los sujetos en los que no se disponía información de los antecedentes personales, en los que no figura la exploración física, las constantes vitales o el tratamiento administrado en urgencias, de los que no se disponía de una analítica completa en urgencias y a los pacientes que fueron directamente trasladados desde urgencias a otro centro. Los valores faltantes se excluyeron de los análisis, y no se realizó imputación de datos debido a la ausencia de información crítica que impedía un tratamiento estadístico adecuado. La definición de los tipos de diabetes se basó en los criterios de la clasificación de diabetes mellitus de la OMS y de la Asociación Americana de Diabetes (ADA) en 201912. Definimos los tipos de diabetes según las características bioquímicas y clínicas de los pacientes, La DM1 se diagnosticó con autoanticuerpos pancreáticos positivos o pruebas de péptido C en ayunas menores de 0,08nmol/l13. Si los pacientes tenían autoanticuerpos pancreáticos negativos o no se disponía de autoanticuerpos pancreáticos y péptido C en ayunas, el diagnóstico se realizó mediante criterios clínicos si los pacientes tenían un índice de masa corporal normal a bajo (IMC menor de 23kg/m2) y no pudieron suspender la terapia con insulina dentro de los 12 meses posteriores al diagnóstico inicial de CAD. La diabetes tipo 2 se diagnosticó por criterios clínicos si los pacientes tenían sobrepeso u obesidad (IMC mayor de 23kg/m2), antecedentes familiares de primer grado de DM2, signos de resistencia a la insulina (acantosis nigricans) o péptido C en rango normal. Si los pacientes no cumplían los criterios clínicos para la DM2, el diagnóstico se realizó si los pacientes tenían una prueba negativa de autoanticuerpos pancreáticos y no cumplían las condiciones para la DM1 y los otros tipos específicos de diabetes.
Este estudio siguió las directrices «Fortalecimiento de la presentación de informes de estudios observacionales en epidemiología (STROBE)». El estudio fue aprobado por el Comité de Ética en Investigación del Hospital de La Princesa, Madrid (Número de estudio: 5554-06/24). La investigación se llevó a cabo de acuerdo con la Declaración de Helsinki.
Recopilación de datosEn primer lugar, se realizó un análisis descriptivo de las variables en relación con el tipo de DM:
- 1.
Variables relacionadas con los antecedentes personales recogidos por Historia Clínica: edad, sexo, duración de la diabetes, hemoglobina glicada más reciente (HbA1c), antecedentes de cardiopatía isquémica, ictus, retinopatía diabética, enfermedad renal crónica, amputaciones, hipertensión, dislipemia, sida, cáncer maligno activo, antecedente psiquiátrico, tipo de diabetes, candidatura a unidad de cuidados intensivos (UCI) y tratamiento con iSGLT-2.
- 2.
Variables relacionadas con anamnesis, exploración física e impresión diagnóstica: tensión arterial media, frecuencia respiratoria, temperatura en urgencias, saturación de oxígeno, índice de masa corporal, escala de Glasgow, disnea, vómitos, confusión, pérdida de peso, días desde el inicio de los síntomas, cuerpos cetónicos capilares, gastroenteritis, omisión de dosis de tratamiento, comienzo de diabetes, infección distinta de gastroenteritis, evento cardiovascular y tipo de resucitación inicial aportada (balanceada o cloruro sódico).
- 3.
Variables relacionadas con resultados de analítica de laboratorio básica disponible en urgencias: hemoglobina, hematocrito, recuento de serie blanca, plaquetas, creatinina, urea, sodio, potasio, bilirrubina total, PCR, procalcitonina, pH, PCO2, bicarbonato y L-lactato.
Después de comprobar la verosimilitud de los valores atípicos, los datos que se ajustaban a la distribución normal se examinaron mediante procedimientos estadísticos (prueba de Kolmogorov-Smirnov) y gráficos (gráfico de probabilidad normal). Las variables continuas se presentaron como media y desviación estándar (DE) y las variables categóricas como números y porcentajes de muestras.
Las diferencias bivariadas se contrastaron mediante la prueba t de Student y la prueba U de Mann-Whitney, en función de su ajuste a una distribución normal. Se estimaron los coeficientes de correlación de «Rho» de Spearman para examinar las asociaciones entre variables.
Se realizó un análisis de tendencia para analizar el número de ingresos por año durante todo el seguimiento. Adicionalmente se realizó un modelo de regresión binomial negativo para evaluar si la tendencia de ingresos por CAD a lo largo del tiempo está en relación con el tipo de diabetes y el tratamiento con iSGLT-2.
Tras estudiar las diferencias observadas en las distintas variables entre los individuos con DM1 y DM2, se evaluó la mortalidad a los 30 y 90 días en ambos grupos de pacientes. Se examinó mediante matriz de correlación la mortalidad global a 30 días por todas las variables de antecedentes, de exploración y analíticas recopiladas. Finalmente, se realizó un modelo de regresión logística con las variables que se asociaron con una Rho de Spearman >0,25 con la mortalidad global a 30 días para establecer cuales se asociaban de forma independiente a ella.
El análisis estadístico se realizó utilizando el software estadístico R, versión 4.0.3 y STATA 17.0 Basic Edition (Lakeway Drive, TX, EE. UU.). La significación estadística se fijó en p<0,05.
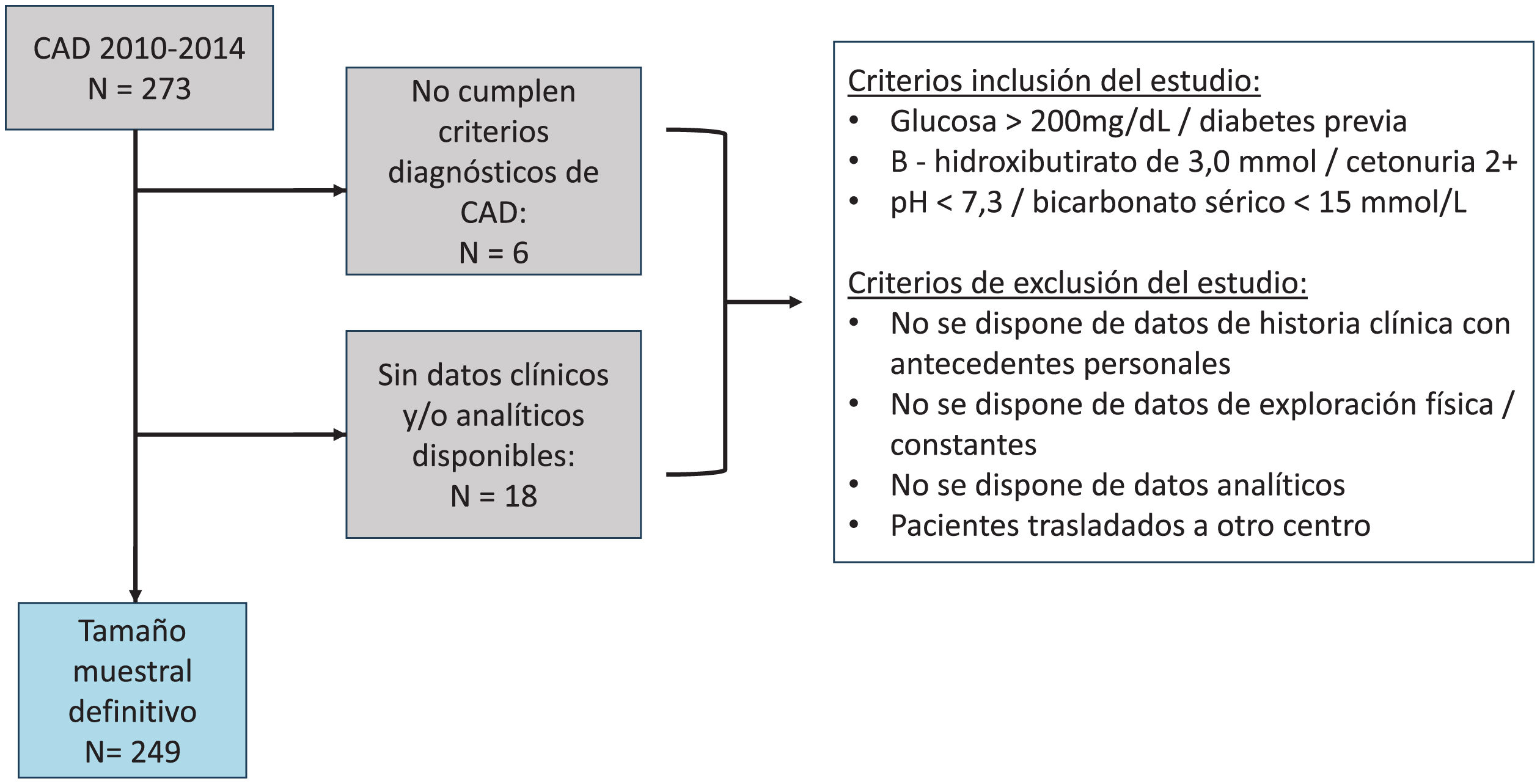
ResultadosDurante el periodo de recopilación de datos, se registraron un total de 273 eventos de CAD. Tras la aplicación de los criterios de inclusión y exclusión, la muestra final quedó compuesta por 249 sujetos. La edad media de la muestra era 50,2±19,9 años y 115 (50,2%) eran varones. Ciento sesenta (64,3%) de los eventos correspondieron a personas con DM1, 89 (35,7%) DM2. Ciento diez (44,2%) de los eventos precisó ingreso en la UCI y 14 (5,6%) sujetos fallecieron en los 30 primeros días del ingreso (fig. 1).
Diagrama de inclusión de los pacientes en el estudio.
De un total de 273 pacientes inicialmente considerados con diagnóstico de cetoacidosis diabética (CAD) entre 2010 y 2014, se excluyeron 6 pacientes por no cumplir los criterios diagnósticos de CAD y 18 por ausencia de datos clínicos y/o analíticos. Finalmente, el tamaño muestral definitivo incluyó 249 pacientes que cumplieron con los criterios de inclusión: glucosa >200mg/dl o diagnóstico previo de diabetes, β-hidroxibutirato ≥3,0mmol/l o cetonuria ≥2+ y pH<7.3 o bicarbonato sérico <15mmol/l. Los criterios de exclusión incluyeron ausencia de datos de historia clínica, exploración física, constantes vitales o datos analíticos, así como pacientes trasladados a otro centro.
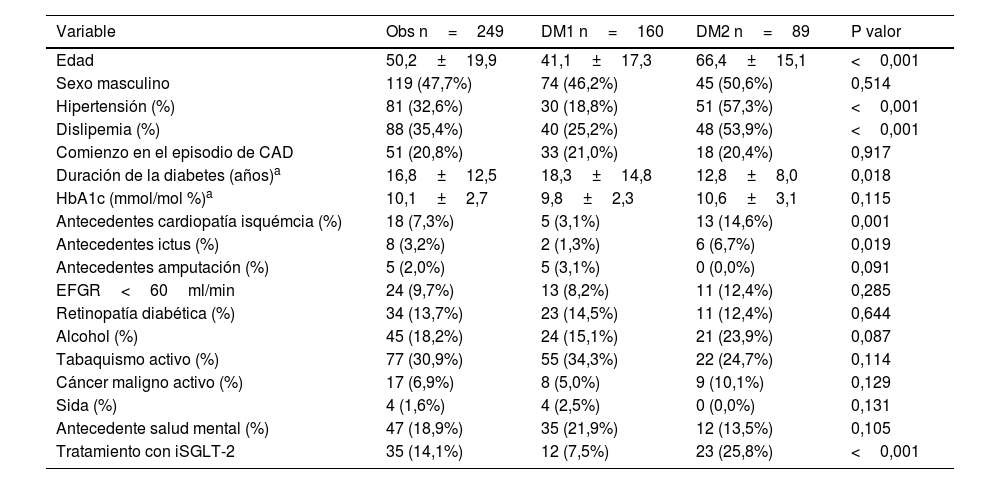
Entre las características basales de la muestra, obtenidas a partir de los antecedentes personales, se observó que los pacientes con DM2 tenían una edad significativamente mayor (66,4±15,1 años) en comparación con los pacientes con DM1 (41,1±17,3 años; p<0,001). La hipertensión arterial fue más común en los pacientes con DM2 (57,3%) frente a aquellos con DM1 (18,8%, p<0,001). De manera similar, la dislipemia mostró una mayor prevalencia en los pacientes con DM2 (53,9 frente al 25,2%; p<0,001).
Los pacientes con DM1 presentaron una mayor duración de la enfermedad (18,3±14,8 años frente a 12,8±8,0 años en DM2; p=0,018). En cuanto a los antecedentes de eventos vasculares, tanto la cardiopatía isquémica (14,6 frente al 3,1%; p<0,001) como el ictus (6,7 frente al 1,3%; p=0,019) fueron más prevalentes en los pacientes con DM2 que en aquellos con DM1.
El consumo crónico de alcohol mostró una tendencia no significativa a ser más frecuente en los pacientes con DM2 (23,9%) en comparación con DM1 (15,1%; p=0,087). El tratamiento con inhibidores del cotransportador 2 de sodio-glucosa (iSGLT2), fue significativamente más frecuente en DM2 (25,8 frente al 7,5%; p<0,001).
No se observaron diferencias significativas en los niveles de HbA1c, el comienzo en el episodio de CAD, en la prevalencia de complicaciones microvasculares crónicas de la diabetes (retinopatía ni enfermedad renal crónica (ERC) con EFGR<60ml/min), en el hábito tabáquico activo, o la existencia de sida, cáncer activo o antecedentes de salud mental. Los resultados detallados de las variables obtenidas a partir de los antecedentes personales se muestran en la tabla 1.
Características basales de la muestra en las variables obtenidas por los antecedentes personales
| Variable | Obs n=249 | DM1 n=160 | DM2 n=89 | P valor |
|---|---|---|---|---|
| Edad | 50,2±19,9 | 41,1±17,3 | 66,4±15,1 | <0,001 |
| Sexo masculino | 119 (47,7%) | 74 (46,2%) | 45 (50,6%) | 0,514 |
| Hipertensión (%) | 81 (32,6%) | 30 (18,8%) | 51 (57,3%) | <0,001 |
| Dislipemia (%) | 88 (35,4%) | 40 (25,2%) | 48 (53,9%) | <0,001 |
| Comienzo en el episodio de CAD | 51 (20,8%) | 33 (21,0%) | 18 (20,4%) | 0,917 |
| Duración de la diabetes (años)a | 16,8±12,5 | 18,3±14,8 | 12,8±8,0 | 0,018 |
| HbA1c (mmol/mol %)a | 10,1±2,7 | 9,8±2,3 | 10,6±3,1 | 0,115 |
| Antecedentes cardiopatía isquémcia (%) | 18 (7,3%) | 5 (3,1%) | 13 (14,6%) | 0,001 |
| Antecedentes ictus (%) | 8 (3,2%) | 2 (1,3%) | 6 (6,7%) | 0,019 |
| Antecedentes amputación (%) | 5 (2,0%) | 5 (3,1%) | 0 (0,0%) | 0,091 |
| EFGR<60ml/min | 24 (9,7%) | 13 (8,2%) | 11 (12,4%) | 0,285 |
| Retinopatía diabética (%) | 34 (13,7%) | 23 (14,5%) | 11 (12,4%) | 0,644 |
| Alcohol (%) | 45 (18,2%) | 24 (15,1%) | 21 (23,9%) | 0,087 |
| Tabaquismo activo (%) | 77 (30,9%) | 55 (34,3%) | 22 (24,7%) | 0,114 |
| Cáncer maligno activo (%) | 17 (6,9%) | 8 (5,0%) | 9 (10,1%) | 0,129 |
| Sida (%) | 4 (1,6%) | 4 (2,5%) | 0 (0,0%) | 0,131 |
| Antecedente salud mental (%) | 47 (18,9%) | 35 (21,9%) | 12 (13,5%) | 0,105 |
| Tratamiento con iSGLT-2 | 35 (14,1%) | 12 (7,5%) | 23 (25,8%) | <0,001 |
CAD: cetoacidosis diabética; EFGR: estimación del filtrado glomerular renal; HbA1c: hemoglobina glicosilada; Sida: síndrome de inmunodeficiencia adquirida.
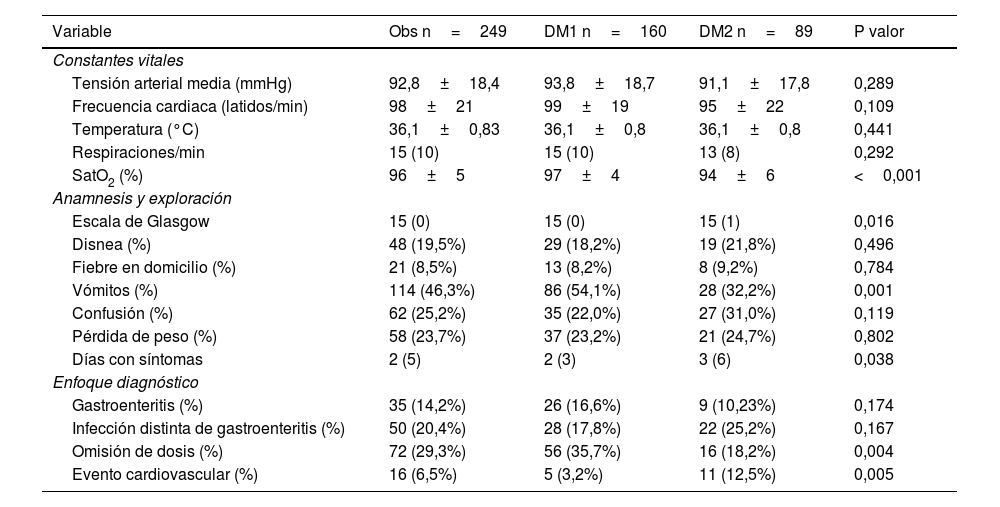
A partir de los datos obtenidos de la anamnesis y exploración física, se observó que el cuadro clínico de la CAD en los pacientes con DM2 presentó saturaciones basales de oxígeno menores (94±6 frente al 97±4%; p<0,001) y una duración de los síntomas mayor (3 días frente a 2 días; p=0,038). Por el contrario, la presentación clínica de la CAD con vómitos fue más prevalente en los pacientes con DM1 (54,1%) que en aquellos con DM2 (32,2%; p<0,001). Asimismo, se observaron puntuaciones inferiores de la escala de Glasgow en los pacientes con DM2 respecto a los pacientes con DM1 (p=0,016).
La distribución de los precipitantes también fue un aspecto diferencial en ambos tipos de diabetes. La omisión de dosis de insulina fue más común en los pacientes con DM1 (35,7%) que en aquellos con DM2 (18,2%; p=0,004), mientras que los eventos cardiovasculares fueron más prevalentes en DM2 (12,5 frente al 3,2%; p=0,005). No se encontraron diferencias en el resto de los desencadenantes descritos (gastroenteritis, infecciones etc.). El resto de los resultados de las variables obtenidas a partir de la anamnesis y la exploración física se muestran en la tabla 2.
Variables obtenidas por anamnesis, exploración física
| Variable | Obs n=249 | DM1 n=160 | DM2 n=89 | P valor |
|---|---|---|---|---|
| Constantes vitales | ||||
| Tensión arterial media (mmHg) | 92,8±18,4 | 93,8±18,7 | 91,1±17,8 | 0,289 |
| Frecuencia cardiaca (latidos/min) | 98±21 | 99±19 | 95±22 | 0,109 |
| Temperatura (°C) | 36,1±0,83 | 36,1±0,8 | 36,1±0,8 | 0,441 |
| Respiraciones/min | 15 (10) | 15 (10) | 13 (8) | 0,292 |
| SatO2 (%) | 96±5 | 97±4 | 94±6 | <0,001 |
| Anamnesis y exploración | ||||
| Escala de Glasgow | 15 (0) | 15 (0) | 15 (1) | 0,016 |
| Disnea (%) | 48 (19,5%) | 29 (18,2%) | 19 (21,8%) | 0,496 |
| Fiebre en domicilio (%) | 21 (8,5%) | 13 (8,2%) | 8 (9,2%) | 0,784 |
| Vómitos (%) | 114 (46,3%) | 86 (54,1%) | 28 (32,2%) | 0,001 |
| Confusión (%) | 62 (25,2%) | 35 (22,0%) | 27 (31,0%) | 0,119 |
| Pérdida de peso (%) | 58 (23,7%) | 37 (23,2%) | 21 (24,7%) | 0,802 |
| Días con síntomas | 2 (5) | 2 (3) | 3 (6) | 0,038 |
| Enfoque diagnóstico | ||||
| Gastroenteritis (%) | 35 (14,2%) | 26 (16,6%) | 9 (10,23%) | 0,174 |
| Infección distinta de gastroenteritis (%) | 50 (20,4%) | 28 (17,8%) | 22 (25,2%) | 0,167 |
| Omisión de dosis (%) | 72 (29,3%) | 56 (35,7%) | 16 (18,2%) | 0,004 |
| Evento cardiovascular (%) | 16 (6,5%) | 5 (3,2%) | 11 (12,5%) | 0,005 |
DM1: diabetes mellitus tipo 1; DM2: diabetes mellitus tipo 2; SatO2: saturación de oxígeno.
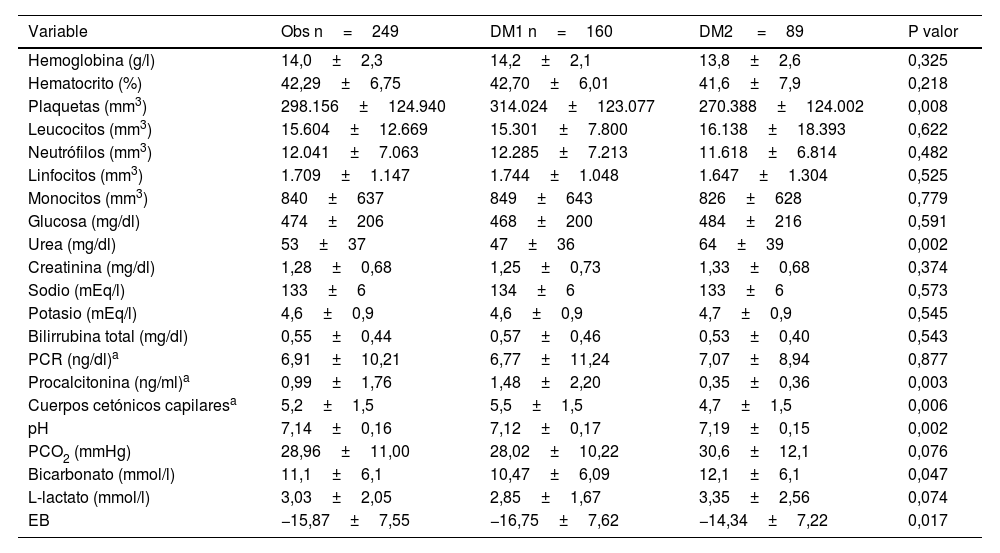
Los resultados analíticos mostraron que la gravedad de la acidosis metabólica fue mayor en los pacientes con DM1, quienes presentaron un pH menor en comparación con los pacientes con DM2 (7,12±0,17 frente a 7,19±0,15; p=0,002), así como un bicarbonato también menor (10,47±6,09 frente a 12,1±6,1mmol/l; p=0,047) y mayores niveles de cuerpos cetónicos capilares (5,5±1,5 frente a 4,7±1,5; p=0,006).
Las plaquetas y la procalcitonina mostraron cifras menores en los pacientes con DM2 en comparación con los pacientes con DM1 (270.388±124.002 frente a 314.024±123.077mm3; p=0,008; y 0,35±0,36 frente a 1,48±2,20ng/ml; p=0,003). Los niveles de urea fueron superiores en DM2 (64±39mg/dl) que en DM1 (47±36mg/dl; p=0,002).
No se encontraron diferencias significativas en los niveles de hemoglobina, hematocrito, leucocitos, neutrófilos, linfocitos, monocitos, glucosa, creatinina, sodio, potasio, bilirrubina total, PCR, PCO2, L-lactato ni exceso de bases, Los resultados detallados de las variables analíticas se presentan en la tabla 3.
Variables analíticas de la muestra
| Variable | Obs n=249 | DM1 n=160 | DM2 =89 | P valor |
|---|---|---|---|---|
| Hemoglobina (g/l) | 14,0±2,3 | 14,2±2,1 | 13,8±2,6 | 0,325 |
| Hematocrito (%) | 42,29±6,75 | 42,70±6,01 | 41,6±7,9 | 0,218 |
| Plaquetas (mm3) | 298.156±124.940 | 314.024±123.077 | 270.388±124.002 | 0,008 |
| Leucocitos (mm3) | 15.604±12.669 | 15.301±7.800 | 16.138±18.393 | 0,622 |
| Neutrófilos (mm3) | 12.041±7.063 | 12.285±7.213 | 11.618±6.814 | 0,482 |
| Linfocitos (mm3) | 1.709±1.147 | 1.744±1.048 | 1.647±1.304 | 0,525 |
| Monocitos (mm3) | 840±637 | 849±643 | 826±628 | 0,779 |
| Glucosa (mg/dl) | 474±206 | 468±200 | 484±216 | 0,591 |
| Urea (mg/dl) | 53±37 | 47±36 | 64±39 | 0,002 |
| Creatinina (mg/dl) | 1,28±0,68 | 1,25±0,73 | 1,33±0,68 | 0,374 |
| Sodio (mEq/l) | 133±6 | 134±6 | 133±6 | 0,573 |
| Potasio (mEq/l) | 4,6±0,9 | 4,6±0,9 | 4,7±0,9 | 0,545 |
| Bilirrubina total (mg/dl) | 0,55±0,44 | 0,57±0,46 | 0,53±0,40 | 0,543 |
| PCR (ng/dl)a | 6,91±10,21 | 6,77±11,24 | 7,07±8,94 | 0,877 |
| Procalcitonina (ng/ml)a | 0,99±1,76 | 1,48±2,20 | 0,35±0,36 | 0,003 |
| Cuerpos cetónicos capilaresa | 5,2±1,5 | 5,5±1,5 | 4,7±1,5 | 0,006 |
| pH | 7,14±0,16 | 7,12±0,17 | 7,19±0,15 | 0,002 |
| PCO2 (mmHg) | 28,96±11,00 | 28,02±10,22 | 30,6±12,1 | 0,076 |
| Bicarbonato (mmol/l) | 11,1±6,1 | 10,47±6,09 | 12,1±6,1 | 0,047 |
| L-lactato (mmol/l) | 3,03±2,05 | 2,85±1,67 | 3,35±2,56 | 0,074 |
| EB | −15,87±7,55 | −16,75±7,62 | −14,34±7,22 | 0,017 |
EB: exceso de base; PCO2: presión parcial de dióxido de carbono; PCR: proteína C reactiva.
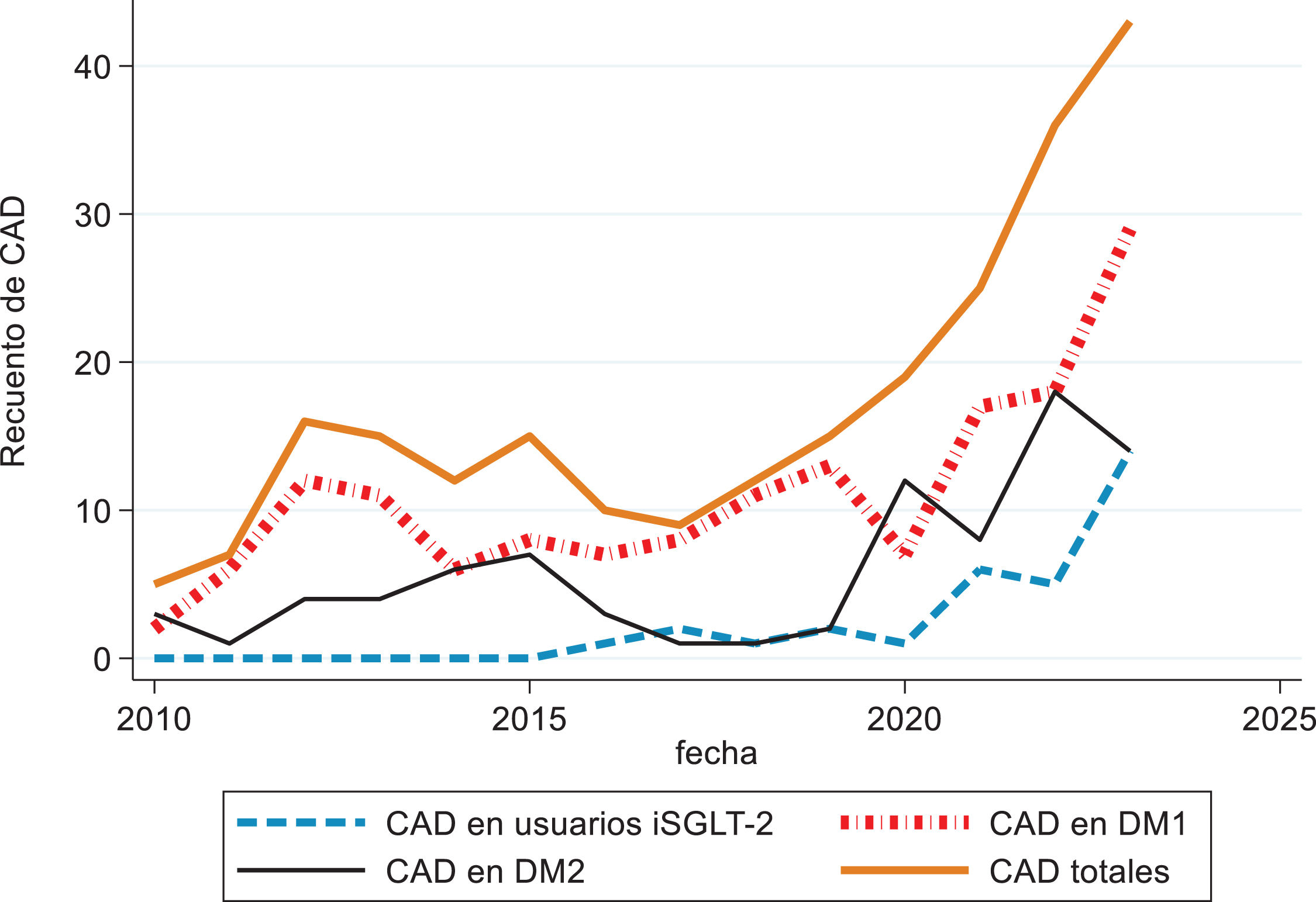
Se realizó un análisis de la evolución temporal de la incidencia de CAD por cada año cumplido de seguimiento entre 2010 y 2023. Se excluyó el año 2024 por estar en curso en el momento de la realización del trabajo. Se observó una tendencia no estacionaria al aumento de episodios de CAD y especialmente acusada a partir del año 2020 tal y como se muestra en la figura 2. El modelo de regresión binomial negativo para el recuento de ingresos mostró una tendencia estadísticamente significativa al aumento paulatino de los episodios de CAD por cada año cumplido odds ratio (OR): 1,12; IC 95%: 1,08-1,17; p<0,001. Al ajustar el modelo por tipo de diabetes, tratamiento con iSGLT-2 y la interacción del tratamiento con iSGLT-2 con la fecha y el tipo de diabetes, no se observó una asociación estadísticamente significativa entre el tratamiento con iSGLT-2 y el aumento de incidencia de episodios de CAD (p=0,840). La figura 2 muestra una representación gráfica de la evolución de los episodios de CAD durante el periodo 2010-2023 en función del tratamiento con iSGLT-2 y el tipo de diabetes.
Incidencia total de CAD y en individuos tratados con fármacos iSGLT-2.
La gráfica muestra un incremento progresivo en los casos de CAD desde 2010, con una aceleración marcada a partir del año 2020. Este aumento se observa de forma consistente tanto en los pacientes tratados con iSGLT-2 (línea azul discontinua), como en aquellos con DM1 (línea roja discontinua) y DM2 (línea negra continua). En particular, los pacientes tratados con iSGLT-2 presentan un crecimiento proporcional de CAD en línea con la adopción creciente de esta clase terapéutica en la práctica clínica. Este análisis sugiere que múltiples factores, incluyendo cambios en los enfoques terapéuticos y el impacto de comorbilidades, podrían haber contribuido a estas tendencias. CAD: cetoacidosis diabética; iSGLT-2: inhibidores del cotransportador de sodio-glucosa tipo 2.
Se evaluó la necesidad de ingreso en la UCI y la mortalidad a los 30 y 90 días en los pacientes con DM1 y DM2. El ingreso en la UCI fue más común en los pacientes con DM1 (50,6%) que en aquellos con DM2 (35,2%; p=0,020). Por el contrario, la mortalidad fue significativamente mayor en los pacientes con DM2 tanto a los 30 días como a los 90 días (13,5 frente al 1,3%; p<0,001 y 14,8 frente al 3,1%; p=0,001, respectivamente).
Se realizó una matriz de correlaciones de la mortalidad a los 30 días con las variables obtenidas de los antecedentes personales, exploración física y analítica de urgencias. Se observó una asociación estadísticamente significativa entre las variables edad, la existencia de cardiopatía, ictus o cáncer activo, el no ser candidato a la UCI y a DM2. También se asociaron de forma significativa con la mortalidad a 30 días la frecuencia respiratoria elevada en urgencias, la menor saturación de oxígeno basal, una peor puntuación en la Escala Neurológica Glasgow y tener un evento cardiovascular como desencadenante de la CAD. Finalmente, en las variables analíticas de urgencias, tan solo se encontró asociación significativa entre mortalidad y niveles elevados de urea. Los resultados de todas las matrices de correlaciones se muestran en material suplementario S1.
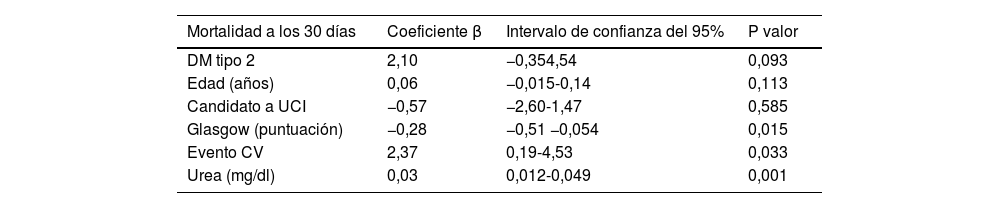
Se realizó un modelo de regresión logística con las variables que se asociaron con la mortalidad global a 30 días de forma estadísticamente significativa con una Rho de Spearman >0,25, observando que las diferencias de mortalidad se asociaron a la gravedad del desencadenante y al deterioro neurológico. Los pacientes que presentaron un evento cardiovascular como desencadenante de la CAD (β: 2,36: IC 95%: 0,20-4,54; p=0,033) y mayores cifras de urea (β: 0,03; IC 95%: 0,012-0,049; p=0,001) se asociaron a una mayor mortalidad. Por otro lado, una mayor puntuación en la escala Glasgow se asoció a menor riesgo de mortalidad a 30 días (β: −0,28; IC 95%: −0,51 −0,054; p=0,015). No se observó una asociación estadísticamente significativa entre la mortalidad con otras variables, como el tipo de diabetes o la edad (tabla 4).
Análisis por regresión logística de las diferencias en la mortalidad a 30 días
| Mortalidad a los 30 días | Coeficiente β | Intervalo de confianza del 95% | P valor |
|---|---|---|---|
| DM tipo 2 | 2,10 | −0,354,54 | 0,093 |
| Edad (años) | 0,06 | −0,015-0,14 | 0,113 |
| Candidato a UCI | −0,57 | −2,60-1,47 | 0,585 |
| Glasgow (puntuación) | −0,28 | −0,51 −0,054 | 0,015 |
| Evento CV | 2,37 | 0,19-4,53 | 0,033 |
| Urea (mg/dl) | 0,03 | 0,012-0,049 | 0,001 |
CV: cardiovascular (desencadenante de CAD); DM: diabetes mellitus; Glasgow: escala de Glasgow; UCI: unidad de cuidados intensivos.
El modelo de regresión logística mostró una asociación independiente estadísticamente significativa entre el evento cardiovascular como precipitante y las cifras de urea con la mortalidad. Una mayor puntuación en la escala de Glasgow se asoció con un menor riesgo de mortalidad.
El objetivo de este trabajo fue estudiar las diferencias clínicas, analíticas y los posibles factores pronósticos en los episodios de CAD en personas con DM2 respecto a personas con DM1. Nuestro estudio reveló que los pacientes con DM2 tienen un mayor riesgo de mortalidad, basado en la gravedad del desencadenante de la CAD y el nivel de deterioro neurológico, a pesar de tener un perfil ácido-base inicial más favorable que los pacientes con DM1.
La CAD en la DM2 es un fenómeno infrecuente pero no extraordinario. Aunque históricamente ha recibido menos atención que en la DM1 su evaluación y tratamiento deben seguir principios similares en ambas condiciones2,8. Sin embargo, algunos estudios han intentado comparar las características clínicas de la CAD en DM1 y DM2 para identificar diferencias relevantes. En este contexto, nuestros hallazgos son consistentes con la literatura que describe una mayor edad promedio en los pacientes con CAD asociada a DM210,11. Por otro lado, observamos que los desencadenantes en la DM2 difieren ostensiblemente con la DM1. Mientras que la omisión del tratamiento fue la principal causa en DM1, las infecciones lo fueron en DM28,10. Además, los eventos cardiovasculares agudos fueron un desencadenante mucho más frecuente en DM2 que en DM1. En este sentido, la mayor proporción de desencadenantes graves en la DM2 se asoció con cifras inferiores de saturación basal de oxígeno, mayor duración de los síntomas y un mayor deterioro del nivel de consciencia, reflejado en puntuaciones inferiores en la escala de Glasgow, como ya se ha descrito en otros estudios14. Algunas variables mostraron tendencias a diferir entre sujetos con DM1 y DM2, aunque sin alcanzar significación estadística, como los antecedentes de salud mental o el consumo de alcohol y tabaco. En este contexto, se han reportado diferencias en los hábitos tóxicos y alimentarios entre los 2 tipos de diabetes, aunque este aspecto varía considerablemente entre distintas geografías15. Asimismo, varios trabajos han detectado diferencias en el perfil de salud mental de las personas con DM1 y DM216.
Sin embargo, a pesar de tener desencadenantes más leves nuestros resultados analíticos mostraron que la gravedad de la acidosis metabólica fue mayor en los pacientes con DM1. Los niveles de pH y bicarbonato fueron inferiores en este grupo, a expensas de mayores títulos de cuerpos cetónicos capilares y mayor tasa de ingreso en la UCI. Estos hallazgos sugieren una mayor gravedad inicial en el perfil de la CAD en los pacientes con DM1, que precisa de mayores procedimientos en las primeras horas8 pero que no se traduce siempre en una mayor mortalidad en el corto plazo17. Aunque variables como el pH, el bicarbonato y la intensidad de la acidosis suelen estar estrechamente relacionadas con la necesidad de ingreso en la UCI en el contexto de la CAD18, nuestro análisis no encontró una correlación directa entre estas variables y la mortalidad. Es relevante destacar que el ingreso en la UCI no siempre se asocia con mayores tasas de mortalidad por CAD19 y que las variaciones entre hospitales en la utilización de cuidados intensivos tampoco han demostrado influir significativamente en la duración de la hospitalización ni en las tasas de mortalidad20. Por ello, parece existir una relación indirecta entre el manejo en la UCI y la mortalidad, lo que podría explicar por qué las variables clásicamente asociadas a la indicación de cuidados intensivos no emergieron como predictores de mortalidad en este estudio. En contraste, en otros estudios con objetivos similares al nuestro10,14,21, no se encontraron diferencias en los niveles de pH entre ambos subgrupos de pacientes, si bien si se observó peor pronóstico en la CAD de la DM2. Estas diferencias pueden deberse al diferente diseño de los estudios, con muestras de pacientes muy variables y geografías diferentes a la europea.
Durante el período del estudio, recopilamos más de 200 eventos consecutivos de CAD observando una tendencia al aumento de episodios a lo largo de tiempo. Este fenómeno ya se ha descrito en las últimas décadas22 y más recientemente tras la pandemia COVID-193, si bien el aumento de incidencia de DM1 observado en los últimos años en Europa23 no se ha observado en España24. En nuestro caso, llama especialmente la atención el marcado aumento en la tendencia temporal a partir del año 2020, tanto en los pacientes con DM1 como DM2. A pesar de la asociación entre los iSGLT-2 y el mayor riesgo de CAD e incluso ingreso en la UCI por este motivo25 en comparación con otros antidiabéticos orales, el incremento de incidencia fue similar en los pacientes en tratamiento con estos fármacos y sin ellos, con pendientes de incidencia paralelas tanto en DM1, DM2 y los pacientes tratados con iSGLT-2. El pico de incidencia coincide con la pandemia de COVID-19, lo que sugiere una posible influencia de la infección viral en la precipitación de CAD que no fue estudiada en este trabajo. Sin embargo, es posible que una causa relevante del aumento de casos observado se deba a la repercusión asistencial que supuso la pandemia en todos los pacientes, con disminución de seguimiento y realización de ejercicio físico, peor control glucémico, reducción de adherencia a tratamientos e incluso pérdida de seguimiento médico26.
En el pronóstico de la CAD, observamos que la mortalidad fue significativamente mayor en los pacientes con DM2 tanto a los 30 días como a los 90 días. Este hecho ha sido refrendado en varias ocasiones en la literatura10,14. En el modelo de regresión logística para la mortalidad a 30 días se observó que las diferencias de mortalidad se debían a la gravedad del desencadenante y el deterioro neurológico consiguiente, sin asociarse con la edad de los pacientes ni con el tipo de diabetes. En este contexto, proponemos la hipótesis de que el peor pronóstico en los pacientes con DM2 no se debe al tipo de diabetes en sí, sino a las características que frecuentemente se asocian a esta población, como una mayor repercusión neurológica, desencadenantes más graves, y marcadores como niveles elevados de urea, entre otros, debidos probablemente a una menor reserva funcional. Por tanto, es crucial extremar la atención ante un episodio de CAD en una persona con DM2 independientemente de que el desequilibrio ácido-base sea leve inicialmente, debido a la alta tasa de desencadenantes graves y mortalidad en el corto plazo que presenta.
Este trabajo adolece de varias limitaciones. Se trata de un estudio observacional retrospectivo, por lo tanto, su capacidad para establecer criterios de causalidad queda restringida al planteamiento de hipótesis. Adicionalmente, el carácter unicéntrico puede generar sesgos por las idiosincrasias del medio de trabajo que no sean reproducibles en otros escenarios. Una limitación importante del estudio es la exclusión de sujetos con datos faltantes, un problema inherente a los estudios observacionales, que podría introducir un sesgo de selección y limitar la generalización de los resultados. Asimismo, no se dispone de información suficiente sobre los pacientes trasladados a otros centros para determinar si sus características diferían significativamente de los incluidos en el análisis. En tercer lugar, no se recogieron los tiempos en los que se llevó a cabo la atención ni la duración en la resolución de la CAD. Tampoco se analizó el estado inmunológico o vacunal de los individuos, así como la tasa de infección por SARS-CoV-2 en los sujetos incluidos en el estudio, lo que podría permitir profundizar en las causas del aumento de incidencia observado en nuestro medio. Por último, no se recogieron variables socioeconómicas, que son decisivas en el control de la diabetes y sus complicaciones. Es sabido que factores como los ingresos económicos, el nivel educativo y el acceso a los servicios de salud pueden influir significativamente en la adherencia al tratamiento, el acceso a tecnologías avanzadas y la capacidad para implementar cambios en el estilo de vida necesarios para un adecuado control metabólico27,28. La falta de estas variables en el análisis podría limitar la interpretación de los resultados, ya que los pacientes en situaciones socioeconómicas más vulnerables suelen presentar peores desenlaces clínicos29. Asimismo, no se evaluó el impacto que ha tenido la implementación de la tecnología en diabetes30 en los últimos años sobre la CAD, lo que también podría influir en las diferencias observadas en el control glucémico y las complicaciones asociadas.
En resumen, la CAD en la DM2 se asocia a un peor pronóstico vital en el corto plazo a pesar de presentar un perfil gasométrico inicial más favorable. La gravedad de los desencadenantes y el deterioro neurológico podría justificar el mayor riesgo de mortalidad observado. Existe una tendencia al aumento de la CAD en DM2 y en DM1 cuyas causas aún están por determinar.
Aprobación ética y consentimiento para participarEl Comité de Ética de la Investigación del Hospital de La Princesa, Madrid (Número del estudio: 5554-06/24), aprobó este estudio y renunció al consentimiento informado de los pacientes. La investigación se llevó a cabo de acuerdo con la Declaración de Helsinki.
AutoríasFS-V y JAM-A: participaron en el diseño del estudio, investigaron los datos, contribuyeron a la discusión y redactaron/editaron el artículo. CM.O: realizó los análisis estadísticos. MST-S: ML-R y MM: redactaron/editaron el artículo. JJR-L, VNM, SA, SG-C, EC-L y CS-L: participaron en la recolección de datos y revisaron/editaron el artículo.
Todos los autores han revisado y aprobado los datos, han contribuido al desarrollo y aprobación del manuscrito, y han acordado la decisión de enviar el manuscrito para su publicación.
FinanciaciónEste trabajo fue financiado por los Proyectos de Investigación en Salud PI19/00584, PI22/01404 y PMP22/00021 (financiados por el Instituto de Salud Carlos III), iTIRONET-P2022/BMD7379 (financiado por la Comunidad de Madrid) y cofinanciado por fondos FEDER a MM.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.