La asociación entre la apnea obstructiva del sueño (AOS) y el metabolismo de la glucosa sigue siendo controvertida. Este estudio investiga la relación entre la AOS y la diabetes mellitus tipo 2 (DM) y prediabetes (preDM) incidentes, así como el efecto del tratamiento con presión positiva continua en la vía aérea (CPAP) a largo plazo.
MétodosEstudio de seguimiento en cohorte retrospectiva clínica de pacientes con AOS y controles seleccionados de manera aleatoria. Los datos sobre DM incidente y preDM, así como de la CPAP se obtuvieron de los registros hospitalarios. La relación entre AOS basal y la DM incidente se examinó con modelos de regresión de Cox.
ResultadosDe un total de 356 pacientes, 169 con AOS y 187 controles fueron seguidos por una mediana de 98 meses; 47 enfermos (13,2%) desarrollaron DM y 43 (12,1%) preDM. La incidencia acumulada a los cinco años de DM fue de 10,7% (6,5-13,9%). De los sujetos con preDM en la muestra basal, 87% evolucionaron a DM incidente. Se demuestra que el índice de masa corporal (IMC), la hipoxia nocturna y el índice de apnea hipopnea (IAH) son factores de riesgo para el desarrollo de DM, y que la CPAP los disminuye.
ConclusionesLos pacientes con AOS tienen mayor probabilidad de desarrollar DM. Los factores de riesgo implicados son el IMC, la hipoxia nocturna y el IAH. El uso regular de CPAP a largo plazo se asoció con una disminución de estos.
The association between obstructive sleep apnea (OSA) and glucose metabolism remains controversial. This study investigates the relationship between OSA and incident type 2 diabetes (DM) and prediabetes (preDM), as well as the effect of long-term CPAP (continuous positive airway pressure) treatment.
MethodsFollow-up study in a retrospective clinical cohort of patients with OSA and randomly selected controls. Data on incident DM and preDM as well as CPAP were obtained from hospital records. The relationship between baseline OSA and incident DM was examined using COX regression models.
ResultsThree hundred and fifty-six patients, 169 with OSA and 187 controls were followed for a median of 98 months; 47 patients (13.2%) developed DM and 43 (12.1%) developed preDM. The 5-year cumulative incidence of DM was 10.7% (6.5–13.9%). 87% of subjects with preDM in the baseline sample progressed to incident DM. It is shown that body mass index (BMI), nocturnal hypoxia and apnea hypopnea index (AHI) are risk factors for the development of DM and that CPAP reduces this risk.
ConclusionsPatients with OSA have a higher risk of developing DM. The risk factors involved are BMI, nocturnal hypoxia and AHI. Regular long-term CPAP use was associated with a decreased risk.
La apnea obstructiva del sueño (AOS) es un trastorno caracterizado por episodios de oclusión total o parcial de la vía aérea superior, que cursa con hipoxemia, fragmentación del sueño y excesiva somnolencia diurna (ESD)1. El tratamiento habitual para la AOS es la presión positiva continua en las vías aéreas (CPAP) que previene la obstrucción de las vías respiratorias y reduce la repercusión clínica de la enfermedad2.
Diferentes estudios han demostrado que el AOS se asocia a la diabetes mellitus tipo 2 (DM)3 siendo la obesidad un factor común para el desarrollo de ambas condiciones4. La asociación entre AOS y DM incrementa el riesgo de enfermedad cardiovascular, en parte debido a la coexistencia de factores de riesgo vascular, tales como la hipertensión arterial (HTA) y/o la dislipidemia5,6.
En distintos metaanálisis se observa que la presencia de AOS corresponde a un mayor riesgo de desarrollar DM7–9, aunque existe discusión sobre si incrementa el de padecer prediabetes (preDM) incidente10. Tampoco hay información definitiva sobre los parámetros asociados con el riesgo de presentar DM o preDM en personas con AOS8. Por otra parte, la CPAP no ha demostrado de manera consistente que mejore el control glucémico o reduzca la resistencia a la insulina. Mientras que en algunos estudios no se encuentra relación11,12, sí que la hay en otros13,14. Son necesarias nuevas investigaciones para establecer con claridad si la CPAP pudiera tener un efecto clínicamente relevante e independiente sobre los trastornos metabólicos15. Este estudio tiene como objetivo analizar la conexión entre la AOS y la DM en una cohorte clínica de pacientes y evaluar el efecto de la terapia CPAP a largo plazo.
MetodologíaDiseñoEstudio de seguimiento de una cohorte retrospectiva de pacientes. Se incluyeron personas remitidas por sospecha de AOS a la consulta del Hospital Clínico Universitario de Santiago a los que se les realizó una poligrafía respiratoria (PR) para confirmar/excluir esta enfermedad. La metodología de elección de la muestra, así como las variables registradas, ha sido expuesta en un estudio previo16. El trabajo fue aprobado por el Comité Ético del hospital (código de registro: 2019/219).
Historia clínica y análisis bioquímicoSe registraron variables demográficas como la edad, género e índice de masa corporal (IMC), así como los antecedentes personales, incluyendo la presencia de HTA, hábitos tabáquicos y de alcohol y preDM. La comorbilidad se valoró mediante el índice de Charlson. Se evaluaron los síntomas obtenidos en la historia clínica como el ronquido, las pausas respiratorias presenciadas, cefalea matutina y la ESD.
Se registraron variables analíticas como glucosa, urea, creatinina, hemoglobina glicosilada (HbA1c), colesterol total, lipoproteína de baja densidad (LDL), lipoproteína de alta densidad (HDL), triglicéridos y hormona estimulante del tiroides (TSH) (se eligieron los datos más cercanos a la fecha de realización de la PR).
Poligrafía respiratoria y variables asociadasEl registro se realizó mediante el sistema de poligrafía Embletta® con software Embla® (Embla Systems Kanata,Canadá) RemLogic™ que monitoriza el flujo nasal, la saturación de oxígeno (SaO2), los movimientos torácicos, la actimetría, el sonido de ronquido y la posición. La apnea se definió como la interrupción del flujo de aire de al menos 10 s y la hipopnea como una disminución de este de al menos 10 s combinada con una desaturación ≥ 3% en comparación con el valor inicial previo al evento durante el sueño. La frecuencia de momentos obstructivos se informó con el índice de apnea hipopnea (IAH). Se consideró AOS a la presencia de un IAH ≥15/h, predominantemente obstructivas, o la observación de un IAH ≥ 5/h acompañado de uno o más de los siguientes factores: ESD, sueño no reparador, cansancio excesivo y/o deterioro de la calidad de vida relacionada con el sueño no justificables por otras causas16,17. Si en la PR el IAH era < 5, se contempló la prueba como negativa. La gravedad de la AOS se expresó de acuerdo con el IAH: leve para valores entre 5 y 14, moderada entre 15 y 30 y grave mayores de 30. Además del IAH, se tomó en cuenta el número total de apneas obstructivas (AO) durante el registro, la cantidad total de hipopneas, la SaO2 media y mínima, el índice de desaturación de O2 (IDO) por hora y el tiempo acumulado con SaO2 por debajo de 90% (CT90).
Terapia con presión positiva continua en la vía aéreaLa terapia con CPAP se prescribió con base en los criterios y guías habituales a personas con AOS moderada o grave y a pacientes con AOS leve, ESD u otros síntomas o riesgos significativos17.
Un técnico del sueño calificado instruyó a los de la terapia CPAP sobre el manejo del dispositivo y el médico le brindó la atención habitual. Los datos de uso de CPAP se obtuvieron del sistema electrónico de administración de salud y fueron descargados en cada visita a la clínica para ser proporcionados, al igual que las fugas e IAH residual.
Se consideró como cumplimiento a un uso promedio de 4 h/noche en más de 70% de estas durante todo el periodo de seguimiento. Los sujetos que rechazaron el empleo de CPAP en el momento del diagnóstico de AOS, aquellos con un manejo menor al habitual o que suspendieron su uso durante el curso de la supervisión en la clínica del sueño, y los que abandonaron dicha observación, fueron clasificados como «no tratados».
Diabetes o prediabetes. Criterios diagnósticosSe consideró DM a la presencia de niveles ≥126 mg/dL de glucosa en plasma en ayunas y/o HbA1c ≥ 6,5, y preDM a la de valores entre 100 y 125 mg/dL de glucosa en plasma en ayunas y/o HbA1c de 5,7-6,418.
Análisis de los datosLos datos se presentan como media (desviación estándar [DE]) para variables distribuidas normalmente y mediana (rango) para no normales. Las comparaciones entre grupos se realizaron con la prueba t de Student y la U de Mann Whitney, según correspondiera. Los parámetros categóricos se cotejaron con una prueba de X2. El IAH se trató como una variable continua y categórica.
Utilizamos modelos de regresión de Cox multivariable para investigar las relaciones entre los predictores relacionados con la AOS y la incidencia de DM y expresamos los resultados como cocientes de riesgos.
Los análisis estadísticos se llevaron a cabo con el programa informático Statistical Package for the Social Sciences (SPSS) para Windows (versión 11.5.1; SPSS, Chicago, IL, EE. UU.).
ResultadosDe los 416 pacientes elegidos entre marzo del 2011 hasta agosto del 2013, se retiraron 60 enfermos diagnosticados de DM. De esta forma, se siguieron 169 del grupo de casos y 187 controles hasta junio del 2020.
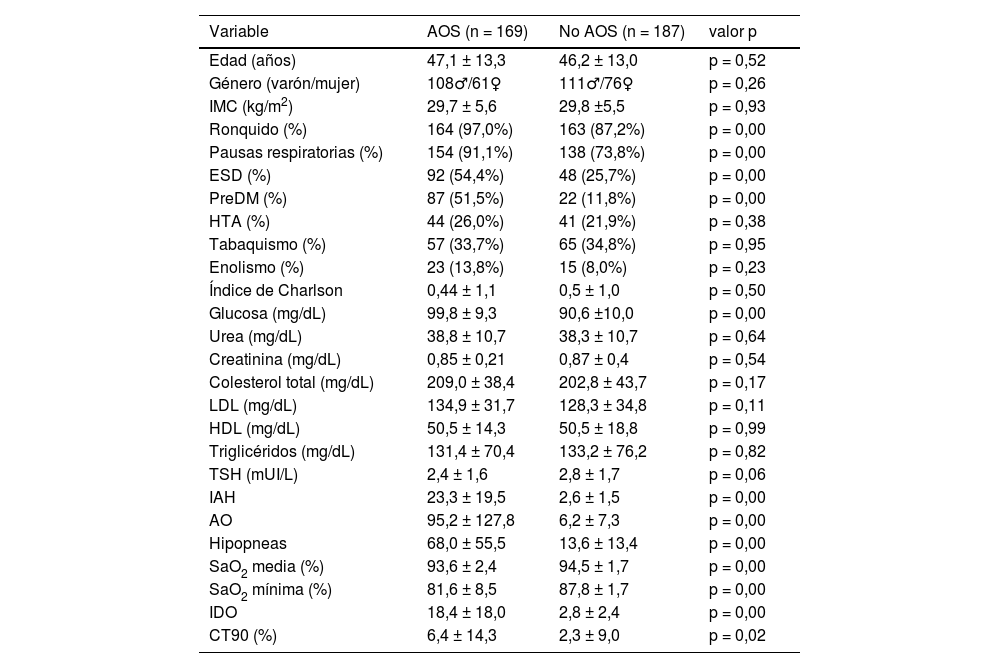
Las características demográficas, los síntomas referidos, comorbilidades, datos analíticos y poligráficos de los pacientes con y sin AOS se presentan en la tabla 1. No se encontraron diferencias entre los grupos con respecto a la edad, género e IMC. Como era previsible, los casos presentaron significativamente más porcentaje de ronquido, pausas respiratorias, ESD y mayor número de preDM y de valores de glucosa. El IAH, el IDO, las AO, las hipopneas y el CT90 tenían valores significativamente mayores en el grupo de estudio en relación al de control. La SaO2 media (%) y SaO2 mínima (%) eran menores en el primero.
Características de los pacientes
| Variable | AOS (n = 169) | No AOS (n = 187) | valor p |
|---|---|---|---|
| Edad (años) | 47,1 ± 13,3 | 46,2 ± 13,0 | p = 0,52 |
| Género (varón/mujer) | 108♂/61♀ | 111♂/76♀ | p = 0,26 |
| IMC (kg/m2) | 29,7 ± 5,6 | 29,8 ±5,5 | p = 0,93 |
| Ronquido (%) | 164 (97,0%) | 163 (87,2%) | p = 0,00 |
| Pausas respiratorias (%) | 154 (91,1%) | 138 (73,8%) | p = 0,00 |
| ESD (%) | 92 (54,4%) | 48 (25,7%) | p = 0,00 |
| PreDM (%) | 87 (51,5%) | 22 (11,8%) | p = 0,00 |
| HTA (%) | 44 (26,0%) | 41 (21,9%) | p = 0,38 |
| Tabaquismo (%) | 57 (33,7%) | 65 (34,8%) | p = 0,95 |
| Enolismo (%) | 23 (13,8%) | 15 (8,0%) | p = 0,23 |
| Índice de Charlson | 0,44 ± 1,1 | 0,5 ± 1,0 | p = 0,50 |
| Glucosa (mg/dL) | 99,8 ± 9,3 | 90,6 ±10,0 | p = 0,00 |
| Urea (mg/dL) | 38,8 ± 10,7 | 38,3 ± 10,7 | p = 0,64 |
| Creatinina (mg/dL) | 0,85 ± 0,21 | 0,87 ± 0,4 | p = 0,54 |
| Colesterol total (mg/dL) | 209,0 ± 38,4 | 202,8 ± 43,7 | p = 0,17 |
| LDL (mg/dL) | 134,9 ± 31,7 | 128,3 ± 34,8 | p = 0,11 |
| HDL (mg/dL) | 50,5 ± 14,3 | 50,5 ± 18,8 | p = 0,99 |
| Triglicéridos (mg/dL) | 131,4 ± 70,4 | 133,2 ± 76,2 | p = 0,82 |
| TSH (mUI/L) | 2,4 ± 1,6 | 2,8 ± 1,7 | p = 0,06 |
| IAH | 23,3 ± 19,5 | 2,6 ± 1,5 | p = 0,00 |
| AO | 95,2 ± 127,8 | 6,2 ± 7,3 | p = 0,00 |
| Hipopneas | 68,0 ± 55,5 | 13,6 ± 13,4 | p = 0,00 |
| SaO2 media (%) | 93,6 ± 2,4 | 94,5 ± 1,7 | p = 0,00 |
| SaO2 mínima (%) | 81,6 ± 8,5 | 87,8 ± 1,7 | p = 0,00 |
| IDO | 18,4 ± 18,0 | 2,8 ± 2,4 | p = 0,00 |
| CT90 (%) | 6,4 ± 14,3 | 2,3 ± 9,0 | p = 0,02 |
♂: hombre, ♀: mujer; AO: apneas obstructivas; AOS: apnea obstructiva del sueño; CT90: tiempo de registro con SaO2 por debajo de 90%; ESD: excesiva somnolencia diurna; HDL: lipoproteína de alta densidad; HTA: hipertensión arterial; IAH: índice de apnea hipopnea; IDO: índice de desaturación de oxígeno; IMC: índice de masa corporal; LDL: lipoproteína de baja densidad; preDM: prediabetes; TSH: hormona estimulante del tiroides.
A los cinco años de seguimiento, 38 de los 356 pacientes habían desarrollado DM, lo que supone una incidencia acumulada de esta enfermedad de 10,7 (intervalo de confianza [IC] 95% [6,5-13,9]). Durante un seguimiento completo, con una mediana de 98 meses (rango intercuartílico [IQR] 86-103), 47 usuarios (13,2%) experimentaron DM y 43 preDM (12,1%). De los 47 que desarrollaron DM, 42 padecían AOS (89,4%) y cinco (10,6%) no. De los 43 que tuvieron preDM, 35 padecían AOS (81,4%) y ocho (18,6%) no. Fallecieron 18 enfermos, (58,7 ± 10,6 años, IMC 31,1 ± 9,5 kg/m2, 13 varones y cinco mujeres), ocho por neoplasia, cinco por infección respiratoria, dos por traumatismo craneoencefálico, dos por accidente cerebrovascular y uno por fallo cardiaco. De ellos, 10 padecían AOS (cinco en tratamiento con CPAP) y ocho eran controles. Es de destacar la presencia de desaturación nocturna con saturaciones medias por debajo de 90% y/o CT90 > de 30% en nueve pacientes (50%).
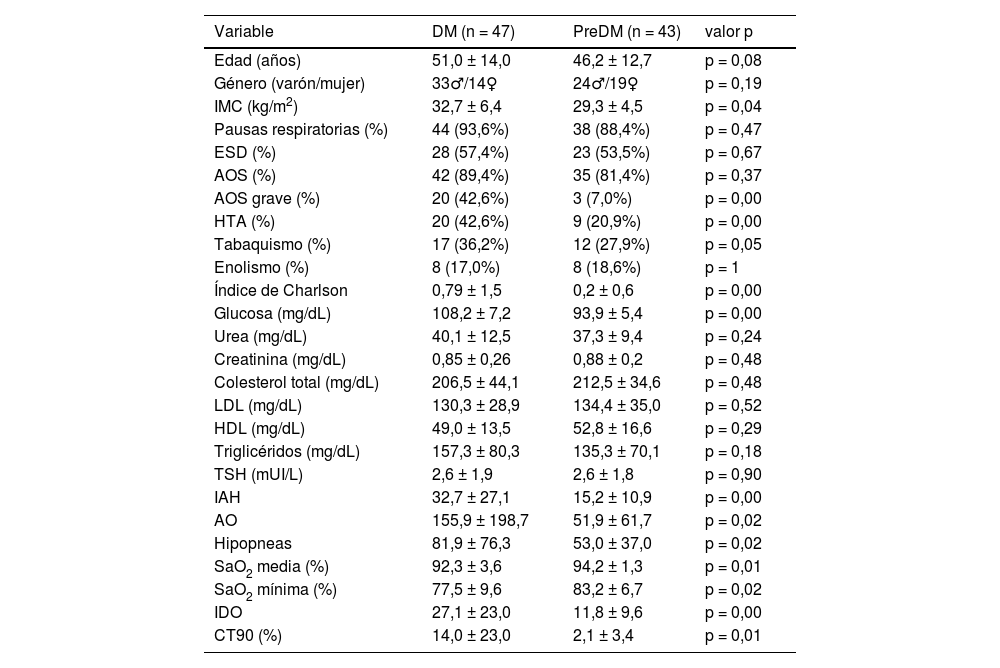
Las características demográficas, síntomas referidos, comorbilidades, datos analíticos y poligráficos de los usuarios que desarrollaron DM o preDM se presentan en la tabla 2. El IMC era significativamente mayor en el grupo con DM, sin diferencias con respecto a la edad y género. No se observaron diferencias en la sintomatología clínica de AOS, como ronquido, pausas respiratorias o ESD ni en el porcentaje de AOS. El AOS grave era notablemente más común en el grupo de pacientes con DM, así como la presencia de HTA y el tabaquismo. La comorbilidad existente, según el índice de Charlson fue superior en aquellos con DM que en el grupo de preDM. La glucosa, como era de esperar, fue considerablemente superior en el grupo de DM con respecto a los del preDM. También el IAH, AO, SaO2 media, IDO y CT90 fueron significativamente mayores en el grupo de DM. La SaO2 media (%) y SaO2 mínima (%) eran menores en el grupo con DM.
Características de los pacientes que desarrollan DM o preDM durante el seguimiento
| Variable | DM (n = 47) | PreDM (n = 43) | valor p |
|---|---|---|---|
| Edad (años) | 51,0 ± 14,0 | 46,2 ± 12,7 | p = 0,08 |
| Género (varón/mujer) | 33♂/14♀ | 24♂/19♀ | p = 0,19 |
| IMC (kg/m2) | 32,7 ± 6,4 | 29,3 ± 4,5 | p = 0,04 |
| Pausas respiratorias (%) | 44 (93,6%) | 38 (88,4%) | p = 0,47 |
| ESD (%) | 28 (57,4%) | 23 (53,5%) | p = 0,67 |
| AOS (%) | 42 (89,4%) | 35 (81,4%) | p = 0,37 |
| AOS grave (%) | 20 (42,6%) | 3 (7,0%) | p = 0,00 |
| HTA (%) | 20 (42,6%) | 9 (20,9%) | p = 0,00 |
| Tabaquismo (%) | 17 (36,2%) | 12 (27,9%) | p = 0,05 |
| Enolismo (%) | 8 (17,0%) | 8 (18,6%) | p = 1 |
| Índice de Charlson | 0,79 ± 1,5 | 0,2 ± 0,6 | p = 0,00 |
| Glucosa (mg/dL) | 108,2 ± 7,2 | 93,9 ± 5,4 | p = 0,00 |
| Urea (mg/dL) | 40,1 ± 12,5 | 37,3 ± 9,4 | p = 0,24 |
| Creatinina (mg/dL) | 0,85 ± 0,26 | 0,88 ± 0,2 | p = 0,48 |
| Colesterol total (mg/dL) | 206,5 ± 44,1 | 212,5 ± 34,6 | p = 0,48 |
| LDL (mg/dL) | 130,3 ± 28,9 | 134,4 ± 35,0 | p = 0,52 |
| HDL (mg/dL) | 49,0 ± 13,5 | 52,8 ± 16,6 | p = 0,29 |
| Triglicéridos (mg/dL) | 157,3 ± 80,3 | 135,3 ± 70,1 | p = 0,18 |
| TSH (mUI/L) | 2,6 ± 1,9 | 2,6 ± 1,8 | p = 0,90 |
| IAH | 32,7 ± 27,1 | 15,2 ± 10,9 | p = 0,00 |
| AO | 155,9 ± 198,7 | 51,9 ± 61,7 | p = 0,02 |
| Hipopneas | 81,9 ± 76,3 | 53,0 ± 37,0 | p = 0,02 |
| SaO2 media (%) | 92,3 ± 3,6 | 94,2 ± 1,3 | p = 0,01 |
| SaO2 mínima (%) | 77,5 ± 9,6 | 83,2 ± 6,7 | p = 0,02 |
| IDO | 27,1 ± 23,0 | 11,8 ± 9,6 | p = 0,00 |
| CT90 (%) | 14,0 ± 23,0 | 2,1 ± 3,4 | p = 0,01 |
♂ = hombre, ♀: mujer; AO: apneas obstructivas; AOS: apnea obstructiva del sueño; CT90: tiempo de registro con SaO2 por debajo de 90%; DM: diabetes mellitus; ESD: excesiva somnolencia diurna; HDL: lipoproteína de alta densidad; HTA: hipertensión arterial; IAH: índice de apnea hipopnea; IDO: índice de desaturación de oxígeno; IMC: índice de masa corporal; LDL: lipoproteína de baja densidad; TSH: hormona estimulante del tiroides.
Entre los 169 pacientes con AOS, 45 (26,6%) iniciaron tratamiento con CPAP. La presión media utilizada fue 7,8 ± 1,1 cm de H2O y el uso medio 6,0 ± 2,3 h. De los 45 enfermos que cumplieron el tratamiento con CPAP, 15 desarrollaron DM (33,3%).
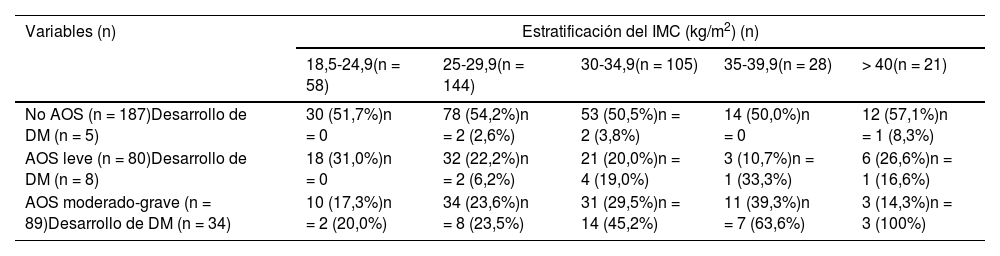
En la tabla 3 se relaciona el nivel de gravedad de la AOS con la prevalencia de DM y preDM, observándose una elevación del porcentaje de pacientes con DM a medida que aumenta el nivel de gravedad de AOS en la muestra inicial de seguimiento. De los usuarios con AOS moderado-grave, 34 (38,2%) desarrollaron DM, con respecto a ocho (10%) con AOS leve y cinco (2,7%) sin AOS. No se encontró asociación entre el nivel de gravedad de la AOS y la preDM incidente. De los que tenían AOS moderado-grave, 18 (20,2%) desarrollaron preDM, con respecto a 17 (21%) del grupo con AOS leve.
Incidencia acumulada de Diabetes y prediabetes en relación con el nivel de gravedad de la AOS*
| No AOS (n = 187) | AOS leve (n = 80) | AOS moderado-grave (n = 89) | |
|---|---|---|---|
| DM | 5 (2,7%) | 8 (10,0%) | 34 (38,2%) |
| PreDM | 8 (4,3%) | 17 (21,2%) | 18 (20,2%) |
AOS: apnea obstructiva del sueño; DM: diabetes mellitus; preDM: prediabetes.
La tabla 4 relaciona distintos niveles del IMC con la gravedad de la AOS (basado en niveles de IAH) y con el desarrollo de DM. Los sujetos sin AOS no presentan cambios en la prevalencia de DM con respecto a los distintos estratos de IMC. En el AOS leve el predominio de DM se incrementa sobre todo a partir de un IMC de 30 kg/m2. Como puede observarse, es con la AOS moderada-grave cuando la prevalencia de DM es muy alta, incrementándose de forma progresiva en comparación con el IMC. De hecho, 63% de los pacientes con AOS moderado-grave e IMC entre 35-39,9 kg/m2 y todos los enfermos con AOS moderado-grave y IMC mayor de 40 kg/m2, sufren DM.
Estratificación del IMC, presencia o no de AOS y desarrollo de DM
| Variables (n) | Estratificación del IMC (kg/m2) (n) | ||||
|---|---|---|---|---|---|
| 18,5-24,9(n = 58) | 25-29,9(n = 144) | 30-34,9(n = 105) | 35-39,9(n = 28) | > 40(n = 21) | |
| No AOS (n = 187)Desarrollo de DM (n = 5) | 30 (51,7%)n = 0 | 78 (54,2%)n = 2 (2,6%) | 53 (50,5%)n = 2 (3,8%) | 14 (50,0%)n = 0 | 12 (57,1%)n = 1 (8,3%) |
| AOS leve (n = 80)Desarrollo de DM (n = 8) | 18 (31,0%)n = 0 | 32 (22,2%)n = 2 (6,2%) | 21 (20,0%)n = 4 (19,0%) | 3 (10,7%)n = 1 (33,3%) | 6 (26,6%)n = 1 (16,6%) |
| AOS moderado-grave (n = 89)Desarrollo de DM (n = 34) | 10 (17,3%)n = 2 (20,0%) | 34 (23,6%)n = 8 (23,5%) | 31 (29,5%)n = 14 (45,2%) | 11 (39,3%)n = 7 (63,6%) | 3 (14,3%)n = 3 (100%) |
AOS: apnea obstructiva del sueño; DM: diabetes mellitus; IMC: índice de masa corporal.
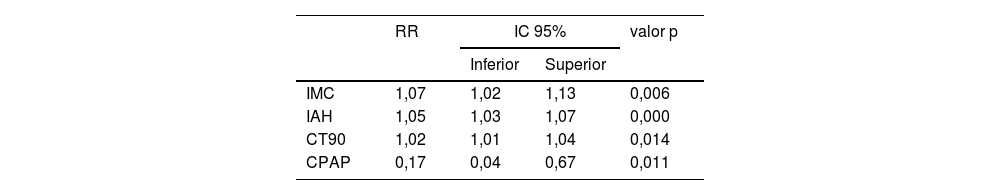
La tabla 5 muestra que los factores de riesgo para desarrollar DM fueron el IMC, IAH, CT90 y el tratamiento con CPAP. Mientras que las tres primeras variables incrementaron la posibilidad de padecer DM, el tratamiento con CPAP lo disminuyó. Aplicar la terapia con CPAP rebaja el riesgo de DM en 83% con respecto a los que no la recibieron.
Ajuste del modelo y efecto de los predictores expresados como RR e IC de 95% para DM
| RR | IC 95% | valor p | ||
|---|---|---|---|---|
| Inferior | Superior | |||
| IMC | 1,07 | 1,02 | 1,13 | 0,006 |
| IAH | 1,05 | 1,03 | 1,07 | 0,000 |
| CT90 | 1,02 | 1,01 | 1,04 | 0,014 |
| CPAP | 0,17 | 0,04 | 0,67 | 0,011 |
CPAP: presión positiva continua en la vía aérea; CT90: tiempo de registro con SaO2 por debajo de 90%; DM: diabetes mellitus; IAH: índice de apnea hipopnea; IC: intervalo de confianza; IMC: índice de masa corporal; RR: riesgo relativo.
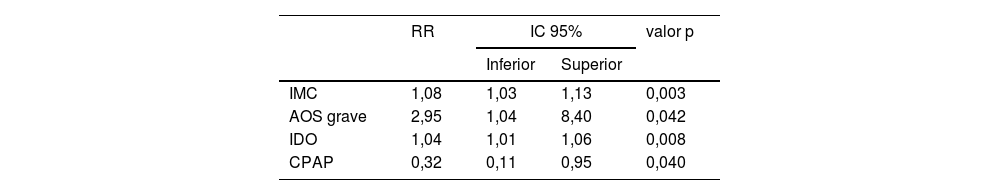
En la tabla 6 se muestra un segundo modelo donde se incluye la AOS grave como factor de riesgo, con un valor relativo de 2,95 (IC 95% [1,4-8,4]). También se agrega el IMC y el IDO. El tratamiento con CPAP disminuye el desarrollar DM en 68% con respecto a los que no lo recibieron.
Ajuste del modelo y efecto de los predictores expresados como RR e IC de 95% para DM
| RR | IC 95% | valor p | ||
|---|---|---|---|---|
| Inferior | Superior | |||
| IMC | 1,08 | 1,03 | 1,13 | 0,003 |
| AOS grave | 2,95 | 1,04 | 8,40 | 0,042 |
| IDO | 1,04 | 1,01 | 1,06 | 0,008 |
| CPAP | 0,32 | 0,11 | 0,95 | 0,040 |
AOS grave: IAH ≥ 30.
AOS: apnea obstructiva del sueño; CPAP: presión positiva continua en la vía aérea; DM: diabetes mellitus; IAH: índice de apnea hipopnea; IC: intervalo de confianza; IDO: índice de desaturación de oxígeno; IMC: índice de masa corporal; RR: riesgo relativo.
Nuestros resultados muestran que los pacientes con AOS son más propensos de padecer DM y preDM y que el IMC, el IAH, CT90 y el IDO son factores de riesgo de DM incidente. Estos hallazgos concuerdan con varios estudios prospectivos8,19,20 y metaanálisis recientes9,21.
La AOS conduce a varios trastornos fisiológicos, como hipoxia intermitente, fragmentación del sueño y aumento del tono autonómico. Estos trastornos se han asociado con la resistencia a la insulina y la DM en estudios con animales y humanos. La hipoxia intermitente juega un papel fundamental en la patogenia de AOS y las investigaciones experimentales indican que esta conduce a la atenuación de la secreción de insulina inducida por glucosa de las células β pancreáticas y al incremento de la resistencia a esta en células y tejidos periféricos. La combinación de interrupción del sueño y un sistema simpático hiperactivado también acrecienta la liberación de catecolaminas por el eje hipotalámico-pituitario-suprarrenal, en parte debido a los niveles elevados de norepinefrina que media la secreción del factor liberador de corticotropina. Un aumento en la secreción de este componente provoca una elevación de los grados de glucocorticoides que promueve la gluconeogénesis en el hígado y una disminución en la captación y utilización de glucosa en el músculo esquelético y el tejido adiposo blanco al antagonizar la respuesta a la insulina. Esto conduce a hiperglucemia y resistencia a la insulina22,23.
En nuestro estudio, con una mediana de seguimiento de 98 meses, 13,2% pacientes desarrollaron DM, con una incidencia acumulada a los cinco años de 10,7% (6,5-13,9%), cifras similares a otras series. En una investigación canadiense, con una mediana de seguimiento de 67 meses, 11,7% usuarios desarrollaron DM y con una incidencia acumulada a los cinco años de 9,1%20. En otro estudio con 1.206 pacientes con una mediana de seguimiento de 7,3 años, 12,6% desarrollaron DM8. En otra serie con una mediana de observación mayor a la nuestra (13 años), hubo más porcentaje de DM incidente (19,6%)24. En una investigación reciente, con cinco años de supervisión, 14,5% de los usuarios desarrollaron DM incidente19. Por último, en un trabajo realizado en Corea en el que siguieron a 1.216 sujetos, la incidencia acumulada a los cuatro años fue de 7,9% y de 14% a los ocho años25.
Distintas series han mostrado un incremento del riesgo de desarrollar DM en pacientes con AOS grave. Kendzerska et al. encontraron que los enfermos con AOS grave tenían 30% más de probabilidades de sufrir DM con respecto a aquellos sin AOS20. Estas incrementan en otros estudios hasta 71%24. En el nuestro, 38% de los usuarios con AOS moderada-grave padecieron DM con respecto a 10% con AOS leve y 2,7% sin AOS. El riesgo relativo de presentar DM en personas con AOS grave fue de 2,95 (IC 95% [1,04-8,40]); p = 0,042], cifras similares a las aportadas por Xu et al. quienes encuentran unos índices de riesgo de 2,01 (IC 95% [1,06-3,81]) en AOS moderado y 2,62 (IC 95% [1,40-4,93]) en AOS grave8. En el estudio de Siddiquee et al., los participantes con AOS moderado-grave tenían un riesgo 1,5 veces mayor de desarrollar DM al final del seguimiento de ocho años, tras ajustar las posibles covariables25.
Aunque distintos estudios recientes relacionan el AOS con la DM incidente3,9,21, existe, sin embargo, escasa información con respecto a la asociación entre AOS con la preDM incidente. En nuestra serie, 12,1% llegan a padecer preDM tras una mediana de seguimiento de 98 meses y, al contrario que en la DM, no hemos encontrado conexión entre la gravedad de la AOS y la preDM incidente. Sin embargo, sí que hemos comprobado que la preDM es una situación que padecen muchas personas y que posteriormente pasan a desarrollar DM, siendo el AOS un factor que puede intervenir. De hecho, 41 de los 47 enfermos con DM incidente (87,2%) tenían preDM en la muestra inicial. De esos 41, 38 padecían un AOS. Esta evolución de preDM a DM ha sido también observada en otros estudios9,26. Todo ello enfatiza la importancia de la preDM e identifica los vínculos con la AOS. De los 38 enfermos con AOS, 11 (30%) seguían ya tratamiento con CPAP y a pesar de ello evolucionaron a DM. Por tanto, es posible que estos pudieran beneficiarse del tratamiento con antidiabéticos orales. Solo uno de los enfermos seguía terapia con metformina. Son escasos los estudios sobre este tema. Tang et al., en 36 pacientes seguidos durante 24 meses, encontraron que la combinación de dapagliflozina y metformina optimizó el control glucémico en usuarios con AOS y DM, además de mejorar la sintomatología asociada al AOS. En otro estudio, la metformina mejoró el control glucémico, pero no ayudó al manejo de la AOS27,28. Es de destacar también la mayor presencia de comorbilidad según el índice de Charlson y enfermedad cardiovascular, como HTA en el grupo con DM incidente con respecto al de preDM incidente. Por tanto, el tratamiento de AOS es un factor esencial para prevenir una patología metabólica y cardiovascular. Entre los tratamientos, la CPAP es la que ha demostrado un claro beneficio en estos enfermos2.
El uso regular de CPAP, que se logró en aproximadamente un tercio de los sujetos con AOS moderada-grave, se asoció con una reducción de la DM incidente8. En nuestro estudio, 26% completaron el tratamiento con CPAP durante todo el seguimiento, de acuerdo con las indicaciones de nuestras guías17. Esta terapia se relacionó con la reducción del riesgo de DM en nuestros enfermos.
Distintos estudios han informado de efectos metabólicos beneficiosos de la CPAP en pacientes con una alta adherencia a la terapia y a muy corto plazo29–31. Recientemente, a largo plazo, en un estudio de seguimiento durante cinco años, se encontró que la CPAP reduce el desarrollo de DM en personas con AOS32. Sin embargo, en un estudio de Loffler et al., con 888 participantes, con una mediana de seguimiento de 4,3 años, no se observó evidencia de que la terapia con CPAP afectara al control glucémico en aquellos pacientes con DM o preDM, en comparación con el tratamiento estándar12. Múltiples factores pueden contribuir a la heterogeneidad de los resultados, incluidos diferentes niveles de cumplimiento de la CPAP o diversas duraciones de esta terapia.
Hay algunas limitaciones que deben ser consideradas en la interpretación de nuestros hallazgos. El número de pacientes tratados con CPAP no es elevado y es posible que el tamaño de la muestra sea reducido para este análisis. Por otra parte, la generalización de los resultados debe hacerse con precaución al ser un estudio de un solo centro. Finalmente, la valoración de la gravedad de la AOS, basada únicamente en el IAH, no refleja la heterogeneidad de la enfermedad, aunque nosotros hemos tenido en cuenta también el CT90 como reflejo de la hipoxemia, el grado de obesidad medido por el IMC y las comorbilidades.
En definitiva, nuestro estudio muestra que la presencia de AOS es un factor de riesgo de DM incidente, que se incrementa en los pacientes con AOS grave y disminuye tras el tratamiento con CPAP en los casos moderados y graves. Estos hallazgos sugieren que los proveedores de atención médica que trabajan en los campos de diabetes y AOS deberían evaluar a los usuarios que presentan una afección para detectar la presencia de la otra. La intervención temprana puede prevenir eventos cardiovasculares al realizar un diagnóstico temprano de AOS en personas con DM o preDM y disminuir la morbilidad en este segmento de la población.
Consideraciones éticasConsentimiento informado según dictamen del Comité de Ética de la investigación de Santiago-Lugo. Código de Registro: 2019/219.
FinanciaciónEste trabajo no ha recibido ningún tipo de financiación.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Romina Abelleira. Concepción y diseño del estudio. Autora. Recogida de los datos. Análisis e interpretación de los datos. Revisión crítica del artículo. Aprobación final del manuscrito.
Carlos Zamarrón. Recogida de los datos. Concepción y diseño del estudio. Autor. Análisis e interpretación de los datos. Revisión crítica del artículo. Aprobación final del manuscrito.
Vanessa Riveiro. Recogida de los datos. Análisis e interpretación de los datos. Revisión crítica del artículo. Aprobación final del manuscrito.
Ana Casal. Recogida de los datos. Análisis e interpretación de los datos. Revisión crítica del artículo. Aprobación final del manuscrito.
María Elena Toubes. Recogida de los datos. Análisis e interpretación de los datos. Revisión crítica del artículo. Aprobación final del manuscrito.
Carlos Rábade. Recogida de los datos. Análisis e interpretación de los datos. Revisión crítica del artículo. Aprobación final del manuscrito.
Jorge Ricoy. Recogida de los datos. Análisis e interpretación de los datos. Revisión crítica del artículo. Aprobación final del manuscrito.
Adriana Lama. Recogida de los datos. Análisis e interpretación de los datos. Revisión crítica del artículo. Aprobación final del manuscrito.
Nuria Rodríguez-Núñez. Recogida de los datos. Análisis e interpretación de los datos. Revisión crítica del artículo. Aprobación final del manuscrito.
Lucía Ferreiro. Recogida de los datos. Análisis e interpretación de los datos. Revisión crítica del artículo. Aprobación final del manuscrito.
Juan Rodríguez Ozores. Recogida de los datos. Análisis e interpretación de los datos. Revisión crítica del artículo. Aprobación final del manuscrito.
Luis Valdés. Concepción y diseño del estudio. Autor. Análisis e interpretación de los datos. Revisión crítica del artículo. Aprobación final del manuscrito.