Durante la pandemia de COVID-19 surgieron diversas estrategias para el manejo de la enfermedad, incluidos los tratamientos farmacológicos y no farmacológicos como el plasma convaleciente (PC). El uso de PC se sugirió debido a los resultados benéficos mostrados al tratar otras enfermedades virales.
ObjetivoDeterminar la eficacia y la seguridad de la administración de PC obtenido de sangre total en pacientes con COVID-19.
MétodosEnsayo clínico piloto en pacientes con COVID-19 de un hospital general. Los sujetos se separaron en 3 grupos que recibieron la transfusión de 400ml de PC (n=23) o 400ml de plasma estándar (PE) (n=19) y un grupo no transfundido (NT) (n=37). Los pacientes recibieron además, el tratamiento médico estándar disponible para COVID-19. El seguimiento de los sujetos se llevó a cabo diariamente desde el ingreso hasta el día 21.
ResultadosEl PC no mejoró la curva de supervivencia en las variantes moderadas y graves de COVID-19, ni disminuyó el grado de severidad de la enfermedad evaluado con la escala de progresión clínica COVID-19, OMS y SOFA. Ningún paciente presentó una reacción postransfusional severa al PC.
ConclusionesEl tratamiento con PC no disminuye la mortalidad de los pacientes, aun cuando su administración tiene un alto grado de seguridad.
During the COVID-19 pandemic, several strategies were suggested for the management of the disease, including pharmacological and non-pharmacological treatments such as convalescent plasma (CP). The use of CP was suggested due to the beneficial results shown in treating other viral diseases.
ObjectiveTo determine the efficacy and safety of CP obtained from whole blood in patients with COVID-19.
MethodsPilot clinical trial in patients with COVID-19 from a general hospital. The subjects were separated into three groups that received the transfusion of 400ml of CP (n=23) or 400ml of standard plasma (SP) (n=19) and a non-transfused group (NT) (n=37). Patients also received the standard available medical treatment for COVID-19. Subjects were followed up daily from admission to day 21.
ResultsThe CP did not improve the survival curve in moderate and severe variants of COVID-19, nor did it reduce the degree of severity of the disease evaluated with the COVID-19 WHO and SOFA clinical progression scale. No patient had a severe post-transfusion reaction to CP.
ConclusionsTreatment with CP does not reduce the mortality of patients even when its administration has a high degree of safety.
La enfermedad por infección de SARS-CoV-2 se declaró pandemia en marzo de 2020, y dada la urgencia de la situación, las instituciones de salud mundial permitieron el empleo de sustancias que potencialmente tuvieran efectos benéficos1. Por este motivo se inició el uso de plasma convaleciente (PC) en COVID-19 en ensayos clínicos, tomando como base el concepto de inmunidad pasiva que es la protección que un individuo adquiere tras la recepción de anticuerpos procedentes de personas previamente infectadas2.
Algunos de los primeros estudios sobre el uso de PC en COVID-19 encontraron efectos benéficos como la disminución de temperatura, de la carga viral, del índice SOFA, cambios favorables en la PaO2/FiO2 y mejoría de la imagen tomográfica a partir del tercer día de la transfusión3. En otro estudio se encontró que el PC redujo la mortalidad en los pacientes críticos, disminuyó los síntomas clínicos, aumentó los títulos de anticuerpos neutralizantes y disminuyó la presencia del SARS-CoV-2 en la mayoría de los pacientes4. En contraste, otro ensayo reportó que la mortalidad al día 28 no presentó diferencia significativa entre los transfundidos con PC y los que recibieron cuidados estándar5.
En cuanto a la seguridad de la terapia transfusional, es bien conocido que la administración de plasma siempre está ligada al riesgo de reacciones postransfusionales adversas que pueden ser inmediatas o tardías6. En un estudio previo con participantes graves se registraron 2 reacciones transfusionales leves y ninguna grave7. Aunque no se conoce con exactitud el riesgo de la administración de PC en el tratamiento del COVID-19, los efectos adversos graves (EAG) observados predominantemente han sido alérgicos, respiratorios, trombóticos, tromboembólicos y cardíacos8,9. Se reporta un riesgo bajo para reacciones adversas relacionadas con la transfusión ya que la incidencia de todos los EAG fue <1%10.
Múltiples publicaciones a nivel internacional indican que los resultados del uso de plasma en pacientes convalecientes, puede ser una modalidad de tratamiento potencialmente útil para el COVID-19, sin embargo, hasta la fecha, no existe un consenso sobre los beneficios de esta terapia que confirmen plenamente su eficacia y seguridad. En este estudio piloto, el objetivo fue determinar la eficacia y la seguridad de la administración de PC obtenido de sangre total en pacientes con COVID-19.
MétodosParticipantesSe incluyeron pacientes con síndrome de distrés respiratorio agudo (SDRA) por COVID-19, que ingresaron al Hospital General de Zona (HGZ) No. 46 del Instituto Mexicano del Seguro Social (IMSS) de Villahermosa, Tabasco, desde el 1.° de febrero al 30 de octubre de 2021, con edad mayor a 18 años, con diagnóstico de infección por SARS-CoV-2 confirmado por RT-PCR positivo en hisopado nasofaríngeo, con saturación parcial de oxígeno (SpO2)≤94% y/o requerimiento de oxígeno suplementario y con evidencia radiológica de afección pulmonar con clasificación CORADS 5 o 6 por tomografía computarizada (TC) de tórax. Se excluyeron los pacientes con prueba negativa para COVID-19, con CORADS<5 por TC de tórax, mujeres embarazadas o lactando; con diagnóstico de infección bacteriana, fúngica o tuberculosis; hemodiálisis o con diálisis peritoneal; insuficiencia hepática; insuficiencia cardiaca; diagnóstico oncológico con pronóstico de vida <3 meses; antecedente de reacción alérgica a la transfusión; enfermedad pulmonar obstructiva crónica con uso de oxígeno domiciliario; presencia de serología positiva para VIH, hepatitis B y C; y diagnóstico de enfermedades autoinmunes.
Diseño de estudio y tratamientosEl presente estudio es un ensayo clínico piloto realizado en pacientes hospitalizados con COVID-19 que cumplieron con los criterios de selección. De 211 pacientes hospitalizados de los cuales se aleatorizaron 46 pacientes para recibir tratamiento con plasma estándar (PE, n=23) (control) o PC, n=23. Otro grupo de comparación estuvo constituido por sujetos que cumplieron con los criterios de inclusión y exclusión, y aceptaron participar en el estudio, pero sin recibir la transfusión (NT, n=37). El método utilizado para generar la secuencia de asignación aleatoria a la transfusión con plasma se llevó a cabo mediante un generador de números aleatorios en línea basado en un ordenador (www.random.org). Los participantes y los investigadores fueron cegados para el tipo de plasma que fue transfundido. La secuencia de asignación a los tratamientos fue implementada por el personal administrativo del banco de sangre, que no participó en el ensayo. Un investigador registró a los participantes y recibió los diferentes plasmas sin conocer si eran PE o PC. Las unidades de plasma fueron colocadas en sobres plásticos negros a medida, que impedían la identificación del donante convaleciente o no convaleciente, con etiquetas finales para su identificación que incluyeron el número de codificación interno del banco de sangre y la leyenda «Uso exclusivo de paciente COVID-19».
Los pacientes enrolados en los grupos PE y PC fueron transfundidos con 200ml del plasma respectivo compatible (sistema ABO y Rh) vía intravenosa durante 1h, en 2 ocasiones separadas por 24h. Además, todos los sujetos recibieron el tratamiento estándar, de acuerdo con la mejor evidencia disponible al momento y la guía de procedimientos para los pacientes con COVID-1911. Dentro de este tratamiento, los pacientes recibieron oxígeno a diferentes volúmenes y presiones ajustados a sus necesidades ventilatorias, así como 8mg de dexametasona/2 veces al día desde su ingreso al hospital. Se registraron los datos basales (día 0), y a partir de la primera transfusión se continuó el seguimiento los días 3, 5, 7, 14 y 21. La terminación del seguimiento fue hasta el día de mejoría clínica y alta o alta voluntaria o pérdida del seguimiento hasta el día 21 o fallecimiento.
Selección de donantes convalecientes de COVID-19Los donantes fueron sujetos recuperados de COVID-19 sin historial de embarazo, ni transfusión, que fueron diagnosticados por RT-PCR positivo de hisopado nasofaríngeo. Los donantes de PC cumplieron desde 21 días hasta 60 días de haber iniciado con síntomas leves y manejo fuera del hospital, asintomáticos al momento de la donación, con posterior prueba RT-PCR negativa y que cumplieran los criterios de selección de la NOM-253-SSA-01-2012. La obtención del plasma se realizó por medio del fraccionamiento de sangre total con el procedimiento estándar de acuerdo con los lineamientos oficiales del banco de sangre establecidos por la Secretaría de Salud de México.
Evaluación de la eficacia del plasma convaleciente en pacientes con COVID-19La eficacia del PC se determinó mediante análisis de supervivencia realizada a los 21 días y la mejoría clínica. La mejoría clínica se evaluó mediante la escala de progresión clínica COVID-19 de la OMS12 y la Escala de Evaluación Secuencial de Falla Orgánica (SOFA)13. La primera define la mejoría como alta del paciente o una reducción de 2 puntos de acuerdo a la siguiente clasificación: 6 puntos, muerte; 5 puntos, hospitalización más uso de oxigenación por membrana extracorpórea (ECMO) o ventilación mecánica invasiva; 4 puntos, hospitalización más ventilación no invasiva u oxígeno suplementario de alto flujo; 3 puntos, hospitalización más oxígeno suplementario (que no sea de alto flujo o ventilación no invasiva); 2 puntos, hospitalización sin oxígeno suplementario; 1 punto, alta hospitalaria; la segunda evalúa la severidad mediante indicadores de daño orgánico como respiración, coagulación, función hepática, cardiovascular, del sistema nervioso y renal.
Evaluación de la seguridad del plasma convaleciente en pacientes con COVID-19La seguridad del PC se evaluó considerando la presencia de efectos adversos como: fiebre, escalofrío, prurito, urticaria, hipotensión, hasta situaciones graves como choque anafiláctico, lesión pulmonar aguda relacionada a la transfusión o sobrecarga de volumen del sistema cardiovascular; o reacción alérgica al citrato. Se consideró reacción adversa a la transfusión cuando se presentó durante las 48h después de la última transfusión. Todas las determinaciones bioquímicas se realizaron usando el equipo Architect i2000SR® (Abbott Diagnostics, Abbott Park, Illinois, EE. UU). La tipificación de grupos ABO/Rh D se realizó en el equipo Echo Lumena® (Immucor®, Cerdanyola del Vallès, Barcelona, España) y las citometrías hemáticas en el equipo Medonic Serie M32B® (Boule Diagnostics AB®, Spånga, Suecia) con los reactivos para los respectivos equipos.
Análisis estadísticoPara determinar si las variables siguieron una distribución paramétrica se empleó la prueba de D’Agostino-Pearson. Las medidas de tendencia central se expresaron como media y desviación estándar (DE) o mediana (percentil 25 y percentil 75). La prueba ANOVA de una vía y Tukey se usó para comparar variables con distribución paramétrica. Para la comparación de variables no paramétricas se usó la prueba de Chi-cuadrado. La supervivencia de los sujetos durante el periodo de 21 días se analizó mediante curvas de Kaplan-Meier. Las comparaciones múltiples se realizaron mediante la regresión de Mantel-Cox (regresión de logrank) y de Gehan-Wilcoxon. Los cursos temporales de los valores de las escalas de progresión clínica de la OMS y SOFA se analizaron mediante el modelo de efectos mixtos usando los valores transformados a logaritmos para normalizar las distribuciones y la prueba de Tukey para comparaciones múltiples. De esta manera se analizaron los efectos del tiempo, del tratamiento y las interacciones en dichas variables. Para investigar los factores asociados con la mortalidad se usó la prueba de regresión logística multivariada con el método «entrar» en la selección de variables. En todos los casos se aceptó una p<0,05 como estadísticamente significativa. Los datos se procesaron en el software estadístico GraphPad Prism v.7.0 para Windows e IBM SPSS® Statistics v.26.
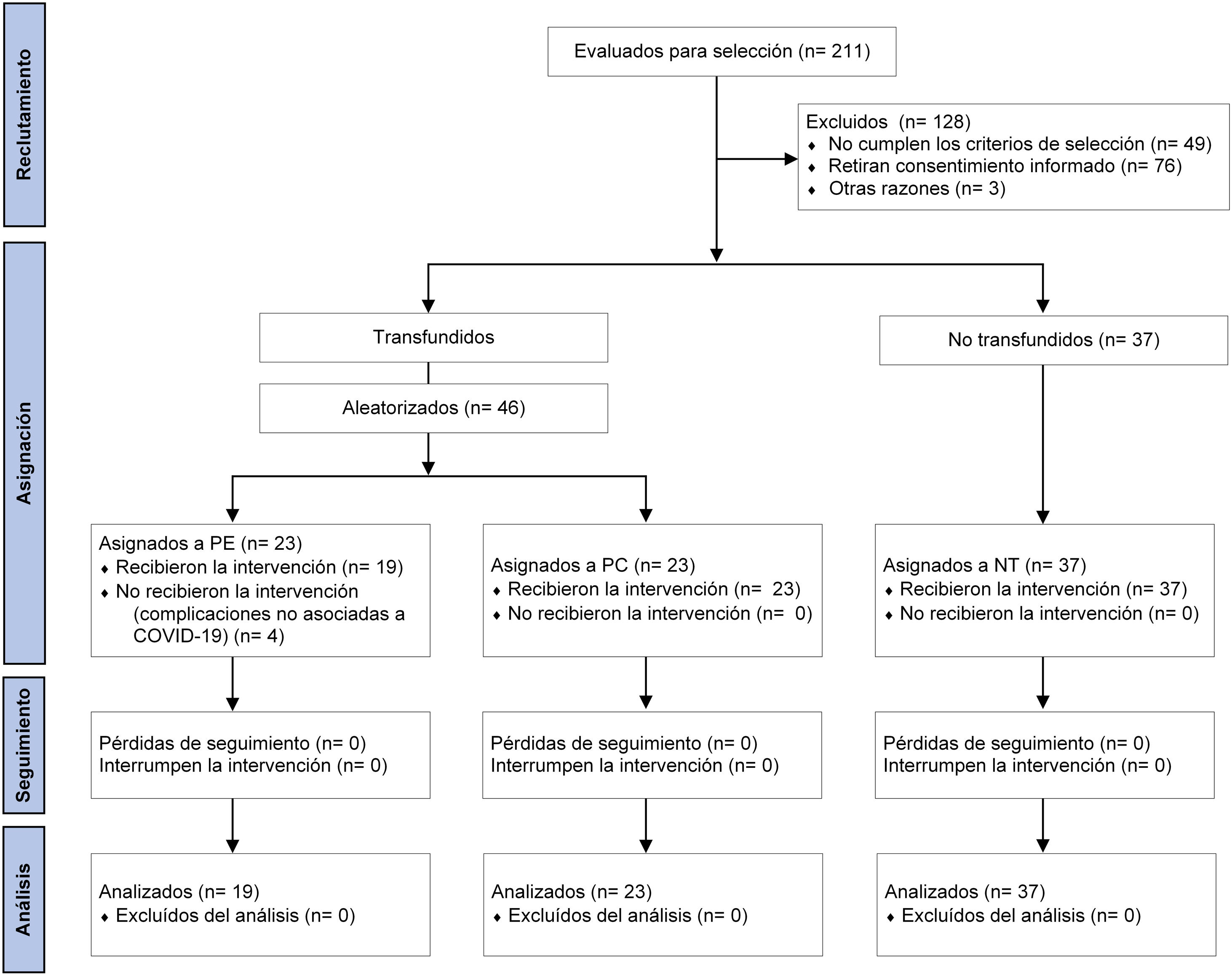
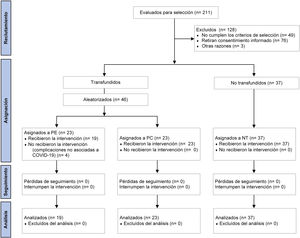
ResultadosCaracterísticas de los participantesDe todos los pacientes admitidos a hospitalización durante el periodo de estudio, se valoraron 211 elegibles para participar. Se excluyeron aquellos que no cumplieron con los criterios de inclusión (n=53), retiraron consentimiento informado (n=76) u otras razones (n=3). De esta manera, se incluyeron 83 pacientes, de los cuales 46 fueron aleatorizados para recibir transfusiones con PE (n=23) o PC (n=23). En el grupo PE, se eliminaron 4 pacientes antes de ser transfundidos por presentar complicaciones no asociadas a COVID-19. En el grupo NT se incluyeron 37 que no recibieron ninguna transfusión con plasma (fig. 1).
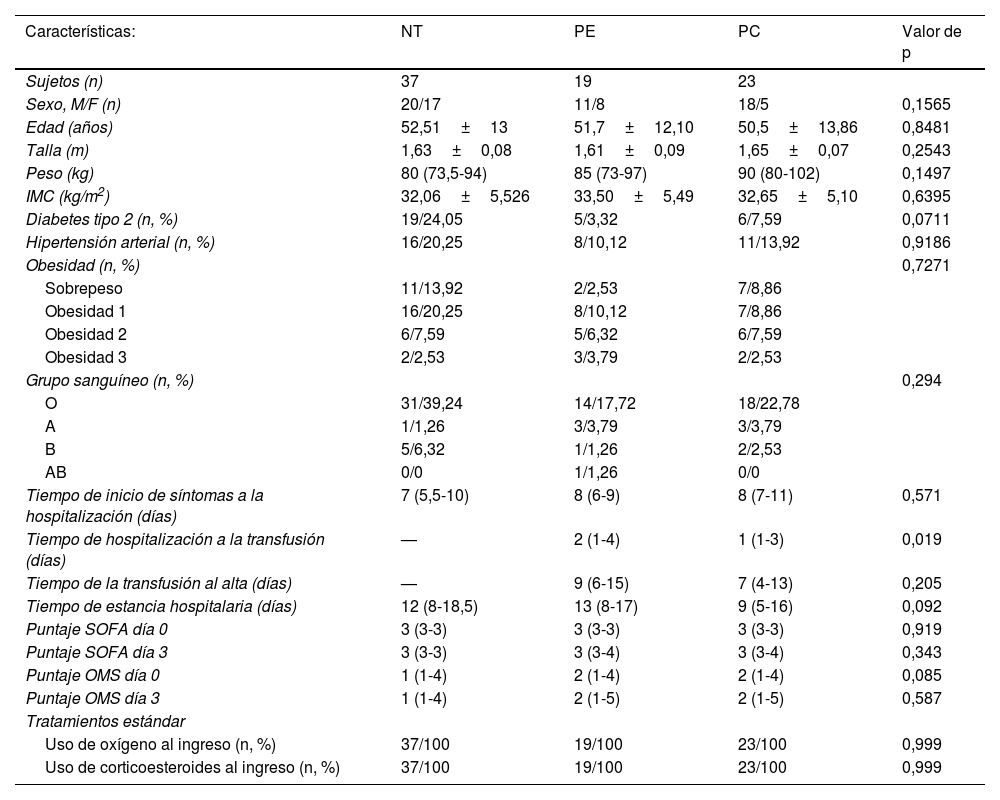
Las características clínicas de los sujetos estudiados se muestran en la tabla 1. En general se observó homogeneidad entre los grupos para las diferentes variables presentadas. Las edades oscilaron entre 24 y 82 años, con una media de 51,07±12,95 años y un 62% de ellos fueron del género masculino. La mediana del peso de los participantes fue de 85kg (76-97), de los cuales el 25,31% presentó sobrepeso y el 69,62% presentó obesidad. El 45,2% de todos los sujetos fueron hipertensos y el 34,96% tuvieron diagnóstico de diabetes. Los participantes que se transfundieron pasaron en promedio 2,17 días entre la hospitalización y la transfusión del plasma, siendo mayor este periodo de tiempo para el grupo de PE (2,89 días; IC 95%: 1,87-3,92) con respecto a PC (1,57 días; IC 95%: 1,03-2,10) (p=0,019).
Características clínicas de los participantes
| Características: | NT | PE | PC | Valor de p |
|---|---|---|---|---|
| Sujetos (n) | 37 | 19 | 23 | |
| Sexo, M/F (n) | 20/17 | 11/8 | 18/5 | 0,1565 |
| Edad (años) | 52,51±13 | 51,7±12,10 | 50,5±13,86 | 0,8481 |
| Talla (m) | 1,63±0,08 | 1,61±0,09 | 1,65±0,07 | 0,2543 |
| Peso (kg) | 80 (73,5-94) | 85 (73-97) | 90 (80-102) | 0,1497 |
| IMC (kg/m2) | 32,06±5,526 | 33,50±5,49 | 32,65±5,10 | 0,6395 |
| Diabetes tipo 2 (n, %) | 19/24,05 | 5/3,32 | 6/7,59 | 0,0711 |
| Hipertensión arterial (n, %) | 16/20,25 | 8/10,12 | 11/13,92 | 0,9186 |
| Obesidad (n, %) | 0,7271 | |||
| Sobrepeso | 11/13,92 | 2/2,53 | 7/8,86 | |
| Obesidad 1 | 16/20,25 | 8/10,12 | 7/8,86 | |
| Obesidad 2 | 6/7,59 | 5/6,32 | 6/7,59 | |
| Obesidad 3 | 2/2,53 | 3/3,79 | 2/2,53 | |
| Grupo sanguíneo (n, %) | 0,294 | |||
| O | 31/39,24 | 14/17,72 | 18/22,78 | |
| A | 1/1,26 | 3/3,79 | 3/3,79 | |
| B | 5/6,32 | 1/1,26 | 2/2,53 | |
| AB | 0/0 | 1/1,26 | 0/0 | |
| Tiempo de inicio de síntomas a la hospitalización (días) | 7 (5,5-10) | 8 (6-9) | 8 (7-11) | 0,571 |
| Tiempo de hospitalización a la transfusión (días) | — | 2 (1-4) | 1 (1-3) | 0,019 |
| Tiempo de la transfusión al alta (días) | — | 9 (6-15) | 7 (4-13) | 0,205 |
| Tiempo de estancia hospitalaria (días) | 12 (8-18,5) | 13 (8-17) | 9 (5-16) | 0,092 |
| Puntaje SOFA día 0 | 3 (3-3) | 3 (3-3) | 3 (3-3) | 0,919 |
| Puntaje SOFA día 3 | 3 (3-3) | 3 (3-4) | 3 (3-4) | 0,343 |
| Puntaje OMS día 0 | 1 (1-4) | 2 (1-4) | 2 (1-4) | 0,085 |
| Puntaje OMS día 3 | 1 (1-4) | 2 (1-5) | 2 (1-5) | 0,587 |
| Tratamientos estándar | ||||
| Uso de oxígeno al ingreso (n, %) | 37/100 | 19/100 | 23/100 | 0,999 |
| Uso de corticoesteroides al ingreso (n, %) | 37/100 | 19/100 | 23/100 | 0,999 |
IMC: índice de masa corporal; NT: no transfundido; OMS: Organización Mundial de la Salud; PC: plasma convaleciente; PE: plasma estándar; SOFA: Escala de Evaluación Secuencial de Falla Orgánica.
Datos expresados como media±desviación estándar o mediana (percentiles 25 y 75), o como frecuencia (n o %).
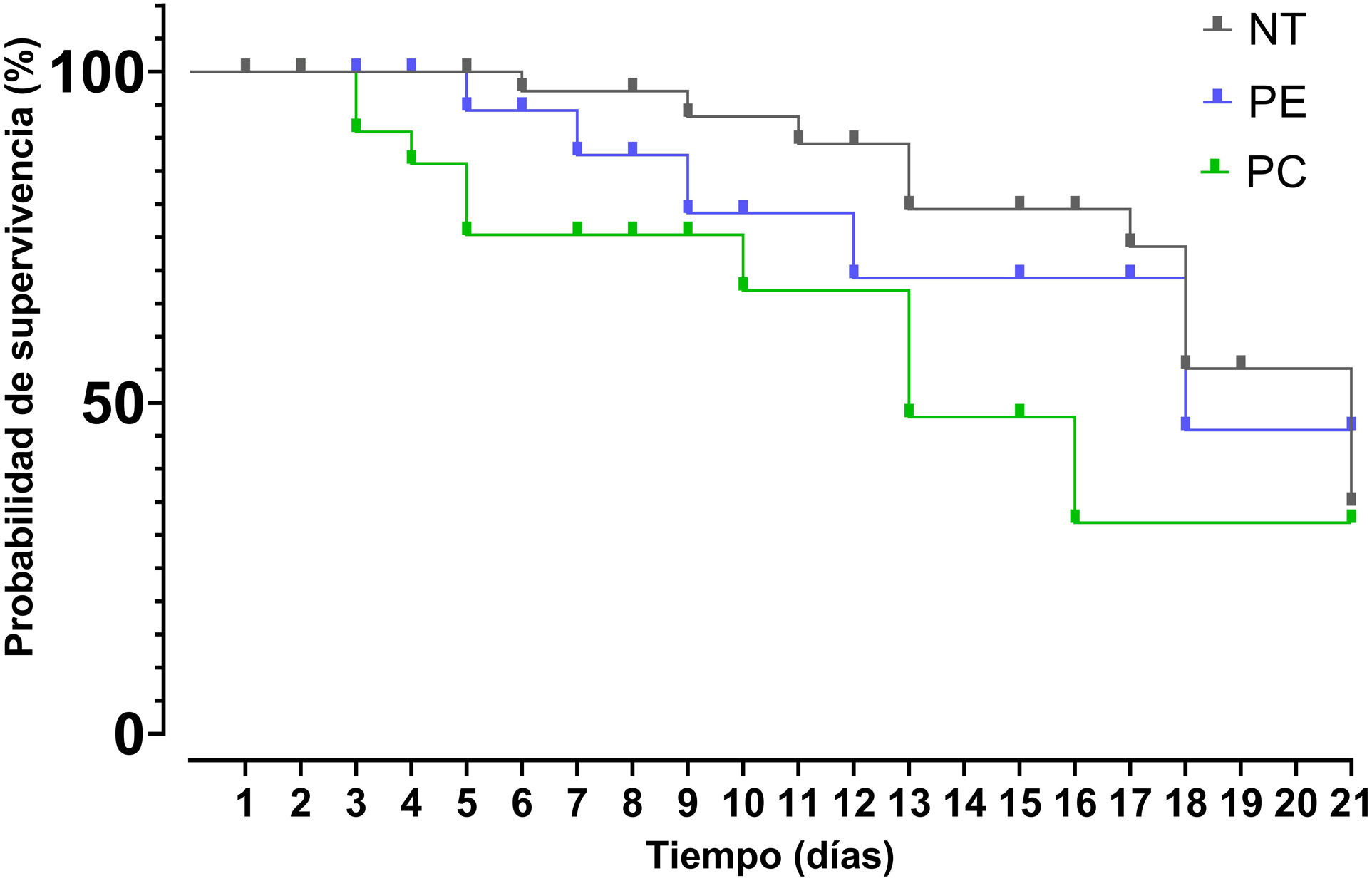
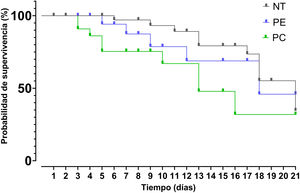
Después de un análisis de los datos mediante curvas de Kaplan-Meier se encontró que la mediana de supervivencia para el grupo que recibió PE fue de 18 días, mientras que para el grupo de PC fue de 13 días y para el grupo NT fue de 21 días. Los resultados de la prueba de Mantel-Cox mostraron que no existen diferencias significativas entre los tratamientos (IC 95%: 15,54-20,46; p>0,05). El valor de Chi-cuadrado fue de 5,608 con un grado de libertad y un valor de p=0,061 (fig. 2).
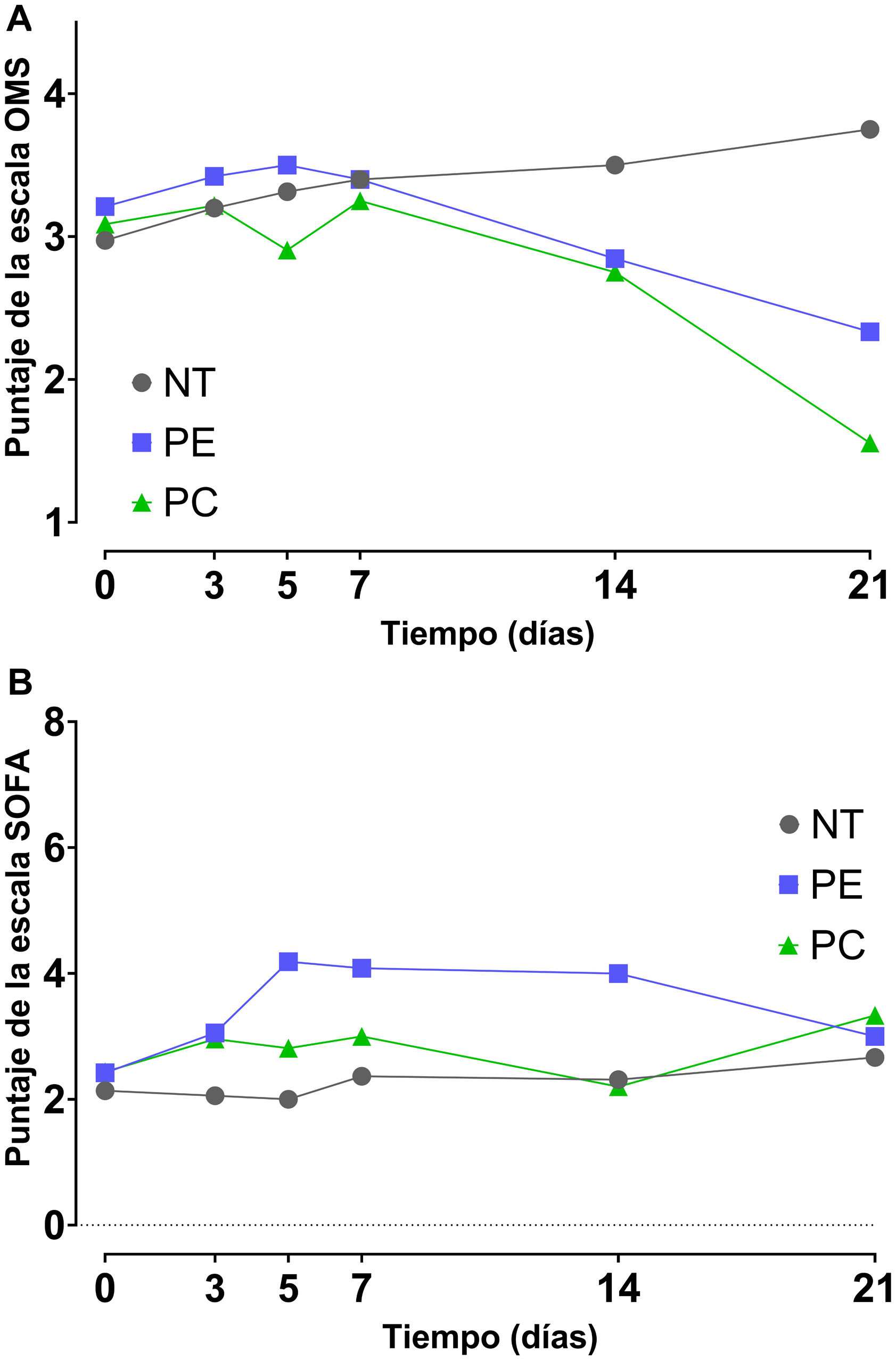
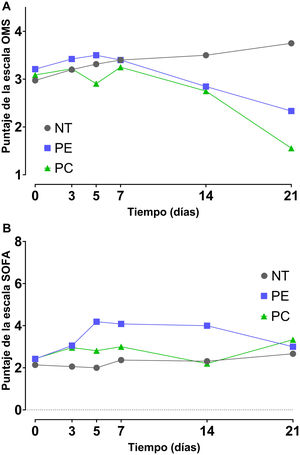
Efecto de la administración de plasma convaleciente sobre la severidad de la enfermedad en pacientes con COVID-19Los resultados del modelo de efectos mixtos mostraron que no hubo diferencias en el curso temporal (días 0, 3, 5, 7, 14 y 21) de los valores de las escalas SOFA y OMS entre las diferentes intervenciones. Aun cuando se encontraron diferencias en el factor tiempo para la escala SOFA (p=0,011) y para la escala OMS (p<0,001), las comparaciones múltiples mediante la prueba de Tukey y el análisis de los intervalos de confianza mostraron falta de evidencias para rechazar la carencia de efectos del PC (p>0,05) (figs. 3A y B).
Severidad de la enfermedad en pacientes con COVID 19 desde el inicio de la transfusión hasta los 21 días mediante la escala de progresión clínica COVID-19 de la OMS (A) y mediante la escala SOFA (B). Se muestran los valores de mediana y error estándar. NT (n=37), PE (n=19) y PC (n=23). NT: no transfundidos; PC: plasma convaleciente; PE: plasma estándar.
Después de una prueba de ANOVA y Tukey post hoc no se observaron efectos del PC sobre algunos parámetros inflamatorios como: leucocitos (F=0,440; p=0,646); linfocitos (F=0,152; p=0,859); DHL (F=0,233; p=0,801); PCR (F=0,754; p=0,475); procalcitonina (F=0,335; p=0,717); dímero D (F=0,400; p=0,672) y ferritina (F=1,646; p=0,206) determinados después de 3 días de la transfusión.
Regresión logísticaEl análisis de regresión logística multivariada para el estudio de los factores que afectan la mortalidad mostró que el tipo de plasma, días de estancia hospitalaria, grado de obesidad, presencia de diabetes tipo 2 e hipertensión no resultaron significativos. Sin embargo, la variable edad con una B=0,086 y un OR de 1,090 (IC 95%: 1,009-1,177) indica que a mayor edad existe mayor riesgo de muerte (p=0,028). También que a menor tiempo desde los síntomas hasta el ingreso hospitalario aumenta la probabilidad de supervivencia, B=0,412 con un OR=0,662 (IC 95%: 0,496-0,884; p=0,005).
Seguridad de la administración de plasma convaleciente en pacientes con COVID-19No se observaron reacciones transfusionales en los pacientes transfundidos con PC. Sin embargo, en el grupo PE se reportó una paciente con reacción adversa leve caracterizada por urticaria, presencia de habones rojizos generalizados y prurito, que cedieron inmediatamente después de suspender la transfusión y posterior a la administración de una dosis única de 25mg de difenhidramina vía intravenosa. La comorbilidad asociada a este sujeto fue hipertensión arterial de 5 años de evolución que estaba bajo control al momento de la COVID-19. Además, el paciente nunca había sido transfundido y no padecía alergias.
DiscusiónLos resultados del presente estudio muestran que el PC no es eficaz para reducir la mortalidad ni la severidad de pacientes en las fases graves y muy graves de COVID-19.
Contrario a lo esperado, la mortalidad de los pacientes que recibieron PC presentaron una tendencia a ser mayor que en los grupos PE y NT. Estos resultados son parcialmente similares a un estudio previo, donde se reportó que la mortalidad fue mayor en el grupo que recibió PC respecto al grupo con cuidado estándar. Ellos sugieren que una posible explicación de la falta de efecto podría ser la variación en los niveles de anticuerpos de cada donante14. De igual manera, otros investigadores no observaron diferencia significativa en el riesgo de mortalidad ni en la tasa global de alta hospitalaria entre un grupo con PC y otro que recibió cuidado estándar15. En contraste, un metaanálisis reciente informó que pacientes transfundidos con PC exhibieron una reducción del 51% en la tasa de mortalidad con respecto al tratamiento estándar, mientras que otros reportaron que el grupo que recibió PC con concentraciones elevadas de anticuerpos, se asoció con un menor riesgo de muerte en pacientes no intubados, comparado con el uso de plasma con bajos niveles de anticuerpos16,17. En el presente trabajo, no fue posible realizar la cuantificación de anticuerpos neutralizantes en nuestro laboratorio, por lo que se desconoce si los niveles bajos de estos pudieron haber afectado a nuestros hallazgos. Por otra parte, las unidades de PC se recolectaron entre los días 21 y 60 después de haber iniciado los síntomas leves de COVID-19, por lo que suponemos que el título de anticuerpos también fue variable y dependiente del estado inmune característico de cada individuo18,19.
Otras posibles razones de la carencia de efectos del PC sobre mortalidad podrían atribuirse al uso de un tamaño de muestra reducido en este estudio. Debe mencionarse que originalmente este trabajo fue diseñado para ser un estudio clínico controlado y aleatorizado con un tamaño de muestra estimado en 100 participantes tomando como base la variable disminución de la mortalidad. Sin embargo, debido a la carencia de donación altruista de PC y con la administración de las primeras vacunas contra la COVID-19 en potenciales donantes, no fue posible completar dicho tamaño de muestra, por lo que se decidió introducir un grupo de comparación secundario constituido por sujetos con las mismas características, pero que no recibieron ninguna transfusión.
El análisis de los efectos de PC sobre el grado de severidad evaluado mediante la escala de la OMS y la escala SOFA, mostró que no existe diferencia entre los grupos de tratamiento a través del tiempo. Aunque existen otras escalas con mayor sensibilidad y especificidad, estudios previos han empleado la escala SOFA para predecir la morbimortalidad en los pacientes con COVID-19 en terapia intensiva20.
Algunos estudios han mostrado que los síntomas de hipoxemia e insuficiencia respiratoria en los pacientes con la presentación severa y muy severa comienzan a partir de la segunda semana del inicio de la enfermedad, y que el tratamiento con PC en este periodo podría no ser capaz de revertir el desenlace fatal20. Además, en otro ensayo en pacientes con COVID moderada, la transfusión con PC no indujo disminución de la mortalidad o del progreso a enfermedad severa, aun cuando se realizó un seguimiento hasta el día 28 posterior al ingreso. Dichos autores proponen que el uso de los PC en etapas tempranas de la enfermedad podría no ser útil, ya que existe un alto índice de recuperación autónoma en los pacientes con enfermedad leve21.
Las comorbilidades mayormente observadas en los participantes de este estudio fueron la hipertensión y la diabetes, observándose el mayor porcentaje de diabetes en el grupo NT. De manera similar, en un estudio retrospectivo se informó que el 48% de sus pacientes presentaba comorbilidades, siendo la más común la hipertensión arterial con el 30%, seguido de la diabetes con el 19% y la enfermedad coronaria con el 8%. En dicho estudio se informa que el aumento del riesgo de muerte intrahospitalaria se asocia con la edad avanzada y una mayor puntuación de la escala SOFA22.
Otra observación importante es que los tratamientos estándar en todos los grupos no se prescribieron en el protocolo, ya que consisten en cuidados de soporte, tratamientos para síntomas respiratorios y tratamientos disponibles al momento para COVID-19 sugeridos por la OMS, y que han sido reportados en diversos ensayos clínicos5,11.
En relación con la seguridad, nuestros resultados indican que la proporción de sujetos con reacción postransfusional adversa fue muy baja. La única paciente que presentó reacción transfusional se encontraba en el grupo PE, esta fue del tipo leve y remitió con la administración de una dosis única de difenhidramina. Es importante mencionar que la premedicación con 8mg de dexametasona/2 veces al día en todos los participantes pudo haber contribuido a disminuir algunas de las potenciales reacciones postransfusionales. Este protocolo de tratamiento fue implementado a partir de marzo de 2021 para pacientes en las primeras etapas de la fase inflamatoria de la enfermedad debido a que se demostró un efecto benéfico sobre el índice de supervivencia en pacientes que recibían ventilación mecánica invasiva o no invasiva23.
Es bien conocido que las reacciones transfusionales a cualquier hemoderivado pueden ser desde leves a severas, e incluso llevar a la muerte6. Las reacciones leves reportadas en los estudios específicamente con PC para COVID-19 han sido la urticaria, el prurito y la fiebre. En otros estudios con diferentes diseños se han reportado reacciones severas como la lesión pulmonar aguda relacionada a la transfusión (TRALI) y la reacción anafiláctica24. Sin embargo, estos eventos podrían estar relacionados con la presencia de enfermedades concomitantes y/o a otros tratamientos, y no por la transfusión por sí misma8. En otro estudio que evaluó la seguridad se reportó que los eventos adversos severos relacionados a la transfusión fueron menores al 1%25.
La fortaleza del presente estudio es que fue realizado en una etapa de extrema urgencia epidemiológica y dentro de condiciones de alta contagiosidad, cuando se investigaban diferentes medidas terapéuticas para tratar de combatir esta epidemia. Además, el estudio fue doble ciego ya que ni los participantes ni los investigadores conocían que tipo de intervención fue asignada.
En conclusión, en el presente estudio, no se observaron efectos benéficos del tratamiento con PC sobre la mortalidad por COVID-19, ni en la severidad de la enfermedad. La administración de PC presentó un alto nivel de seguridad evidenciado por la ausencia de reacciones postransfusionales después de 72h. Se recomienda posteriores estudios para elucidar otras variables implicadas en estos resultados.
Consideraciones éticasEl protocolo de investigación se aprobó por el Comité Nacional de Investigación Científica (CNIC) y el Comité de Ética en Investigación en Salud (CEIS) del IMSS con número de registro R-2020-785-139. Todos los participantes firmaron un consentimiento informado para la realización del presente trabajo. La recolección de sangre se realizó bajo los lineamientos de la Norma Oficial Mexicana NOM-253-SSA1-2012, para la disposición de sangre humana y sus componentes con fines terapéuticos, así como la Norma Oficial Mexicana NOM-012-SSA3-2012, que establece los criterios para la ejecución de proyectos de investigación para la salud en seres humanos.
FinanciaciónLa presente investigación no recibió ayudas específicas provenientes de agencias del sector público, sector comercial o entidades sin ánimo de lucro.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Se extiende un agradecimiento especial a todos los voluntarios que participaron en este estudio. A la Dra. Rita Rivera, al Q.F.B. Mateo Castillo y al Q.F.B. Pablo Ramos por el apoyo técnico en el Banco de Sangre del Hospital General de Zona No. 46 (IMSS) y al personal del Centro Estatal de Hemoterapia por proporcionar unidades de plasma fresco congelado.