En Latinoamérica y Colombia hay pocos estudios acerca las características clínicas y terapéuticas de pacientes con enfermedad inflamatoria intestinal (EII). Se plantea como objetivo obtener una aproximación a dichos datos a partir de una muestra de pacientes de diferentes centros de referencia en Colombia.
Pacientes y métodosEstudio de corte transversal en pacientes adultos y pediátricos, con EII, atendidos ambulatoriamente en seis instituciones en diferentes ciudades, entre 2017-2020 se recolectó información en fechas distintas, acerca aspectos demográficos, clínicos y terapéuticos.
ResultadosSeiscientos cinco sujetos, 565 (93,4%) adultos, edad promedio de 43 años (DE 12,78), 64% con colitis ulcerosa (CU). La edad de diagnóstico de CU fue 41,9 años, mientras en enfermedad de Crohn (EC) fue 47,9 años. En CU, mayor compromiso izquierdo (47,2%), y en EC, 42,8% ileocolónico (L3). Más de 50% en actividad leve o remisión clínica. En CU, el requerimiento de biológico fue de 27,2%. mientras en EC, 78%. Requerimiento global de hospitalización en 39,5%, y necesidad de cirugía, de 37,5% en CU y 62,5% en EC. También, 40 pacientes pediátricos, 90% mujeres, siendo CU más frecuente (80%). En CU, 83,3% presentaron colitis extensa, y en EC, todas con localización ileocolónica (L3). Más de 95% en actividad leve o remisión. Requerimiento de biológico, en 16,6 y 75%, para CU y EC, respectivamente. La frecuencia hospitalizaciones y cirugía fue 2,7%.
ConclusionesEste estudio muestra algunas características únicas de los pacientes con EII en Colombia. Se requiere de un diagnóstico más temprano, con un mejor enfoque terapéutico.
In Latin America and Colombia there are few studies about the clinical and therapeutic characteristics of patients with inflammatory bowel disease (IBD). The objective of this study is to obtain an approximation to these data from a sample of patients from different reference centres in Colombia.
Patients and methodsCross-sectional study in adult and paediatric patients, with IBD, attended ambulatory in 6 institutions in different cities, between 2017 and 2020 information was collected on different dates, about demographic, clinical, and therapeutic aspects.
ResultsSix hundred and five subjects, 565 (93.4%) adults, mean age 43 years (SD 12.78), 64% with ulcerative colitis (UC). The age at diagnosis of UC was 41.9 years, while in Crohn's disease (CD) it was 47.9 years. In UC, there was greater left involvement (47.2%), and in CD, 42.8% ileocolonic (L3). More than 50% were in mild activity or clinical remission. In UC, the biologic requirement was 27.2%, while in CD, 78%. Overall hospitalisation requirement was 39.5%, and the need for surgery was 37.5% in UC and 62.5% in CD. Also, 40 pediatric patients, 90% female, with UC being more frequent (80%). In UC, 83.3% presented extensive colitis, and in CD, all with ileocolonic localization (L3). More than 95% were in mild activity or remission. Biologic therapy was required in 16.6% and 75% for UC and CD, respectively. The frequency of hospitalisations and surgery was 2.7%.
ConclusionsThis study shows some unique characteristics of patients with IBD in Colombia. An earlier diagnosis is required, with a better therapeutic approach.
La enfermedad inflamatoria intestinal (EII) incluye dos entidades: colitis ulcerosa (CU) y enfermedad de Crohn (EC), cuya etiología es multifactorial, e implica factores genéticos ambientales e inmunológicos. Estas conllevan inflamación crónica, recurrente, con diferentes grados de gravedad en tracto digestivo, y curso clínico con recaídas y remisiones a lo largo de la enfermedad, así como afectación potencial de otros órganos1,2. Además, la EII presenta tasas de morbimortalidad importantes y costes socioeconómicos elevados, puesto que se trata de una entidad de aparición temprana en la vida y en edades altamente productivas3.
La EII es una enfermedad global, cuya evolución puede ser clasificada en cuatro etapas epidemiológicas, que incluyen emergencia, aceleración de la incidencia, prevalencia compuesta y equilibrio de prevalencia. Latinoamérica se encuentra en la segunda etapa, denominada aceleración de la incidencia, que se asocia a aumento rápido de la incidencia y prevalencia baja4. Una revisión sistemática de estudios clínicos y epidemiológicos de EII en Latinoamérica documentó la aparición de EII en el siglo XX, con rápido aumento de su incidencia durante el siglo XXI, y también, una notable heterogeneidad entre los países en relación con factores como la colonización histórica, la cultura, el estatus socioeconómico, los antecedentes genéticos, el estilo de vida y la dieta5. Asimismo, en estas regiones se ha ido describiendo más acerca de características clínicas y tratamiento de los pacientes con EII, que incluyen: comportamiento penetrante en la EC, dependencia de esteroides, resistencia a los esteroides, intolerancia a las tiopurinas, presencia de manifestaciones extraintestinales y requerimiento quirúrgico, hospitalizaciones por EII e historia familiar de EII. Mientras que los factores asociados al uso de la terapia biológica fueron: la presencia de pancolitis en CU, enfermedad penetrante en la EC, la resistencia y la dependencia de los esteroides, la presencia de manifestaciones extraintestinales y la necesidad de cirugía6–9. Por lo que se ha visto, los fenotipos de EII observados varían ligeramente entre los países, pero son consistentes con lo descrito en otras regiones del mundo6,9.
Para el caso particular de Colombia, se encuentra catalogada como una nación con prevalencia intermedia de EII con aumento de la carga de la enfermedad, en posible relación con cambios en factores ambientales, como la creciente urbanización, el incremento de la obesidad y el aumento del consumo de comida rápida10,11. Y estos datos incluye información del estudio por Fernández Ávila et al.11, en el cual se estimó prevalencia de EII de 87 casos por 100.000 habitantes, siendo más frecuente en mujeres, y prevalencias de EC y UC, de 17 por 100.000 habitantes y 113 por 100.000 habitantes, respectivamente. Y del estudio por Juliao-Baños et al.10, el cual reportó aumento de la incidencia de 6,88/100.000 en 2010 a 7,04/100.000 en 2017, con mayor riesgo de enfermedad en las mujeres, y en edades de 40 a 59 años de edad. Sin embargo, aún existe un vacío de conocimiento acerca las características clínicas y terapéuticas de los pacientes con EII a nivel nacional, y la escasa información existente proviene principalmente de población adulta, sin datos sólidos en población pediátrica. Es importante comprender las diferencias en la presentación de la EII entre regiones geográficas debido al impacto de la enfermedad en los sistemas sanitarios, así como para determinar las estrategias de prevención y tratamiento adecuadas. Por lo tanto, se requieren estudios en los que se caracterice a la población afectada considerando los fenotipos clínicos y el punto de vista terapéutico, y también información que incluya a pacientes en edad pediátrica. El objetivo principal de este estudio es describir características demográficas, la presentación clínica, el fenotipo y el tratamiento, de pacientes con EII, a partir de información recolectada en pacientes diagnosticados con EII a partir de seis centros de gastroenterología de referencia en EII en tres ciudades principales.
Pacientes y métodosDiseño del estudio y extracción de datosSe realizó un estudio observacional descriptivo de corte transversal mediante un muestreo por conveniencia en el que la población objeto fueron pacientes diagnosticados con EII, tanto población adulta como pediátrica, atendidos entre los periodos de 2017-2020, en consulta externa de seis instituciones diferentes, que incluyeron cuatro centros de gastroenterología, uno de coloproctología y uno de gastroenterología pediátrica, en diferentes ciudades de Colombia.
La población de estudio la constituyeron pacientes de cualquier edad, tanto adultos como pediátricos, que fueron atendidos en consulta externa de cuatro centros de Clínica Gastroadvanced IPS en Bogotá, Clínica GastroKids S.A.S en Pereira y el Instituto de Coloproctología ICO en Medellín. Se consideraron adultos aquellos pacientes de 18 años o mayores (por decreto de la legislación nacional), y se definió población pediátrica como aquella de dos a 17 años.
Los pacientes adultos y pediátricos elegibles debían tener información completa sobre el año de nacimiento, la edad, el sexo, y seguimiento clínico activo en cada institución del estudio. Se excluyeron aquellos sujetos con diagnóstico de colitis indeterminada.
Recolección de datosDurante un período de tres años se recolectó información en fechas distintas en los diversos hospitales incluidos en el estudio. Se usaron como fuente de información primaria las historias clínicas. Se recolectaron variables sociodemográficas y clínicas tales como sexo, edad, extensión de la EII, edad de diagnóstico de la EII, tratamiento farmacológico para la EII, respuesta clínica al tratamiento farmacológico. También se consideraron indicaciones de terapia biológica, edad de inicio de terapia biológica, hospitalizaciones relacionadas con la EII, frecuencia de manifestaciones extraintestinales, complicaciones de la EII, así como antecedentes de tratamiento quirúrgico y tipo de procedimiento. Se registró el tratamiento utilizado en cada paciente, frecuencia de requerimiento de corticoide, uso de inmunosupresor (azatioprina), según fenotipo de la enfermedad y momento de su requerimiento. También se consideró requerimiento de terapia biológica, según utilización de primera, segunda o tercera línea. Los biológicos disponibles en Colombia incluyen los agentes inhibidores del factor necrosis tumoral (anti-TNF) infliximab, adalimumab, golimumab, y certolizumab; antiintegrina alpha4-beta7 vedolizumab, inhibidores de la interleucina-12 e interleucina-23 ustekinumab, e inhibidor de la Janus-Cinasa tofacitinib. Se evaluó frecuencia en indicaciones de terapia biológica, y eficacia terapéutica en inducción o mantenimiento de acuerdo a fármaco elegido. En aquellos pacientes que requirieron de biológico, se evaluó respuesta terapéutica en términos clínicos, con recolección de datos en un momento único, según correspondiera si al completar la fase de inducción y en el mantenimiento de acuerdo a esquemas recomendados según indicación específica.
DefinicionesPara la evaluación de la gravedad de la enfermedad, en adultos y pacientes pediátricos se consideró la clasificación de Montreal12 para CU según la extensión (E1: proctitis, E2: lado izquierdo, y E3: extensa o pancolitis) y para EC, localización (L1: íleon terminal, L2: colon, L3: ileocolónica, y L4: localización gastrointestinal superior), y comportamiento (B1: no estenosante y no penetrante, B2: estenosante, B3: penetrante, y p: enfermedad perianal).
Se evaluó respuesta al tratamiento farmacológico según términos clínicos, en adultos, para CU mediante el subíndice de gravedad según la escala de Montreal (remisión clínica: sin síntomas de CU; actividad leve: ≤ 4 deposiciones con sangre diarias, ausencia de fiebre, pulso < 90 lpm, hemoglobina ≥ 10,5 g/dL (105 g/L), velocidad de sedimentación globular < 30 mm/h; actividad moderada: > 4-5 deposiciones diarias pero con mínimos signos de toxicidad sistémica; actividad grave: ≥ 6 deposiciones con sangre al día, pulso ≥ 90 lpm, temperatura ≥ 99,5 °F (37,5°C), hemoglobina < 10,5 g/dL (105 g/L) y velocidad de sedimentación globular ≥ 30 mm/h)12, y para EC mediante el Clinical Disease Activity Index (CDAI) (0-149 puntos: remisión clínica asintomática; 150-220 puntos: activa de forma leve a moderada; 221-450 puntos: activa de forma moderada a grave; 451-1.100 puntos: enfermedad activa de forma grave a fulminante)13. Mientras que en pacientes pediátricos, para la actividad de la CU se consideró el Pediatric Ulcerative Colitis Activity Index (PUCAI) (0-9 puntos: remisión; 10-34 puntos: actividad leve; 35-64 puntos: actividad moderada; 65-85 puntos: actividad grave)14, y para EC el Pediatric Crohn's Disease Activity Index (PCDAI) (< 10 puntos: remisión; 10-27,5 puntos: actividad leve; 30-37,5 puntos: actividad moderada; ≥ 40 puntos actividad grave)15. Y se consideró falla terapéutica primaria como aquellos pacientes que no respondieron a la terapia de inducción anti-TNF; y falla terapéutica secundaria aquellos pacientes que responden inicialmente a los fármacos anti-TNF e interrupción de la terapia por perdida de su respuesta (no respondedores secundarios)16.
Análisis estadísticoSe elaboró la base de datos en Excel versión 2019. Se completaron los datos faltantes con nuevas revisiones de las fuentes de información y se realizaron al final solo análisis de datos completos. El procesamiento de datos se realizó en el programa para ciencias sociales SPSS versión 25.0 (IBM Corp., Armonk, NY, EE. UU.). Para el análisis descriptivo de las variables cuantitativas se utilizó el promedio aritmético, el mínimo, el máximo y la desviación estándar (DE); para las variables cualitativas se utilizaron frecuencias absolutas y relativas. Las variables cuantitativas se compararon de acuerdo a su distribución mediante la prueba U de Mann-Whitney o t de Student. Se calcularon las p y se consideraron estadísticamente significativas si eran menores a 0,05.
Consideraciones éticasEsta investigación fue revisada y aprobada por el Comité de Ética en Investigación de cada institución participante. En su diseño fueron tenidos en cuenta los requerimientos establecidos en la declaración de Helsinki, versión 2013, en Fortaleza, Brasil17, y a la resolución 8430 de 1993 del Ministerio Nacional de Salud de Colombia18, de manera que se consideró una investigación sin riesgo, y se garantizó confidencialidad y reserva de la información recolectada. En su realización no se requirió de consentimiento informado. Ningún registro contenía información sensible sobre identidad de pacientes.
ResultadosSe evaluaron 605 pacientes, de los cuales 169 (27,9%) fueron de Bogotá, 396 (65,4%) de Medellín y 40 (6,6%) de Pereira, correspondientes a un centro de atención pediátrica (Gastrokids S.A.S).
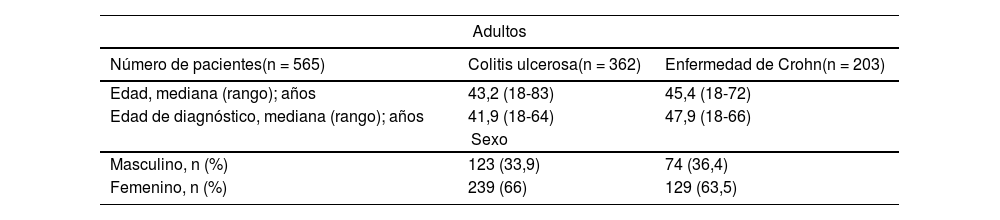
Características clínicas y demográficasSe incluyeron 565 (93,4%) adultos, predominantemente mujeres, con una edad promedio de 43 años (DE 12,78), siendo la edad mínima de 18 años y la máxima de 83 años. En cuanto a tipo de EII predominó CU, encontrándose relación de CU:EC de 1,8:1 casos. La edad de diagnóstico en EC fue más tardía, encontrando una diferencia significativa (p = 0,02342) (tabla 1). En la cohorte pediátrica (40 pacientes), la mayoría correspondió a mujeres, y el tipo de EII más frecuente fue CU (tabla 1).
Características clínicas y demográficas de pacientes con EII
| Adultos | ||
|---|---|---|
| Número de pacientes(n = 565) | Colitis ulcerosa(n = 362) | Enfermedad de Crohn(n = 203) |
| Edad, mediana (rango); años | 43,2 (18-83) | 45,4 (18-72) |
| Edad de diagnóstico, mediana (rango); años | 41,9 (18-64) | 47,9 (18-66) |
| Sexo | ||
| Masculino, n (%) | 123 (33,9) | 74 (36,4) |
| Femenino, n (%) | 239 (66) | 129 (63,5) |
| Pediátrico | ||
|---|---|---|
| Número de pacientes (n = 40) | Colitis ulcerosa(n = 36) | Enfermedad de Crohn(n = 4) |
| Edad, mediana (rango); años | 12 (2-17,8) | 15 (8,2-17,5) |
| Edad de diagnóstico, mediana (rango); años | 10,6 (1,3-16,7) | 13 (9,5-17,9) |
| Sexo | ||
| Masculino, n (%) | 4 (11,1) | 0 |
| Femenino, n (%) | 32 (88,9) | 4 (100) |
EII: enfermedad inflamatoria intestinal; n: número.
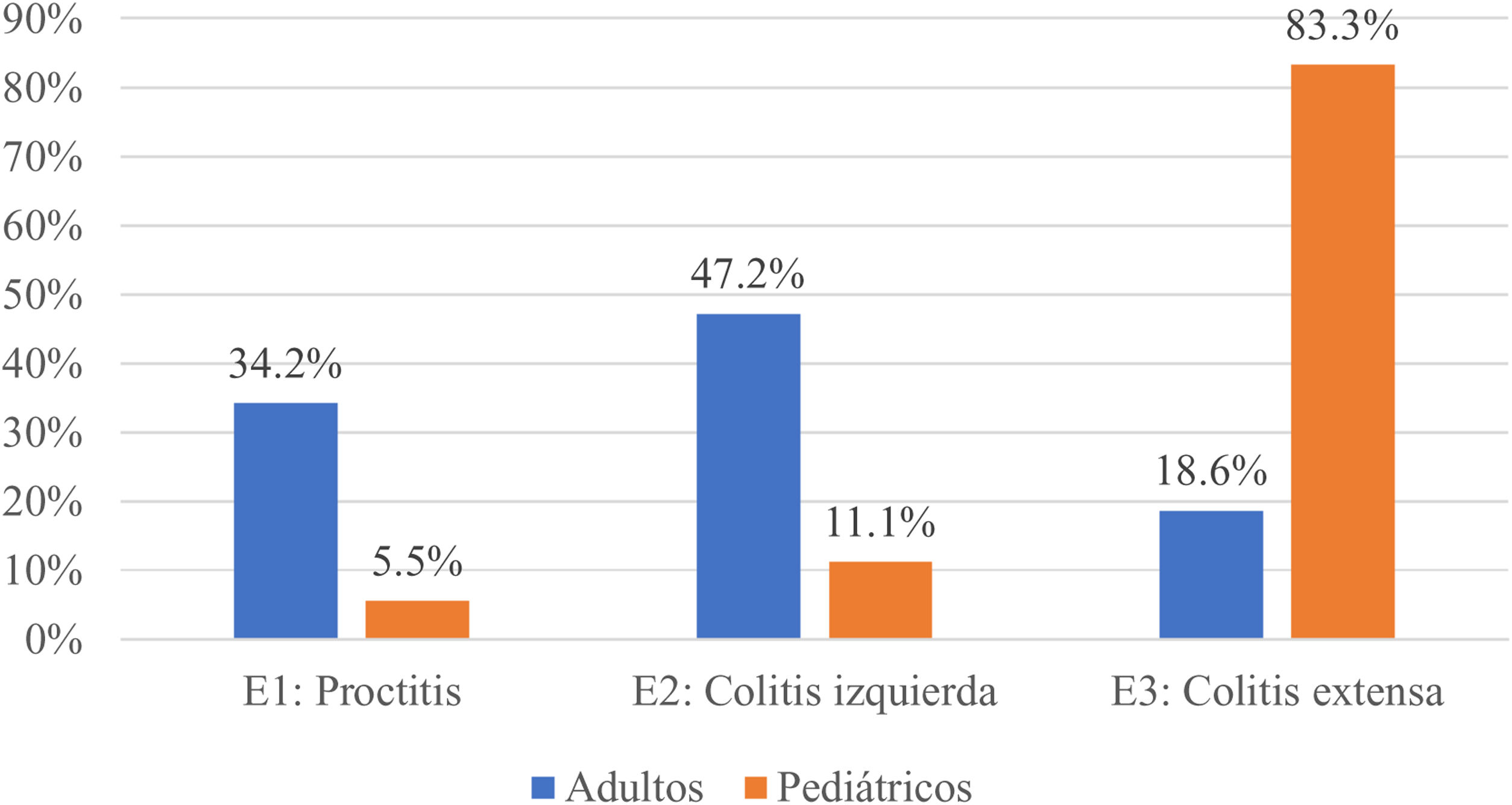
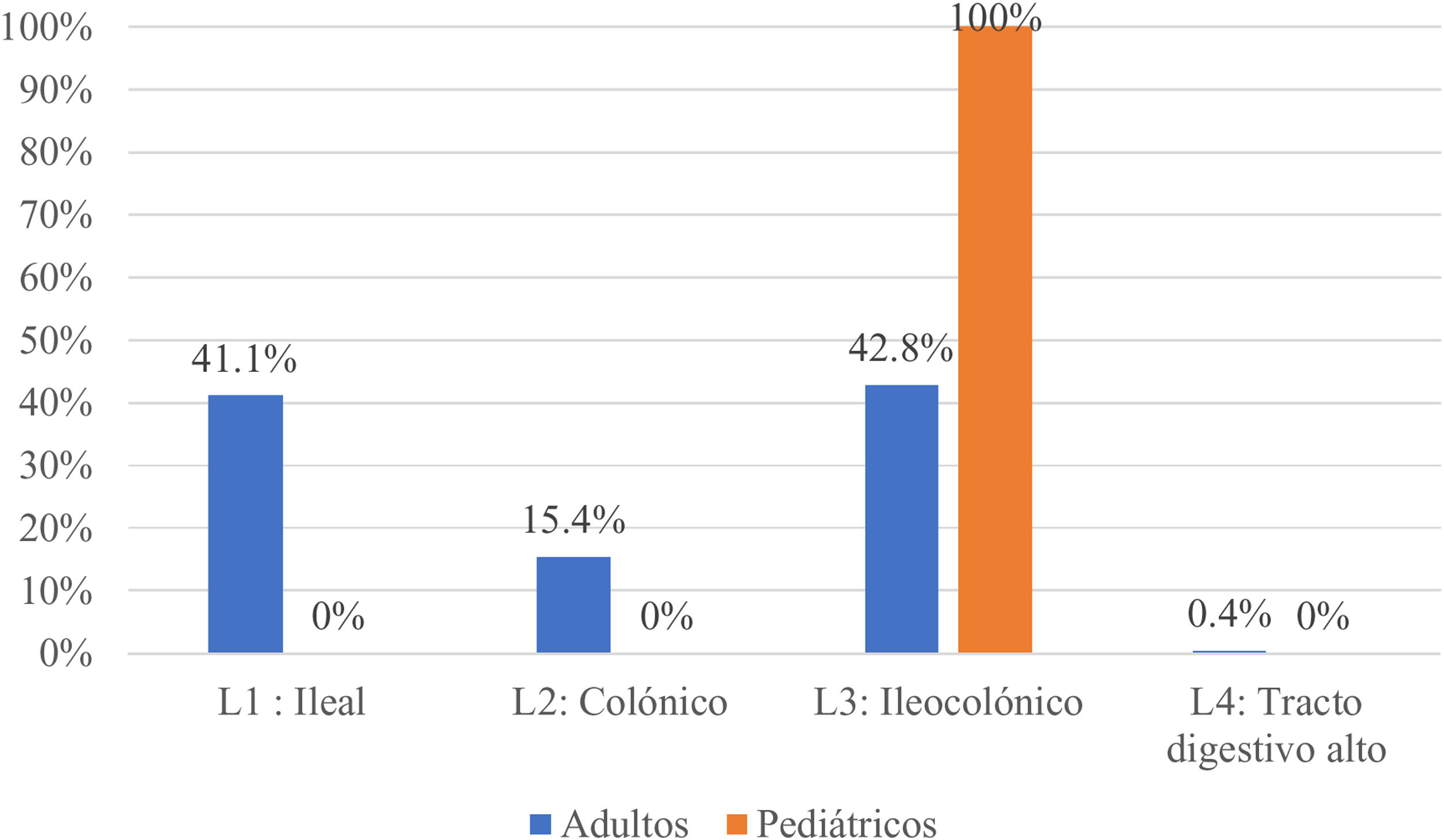
En adultos, en cuanto a la extensión de la enfermedad, los pacientes con CU el mayor compromiso fue de izquierdo (47,2%), seguido por proctitis (34,2%) y colitis extensa (18,6%) (fig. 1). Al evaluar la gravedad, la mayoría se encontraban en actividad leve (48,9%) y 10% en remisión clínica. Aquellos con diagnóstico de EC, la localización principal fue a nivel ileocolónico (L3) 42,8%, seguido del ileal (L1) 41,1%, colónico (L2) 15,4% y próximal (L4) dos casos (0,4%) (fig. 2), en su mayoría, el comportamiento fue inflamatorio no estenosante (B1) con 51%. Al evaluar la gravedad, 43,7% se encontraban en actividad leve y 9,2% en remisión clínica.
En la cohorte pediátrica, aquellos con CU, 30 (83,3%) presentaron colitis extensa, seguido de izquierda cuatro (11,11%) y proctitis dos (5,5%) (fig. 1). Y 95% se encontraron en remisión (PUCAI 0-9), 4% en actividad leve (PUCAI 10-34) y 1% moderada (PUCAI 35-64), ninguno en brote grave u hospitalizado. Las cuatro pacientes pediátricas con EC presentaron localización ileocolónica (L3) (fig. 2), con comportamiento inflamatorio no fistulizante ni estenosante en tres (75%), y uno (25%) siendo fistulizante (B3) y perianal (p), todas presentaron retraso de crecimiento al momento del diagnóstico (estadio G1). En cuanto a actividad, todas se encontraron en remisión (PCDAI < 10).
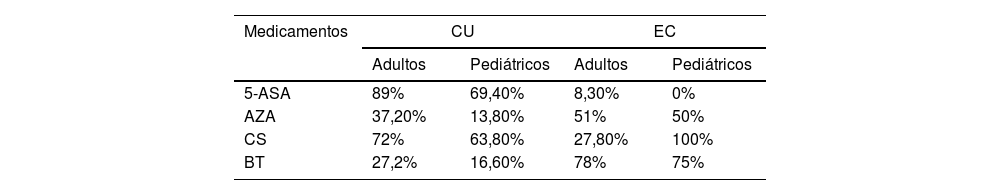
Tratamiento médicoDentro de los esquemas de tratamiento médico (tabla 1), entre los adultos, al ser divididos por enfermedad, en CU, 95% requirieron de manejo farmacológicos a lo largo de la enfermedad, aminosalicilatos (5-ASA) fue la piedra angular en el tratamiento seguidos por inmunosupresores específicamente azatioprina (AZA), a pesar de que en 72,2% fue necesario el uso de esteroide en algún momento con el fin de obtener remisión, en ningún caso superó las 12 semanas. En EC, 100% requirieron manejo farmacológico, y, al comparar EC frente a CU, se documentó mayor frecuencia de uso de biológico, y menor uso de terapia convencional (tabla 2).
Frecuencias de uso de terapias farmacológicas en EII de acuerdo a enfermedad y tipo de población
| Medicamentos | CU | EC | ||
|---|---|---|---|---|
| Adultos | Pediátricos | Adultos | Pediátricos | |
| 5-ASA | 89% | 69,40% | 8,30% | 0% |
| AZA | 37,20% | 13,80% | 51% | 50% |
| CS | 72% | 63,80% | 27,80% | 100% |
| BT | 27,2% | 16,60% | 78% | 75% |
5-ASA: aminosalicilatos; AZA: azatioprina; CS: corticoides; TB: terapia biológica; EC: enfermedad de Crohn; CU: colitis ulcerosa.
Entre los pacientes pediátricos, en CU, 90% requirieron de manejo farmacológico a lo largo de la enfermedad, las frecuencias de uso de 5-ASA, AZA, esteroide y biológico fueron menores en comparación a adultos. Y en EC, 100% requirieron de manejo farmacológico, predominantemente, requerimiento de biológico (tres infliximab y una adalimumab) y AZA (tabla 1), todos estos pacientes habían requerido uso de esteroide en algún momento de su cuadro. Las indicaciones de biológico fueron no respuesta a tratamientos previos en tres casos (75%), y un caso (25%) enfermedad fistulizante.
Los biológicos utilizados en primera línea fueron: infliximab 24,8%, adalimumab: 59%, vedolizumab: 4,0%, golimumab: 24%. Cuando se requirió de segunda línea de manejo, la distribución fue: infliximab 11,1%, adalimumab 44,4%, vedolizumab 44,4% y en los que se implantó una tercera línea de tratamiento se inició con golimumab, ustekinumab, certolizumab y tofacitinib en una paciente con artritis reumatoide y CU; todos usados de a uno solo por caso. Al evaluar el tiempo entre el diagnóstico e inicio de la terapia biológica fueron 2,81 años en CU, y 5,12 años en EC, con una diferencia no estadísticamente significativa p = 0,08721.
Eficacia de terapia biológicaDentro de las indicaciones de terapia biológica fueron: actividad luminal 78,4%, manifestaciones extraintestinales 13,5%, y recurrencia postoperatoria en 8,1%. La elección del medicamento biológico no estuvo afectada por la disponibilidad a nivel nacional. Al evaluar la eficacia a la inducción, se evidenció falta de respuesta primaria en 33,3%, respuesta clínica en 47,2% y remisión en 19,4%. Durante el mantenimiento se presentó falla secundaria en 36,1%, respuesta en 47,2% y remisión 16,7%. Durante la evolución, en el tratamiento se optimizó de la terapia biológica en 18,9%.
Hospitalización y cirugíaLa frecuencia de hospitalizaciones global fue de 39,5%, sin hallar diferencias significativas entre CU y EC (p = 0,7). Solo se presentó una muerte asociada a la EII por colitis fulminante.
En cuanto a procedimientos quirúrgicos asociados a la EII, en la cohorte adulta se encontró en 37,5% en pacientes con CU y 62,5% con EC. Todos estos pacientes requirieron de terapia biológica. No se evaluaron frecuencias de cáncer.
Entre los pacientes pediátricos, la frecuencia hospitalizaciones fue de 2,7%, siendo baja, y en cuanto a cirugía, de los sujetos incluidos, solamente en un caso se requirió colectomía previa al seguimiento en una de las instituciones, siendo un paciente con megacolon tóxico catalogado inicialmente como CU a quien mediante enteroscopia se le diagnosticó posteriormente EC y manejo de fístula perianal en una de nuestras pacientes con EC.
DiscusiónEn este estudio se describe una cohorte colombiana con EII, cuyas fortalezas incluyen el número de pacientes, procedentes de seis centros de referencia en EII, con gran variedad en fenotipos clínicos, y en el que se incluyeron pacientes pediátricos. Y sus hallazgos merecen ser analizados a la luz de la evidencia actual.
Este estudio presenta algunos hallazgos similares a otros estudios a nivel nacional19,20, y latinoamericanos5,7,8, encontrando que la EII fue más frecuente mujeres jóvenes, asimismo, la CU fue el diagnóstico con mayor frecuencia y su edad media de diagnóstico fue más temprana en comparación a EC. En cuanto a pacientes pediátricos, las características fueron variables en comparación a otros estudios poblacionales, por un lado, se encontró edad de diagnóstico de CU y EC que se aproximan a las encontradas en el registro EUROKIDS21 pero más tardías frente a lo encontrado en otros países latinoamericanos22, por el otro, se encontró que afecta predominantemente a mujeres, lo cual difiere de otros trabajos, que incluyen estudios realizados en Europa, Asia, y Latinoamérica21–23 en donde los hombres son principalmente afectados por EII.
En EC, tanto en adultos como pediátricos, la duración de la enfermedad desde el diagnóstico hasta el momento de corte fue más larga, presentando entonces mayor edad al diagnóstico, lo cual es un resultado poco común en comparación a otros estudios a nivel regional8,9. Si bien la frecuencia de diagnóstico oportuno tanto de CU como EC ha venido en aumento en las últimas tres décadas en Latinoamérica, y que hay mayor acceso a infraestructura en salud y tecnología9,22, los síntomas de EC pueden llegar a ser desconocidos para el personal médico primario o de familia, primero no tienen un entrenamiento sobre el concepto de que la EII es una realidad creciente en nuestro medio, y segundo no consideran esta enfermedad al no cursar tradicionalmente con diarrea con sangre sino más bien con dolor abdominal crónico, pérdida de peso y anemia ferropénica; además su presentación es más indolente y menos florida que la CU debido a su compromiso transmural y afectación ileocecal haciendo más difícil su valoración24. Por lo que en futuros estudios poblacionales la edad del diagnóstico y el tiempo de demora en diagnóstico son variables de interés a considerar acerca de epidemiología en EII a nivel regional.
En cuanto a fenotipos de la enfermedad, en nuestra cohorte, en adultos, en CU fue más frecuente la afectación del colon izquierdo (E2), seguido por proctitis y colitis extensa, mientras que, en EC la localización colónica (L2) e ileocolónica (L3) fueron las más frecuentes, y el comportamiento no estenosante no penetrante (B1), con baja frecuencia de enfermedad perianal (p); todo lo anterior está acorde con lo publicado en la literatura8,9,25. Se debe mencionar que, en CU, se ha observado diferencia en la extensión de las CU según la edad9,10, y de los que tienen enfermedad limitada al recto o al colon sigmoide (colitis distal), 25 a 50% progresan a formas más extensas de la enfermedad en el tiempo26–28; en nuestra casuística esto es un fenómeno mínimo. Mientras que, en EC, cabe resaltar que en el patrón B3 está incluida toda la enfermedad perianal29, que como grupo aparte sería 43% de nuestra cohorte para EC. Esto nos muestra dos caras de una misma moneda y es que estamos detectando y tratando a la mayoría de pacientes en los estadios iniciales de la enfermedad, pero también, y con números muy cercanos, tenemos un gran grupo con las presentaciones más complicadas de esta. También en el grupo pediátrico, en CU predominaron las formas más extensas y en EC predominó la localización ileocolónica y comportamiento inflamatorio no fistulizante ni penetrante, y se observaron formas fistulizantes. La EII puede debutar hasta en 30% en la edad pediátrica, con presentaciones más graves y extensas30. Estos resultados apoyan la noción de que la EII es una entidad heterogénea, en la que factores ambientales, como el estatus socioeconómico, la exposición a infecciones, el abuso de antibióticos y la falta de higiene, podrían ayudar a explicar las diferencias epidemiológicas entre las poblaciones.
En EII, la terapia se debe orientar de acuerdo a la presentación clínica de la enfermedad, la extensión y gravedad de esta, respuestas anteriores a tratamientos y existencia de complicaciones31,32. En nuestra cohorte se documentó frecuencia de uso inmunosupresor como ahorrador de corticoide y de terapia biológica, en alrededor de 35 y 50% de los casos de CU y EC, respectivamente, los cual posiblemente repercutió en mejores desenlaces, dado que la mayoría de los pacientes se encontraron en remisión clínica o actividad leve. También se confirma que la terapia convencional con sus combinaciones (5-ASA, esteroides e inmunomoduladores) fue suficiente para el control inflamatorio y el mantenimiento de remisión, en cerca de 73% de pacientes con CU, mientras que en EC correspondió a menos de una cuarta parte. Esta diferencia se ha descrito previamente en otros estudios8,33, y está en relación con la mayor dificultad para tratar a los pacientes con EC grave, siendo congruente con nuestra realidad.
En cuanto a terapia biológica, hubo mayor uso en EC en comparación a CU, un tercio de los pacientes no fueron respondedores primarios a la terapia biológica de primera línea, y de los respondedores primarios, aproximadamente un tercio presentaron falla terapéutica o intolerancia al medicamento. También a pesar de la terapia con biológicos de primera generación, en casi 40% puede presentarse falla primaria anti-TNF, e incluso, falla secundaria hasta en 46%, debido a aumento del aclaramiento del fármaco o desarrollo de anticuerpos neutralizantes34. Los resultados en nuestro estudio se alejan a lo observado en estudios de cohortes anglosajonas35 y europeas36,37, en las que se ha observado menor proporción de pacientes expuestos a terapia biológica, pero con frecuencias similares de falla terapéutica35–37, y en comparación a estos, en nuestro estudio, los pacientes presentaron mayor frecuencia en formas más extensas de la enfermedad, resistencia y dependencia de esteroides, presencia MEI y requerimiento de cirugía, siendo la experiencia en vida real en nuestro medio.
En consecuencia, con la etapa epidemiológica actual por la que cruzan Latinoamérica y el Caribe, denominada aceleración de la incidencia4, se han observado mayores tasas de hospitalización y cirugía y, al mismo tiempo, mayor utilización de recursos para tratamiento de actividad de EII y prevenir sus complicaciones5,7,8. Nuestro estudio demostró que, en adultos, casi 40% requirieron de hospitalización, sin observarse diferencias significativas entre CU y EC; mientras que la frecuencia de requerimiento de cirugía en EC fue superior frente a CU. En cambio, en pacientes pediátricos la frecuencia de hospitalización y requerimiento quirúrgico para EII fueron bajas. La proporción de pacientes que requirieron de hospitalización, así como los de cirugía, tanto en CU y EC, fueron superiores a lo descrito en otros países, que incluyen de Latinoamérica7,8, EE. UU.38, Europa39,40 y Asia41. Dentro de los países de Latinoamérica, ya se habían descrito previamente mayores frecuencias de hospitalización en Colombia frente a otros países de la misma región5,9. Estos hallazgos apoyan la idea de que las características de la EII varían de un país a otro, y entre regiones, lo que respalda una influencia multifactorial en EII, y lo que esta variación acarrea en la población.
Existen algunas limitaciones del estudio, la principal limitación fue su carácter retrospectivo, basado en datos tomados en revisión de historias clínicas de pacientes evaluados de modo ambulatorio, y la calidad de la información pudo verse afectada al diligenciamiento de las historias clínicas. La verificación por al menos dos investigadores de los datos de los registros clínicos pudo además disminuir el sesgo de transcripción. También hay que mencionar que carece de resultados de laboratorio (por ejemplo, recuentos sanguíneos completos, proteína C reactiva, nivel sérico de biológicos y anticuerpos) para investigar más a fondo la asociación entre la progresión de la enfermedad, y las diferentes decisiones de relacionadas con el tratamiento. Por otro lado, las diferentes instituciones participantes son de alta complejidad, centros de referencia de pacientes con EII, por lo que probablemente se incluyeron pacientes con mayor gravedad de la enfermedad y complicados que los de otros centros del país, y se sabe que este tipo de pacientes pueden a llegar requerir de manejos más avanzados desde el punto de vista terapéutico, a pesar de esto, debe mencionarse que son centros en lo que se cuenta con personal con entrenamiento para el uso de terapias biológicas, con mayor frecuencia en su uso, por lo que, no se refleja toda la realidad de Colombia. A pesar de que se trató de un estudio netamente descriptivo, con limitaciones en su extensión y los centros incluidos, al incluir sujetos de todas las edades, confiere un panorama acerca de las características de la EII en grupos más jóvenes, y una comparación frente a grupos de mayor edad. También la muestra incluida en el estudio se considera representativa. Los datos estadísticos documentados son concordantes y se asemejan a información previa.
ConclusionesEste estudio aporta información valiosa sobre EII en nuestro medio, en resumen, se demostró predominio en prevalencia de CU, y un diagnóstico más tardío de la EC. También se documentó frecuencia considerable de uso de inmunosupresor como ahorrador de corticoides y de terapia biológica, con mejores desenlaces de la enfermedad. En EC se presentó mayor frecuencia de uso de terapia biológica frente a CU. La principal indicación de terapia biológica fue actividad luminal, y todos los pacientes que tuvieron manejo quirúrgico necesitaron de terapia biológica. La mortalidad por EII fue muy baja. Y en comparación a otros países, hubo mayor frecuencia de hospitalización y requerimiento de cirugía.
Todos estos resultados indican que, se requiere de un diagnóstico más temprano, con un mejor enfoque terapéutico, lo cual redundará en menor mortalidad, frecuencia de hospitalización y cirugía, y requerimiento de terapia biológica.
FinanciaciónEste trabajo no ha recibido ningún tipo de financiación.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Contribución de los autoresVPI, CFS, JSFO, MV, JK, NLE y JRM contribuyeron en todas las etapas de la investigación (revisión de la literatura, recopilación de datos, y composición). Todos los autores aprobaron la versión final del manuscrito.