Los nuevos anticoagulantes orales (NACO) inhibidores directos de la trombina o del factor Xa ofrecen ahora alternativas a la antagonista de la vitamina K para la prevención y tratamiento de la enfermedad tromboembólica en distintas condiciones clínicas.
Los NACO ofrecen importantes ventajas farmacológicas potenciales sobre los antagonistas de la vitamina k y tienen un perfil de seguridad global favorable ya que reducen el riesgo de hemorragia intracraneal, pero en cambio se asocian a un mayor riesgo de hemorragia digestiva. Además, la experiencia con estos nuevos fármacos es limitada y la reversión de su acción es problemática porque no disponemos de antídotos específicos, por lo que su utilización plantea aún numerosas cuestiones prácticas. En este trabajo revisaremos el riesgo de hemorragia digestiva de estos nuevos fármacos, las estrategias para el abordaje apropiado de la hemorragia digestiva y las recomendaciones para el manejo en pacientes que han de ser sometidos a procedimientos endoscópicos electivos.
New oral direct anticoagulants agents are alternatives to warfarin for long-term anticoagulation in a growing number of patients that require long-term anticoagulation for atrial fibrillation, deep venous thrombosis and pulmonary embolism.
These new agents with predictable pharmacokinetic and pharmacodynamics profiles offer a favorable global safety profile, but increased gastrointestinal bleeding compared to the vitamin K antagonists.
Many gastroenterologists are unfamiliar and may be wary of these newer drugs, since Clinical experience is limited and no specific antidote is available to reverse their anticoagulant effect.
In this article the risk of these new agents and, how to manage these agents in both the presence of acute gastrointestinal bleeding and in patients undergoing endoscopic procedures is reviewed.
En los últimos 6 años, nuevos fármacos anticoagulantes orales de acción directa (NACO) han sido aprobados para su uso en la prevención del ictus embólico en la fibrilación auricular no valvular y para la prevención y el tratamiento de la tromboembolia venosa (TVP y TEP)1–11.
En comparación con los antagonistas de la vitamina K, estos fármacos son como mínimo igual de eficaces y son más seguros ya que reducen el riesgo de hemorragia cerebral y de hemorragia mayor, pero en cambio presentan un mayor riesgo de hemorragia digestiva1,3,12,13.
Este grupo terapéutico ofrece claras ventajas respecto al tratamiento convencional con antagonistas de la vitamina K (warfarina y acenocumarol) por su rápido inicio y cese de acción, efecto anticoagulante predecible que no precisa monitorización ni ajuste de dosis y escasas interacciones farmacológicas. A pesar de estos beneficios, la experiencia en el manejo de estos fármacos es limitada y la reversión rápida de su efecto anticoagulante ante una hemorragia o ante la necesidad de cirugía u otros procedimientos invasivos es problemática. Por este motivo, en este trabajo revisaremos los NACO respecto a: 1) características farmacológicas, 2) el riesgo de hemorragia digestiva, 3) las estrategias prácticas para el abordaje apropiado de la hemorragia digestiva y, 4) las recomendaciones para el manejo clínico en pacientes que han de ser sometidos a procedimientos endoscópicos electivos.
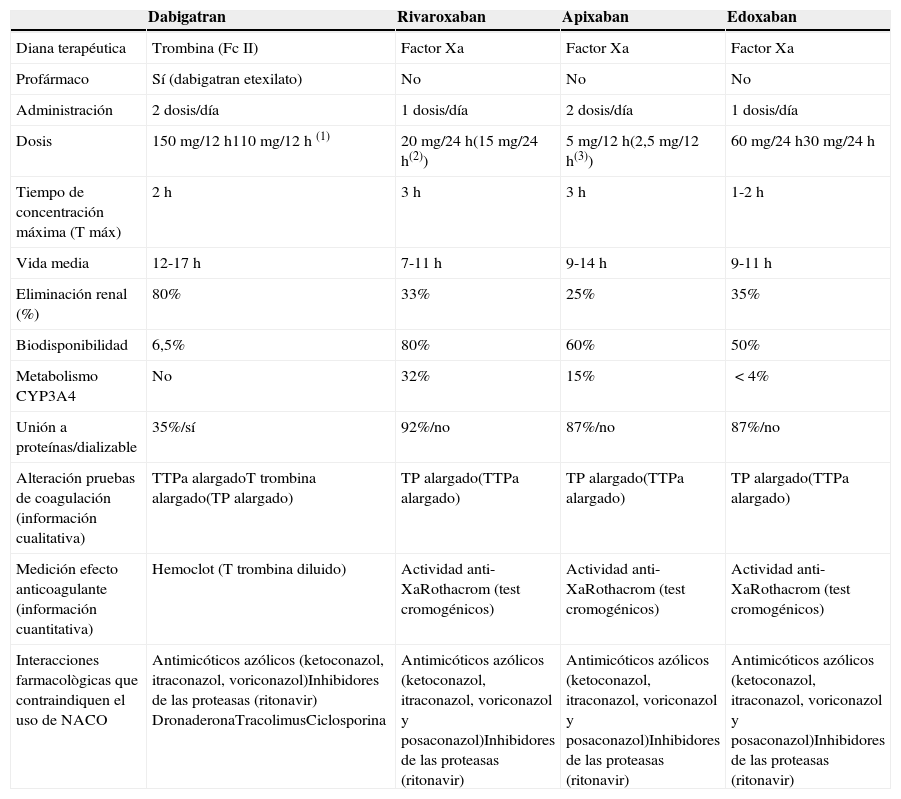
Características farmacocinéticas y farmacodinámicas de los NACOEn la tabla 1 se resumen algunas características principales de los NACO. Dabigatran14 actúa inhibiendo la formación de trombina de forma directa y reversible. Se administra por vía oral en forma de profármaco: dabigatran etelixato, que se transforma por las esterasas plasmáticas en su forma activa. Su absorción es rápida y se obtiene su máximo efecto en menos de 2 horas de su administración. La vida media del fármaco son unas 12 horas. Hasta en un 10% de los pacientes causa dispepsia, aunque el riesgo parece ser mayor en pacientes con patología gastroesofágica, que se puede tratar con antisecretores y raramente obliga a la suspensión del fármaco. Tiene escasa unión a proteínas plasmáticas y su eliminación es principalmente renal, por lo que es dializable y está contraindicado en la insuficiencia renal grave con filtrado glomerular menor de 30ml/min. El profármaco dabigatran etexilato es un sustrato del transportador de eflujo glucoproteína-P, de ahí sus interacciones farmacológicas.
Características farmacocinéticas y farmacodinámicas de los NACO
| Dabigatran | Rivaroxaban | Apixaban | Edoxaban | |
|---|---|---|---|---|
| Diana terapéutica | Trombina (Fc II) | Factor Xa | Factor Xa | Factor Xa |
| Profármaco | Sí (dabigatran etexilato) | No | No | No |
| Administración | 2 dosis/día | 1 dosis/día | 2 dosis/día | 1 dosis/día |
| Dosis | 150mg/12 h110mg/12 h (1) | 20mg/24 h(15mg/24 h(2)) | 5mg/12 h(2,5mg/12 h(3)) | 60mg/24 h30 mg/24 h |
| Tiempo de concentración máxima (T máx) | 2 h | 3 h | 3 h | 1-2 h |
| Vida media | 12-17 h | 7-11 h | 9-14 h | 9-11 h |
| Eliminación renal (%) | 80% | 33% | 25% | 35% |
| Biodisponibilidad | 6,5% | 80% | 60% | 50% |
| Metabolismo CYP3A4 | No | 32% | 15% | <4% |
| Unión a proteínas/dializable | 35%/sí | 92%/no | 87%/no | 87%/no |
| Alteración pruebas de coagulación (información cualitativa) | TTPa alargadoT trombina alargado(TP alargado) | TP alargado(TTPa alargado) | TP alargado(TTPa alargado) | TP alargado(TTPa alargado) |
| Medición efecto anticoagulante (información cuantitativa) | Hemoclot (T trombina diluido) | Actividad anti-XaRothacrom (test cromogénicos) | Actividad anti-XaRothacrom (test cromogénicos) | Actividad anti-XaRothacrom (test cromogénicos) |
| Interacciones farmacològicas que contraindiquen el uso de NACO | Antimicóticos azólicos (ketoconazol, itraconazol, voriconazol)Inhibidores de las proteasas (ritonavir) DronaderonaTracolimusCiclosporina | Antimicóticos azólicos (ketoconazol, itraconazol, voriconazol y posaconazol)Inhibidores de las proteasas (ritonavir) | Antimicóticos azólicos (ketoconazol, itraconazol, voriconazol y posaconazol)Inhibidores de las proteasas (ritonavir) | Antimicóticos azólicos (ketoconazol, itraconazol, voriconazol y posaconazol)Inhibidores de las proteasas (ritonavir) |
En insuficiencia renal moderada con FG 30-50ml/min, edad>80 años y en tratamiento con verpamilo o IRS. En insuficiencia renal con FG 15-30ml/min o en poblaciones de riesgo. En insuficiencia renal con FG 15-30ml/min o en poblaciones de riesgo (> 80 años, peso<50 Kg y creatinina>1,5mg/dl). También para la extensión del tratamiento de la tromboembolia venosa.
Rivaroxaban15, apixaban16 y edoxaban (este último aún no aprobado en nuestro país) son inhibidores orales directos del Fc Xa, con características farmacocinéticas similares y comparables a dabigatran excepto por su menor eliminación renal (entre 25-35%). Su uso está contraindicado en insuficiencia renal grave con filtrado glomerular menor de 15ml/min). El metabolismo de los anti-Xa orales depende del CYP3A4, también son transportados por la glucoproteína-P por lo que comparten las interacciones como dabigatran. Aunque estos fármacos no requieren monitorización regular, la medición del efecto anticoagulante sería de utilidad en algunas situaciones. Las pruebas de coagulación general pueden ser de utilidad para evaluar la existencia de un efecto anticoagulante pero no la intensidad de la anticoagulación ya que sus resultados no se correlacionan bien con las concentraciones plasmáticas del fármaco y muestran una variabilidad individual significativa. En la interpretación del resultado de los test de coagulación se debe tener en cuenta cuándo se administró la última dosis, la farmacocinética del fármaco y la función renal, especialmente con el dabigatran17.
En el caso de dabigatran, el tiempo de tromboplastina parcial activada proporcionará solo una evaluación cualitativa de la presencia del fármaco en sangre. Si 12 a 24 horas después de la última toma todavía supera dos veces el límite superior de la normalidad, el riesgo de hemorragia es mayor. El tiempo de trombina por su parte se eleva de forma importante incluso con bajas concentraciones del fármaco por lo que solo proporciona una información cualitativa de la presencia o no de dabigatran en sangre pero no de su concentración plasmática.
En el caso de los inhibidores del Xa, el tiempo de protrombina puede proporcionar una evaluación solo cualitativa porque aunque existe una buena correlación entre sus resultados y las concentraciones plasmáticas del fármaco, presenta una gran variabilidad según el reactivo que se utilice y es poco sensible a niveles plasmáticos bajos18.
El tiempo de trombina calibrado para dabigatran (Hemoclot®) o los test cromogénicos para la determinación de la actividad anti-Xa (para los inhibidores del Xa) proporcionan una información cuantitativa del efecto de los nuevos anticoagulantes directos. Sin embargo, estas no son pruebas de rutina y están disponibles únicamente en laboratorios especializados19.
Riesgo de hemorragia digestiva de los NACOLa hemorragia digestiva es la complicación grave más frecuente del tratamiento anticoagulante y se asocia a una mortalidad de alrededor del 10%. El riesgo de hemorragia mayor en los estudios con antagonista de la vitamina K se cifra entre el 1 y el 3% por persona-año. Metaanálisis de los estudios de anticoagulación en la FA mostraron que el tratamiento con antagonista de la vitamina K se asocia a un riesgo de HD mayor de 2 a 3 veces superior al de esta población sin tratamiento anticoagulante20–22 y que su asociación con aspirina dobla el riesgo de la antagonista de la vitamina K sola20,23,24. Los resultados de los estudios con NACO indican ahora que estos nuevos anticoagulantes directos se asocian a un aumento modesto pero significativo de riesgo de hemorragia digestiva comparado con el asociado al tratamiento convencional con antagonistas de la vitamina K. La magnitud del aumento de riesgo no es totalmente conocida pero los metaanálisis de los estudios fase II y III con más de 150.000 pacientes indican que el riesgo sería un 20-30% superior al de la antagonista de la vitamina K12,13.
No todos los NACO parecen conferir el mismo aumento de riesgo de hemorragia digestiva. Los estudios individuales iniciales mostraron un riesgo un 1,5 veces superior con dabigatran a la dosis de 150 mg cada 12 horas1 y con rivaroxaban 20mg/día3 que no se observó para apixaban4. Así mismo, el subanálisis por fármaco individual en los metaanálisis12,13 o comparaciones indirectas25–27 mostraron también un mayor riesgo de dabigatran y rivaroxaban a estas dosis, pero no con dabigatran 110 cada 12 horas, apixaban o edoxaban. Sin embargo, en ausencia de estudios comparativos directos y la heterogeneidad de los ensayos clínicos, no podemos decir de forma concluyente cuál de los NACO es más seguro en este aspecto.
Es importante señalar que estas cifras podrían subestimar el riesgo real de hemorragia digestiva, por la exclusión en los ensayos clínicos de los pacientes de edad más avanzada u otras situaciones de mayor riesgo de hemorragia como insuficiencia renal significativa, obesidad extrema, comorbilidad o coterapia antiagregante. Se estima que en la práctica clínica diaria entre un 25-40% de los pacientes serían pacientes de alto riesgo de hemorragia en los que la relación eficacia/seguridad se desplazaría desfavorablemente. Sin embargo, en un estudio de cohorte reciente realizado en Dinamarca28, aunque la hemorragia digestiva fue el efecto adverso más frecuente, no se observó un exceso significativo de hemorragia digestiva en pacientes tratados con dabigatran en comparación con los pacientes tratados con antagonista de la vitamina K.
La hemorragia digestiva en el paciente anticoagulado puede ocurrir a cualquier nivel del tracto digestivo, reflejando las patologías sangrantes comunes en la población general. En el caso del dabigatran, en el estudio RE-LY1 la hemorragia tuvo su origen en el tracto digestivo alto en un 53% de los casos y en el tracto digestivo bajo en el 47% restante. Esta distribución contrasta con la del 75% de hemorragia alta y 25% baja en pacientes con antagonista de la vitamina K o AINE observada en series previas29. Se ha propuesto que esta diferencia puede estar relacionada con la menor biodisponibilidad de estos fármacos en comparación con la antagonista de la vitamina K (95%) y el efecto directo de estas mayores concentraciones de fármaco anticoagulante activo en la mucosa digestiva. Sin embargo, en los últimos años se ha observado una clara tendencia a la reducción de la HDA, lo que ha ocasionado que las tasas de HDA y HDB tiendan actualmente a converger30 y un estudio reciente en España muestra una frecuencia similar de HDA y HDB en pacientes anticoagulados con acenocumarol31.
El subanálisis por la indicación del tratamiento12 mostró también que el riesgo es mayor en pacientes tratados por síndrome coronario agudo (OR, 2,06; I2, 22%), probablemente en relación con el cotratamiento con antiagregantes, que está bien establecido que es un factor de riesgo de hemorragia digestiva en el paciente anticoagulado20,23,24.
Abordaje de la hemorragia digestiva en el paciente anticoaguladoEl manejo de una hemorragia por NACO debe ser individualizado en función de su gravedad, de las características del paciente y comorbilidad, la indicación de la anticoagulación así como el tipo de anticoagulante, la dosis del mismo, tiempo desde la última toma y coterapia.
En la práctica clínica la mejor forma de reducir el riesgo la hemorragia digestiva asociada a NACO es la prevención, con una estricta adherencia a las indicaciones de estos fármacos y reducción de los factores de riesgo modificables como la coterapia con antiagregantes o AINE. Así mismo, antes de iniciar tratamiento con NACO, las recomendaciones recientes de la Sociedad Europea de Cardiología32 aconsejan la estratificación de los pacientes según el riesgo de hemorragia con scores como el HAS- BLED, para identificar a estos con mayor riesgo (HAS-BLED>3) que requieren seguimiento más estrecho.
Ante un episodio de hemorragia digestiva en un paciente en tratamiento con NACO, las recomendaciones de tratamiento se basan en la opinión de expertos o endpoints de laboratorio ya que no disponemos de estudios controlados33–38.
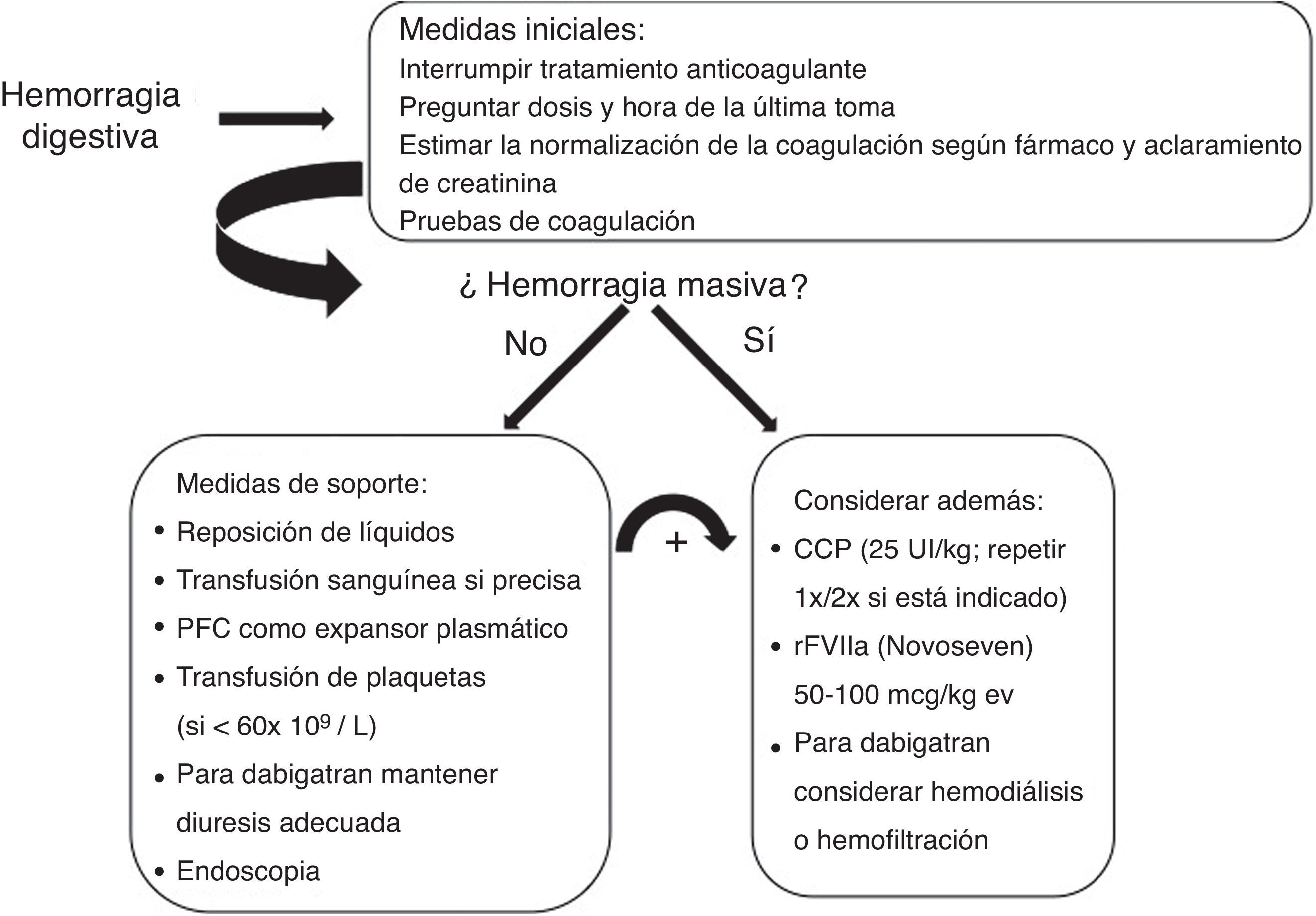
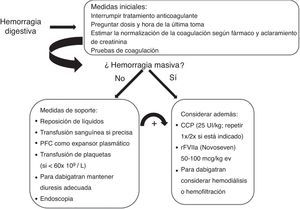
El abordaje inicial de la hemorragia es similar a la que ocurre en el paciente en tratamiento con antagonistas de la vitamina K con las medidas de soporte para la reanimación y estabilización hemodinámica pero con la diferencia de que en caso necesario, el efecto anticoagulante de los antagonistas de la vitamina k se puede revertir en unas 8-24h con la administración de vitamina K y de forma rápida con complejo protrombínico35, mientras que para los NACO no disponemos aún de antídoto específico. Ante esta limitación, el tiempo es un factor que está a nuestro favor ya que la relativamente corta vida media de los NACO (12-14h) hace que tras la interrupción del fármaco, la mayor parte del efecto anticoagulante se disipa en 48 horas (1-2 días). Por este motivo, para el manejo apropiado de la hemorragia digestiva es en primer lugar esencial determinar la dosis del fármaco y la hora exacta de la última toma de medicación. Cuando la última toma de medicación es reciente (menos de 2-3 horas) la administración oral de carbón activado puede evitar la absorción del fármaco residual en estómago. Sin embargo, en caso de hemorragia digestiva esta medida dificultaría notablemente la realización de la endoscopia urgente y en general no solo no puede recomendarse sino que muy probablemente sea más adecuado considerarla contraindicada (fig. 1).
También en este sentido pueden ayudarnos los test básicos de coagulación tal y como hemos comentado previamente. En el caso de dabigatran, un TTPA normal excluye un efecto anticoagulante significativo al igual que un TP normal, en caso de rivaroxaban o apixaban36,37.
Finalmente, en el caso de dabigatran es importante asegurar una diuresis adecuada y en caso de hemorragia grave se podría considerar la diálisis39 en particular en pacientes con insuficiencia renal, aunque esta terapéutica conlleva la dificultad de canalizar una vía central en un paciente anticoagulado y posiblemente inestable.
Reversión de la anticoagulaciónEn la mayoría de los casos la hemorragia digestiva no es masiva y el tratamiento conservador es suficiente. Por el contrario, en pacientes con hemorragia masiva la necesidad de revertir la acción anticoagulante es evidente, aunque resulta problemática. Actualmente están siendo desarrollados antídotos específicos para dabigatran y para inhibidores directos del Fc Xa pero aún se están realizando los estudios de investigación fase III. Por este motivo y con el objetivo teórico de aumentar la generación de trombina, se ha ensayado la administración de agentes prohemostáticos inespecíficos.
En modelos in vitro el concentrado de complejo protrombínico (CCP) ha mostrado normalización de los índices de generación de trombina tanto para dabigatran, rivaroxaban y apixaban pero no se normalizan los parámetros anormales de tromboelastometría. En modelos animales también se han hallado resultados contradictorios a la hora de controlar la hemorragia (incluso, en aquellos que demostraban una normalización de las pruebas de laboratorio). Por otro lado el CCP es responsable de un aumento de las complicaciones tromboembólicas.
Por último, en un estudio en voluntarios sanos tratados con rivaroxaban la administración de CCP corrigió la prolongación anormal del TP. Sin embargo, la importancia clínica que esta normalización de las pruebas de laboratorio pueda tener en el contexto de una hemorragia clínica no ha sido aún establecida.
Tampoco existen datos clínicos sobre la eficacia del uso CCP activado en el control de las hemorragias asociadas a los nuevos anticoagulantes. Aunque tanto los modelos in vitro como en animales sugieren que el CCP activado corrige algunos test de coagulación y el efecto anticoagulante, sobre todo para dabigatran. Debemos tener en cuenta que su uso en Europa no está estandarizado, a diferencia del CCP.
No existen datos clínicos que evalúen la eficacia del factor VIIa recombinante. En modelos in vitro el uso de FVIIar tiene un efecto variable en la corrección de los test de coagulación alterados por rivaroxaban y apixaban. En modelos animales no ha conseguido demostrar ninguna eficacia en disminuir la hemorragia producida por el efecto de dabigatran y rivaroxaban.
En resumen, no disponemos de estudios que evalúen la eficacia clínica de estos agentes prohemostáticos en pacientes en tratamiento con NACO con hemorragia digestiva. Por el momento, y hasta que dispongamos de mejores opciones, la estrategia en el abordaje de la hemorragia en el contexto de pacientes en tratamiento con NACO contempla el uso de estos agentes prohemostáticos tras un cuidadoso balance entre el beneficio y riesgo tromboembólico34–38.
En la hemorragia digestiva en el paciente anticoagulado, ¿cuándo hay que realizar la endoscopia? y en segundo lugar ¿sería eficaz el tratamiento endoscópico en caso de ser necesario?Las recomendaciones de una sesión de consenso internacional reciente sobre el manejo de la hemorragia digestiva en el paciente anticoagulado40 indican que no hay que demorar la endoscopia hasta la corrección de la coagulopatía por antagonista de la vitamina K. Asimismo, en estudios retrospectivos el tratamiento hemostático endoscópico ha sido eficaz y seguro igual que en el paciente sin anticoagulantes41,42.
Aunque no disponemos de datos para los NACO, es preferible realizar la endoscopia cuando el fármaco está en su nivel más bajo (valle), antes de la dosis siguiente para minimizar el efecto anticoagulante. Este retraso de 12 a 24 horas en la realización de la endoscopia podría ser adecuado en pacientes estables tras las medidas iniciales de reanimación y estabilización hemodinámica34. En cambio, en caso de hemorragia grave y dado que no tenemos antídotos efectivos para estos fármacos posiblemente lo más adecuado sea no demorar la endoscopia y el tratamiento endoscópico al igual se propone para los ACO clásicos.
Es cierto que no tenemos información sobre si la terapéutica endoscópica en pacientes con NACO es igualmente efectiva que en pacientes anticoagulados con antagonistas de la vitamina K o si tienen unos mayores porcentajes de resangrado, pero mientras no dispongamos de más datos lo más adecuado parece actuar de la misma forma38.
A pesar de estas limitaciones de los NACO, lo cierto es que el pronóstico de la hemorragia en pacientes en tratamiento con estos anticoagulantes no ha sido peor que la de los pacientes anticoagulados con antagonista de la vitamina K. En el análisis de los 1.121 episodios de hemorragia ocurridos en los 5 estudios fase 3 con casi 30.000 pacientes42, la mortalidad fue menor en los pacientes con dabigatran que en los pacientes con antagonista de la vitamina K (9 vs. 13% Kaplan p=0,052), aunque esta diferencia no alcanzó significación estadística. Esta mejor tendencia en los pacientes ocurrió a pesar que pacientes con dabigatran eran de edad más avanzada, más coterapia y peor función renal.
Tras el episodio de hemorragia, ¿cuándo hay que reiniciar el tratamiento anticoagulante?El tratamiento anticoagulante se debe reiniciar en general tan pronto como sea posible una vez resuelta la hemorragia, debido al alto riesgo de trombosis y mortalidad asociado a la supresión definitiva o interrupción demasiado prolongada43,44. El reinicio de la antagonista de la vitamina K tras el control de la hemorragia reduce riesgo global de tromboembolismo y mortalidad sin aumento significativo del riesgo de recidiva de la hemorragia. Las evidencias disponibles sugieren que el reinicio a partir del cuarto día tras el control de la hemorragia es seguro en la mayoría de los casos43,45,46.
En el caso de los NACO las opciones serían reiniciar el mismo fármaco y dosis, reinicio del mismo fármaco a dosis más bajas (ie dabigatran 110), cambiar a NACO con menor riesgo de hemorragia como apixaban o edoxaban o finalmente, cambiar a antagonista de la vitamina K que al menos hoy por hoy es más fácil de revertir.
Procedimientos endoscópicos en el paciente anticoaguladoEl manejo del tratamiento anticoagulante en pacientes sometidos a procedimientos endoscópicos es un problema clínico común. Aproximadamente un 10% de los pacientes que reciben tratamiento anticoagulante serán sometidos a tratamiento quirúrgico u otros procedimientos invasivos cada año47. Esta situación planteará la necesidad de interrupción temporal de la anticoagulación y en este caso, la necesidad de terapia puente y su reinicio tras el procedimiento.
Distintas sociedades médicas, como la ASGE y la ESGE48,49 o expertos50,51 han formulado recomendaciones para el manejo del tratamiento antiagregante o anticoagulante en procedimientos endoscópicos. Sin embargo, estas recomendaciones se basan primariamente en sesiones de consensos o la opinión de expertos, aunque con escasa evidencia de estudios controlados. Además, por el momento no hay recomendaciones prácticas para los NACO en este contexto. Por tanto, estas recomendaciones han de servir de guía, pero no sustituyen el criterio clínico en las decisiones perioperatorias de cada paciente individual.
¿Cuándo hay que interrumpir la anticoagulación en un paciente que va a ser sometido a un procedimiento endoscópico?La decisión de interrumpir o no el tratamiento antitrombótico depende del balance entre el riesgo de hemorragia del procedimiento endoscópico y el riesgo tromboembólico de la patología de base durante la supresión del tratamiento anticoagulante47. Esta decisión debería idealmente ser consensuada entre el clínico especialista en el manejo perioperatorio de anticoagulantes, el especialista que ha prescrito el tratamiento y el endoscopista.
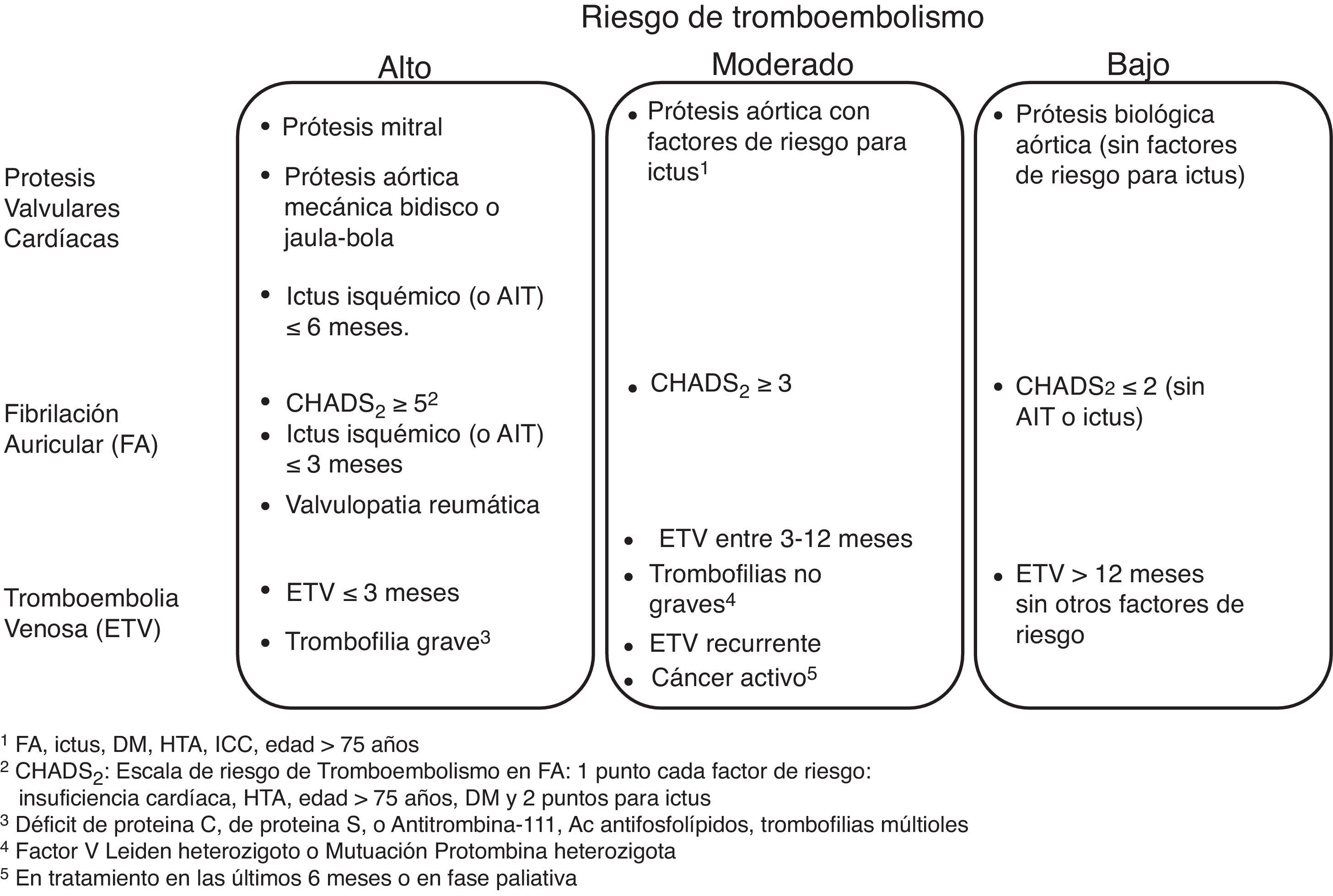
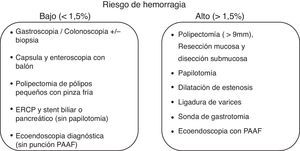
En relación al riesgo de hemorragia del procedimiento, las guías actuales de la ASGE y ESGE48,49 estratifican los procedimientos endoscópicos como de bajo riesgo o de alto riesgo, según que este riesgo sea superior o inferior al 1,5% (fig. 2). Algunos procedimientos como la colocación de prótesis metálicas autoexpandibles o la ablación con argón de lesiones vasculares no están incluidos porque no existe acuerdo en el riesgo de hemorragia.
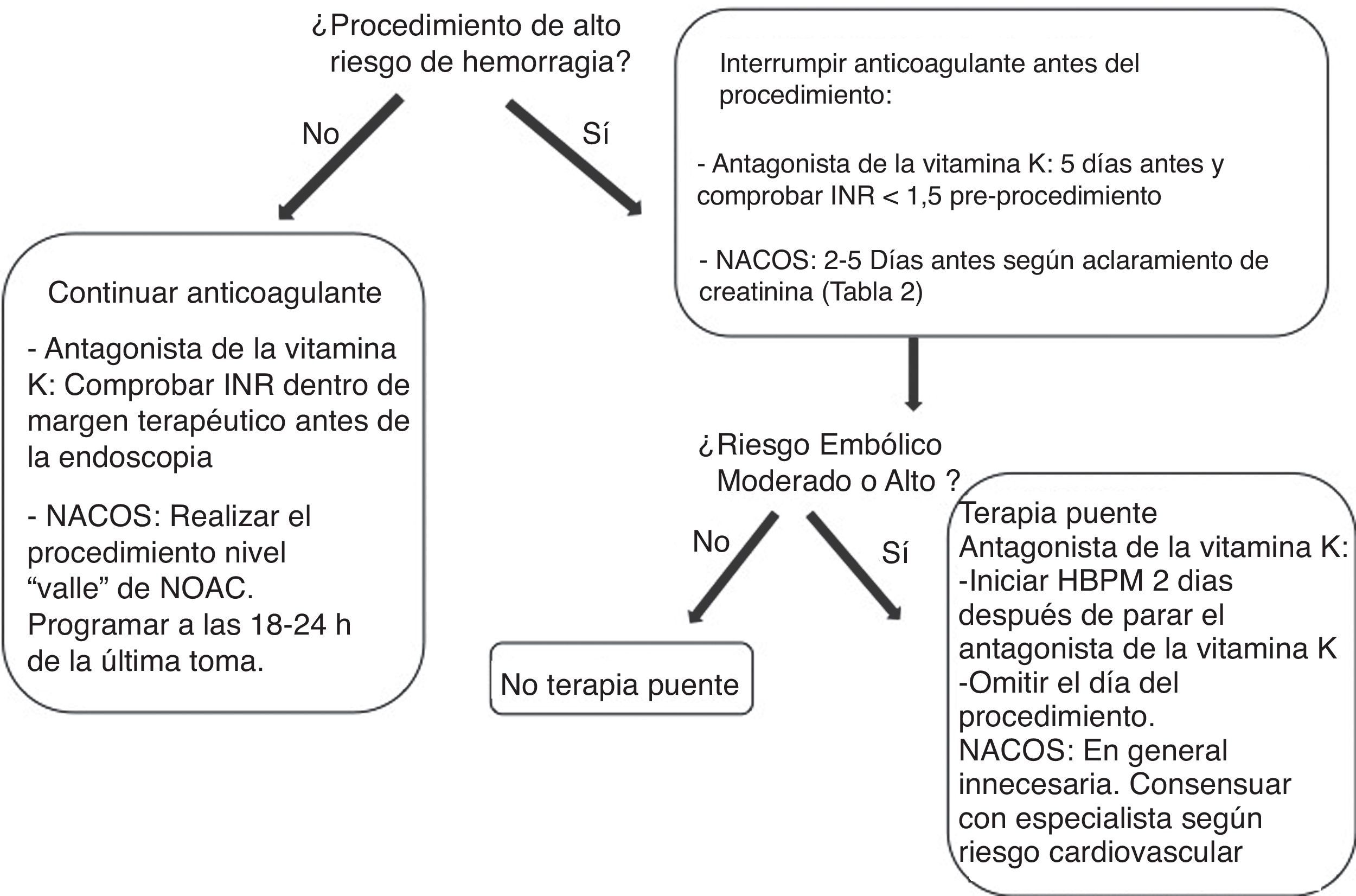
De acuerdo con este riesgo, en pacientes sometidos a procedimientos endoscópicos con bajo riesgo de hemorragia se recomienda en general continuar el tratamiento anticoagulante y en particular deben continuarlo los pacientes con alto riesgo tromboembólico (fig. 3). Para los antagonistas de la vitamina k se recomienda comprobar antes del procedimiento que el INR está dentro del intervalo terapéutico. Para los NACO es preferible realizar la endoscopia cuando el fármaco está en su nivel más bajo (valle), antes de la siguiente dosis para minimizar el efecto anticoagulante.
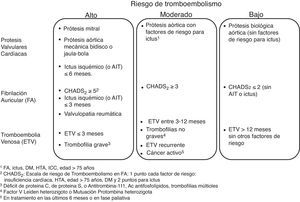
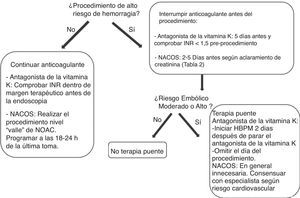
Por el contrario, para los procedimientos de alto riesgo de hemorragia las guías actuales recomiendan la interrupción del tratamiento anticoagulante con objeto de normalizar la coagulación en el momento del procedimiento. En este caso, el clínico debe plantearse primero con qué antelación se debe interrumpir el tratamiento y segundo, si es necesaria una terapia puente para evitar que esta interrupción ocasione un accidente embólico (fig. 4).
En pacientes con condiciones cardiovasculares de bajo riesgo trombótico (fig. 3) la interrupción temporal de la anticoagulación parece segura. En estos pacientes, en el caso de los antagonistas de la vitamina K debido a su larga vida media se recomienda su interrupción 5 días antes del procedimiento, comprobando que el INR sea menor de 1,5 en el momento de la intervención.
En el caso de los NACO, disponemos de pocos datos en relación al manejo perioperatorio. En el subanálisis de los 4.591 pacientes que durante el período del estudio RE-LY requirieron cirugía o fueron sometidos a un procedimiento invasivo, los porcentajes de hemorragia perioperatoria en pacientes con dabigatran o con antagonista de la vitamina K fueron similares52. Aunque por el momento no existen recomendaciones prácticas de las sociedades en este contexto, en pacientes con bajo riesgo tromboembólico parece igualmente adecuado interrumpir la anticoagulación con seguridad. A diferencia de los antagonistas de la vitamina K, la corta vida media de los NACO hace que su interrupción 48 horas antes restablezca la coagulación normal, si no existen otros factores que prolonguen la vida media del fármaco, como por ejemplo insuficiencia renal. El tiempo de interrupción se determinará por tanto de acuerdo con la vida media del NACO y el aclaramiento de creatinina (tabla 2).
Tiempo de interrupción del tratamiento anticoagulante con NACO recomendado para procedimentos endoscópicos de alto riesgo de hemorragia
| Función renal(Fitrado glomerular) | Dabigatran | Rivaroxaban/Apixaban |
|---|---|---|
| >80 ml/min | 2 días antes | 2 días antes |
| 50-80 ml/min | 3 días antes | 2 días antes |
| 30-50 ml/min | 4 días antes | 3 días antes |
| <30 ml/min | ≥ 5 días antesa | 4 días antes |
En pacientes con condiciones cardiovasculares con moderado o alto riesgo trombótico (fig. 3), la interrupción del tratamiento anticoagulante es más problemática. Con el objetivo de reducir el riesgo tromboembólico, estos pacientes podrían beneficiarse de la terapia puente con heparina53,54, aunque se debe tener en cuenta que esta medida puede aumentar el riesgo de hemorragia.
En el caso de los antagonistas de la vitamina K, debido a su interrupción 5 días antes del procedimiento y la lenta recuperación de la anticoagulación tras su reinicio, actualmente se recomienda la terapia puente con heparina bajo peso55,56. Sin embargo, las evidencias del beneficio de esta recomendación son muy escasas. En primer lugar el riesgo perioperatorio de complicaciones tromboembólicas en la FANV asociadas a la interrupción breve de la anticoagulación parece ser muy bajo. En el estudio RE-LY este riesgo fue del 0,5% durante los 7 días antes y hasta 30 días después en 4.591 interrupciones perioperatorias de antagonista de la vitamina K o dabigatran52, confirmando datos observacionales publicados previamente con antagonista de la vitamina K sin terapia puente57.
Además, los pacientes que reciben terapia puente con heparina parecen tener un mayor riesgo de hemorragia perioperatoria con un riesgo de complicaciones tromboembólicas similar al de los pacientes que no la reciben58–61. En un metaanálisis y revisión sistemática de 34 estudios60 en más de 12.000 pacientes sometidos a cirugía o procedimientos invasivos, 7.118 de los cuales recibieron terapia puente con distintas pautas, el riesgo de hemorragia mayor fue 3 veces superior entre los que recibieron terapia puente que en los que no la recibieron (OR: 3,60; 95% CI 1,52-8,50), mientras que no se observaron diferencias significativas en el riesgo embólico (odds ratio [OR]: 0,80; 95% CI: 0,42-1,54). Ante este mayor riesgo de hemorragia con la terapia puente, aun asumiendo que reduciría el riesgo tromboembólico, su beneficio clínico neto no ha sido aún totalmente establecido y deberemos esperar los resultados de los estudios controlados en curso en pacientes con FA u otras condiciones de alto riesgo tromboembólico para definir mejor su papel.
En el caso de los NACO, estas evidencias61 junto a su rápido inicio de acción, dentro de las 2-3 horas de la primera dosis tras el reinicio del tratamiento y su efecto más predecible, sugieren que la terapia puente será innecesaria en la mayoría de los casos, simplificando el manejo perioperatorio de la anticoagulación. Además, de acuerdo con las indicaciones para su utilización aprobadas hasta el momento, el tratamiento con NACO lo podríamos encontrar en pacientes con tromboembolismo reciente (<3 meses) y más frecuentemente en pacientes con FA no valvular. En los primeros sería prudente demorar el procedimiento para poder interrumpir el tratamiento anticoagulante con seguridad mientras que los segundos no tendrían indicación de terapia puente por su bajo riesgo embólico.
La incidencia de hemorragia perioperatoria o periendoscópica implica la necesidad de pautas claras de prevención y mejores medidas de tratamiento similares a las disponibles para la hemorragia por antagonista de la vitamina K. Necesitamos definir mejor cómo monitorizar el efecto anticoagulante con estos fármacos cuando sea necesario, cómo realizar la terapia puente y cómo manejar la coterapia con antiagregantes.
Tras la interrupción del tratamiento anticoagulante para un procedimiento endoscópico, ¿cuándo hay que reiniciar la anticoagulación?Los datos para guiar el reinició de la anticoagulación tras el procedimiento son limitados por lo que aplicamos el mismo principio del balance entre el riesgo trombótico y el riesgo de hemorragia postoperatoria. Tras el procedimiento endoscópico, el tratamiento anticoagulante se debe reiniciar tan pronto como sea posible. Tras procedimientos con hemostasia completa, los expertos recomiendan reiniciar el tratamiento con antagonista de la vitamina K a las 24 horas y con NACO a dosis plenas a las 48-72 horas de la intervención33,62. No obstante, el endoscopista puede recomendar una interrupción más prolongada debido al alto riesgo de sangrado por el procedimiento como por ejemplo tras la polipectomía de pólipos de gran tamaño o resección mucosa63,64. En este caso, no existen datos de eficacia y seguridad de la terapia puente con heparinas de bajo peso molecular o la utilización postoperatoria de dosis bajas de NACO (como las utilizadas para la prevención del TEP en las prótesis de cadera o rodilla).
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.