Evaluación de la capacidad predictiva de fibrosis hepática (FH) del FibroScan® y APRI, FIB-4 y FORNS, con la biopsia hepática como prueba de referencia.
MétodosEl grado de fibrosis hepática (FH) se determinó en 154 pacientes con hepatitis crónica C usando el sistema METAVIR. Se tomaron medidas de FibroScan® (FS) y muestras sanguíneas simultáneamente a la biopsia. Las pruebas se evaluaron usando curvas COR y los valores de concordancia, sensibilidad, especificidad, razones de verosimilitud y valores predictivos.
ResultadosLos pacientes de mayor edad y los coinfectados con VIH tenían significativamente mayores grados de fibrosis. El FS y el FIB-4 tuvieron una capacidad predictiva de FH≥1 significativa, y más de 94% de los pacientes con FS>6,7kPas o FIB-4>1,3 tenían FH≥1 en BH, con sensibilidades bajas (63%FS; 56%Fib-4). Para la detección de FH≥2, todas las pruebas tuvieron una capacidad predictiva significativa, y entre 77–86% de los pacientes con FS>6,8kPas, APRI>0,6, FIB-4>1,4 y FORNS>5,6 tenían FH≥2, con sensibilidades bajas (70%FS; 54%APRI; 59%FIB-4; 54%FORNS). Todas las pruebas tuvieron valores predictivos negativos (91–92%), y especificidades (86–92%) altos para la detección de fibrosis avanzada (FH=4).
ConclusiónTodas las pruebas tuvieron una capacidad aceptable de predicción de la presencia/ausencia de fibrosis leve (FH≥2) y de ausencia de fibrosis avanzada (FH=2). Sin embargo, grados de concordancia con la BH bajos a moderados y valores bajos de sensibilidad para la detección de fibrosis leve indican que la BH sigue siendo necesaria en caso de discordancia o resultados indeterminados usando estos métodos.
To assess the ability of FibroScan® (FS) and the APRI, FIB-4 and FORNS indexes to predict liver fibrosis (LF), using liver biopsy as the gold standard.
MethodsLF stage was determined in 154 patients with chronic hepatitis C virus infection using the METAVIR system. Fibroscan® measurements and blood samples were taken simultaneously with biopsy. The tests were evaluated using ROC curves and the concordance, sensitivity, specificity and predictive values and likelihood ratios.
ResultsSignificantly higher LF stages were found in older patients and in those with HIV coinfection. FS and FIB-4 were able to predict significant LF≥1 and more than 94% of patients with FS>6.7 kPas or FIB-4>1.3 had LF≥1 in liver biopsy, with low sensitivities (63% FS; 56% Fib-4). For the detection of LF≥2, all the tests had significant predictive capacity and between 77% and 86% of the patients with FS>6.8kPas, APRI>0.6, FIB-4>1.4 and FORNS>5.6 had LF≥2, with low sensitivities (70%FS; 54%APRI; 59%FIB-4; 54%FORNS). All tests had high negative predictive values (91–92%) and specificities (86–92%) in the detection of advanced fibrosis (FH=4).
ConclusionAll tests were acceptable in predicting the presence or absence of mild fibrosis (LF≥2) and the absence of advanced fibrosis (LF=2). However, the low or moderate agreement with liver biopsy and low sensitivities in the detection of mild fibrosis indicate that liver biopsy continues to be required when the results of other methods are discordant or indeterminate.
La infección por el VHC afecta a unos 170 millones de personas en el mundo, con una prevalencia estimada entre el 2–3% y gran variabilidad geográfica1. La fibrosis hepática (FH) se usa frecuentemente como indicador de la evolución de la hepatitis crónica C (HCC) y se utiliza en algoritmos de decisión de tratamiento antiviral2–4.
Históricamente, la biopsia hepática (BH) ha sido la prueba de referencia para determinar el grado de FH histológicamente (Ej. escala METAVIR5). Sin embargo, esta técnica es invasiva, se basa en una muestra limitada, puede presentar complicaciones6,7 y su interpretación puede variar según el patólogo8,9.
Se han propuesto diferentes alternativas no invasivas a la biopsia, entre ellas el uso de marcadores bioquímicos y elastografía. Los marcadores bioquímicos propuestos son Actitest10, APRI11, FIB-412, FibroIndex13, FibroTest14, HALT-C15 y Forns16. Estos índices tienen capacidad para predecir grados de FH leve o ausente y avanzadas siendo menos precisos para los grados intermedios17. En cuanto a la elastografía, el FibroScan® (FS) es una técnica sencilla, indolora y reproducible que determina la rigidez hepática utilizando elastografía unidimensional (Echosens, Paris, France)18. Los primeros ensayos realizados para comparar la elasticidad medida por FS y la fibrosis hepática valorada en BH mostraron una correlación significativa18,19 y la capacidad predictiva de fibrosis significativa (F≥2) del FS se ha evaluado en varias ocasiones con resultados satisfactorios20,21. El FS presenta algunas limitaciones: no se puede realizar en pacientes con espacios intercostales estrechos, ascitis u obesidad18,22, no aporta información sobre la actividad necroinflamatoria de la hepatitis23 y hay solapamiento entre estadíos adyacentes de FH, especialmente en los grados más bajos17–19.
Se ha propuesto utilizar de forma combinada marcadores bioquímicos con el FS, con el objetivo de aumentar la eficacia diagnóstica conjunta17,18 y evitar la realización de biopsia hepática en el mayor número de casos posibles. El propósito de este estudio es evaluar la exactitud diagnóstica de varios marcadores bioquímicos (APRI, FIB-4 Y FORNS) y el FS con referencia a la biopsia hepática en pacientes monoinfectados con HCC y coinfectados con HCC-VIH conjuntamente.
Material y métodosPacientesPara realizar este estudio, revisamos las historias clínicas de 154 pacientes del Hospital Clínico Universitario de Valladolid. El examen clínico de estos pacientes se realizó entre agosto–octubre del 2008. Se tomaron las siguientes muestras: a) biopsia hepática por punción transcutánea intercostal guiada por ecografía; b) 10 mediciones con FS, y c) suero y plasma en ayunas. Los criterios de inclusión en el estudio fueron los siguientes: edad superior a 18 años, consentimiento para la realización del estudio, presencia en suero de Ac anti-VHC (detectada por serología de VHC por enzimoinmunoanálisis de tercera generación), RNA del VHC detectable por reacción cuantitativa en cadena de la polimerasa (PCR, sistema Roche Amplicor®), incremento de la alanina aminotransferasa (ALT) durante 6 meses como mínimo y medición con FS satisfactoria. En todos los pacientes se determinó la presencia/ausencia de Ac anti-VIH en suero con serología y Western-blot.
Evaluación histológicaTodas las biopsias se valoraron por el servicio de patología del Hospital Clínico Universitario de Valladolid. Las muestras de tejido hepático se fijaron en parafina y se tiñeron con hematoxilina-eosina y tricrómico de Masson. El sistema de clasificación usado fue el sistema Metavir5, el cual clasifica las FH por estadios en una escala del 0–4 como sigue: FH=0 (no fibrosis), FH=1 (fibrosis portal sin septos), FH=2 (aumento de tractos portales con rara formación de septos), FH=3 (septos numerosos sin fibrosis), FH=4 (cirrosis histológica).
Marcadores bioquímicosLas muestras de suero y plasma se analizaron usando métodos validados para los siguientes parámetros: Plaquetas (x109); aspartato transaminasa (AST; UI/l); alanino aminotransferasa (ALT, UI/l); γ-glutamil transpeptidasa (GGT; UI/l); colesterol (mg/dl). Estos valores se usaron para la obtención de los índices APRI11, FIB-412 y FORNS16 como sigue: APRI: AST/(límite superior de normalidad de AST)×100/plaquetas; FIB-4: [edad (años)×AST]/(plaquetas×2√ALT); FORNS: 7,881−3,131×plaquetas+0,781×ln GGT+3,467×ln edad (años)−0,014×colesterol.
FibroscanEl valor final de Fibroscan® para cada paciente se obtuvo calculando la mediana de 10 mediciones tomadas por vía intercostal en el mismo lugar del lóbulo derecho hepático.
Análisis estadísticosTodos los datos de este estudio se recogieron en una hoja de cálculo en MS Excel® (Microsoft®, USA) y se analizaron con MedCalc® 3.0 (MedCalc Software, Mariakerke, Belgium). Inicialmente, calculamos los valores para APRI, FORNS, FIB-4 y la estadística descriptiva. Para las variables cualitativas se utilizó la frecuencia absoluta y la frecuencia relativa en porcentaje. Para las variables cuantitativas, inicialmente se determinó la normalidad con el test de Kolmogorov-Smirnov. Seguidamente se utilizó la media y la DE para las variables paramétricas, y la mediana y los p 25 y 75 para las no paramétricas. Para evaluar las pruebas, la prueba de referencia fue la biopsia hepática,y los pacientes se clasificaron en presencia de fibrosis (FH≥1), fibrosis significativa (FH≥2), fibrosis grave (FH≥3) y cirrosis (FH=4). Las diferencias entre grupos respecto a las características de los pacientes se analizaron con el test de la t de student para variables paramétricas y con el test de la u de Mann-Whitney para las no paramétricas. La asociación entre el grado de fibrosis y cada prueba se analizó mediante la prueba de Kruskal Wallis. Posteriormente se usaron curvas operativas de rendimiento para evaluar cada prueba respecto a la BH, usando el ABC como indicación de la capacidad predictiva. El punto de corte óptimo de cada prueba para cada grado de fibrosis se determinó como el punto en que la media de la especificidad y la sensibilidad era máxima. Tras establecer este punto, se calculó la sensibilidad, valor predictivo positivo y negativo y las razones de verosimilitud positiva y negativa. Finalmente, se calculó el índice de kappa para cada punto de corte, a fin de evaluar la concordancia con la biopsia hepática.
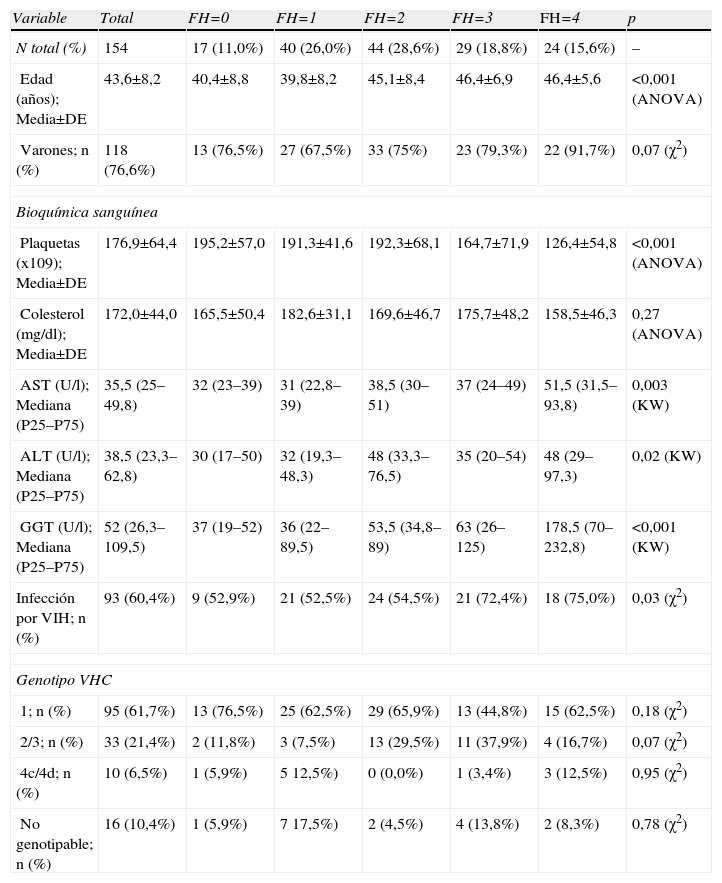
ResultadosPacientes y evaluación histológicaLa tabla 1 contiene las características epidemiológicas de la muestra y los resultados de las analíticas según el grado de fibrosis hepática según la biopsia. Un total de 154 pacientes fueron examinados, con una edad media de 43,6±8,2 años, de los cuales la mayoría eran varones (76,6%).
Características epidemiológicas y resultados de la exploración de 154 pacientes con hepatitis C crónica según el grado de fibrosis hepática
| Variable | Total | FH=0 | FH=1 | FH=2 | FH=3 | FH=4 | p |
| N total (%) | 154 | 17 (11,0%) | 40 (26,0%) | 44 (28,6%) | 29 (18,8%) | 24 (15,6%) | – |
| Edad (años); Media±DE | 43,6±8,2 | 40,4±8,8 | 39,8±8,2 | 45,1±8,4 | 46,4±6,9 | 46,4±5,6 | <0,001 (ANOVA) |
| Varones; n (%) | 118 (76,6%) | 13 (76,5%) | 27 (67,5%) | 33 (75%) | 23 (79,3%) | 22 (91,7%) | 0,07 (χ2) |
| Bioquímica sanguínea | |||||||
| Plaquetas (x109); Media±DE | 176,9±64,4 | 195,2±57,0 | 191,3±41,6 | 192,3±68,1 | 164,7±71,9 | 126,4±54,8 | <0,001 (ANOVA) |
| Colesterol (mg/dl); Media±DE | 172,0±44,0 | 165,5±50,4 | 182,6±31,1 | 169,6±46,7 | 175,7±48,2 | 158,5±46,3 | 0,27 (ANOVA) |
| AST (U/l); Mediana (P25–P75) | 35,5 (25–49,8) | 32 (23–39) | 31 (22,8–39) | 38,5 (30–51) | 37 (24–49) | 51,5 (31,5–93,8) | 0,003 (KW) |
| ALT (U/l); Mediana (P25–P75) | 38,5 (23,3–62,8) | 30 (17–50) | 32 (19,3–48,3) | 48 (33,3–76,5) | 35 (20–54) | 48 (29–97,3) | 0,02 (KW) |
| GGT (U/l); Mediana (P25–P75) | 52 (26,3–109,5) | 37 (19–52) | 36 (22–89,5) | 53,5 (34,8–89) | 63 (26–125) | 178,5 (70–232,8) | <0,001 (KW) |
| Infección por VIH; n (%) | 93 (60,4%) | 9 (52,9%) | 21 (52,5%) | 24 (54,5%) | 21 (72,4%) | 18 (75,0%) | 0,03 (χ2) |
| Genotipo VHC | |||||||
| 1; n (%) | 95 (61,7%) | 13 (76,5%) | 25 (62,5%) | 29 (65,9%) | 13 (44,8%) | 15 (62,5%) | 0,18 (χ2) |
| 2/3; n (%) | 33 (21,4%) | 2 (11,8%) | 3 (7,5%) | 13 (29,5%) | 11 (37,9%) | 4 (16,7%) | 0,07 (χ2) |
| 4c/4d; n (%) | 10 (6,5%) | 1 (5,9%) | 5 12,5%) | 0 (0,0%) | 1 (3,4%) | 3 (12,5%) | 0,95 (χ2) |
| No genotipable; n (%) | 16 (10,4%) | 1 (5,9%) | 7 17,5%) | 2 (4,5%) | 4 (13,8%) | 2 (8,3%) | 0,78 (χ2) |
ALT: alanin aminotransferasa; AST: aspartato aminotransferasa; FH: fibrosis hepática según Metavir5; GGT: γ-glutamil transpeptidasa; N total:154.
Los pacientes de mayor edad, coinfectados con VIH presentaron significativamente mayores grados de fibrosis. En cuanto a los resultados de las analíticas, todos los parámetros variaron significativamente respecto al grado de FH exceptuando el colesterol.
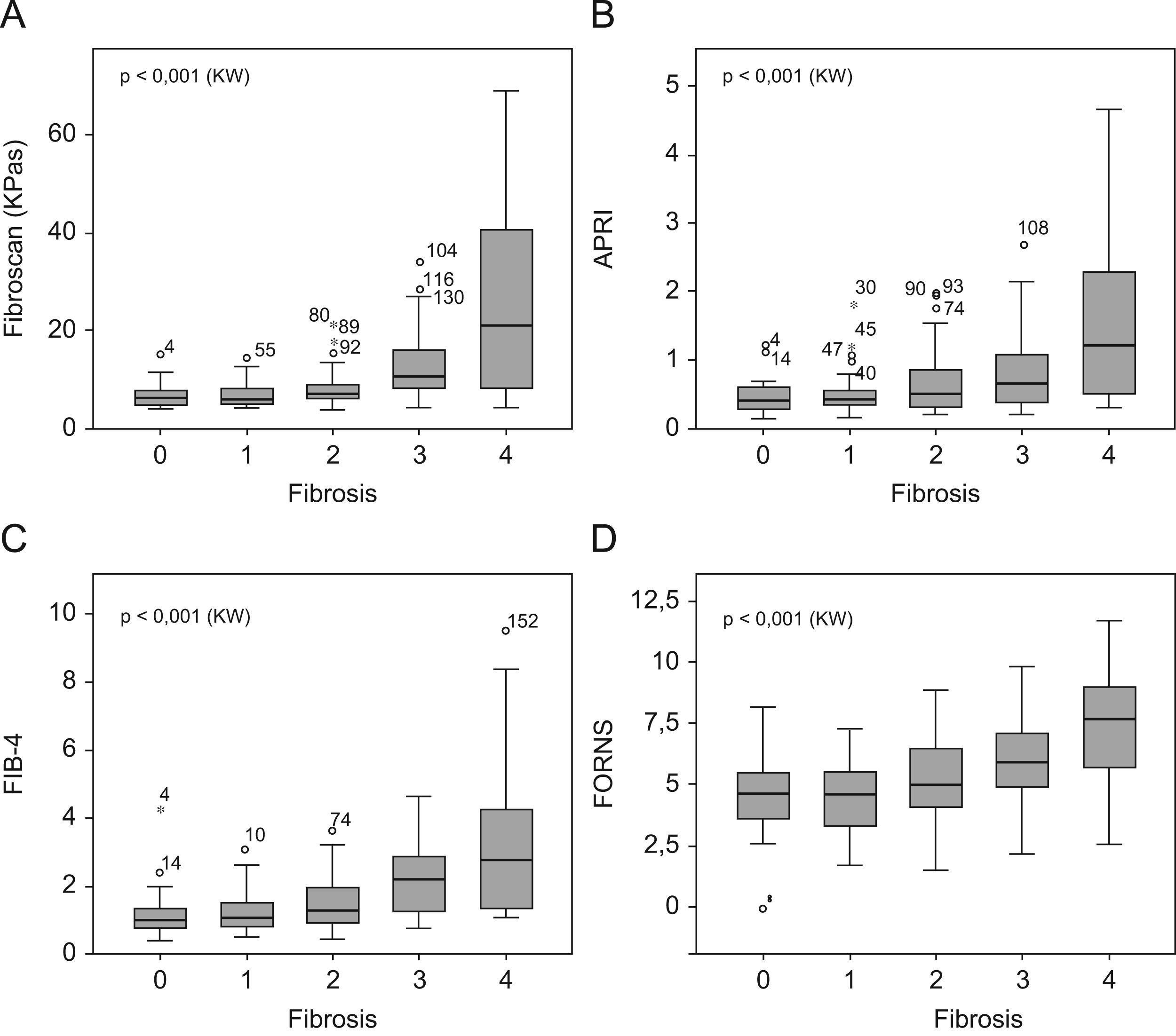
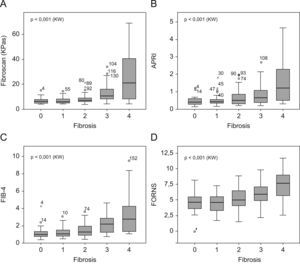
La figura 1 muestra los valores de la mediana, la distribución de los cuartiles y los valores marginales de cada estadio de FH para todas las pruebas. En todos los casos los valores de la prueba aumentaron significativamente respecto al grado de FH.
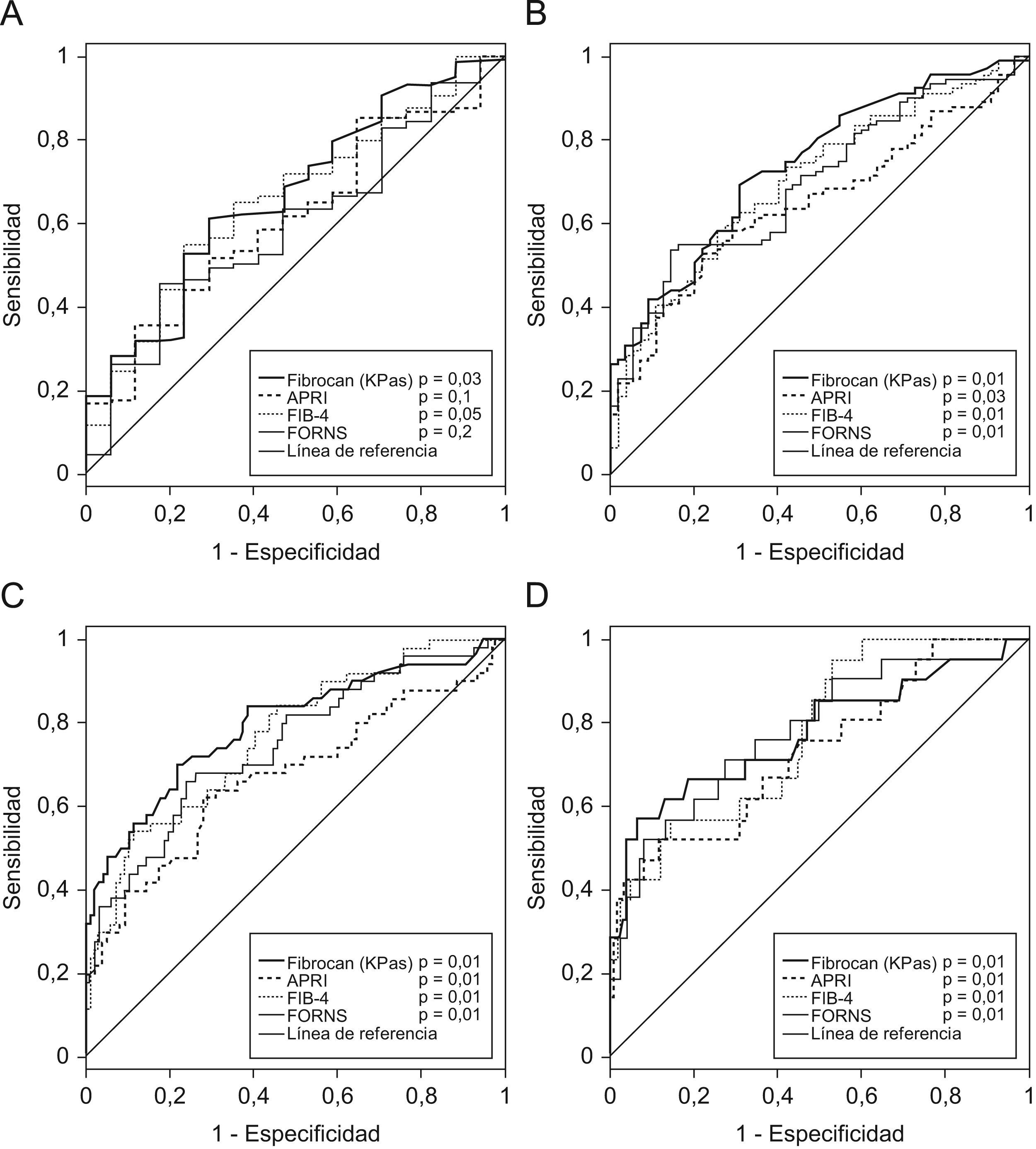
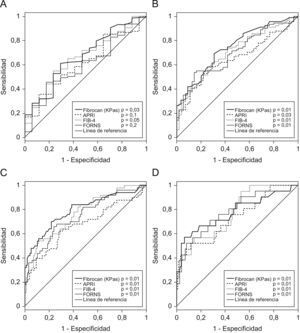
La capacidad predictiva de cada grado de FH de las pruebas, estimada mediante el ABC, se muestra en la figura 2 y las tablas 2tablas 3–5 (Fibroscan), 3 (APRI), 4 (FIB-4) y 5 (FORNS).
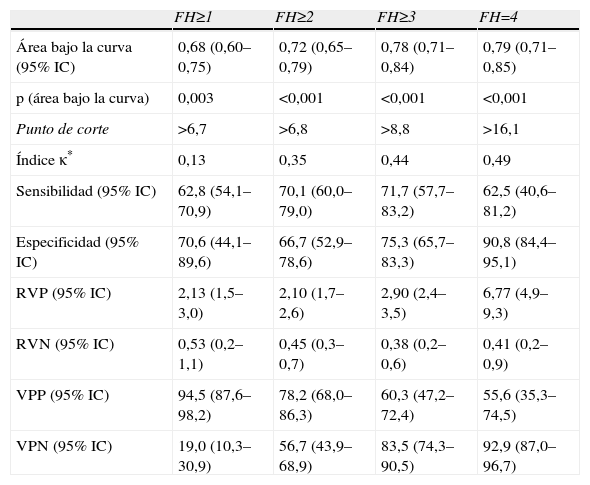
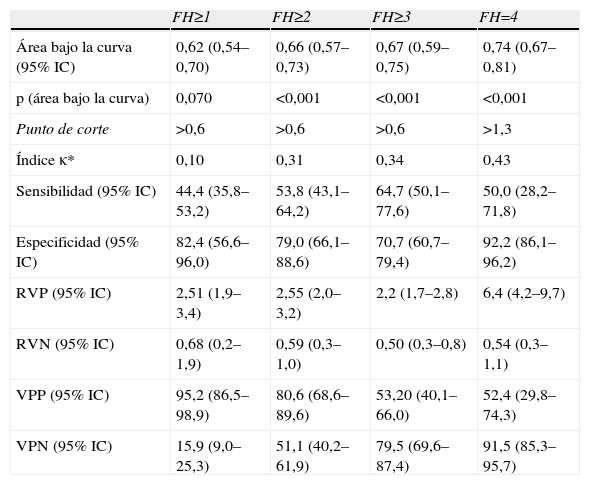
Capacidad predictiva del Fibroscan® para la detección de fibrosis hepática
| FH≥1 | FH≥2 | FH≥3 | FH=4 | |
| Área bajo la curva (95% IC) | 0,68 (0,60–0,75) | 0,72 (0,65–0,79) | 0,78 (0,71–0,84) | 0,79 (0,71–0,85) |
| p (área bajo la curva) | 0,003 | <0,001 | <0,001 | <0,001 |
| Punto de corte | >6,7 | >6,8 | >8,8 | >16,1 |
| Índice κ* | 0,13 | 0,35 | 0,44 | 0,49 |
| Sensibilidad (95% IC) | 62,8 (54,1–70,9) | 70,1 (60,0–79,0) | 71,7 (57,7–83,2) | 62,5 (40,6–81,2) |
| Especificidad (95% IC) | 70,6 (44,1–89,6) | 66,7 (52,9–78,6) | 75,3 (65,7–83,3) | 90,8 (84,4–95,1) |
| RVP (95% IC) | 2,13 (1,5–3,0) | 2,10 (1,7–2,6) | 2,90 (2,4–3,5) | 6,77 (4,9–9,3) |
| RVN (95% IC) | 0,53 (0,2–1,1) | 0,45 (0,3–0,7) | 0,38 (0,2–0,6) | 0,41 (0,2–0,9) |
| VPP (95% IC) | 94,5 (87,6–98,2) | 78,2 (68,0–86,3) | 60,3 (47,2–72,4) | 55,6 (35,3–74,5) |
| VPN (95% IC) | 19,0 (10,3–30,9) | 56,7 (43,9–68,9) | 83,5 (74,3–90,5) | 92,9 (87,0–96,7) |
FH: fibrosis hepática; Índice κ: concordancia con grado de FH determinado mediante biopsia; N:154; RVN: razón de verosimilitud negativa; RVP: razón de verosimilitud positiva; VPN: valor predictivo negativo; VPP: valor predictivo positivo.
Capacidad predictiva del APRI para la detección de fibrosis hepática
| FH≥1 | FH≥2 | FH≥3 | FH=4 | |
| Área bajo la curva (95% IC) | 0,62 (0,54–0,70) | 0,66 (0,57–0,73) | 0,67 (0,59–0,75) | 0,74 (0,67–0,81) |
| p (área bajo la curva) | 0,070 | <0,001 | <0,001 | <0,001 |
| Punto de corte | >0,6 | >0,6 | >0,6 | >1,3 |
| Índice κ* | 0,10 | 0,31 | 0,34 | 0,43 |
| Sensibilidad (95% IC) | 44,4 (35,8–53,2) | 53,8 (43,1–64,2) | 64,7 (50,1–77,6) | 50,0 (28,2–71,8) |
| Especificidad (95% IC) | 82,4 (56,6–96,0) | 79,0 (66,1–88,6) | 70,7 (60,7–79,4) | 92,2 (86,1–96,2) |
| RVP (95% IC) | 2,51 (1,9–3,4) | 2,55 (2,0–3,2) | 2,2 (1,7–2,8) | 6,4 (4,2–9,7) |
| RVN (95% IC) | 0,68 (0,2–1,9) | 0,59 (0,3–1,0) | 0,50 (0,3–0,8) | 0,54 (0,3–1,1) |
| VPP (95% IC) | 95,2 (86,5–98,9) | 80,6 (68,6–89,6) | 53,20 (40,1–66,0) | 52,4 (29,8–74,3) |
| VPN (95% IC) | 15,9 (9,0–25,3) | 51,1 (40,2–61,9) | 79,5 (69,6–87,4) | 91,5 (85,3–95,7) |
FH: fibrosis hepática; Índice κ: concordancia con grado de FH determinado mediante biopsia; N: 150; VPN: valor predictivo negativo; VPP: valor predictivo positivo; RVN: razón de verosimilitud negativa; RVP: razón de verosimilitud positiva.
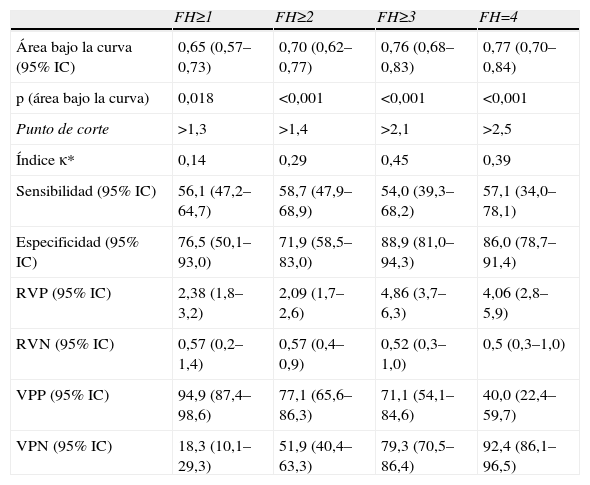
Capacidad predictiva del FIB-4 para la detección de fibrosis hepática
| FH≥1 | FH≥2 | FH≥3 | FH=4 | |
| Área bajo la curva (95% IC) | 0,65 (0,57–0,73) | 0,70 (0,62–0,77) | 0,76 (0,68–0,83) | 0,77 (0,70–0,84) |
| p (área bajo la curva) | 0,018 | <0,001 | <0,001 | <0,001 |
| Punto de corte | >1,3 | >1,4 | >2,1 | >2,5 |
| Índice κ* | 0,14 | 0,29 | 0,45 | 0,39 |
| Sensibilidad (95% IC) | 56,1 (47,2–64,7) | 58,7 (47,9–68,9) | 54,0 (39,3–68,2) | 57,1 (34,0–78,1) |
| Especificidad (95% IC) | 76,5 (50,1–93,0) | 71,9 (58,5–83,0) | 88,9 (81,0–94,3) | 86,0 (78,7–91,4) |
| RVP (95% IC) | 2,38 (1,8–3,2) | 2,09 (1,7–2,6) | 4,86 (3,7–6,3) | 4,06 (2,8–5,9) |
| RVN (95% IC) | 0,57 (0,2–1,4) | 0,57 (0,4–0,9) | 0,52 (0,3–1,0) | 0,5 (0,3–1,0) |
| VPP (95% IC) | 94,9 (87,4–98,6) | 77,1 (65,6–86,3) | 71,1 (54,1–84,6) | 40,0 (22,4–59,7) |
| VPN (95% IC) | 18,3 (10,1–29,3) | 51,9 (40,4–63,3) | 79,3 (70,5–86,4) | 92,4 (86,1–96,5) |
FH: fibrosis hepática; Índice κ: concordancia con grado de FH determinado mediante biopsia; N: 150; VPN: valor predictivo negativo; VPP: valor predictivo positivo; RVN: razón de verosimilitud negativa; RVP: razón de verosimilitud positiva.
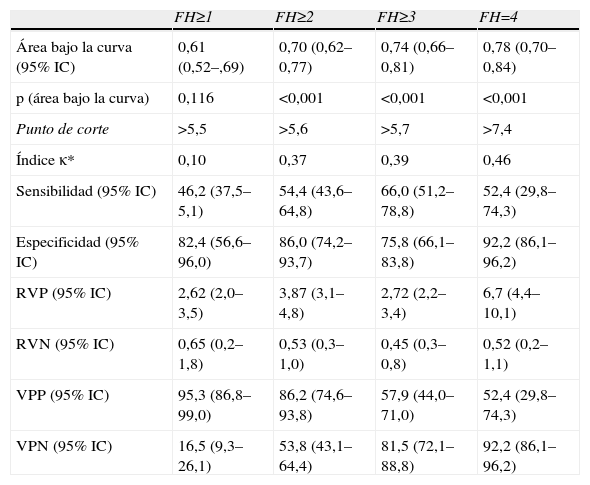
Capacidad predictiva del FORNS para la detección de fibrosis hepática
| FH≥1 | FH≥2 | FH≥3 | FH=4 | |
| Área bajo la curva (95% IC) | 0,61 (0,52–,69) | 0,70 (0,62–0,77) | 0,74 (0,66–0,81) | 0,78 (0,70–0,84) |
| p (área bajo la curva) | 0,116 | <0,001 | <0,001 | <0,001 |
| Punto de corte | >5,5 | >5,6 | >5,7 | >7,4 |
| Índice κ* | 0,10 | 0,37 | 0,39 | 0,46 |
| Sensibilidad (95% IC) | 46,2 (37,5–5,1) | 54,4 (43,6–64,8) | 66,0 (51,2–78,8) | 52,4 (29,8–74,3) |
| Especificidad (95% IC) | 82,4 (56,6–96,0) | 86,0 (74,2–93,7) | 75,8 (66,1–83,8) | 92,2 (86,1–96,2) |
| RVP (95% IC) | 2,62 (2,0–3,5) | 3,87 (3,1–4,8) | 2,72 (2,2–3,4) | 6,7 (4,4–10,1) |
| RVN (95% IC) | 0,65 (0,2–1,8) | 0,53 (0,3–1,0) | 0,45 (0,3–0,8) | 0,52 (0,2–1,1) |
| VPP (95% IC) | 95,3 (86,8–99,0) | 86,2 (74,6–93,8) | 57,9 (44,0–71,0) | 52,4 (29,8–74,3) |
| VPN (95% IC) | 16,5 (9,3–26,1) | 53,8 (43,1–64,4) | 81,5 (72,1–88,8) | 92,2 (86,1–96,2) |
FH: fibrosis hepática; Índice κ: concordancia con grado de FH determinado mediante biopsia; N: 150; VPN: valor predictivo negativo; VPP: valor predictivo positivo; RVN: razón de verosimilitud negativa; RVP: razón de verosimilitud positiva.
Los valores de rigidez hepática por FS abarcaron desde 3,6–69,1 kPas (mediana: 7,8 kPas). Los valores de los índices bioquímicos abarcaron de 0,12–4,7 (mediana: 0,48) para APRI, de 0,40–9,5 (mediana: 1,4) para FIB-4 y de −0,1–15,2 (mediana: 5,3) para FORNS. El ABC de todas las pruebas osciló entre 0,61–0,79, y en todos los casos aumentó gradualmente con el grado de FH detectado. Todas las pruebas tuvieron ABC menores que 0,7 para la detección de presencia/ausencia de FH (FH≥1) y en el caso de APRI y FORNS el ABC no era significativamente diferente a 0,5. Sin embargo, la capacidad predictiva de las pruebas para grados mayores de FH fue significativa en todos los casos. El grado de concordancia de las pruebas con los resultados (κ) de la biopsia fue pobre para la detección de FH≥1 (κ<0,20) e incrementó gradualmente para la detección de mayores grados de FH en todas las pruebas. En ningún caso fue mayor que 0,50, indicando concordancia moderada con la biopsia. Cuatro pacientes mostraron valores atípicos de APRI y FIB-4, que no se incluyeron en el análisis. De estos, 2 pacientes tuvieron FH=4 y los otros 2 FH=0 y FH=3 respectivamente. Todos estos pacientes tenían valores de plaquetas de 11–52 (×109) significativamente menores que la media del resto (P<0,001, ANOVA).
DiscusiónHemos utilizado los resultados del estudio clínico de 154 pacientes con VHC para evaluar la capacidad diagnóstica de FH de varios marcadores bioquímicos (APRI, FIB-4 y FORNS) y del FS, usando la BH como prueba de referencia. La presencia de grados intermedios o mayores de FH (FH≥1–2) se usa como referencia para el tratamiento de FH en pacientes con VHC3,4. Más de la mitad de los pacientes (54,6%) de este estudio tenían grados intermedios de FH24 indicando que estos datos son útiles para la evaluación de la capacidad diagnóstica de estas pruebas no invasivas en el rango de interés clínico.
En esta muestra, los pacientes de mayor edad tuvieron significativamente mayores grados de FH, en consistencia con estudios previos25,26. Más de la mitad estaban coinfectados VHC/VIH, los cuales generalmente presentan una evolución peor de la FH 5 y esto se reflejó en significativamente mayores grados de FH en coinfectados VHC/VIH. Los valores de colesterol no variaron significativamente según el grado de FH, indicando que esta variable, utilizada en el índice FORNS 16, no tenía valor predictivo de FH para estos datos. El análisis de valores atípicos de APRI y FIB-4 sugiere que valores bajos de plaquetas pueden resultar en incremento de estos valores no correlacionado con la FH y en estos casos se debería contrastar el resultado de estos índices con el de otra prueba que no utilice el número de plaquetas.
El objetivo principal de este estudio es la evaluación del FS y marcadores bioquímicos para reducir en la medida de lo posible la necesidad de BH. Según algunos autores, el tratamiento de FH en pacientes coinfectados con VIH se comienza cuando FH≥1 4. En estos datos, solo el FS y el FIB-4 tuvieron una capacidad predictiva de FH≥1 significativa, y más de 94% de los pacientes con >6,7kPas en FS o >1,3 en Fib-4 tenían FH≥1. Sin embargo, la sensibilidad de estas pruebas para FH≥1 fue baja y 37% (FS) y 44% (Fib-4) de los pacientes con FH no fueron detectados. Otras guías de consensos indican el comienzo del tratamiento de FH cuando FH≥2 en pacientes con VHC 3. En este caso, todas las pruebas tuvieron una capacidad predictiva de FH≥2 significativa, y entre 77–86% de los pacientes con >6,8kPas en FS, 0,6 en APRI, 1,4 en FIB-4 y 5,6 en FORNS tuvieron FH≥2. De nuevo, el FS tuvo una sensibilidad relativamente baja y no detectó a 30% de los pacientes con FH≥2. Los índices bioquímicos tuvieron una sensibilidad más pobre y no detectaron entre 41–46% de los pacientes con FH≥2. En cuanto a la detección de fibrosis avanzada, todas las pruebas fueron útiles para excluir a los pacientes que no presentaban FH=4, con valores predictivos negativos (91–92%), y especificidades (86–92%) altos. El valor de ABC de para la detección de cirrosis con FS es inferior a los datos publicados previamente (0,79). Esto puede haber sido consecuencia de diferencias en la distribución del grado de actividad necro inflamatoria en esta muestra respecto a otros estudios, ya que este factor tiene influencia significativa en la rigidez hepática23.
Los resultados de este análisis indican que todas las pruebas tuvieron una capacidad aceptable de predicción de la presencia/ausencia de fibrosis significativa (FH≥2) y de ausencia de fibrosis avanzada (FH=4), en consistencia con estudios previos10,23,25,27. Sin embargo, los resultados indican un grado de concordancia moderado con la BH y valores bajos de sensibilidad, para FH≥2. Varios autores han propuesto combinar estas pruebas para mejorar la detección de FH significativa y cirrosis17,28–30 y se ha observado que de esta manera es posible evitar la BH en hasta un tercio de pacientes con HCC. Concluyendo, los resultados de este estudio apoyan las recomendaciones de las «AASLD Practice Guidelines 2009»31, las cuales indican que los métodos no invasivos son útiles en definir ausencia o presencia de FH avanzada pero sin reemplazar totalmente la BH en la rutina de la práctica clínica. Con la información disponible en la actualidad, la BH sigue siendo necesaria en caso de discordancia o resultados indeterminados usando métodos no invasivos.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Los autores quieren expresar su agradecimiento a Castora Jiménez, enfermera de la Unidad de Enfermedades Infecciosas del Hospital Clínico Universitario de Valladolid por su ayuda en todas las fases de este estudio.