La enfermedad de Crohn y la colitis ulcerosa son 2 formas de enfermedad inflamatoria intestinal (EII). Actualmente se han identificado factores genéticos y ambientales que ejercen influencia en el desarrollo de esta enfermedad. Entre los factores ambientales y dietéticos, se han propuesto los compuestos fenólicos como agentes protectores en diferentes modelos de inflamación intestinal. Sin embargo, aunque existe una amplia bibliografía acerca del efecto beneficioso que ejercen los polifenoles sobre la salud, su efectividad desde un punto de vista dietético no está todavía aclarada. En esta revisión se repasan algunas de las evidencias que vinculan el consumo de compuestos fenólicos en la dieta y un efecto protector sobre la EII.
Crohn's disease and ulcerative colitis are two forms of inflammatory bowel disease (IBD). Genetic and environmental factors influencing the onset and course of this disease have recently been identified. Among the environmental and dietary factors involved in the development of inflammatory colon diseases, dietary polyphenols have been proposed as protective agents in distinct models of colon inflammation. However, despite the huge number of studies on the beneficial effects of polyphenols on health, their dietary effectiveness is unclear. In this review, we examine some of the evidence linking dietary polyphenol intake with protection against IBD.
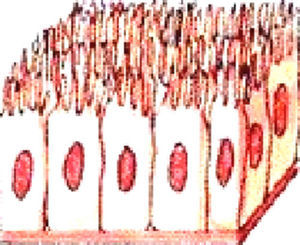
La luz intestinal está revestida con una capa de células epiteliales, representada principalmente por enterocitos columnares absortivos (fig. 1). Estas células no son únicamente causantes del transporte de nutrientes, sino que también participan activamente en la respuesta inmunitaria local del epitelio e incrementan la protección frente a antígenos ingeridos en la dieta y agentes microbianos1.
Diariamente, el intestino se encuentra sometido a importantes desafíos por parte de agentes oxidantes derivados de la dieta; no obstante, éste se encuentra equipado con varios mecanismos de defensa que permiten mantener la integridad celular y la homeostasis del tejido2. La alteración de este sistema de defensa de la mucosa podría contribuir a la aparición de problemas intestinales de naturaleza inmunitaria, como enfermedades inflamatorias intestinales (EII) crónicas y fallos en múltiples órganos3, así como cáncer de colon. Han surgido evidencias que relacionan el consumo de frutas y verduras con una reducción en el riesgo de presentar una enfermedad crónica de tipo inflamatoria4,5, y distintos estudios epidemiológicos muestran datos que afirman que un alto consumo de frutas y verduras se relaciona consistentemente con una alta actividad antiinflamatoria debido al alto contenido polifenólico de sus componentes5,6. En esta revisión se presentan y se discuten los principales hallazgos acerca del papel que ejercen los compuestos fenólicos sobre la modulación de la respuesta inflamatoria intestinal.
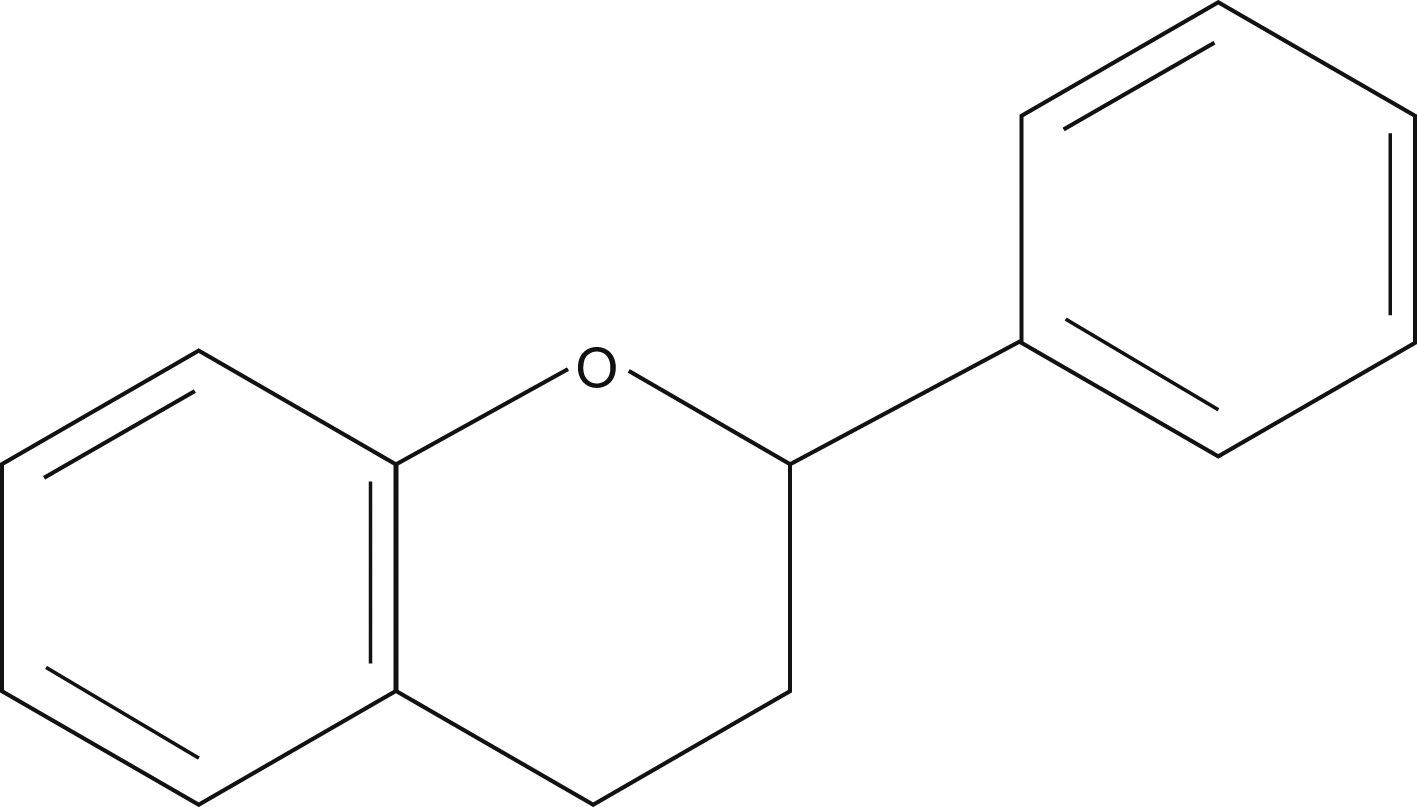
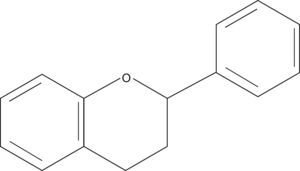
Compuestos fenólicosLos compuestos fenólicos son un grupo de sustancias de naturaleza química variada que se encuentran presentes de un modo significativo en los alimentos de origen vegetal y que presentan una gran capacidad para captar radicales tóxicos debido a la presencia de grupos hidroxilo unidos a anillos aromáticos7. En la planta desempeñan importantes funciones protectoras frente a la radiación ultravioleta o al ataque de algunos agentes patógenos, y contribuyen también, en un modo importante, al aroma y al color de las flores y los frutos. En los alimentos de origen vegetal, los compuestos fenólicos tienen un importante efecto en la calidad, ya que se encuentran directamente relacionados con las características sensoriales de estos alimentos, tales como el aroma, la astringencia y el color8. Desde el punto de vista de su estructura básica, los compuestos fenólicos se pueden clasificar en flavonoides y no flavonoides9. Los flavonoides presentan un bajo peso molecular y se caracterizan por compartir una estructura base formada por el anillo flavano (fig. 2). Este grupo de compuestos fenólicos, en el que se incluyen antocianos, flavonoles, flaván-3-oles, procianidinas, flavonas, flavanonas e isoflavonas, está implicado en el color y el sabor de muchos vegetales. Dentro del grupo de los compuestos fenólicos no flavonoides se incluyen los ácidos hidroxicinámicos, los ácidos hidroxibenzoicos, los taninos hidrolizables y los estilbenos, que están presentes en numerosas frutas y verduras. Existen numerosos estudios que demuestran que la presencia de compuestos fenólicos en la dieta es beneficiosa para la salud debido a su capacidad anticarcinógena y antimutágena, lo que se debe fundamentalmente a sus propiedades antioxidantes10,11.
Propiedades antiinflamatorias de los compuestos fenólicosEstas propiedades antioxidantes justificarían los efectos antiinflamatorios de los compuestos fenólicos, tal y como se ha descrito en numerosos estudios12–14. No obstante, a nivel intestinal existen pocos estudios en este sentido13. La EII se encuentra mediada en gran medida por especies reactivas de oxígeno (reactive oxygen species [ROS]), que son un conjunto de moléculas reactivas producidas en algunos procesos metabólicos en los que participa el oxígeno. Estas moléculas reactivas (O2− y H2O2) pueden producir daños en el ADN de la célula y la oxidación de ácidos grasos poliinsaturados y de aminoácidos. Para evitar estos daños, la célula dispone de mecanismos enzimáticos de eliminación y transformación de las ROS, como la catalasa y la superóxido dismutasa, así como de sustancias antioxidantes, como el glutatión y la vitamina C, que tienen capacidad para reducir las ROS. La alteración del equilibrio del mecanismo de producción y eliminación de éstas conduce a una situación de estrés oxidativo y a daños en la célula. Existen estudios que ponen de manifiesto que los compuestos fenólicos muestran beneficios sobre un amplio espectro de trastornos inflamatorios, en particular cuando las ROS se encuentran significativamente implicadas15.
Mecanismo del daño en la enfermedad inflamatoria intestinal mediado por especies reactivas de oxígenoLa EII comprende un grupo heterogéneo de enfermedades crónicas de etiología y patogénesis no bien conocidas y de naturaleza sistémica que causan inflamación intestinal16. Entre ellas, las más comunes son la colitis ulcerosa (CU) y la enfermedad de Crohn (EC), cuya incidencia ha aumentado en los últimos años (10,4 casos [CU] y 5,6 casos [EC] por cada 100.000 habitantes al año), y que se caracterizan por la aparición de ciclos de inflamaciones agudas con úlceras sangrantes en la mucosa del colon y el recto (en la CU) o que puede afectar a cualquier tramo del intestino delgado (en la EC)17.
Su cuadro sintomático común comprende dolor abdominal, diarrea y melena, tenesmo, anorexia y fiebre, y se asocia frecuentemente a otros procesos, como artritis, uveítis, pioderma gangrenosa y complicaciones obstétricas18. Se caracterizan principalmente por activación e infiltración de las células inflamatorias y lesiones de la mucosa intestinal, lo que resulta en la sobreproducción de ROS y del nitrógeno, que actúan amplificando y cronificando el proceso inflamatorio19. Esto ha hecho que cada vez sea más evidente que pacientes afectados de EII muestren elevados niveles sanguíneos de radicales libres y un inadecuado sistema defensivo antioxidante20–22, y la peroxidación del tejido se considera el principal componente de la respuesta anómala del sistema inmunitario en las EII3. Los radicales de oxígeno formados provocan la desestabilización de las membranas, las alteraciones en el ADN, la inactivación de enzimas proteolíticas asociadas a la detoxificación de metabolitos reactivos de oxígeno y la inducción de estrés oxidativo mediante la interacción con el plasma y con factores celulares. Como resultado de la inflamación intestinal crónica, se favorece un desequilibrio entre los mecanismos oxidantes y antioxidantes en los tejidos22, lo que afecta gravemente las reservas antioxidantes circulantes del organismo23. Las principales células involucradas en la respuesta inflamatoria son los monocitos/macrófagos, los leucocitos polimorfonucleares y las células endoteliales. Cuando estas células se activan, se agregan y se infiltran en el tejido, aumentan considerablemente el consumo de oxígeno, y aparecen ROS y otros mediadores de la inflamación que desempeñan un importante papel en la etiopatogénesis de la EII. El exceso de ROS potencia la respuesta inmunitaria en la EII debido a la estimulación de leucocitos polimorfonucleares, con lo que se crea un círculo vicioso: se generan más ROS y un mayor daño oxidativo en los tejidos. Existen estudios que demuestran que las ROS actúan a través de la regulación de diferentes genes implicados en la respuesta inflamatoria24. Un mecanismo potencial es a través de la activación del factor nuclear de transcripción κB (nuclear factor-κB [NF-κB]), que es un factor de transcripción ubicuo que está implicado en la regulación de varios genes que participan en las respuestas inflamatorias25. En este sentido, se ha indicado que hay una ruta de señalización común para ROS y NF-κB porque los agentes oxidantes son capaces de activar el NF-κB y un grupo de antioxidantes estructuralmente diversos son capaces de inhibir la activación del NF-κB24–26. El aumento de la producción de radicales libres generado en la EII aumenta igualmente la peroxidación lipídica y produce un incremento en los niveles plasmáticos de productos provenientes de esta oxidación, con el consecuente descenso en la capacidad antioxidante del plasma, afectándose también la composición de las partículas lipoproteicas27. En plasma, las lipoproteínas de baja densidad oxidadas pueden inducir la adherencia y la migración de monocitos sanguíneos al endotelio vascular, lo que favorece la aparición de lípidos peroxidados involucrados en la respuesta inflamatoria28,29. En la actualidad, ha incrementado el interés en el desarrollo de nuevos agentes aplicables en el tratamiento de la EII que combinen eficacia con pocos efectos adversos, con una consiguiente mejora en la calidad de vida del enfermo. Existen fundamentos científicos que justifican un creciente uso de factores dietéticos o nutricionales para modular la respuesta inflamatoria.
Dieta en el origen y tratamiento de la enfermedad inflamatoria intestinalExiste actualmente un aumento de atención hacia el estudio de la importancia de los factores nutricionales en la patogénesis y el tratamiento de la EII. Por tanto, nuevos medicamentos o tratamientos para las EII que posean actividad antioxidante con la capacidad de modular cualquiera de las etapas mencionadas anteriormente podrían, potencialmente, ser beneficiosos en el tratamiento de la EII30,31. Existen diversos componentes de la dieta que han demostrado ejercer un efecto antiinflamatorio. Por ejemplo, aminoácidos no esenciales, como la arginina y la glutamina, o aminoácidos azufrados, como la cisteína o la metionina, son rápidamente consumidos por parte del sistema inmunitario durante la respuesta inmunitaria. Minerales, como el cobre, el hierro, el selenio y el cinc, pueden desempeñar un importante papel en el desarrollo de la respuesta inflamatoria. Existen evidencias que indican que un incremento en los niveles de ácidos grasos poliinsaturados w-3 es aconsejable en la dieta de individuos afectados de EII. Otros estudios indican que la ingesta de prebióticos, “ingredientes que estimulan selectivamente el crecimiento o la actividad de determinados microorganismos del colon y proporcionan un beneficio a la salud del individuo”, como por ejemplo la fibra dietética, puede tener un efecto beneficioso sobre pacientes afectados de EII32. El papel que ejercen los compuestos fenólicos, abundantes en frutas y verduras, sobre el proceso inflamatorio a nivel intestinal se trata más en detalle en el siguiente apartado.
Acción de los compuestos fenólicos en la enfermedad inflamatoria intestinal. Papel de la nutrigenómicaDebido a su capacidad antioxidante, la ingesta de compuestos fenólicos podría mostrar efectos beneficiosos en el tratamiento de estos trastornos intestinales, ya que algunos estudios han demostrado la capacidad de este compuesto en disminuir significativamente la producción de ROS33–35. Actualmente, se conocen también otros posibles mecanismos no relacionados con la capacidad antioxidante de los compuestos fenólicos y que están generalmente asociados a la inhibición de enzimas inflamatorias33. Existen estudios realizados en humanos donde se asocia el consumo de compuestos fenólicos a una reducción del riesgo de presentar enfermedad cardiovascular, cáncer o enfermedades neurodegenerativas34. Los estudios encaminados a evaluar el papel de los compuestos fenólicos en el proceso inflamatorio se han realizado, generalmente, en modelos in vitro no intestinales35. El número de investigaciones sobre el efecto de los compuestos fenólicos sobre la EII es todavía escaso, sobre todo cuando se tiene en cuenta el tipo de compuesto fenólico. No obstante, recientemente se ha indicado que el consumo de compuestos fenólicos puede ayudar en el tratamiento de la EII36,37. En la tabla 1 se muestran algunos estudios sobre el efecto que ejercen algunos compuestos fenólicos sobre EII crónicas.
Actividad antiinflamatoria de compuestos fenólicos a nivel intestinal
| Compuestos fenólicos y fuente alimentaria | Actividad antiinflamatoria a nivel intestinal | Referencias |
| Antocianos y flavonoles de la fresa | Regulación de la producción de citocinas | Russell et al, 200738 |
| Extracto de polifenoles del té verde | Reducción en la adherencia de células inflamatorias | Mazzón et al, 200539 |
| Resveratrol de la uva y del vino tinto | Reducción en la infiltración de neutrófilos y en los niveles de citocinas | Ramón Martín et al, 200640 |
| Catequinas del té verde | Actúan sobre la P-glucoproteína de la membrana. | Zhou et al, 200441 |
| Antocianos del fruto de Cornus kousa | Inhibición de la ciclooxigenasa | Vareed et al, 200742 |
| Compuestos fenólicos del vino tinto | Disminución en la infiltración de neutrófilos y de la expresión de citocinas | Canali et al, 200043 |
| Aflavinas del té negro | Disminución de la peroxidación de lípidos, reducción en los niveles de ROS y supresión de la activación de NF-κB | Maity et al, 200344 |
| Rutina, ácido clorogénico y epicatequina del zumo de manzana | Disminución del daño oxidativo y de los niveles de ROS | Schaefer et al, 200645 |
NF-κB: nuclear factor-κB, factor nuclear de transcripción κB; ROS: especies reactivas de oxígeno.
Una de las principales acciones para llevar a cabo en la EII en relación con la dieta y que consigue mejorar la sintomatología de la enfermedad consiste en sustituir la dieta habitual del individuo por una dieta elemental, ya que de un modo similar a como sucede en los celíacos está comprobado que existen ciertos componentes de la dieta que mejoran la sintomatología de la enfermedad, mientras que hay otros componentes que conducen a un empeoramiento del cuadro clínico, por lo que la dieta suministrada debe individualizarse para cada paciente25. Los estudios más recientes en relación con la patogénesis de la EII indican una importante interrelación entre factores ambientales y factores genéticos17, en ellos se ha identificado un determinado número de genes que presentan alterada su expresión en individuos afectados de EII. Sobre la base de estos conocimientos y de la fuerte base genética de la enfermedad que se ha establecido a través de distintos estudios, como se indica en la revisión realizada por Ferguson et al (2007)25, la EII se considera una enfermedad genética. Estos autores se han basado en estas evidencias para indicar que la EII proporciona un buen ejemplo en el que la incidencia y la gravedad de la enfermedad pueden modularse a través de recomendaciones dietéticas de acuerdo con el genotipo del individuo. Se han identificado distintos genes cuya alteración en la expresión está relacionada directamente con la EII46. En esta revisión hacemos referencia a algunos de ellos, no obstante, existen todavía otros muchos que se están estudiando para establecer su grado de implicación en la EII así como para poder definir desde un punto de vista genómico la CU y la EC, ya que parece evidente que responden a patrones genéticos distintos25. El gen CARD15 codifica para la proteína NOD2, que está implicada en la protección frente a microorganismos invasivos en el intestino, por lo que ejerce un papel clave en el desarrollo de la enfermedad47. El gen ATG16L1 está implicado en el proceso de autofagia, que es fundamental en rutas que son relevantes para el reconocimiento bacteriano y la respuesta inflamatoria. El complejo mayor de histocompatibilidad es una región del cromosoma 6p que está claramente relacionada con la EII, ya que desempeña un papel clave en la respuesta inmunitaria. El gen IL23R, receptor de interleucina-23, que codifica para un receptor de una citocina proinflamatoria, participa también en el desarrollo de la enfermedad25. Los receptores similares a Toll son receptores transmembrana que tienen un papel esencial en la detección de patógenos y en la iniciación de la respuesta inflamatoria48. Se han identificado otros genes implicados también en el desarrollo de la EII mediante su participación en el transporte a través de la mucosa intestinal. Por ejemplo, los genes transportadores de cationes orgánicos SLC22A4 y SLC22A5 se encuentran estrechamente implicados con la susceptibilidad a presentar la EC25. En este grupo de genes que participan en el transporte, se incluye también el gen ABCB1/MDR1 que codifica para la P-glucoproteína, con función transportadora de la membrana, y que desempeña un importante papel en la patogénesis de la CU. El gen DLG5 se expresa en múltiples tejidos, incluyendo el tracto gastrointestinal, y parece estar implicado en un incremento en la susceptibilidad a presentar la EII debido a que participa en la función de la barrera intestinal49. Con el estudio del genoma humano, se ha conseguido vislumbrar, de una forma más precisa, la causa de la susceptibilidad de un determinado genotipo a presentar la EII así como evaluar la posibilidad de determinar los individuos que, con un genotipo específico, se podrían beneficiar con la ingesta de determinados alimentos, lo que mejoraría la sintomatología y el bienestar de los pacientes afectados de EII. Day et al (2006)50 comprobaron que el suministro de dietas elementales, aquellas que suministran proteína y nitrógeno en forma de aminoácidos y no como proteínas intactas, a pacientes con EC conduce a una mejora en la sintomatología de la enfermedad, pero se produce una rápida recaída cuando se abandona esta dieta; se consigue retrasar en el tiempo la aparición de esta recaída cuando la dieta se individualiza para cada paciente. Debido a la importancia de personalizar cada tratamiento, un mayor conocimiento de los genes implicados en el desarrollo de la EII es fundamental para determinar, de un modo más específico, qué alimentos son los recomendados o los contraindicados para cada paciente.
Aunque son numerosos los estudios que hacen referencia al efecto beneficioso que ejercen los compuestos fenólicos sobre la salud, la mayoría de los artículos de investigación publicados sobre la acción terapéutica que ejercen los compuestos fenólicos sobre la EII hacen referencia a dosis muy elevadas y que no son representativas desde un punto de vista dietético o nutracéutico, y existe una deficiencia de información en relación con si la dieta puede proporcionar las cantidades necesarias de los distintos compuestos fenólicos que son capaces de ejercer una acción beneficiosa sobre procesos como la EII. Se ha estimado que la ingesta diaria de compuestos fenólicos en humanos es de 1g/día, no obstante, los estudios in vivo llevados a cabo sobre distintos modelos animales estudian dosis desde 0,5–1.500mg/kg peso vivo/día51 pero no pueden considerarse un modelo extrapolable a humanos por la diferente composición de la flora intestinal, que tiene un papel fundamental en el metabolismo de los compuestos fenólicos. Es también de gran importancia el desarrollo de más estudios de nutrigenómica encaminados a obtener un mayor conocimiento de los alimentos que son los más adecuados para un determinado genotipo afectado de EII. La ingesta de alimentos enriquecidos en compuestos fenólicos debe contemplarse como una importante opción para conseguir una disminución de la gravedad y una mejora en la sintomatología de la EII.
FinanciaciónLa Fundación Séneca (Agencia Regional de Ciencia y Tecnología) otorgó una beca para la formación posdoctoral del personal investigador (ref. 09292/PD/08).