La fragilidad es un estado de vulnerabilidad caracterizado por una disminución de la reserva fisiológica y la capacidad de respuesta ante el estrés, lo que aumenta el riesgo de complicaciones, efectos adversos a los tratamientos y al deterioro funcional. La valoración de la fragilidad permite determinar la edad biológica de los pacientes, más allá de su edad cronológica, proporcionando una visión más precisa de su estado de salud y necesidades asistenciales. La proporción de adultos de edad avanzada con EII se halla en aumento de forma paralela al envejecimiento de la población general y se estima que, en la próxima década, más de un tercio de los pacientes con EII superarán los 60 años. Esta población puede sufrir las complicaciones derivadas de la propia EII desarrolladas previamente a la vez que es particularmente susceptible a desarrollar efectos secundarios del tratamiento, lo que hace imprescindible su evaluación integral con el fin de identificar aquellos más vulnerables. A la fragilidad se unen otros síndromes geriátricos como la comorbilidad y la polifarmacia que pueden interferir de forma notable con el manejo y el curso de la EII, condicionando la estrategia terapéutica y el pronóstico.
ObjetivoEn este contexto, la evaluación geriátrica integral debe ser sistemática en los pacientes de edad avanzada con EII, con el objetivo de detectar déficits funcionales e implementar intervenciones específicas de apoyo nutricional, rehabilitación funcional y atención psicológica para optimizar su evolución. Este documento de posicionamiento pretende establecer recomendaciones al respecto basadas en la evidencia disponible.
ConclusionesLa incorporación sistemática de la valoración geriátrica integral en el manejo de personas mayores con EII representa una estrategia esencial para mejorar los resultados clínicos, adaptar los tratamientos a la capacidad funcional del paciente y favorecer un enfoque verdaderamente centrado en la persona.
Frailty is a state of vulnerability characterised by a decrease in physiological reserve and the ability to respond to stress, which increases the risk of complications, adverse effects of treatments and functional decline. Assessing frailty allows the biological age of patients to be determined, beyond their chronological age, providing a more accurate picture of their health status and care needs. The proportion of older adults with IBD is increasing in parallel with the ageing of the general population, and it is estimated that in the next decade, more than a third of IBD patients will be over 60 years of age. This population may suffer from complications arising from previously developed IBD and is particularly susceptible to developing side effects from treatment, making comprehensive assessment essential in order to identify those who are most vulnerable. Frailty is compounded by other geriatric syndromes such as comorbidity and polypharmacy, which can significantly interfere with the management and course of IBD, influencing the therapeutic strategy and prognosis.
ObjectiveIn this context, comprehensive geriatric assessment should be systematic in elderly patients with IBD, with the aim of detecting functional deficits and implementing specific interventions for nutritional support, functional rehabilitation and psychological care to optimise their progress. This position paper aims to establish recommendations in this regard based on the available evidence.
ConclusionsThe systematic incorporation of comprehensive geriatric assessment in the management of older people with IBD represents an essential strategy for improving clinical outcomes, adapting treatments to the patient's functional capacity and promoting a truly person-centred approach.
La enfermedad inflamatoria intestinal (EII) abarca un grupo de trastornos crónicos que incluyen la enfermedad de Crohn (EC) y la colitis ulcerosa (CU), los cuales se caracterizan por una inflamación persistente y recidivante del tracto gastrointestinal. Estas enfermedades no solo impactan negativamente en la calidad de vida de los pacientes, sino que también se asocian a complicaciones a largo plazo que pueden conllevar discapacidad1,2. Dado que el inicio de la EII es más frecuente en la adolescencia o el inicio de la edad adulta, la fragilidad constituye un aspecto crítico y a menudo subestimado de la EII. La fragilidad es una condición que supone una disminución de la reserva fisiológica y de la resistencia a factores estresantes, confiriendo una mayor vulnerabilidad y riesgo de resultados adversos. La fragilidad involucra no solo aspectos físicos, sino también psicológicos y sociales3. El aumento de la prevalencia de EII unido a una mortalidad muy similar a la de la población general hace que la necesidad de comprender y abordar la fragilidad en estos pacientes sea cada vez más urgente. La interacción de inflamación crónica, malnutrición, pérdida de masa muscular y otros factores exacerba la fragilidad y, en consecuencia, el riesgo de hospitalización, complicaciones quirúrgicas y mortalidad4.
La identificación y el manejo de la fragilidad en la EII representa un desafío clínico y requiere un enfoque multidimensional. Este documento de posicionamiento tiene como objetivo mostrar la interrelación entre fragilidad y EII, su prevalencia, los principales factores de riesgo, sus implicaciones clínicas en la EII y se revisan las herramientas disponibles para su identificación y las potenciales estrategias de intervención.
Concepto de fragilidad y sus principales condicionantesSegún el diccionario de la Real Academia Española, frágil significa «que puede deteriorase con facilidad»5. En términos de salud, la definición más aceptada de las diversas existentes es la desarrollada desde el ámbito de la geriatría, que la define como un síndrome biológico de disminución de la reserva y resistencia a estresantes, resultado del deterioro acumulativo de múltiples sistemas fisiológicos, confiriendo mayor vulnerabilidad y riesgo de resultados adversos6,7. Con el envejecimiento, se produce un descenso gradual de la reserva fisiológica; en la fragilidad, este descenso se acelera y los mecanismos homeostáticos empiezan a fallar8. La persona frágil presenta un mayor riesgo de discapacidad y mortalidad a partir de un factor estresante externo mínimo.
La fragilidad se hace más prevalente con el envejecimiento, aunque no todas las personas de edad avanzada la presentan9. Por otro lado, la fragilidad puede ocurrir a cualquier edad, especialmente en las personas con enfermedades crónicas8. El riesgo de fragilidad aumenta con la edad cronológica, en presencia de comorbilidades, deterioro cognitivo, alteración sensorial (auditiva y visual), polifarmacia, baja actividad física, bajo aporte nutricional en la dieta y nivel socioeconómico bajo, entre otros (tabla 1)10. Uno de los factores críticos, al que se ha prestado una especial atención en los últimos años, es la sarcopenia (pérdida muscular), que condiciona debilidad y alteración de la función muscular, frecuentemente asociada a la edad11.
Factores de riesgo asociados con el inicio y la progresión de fragilidad
| Sociodemográficos | Clínicos | Estilo de vida | Biológicos |
|---|---|---|---|
| - Edad avanzada- Sexo femenino- Bajo nivel educativo- Bajo nivel socioeconómico- Procedencia étnica diversa- Soledad- Depresión de la pareja | - Comorbilidad/enfermedad crónica- Obesidad- Capacidad funcional baja- Depresión- Alteración cognitiva- Polifarmacia- Autovaloración de salud negativa | - Inactividad física- Baja ingesta proteica- Deficiencias en micronutrientes- Desnutrición- Baja ingesta de resveratrol- Emociones como ansiedad, tristeza, irritabilidad, culpa o miedo | - Inflamación (elevación de proteína C reactiva y/o de citoquinas inflamatorias)- Niveles bajos de testosterona libre |
Aunque a menudo se utilizan como sinónimos de forma errónea en la práctica clínica, fragilidad, discapacidad y comorbilidad son conceptos diferentes. La comorbilidad, que se define por la coexistencia de múltiples enfermedades y condiciones médicas en un mismo individuo, y puede contribuir a la aparición y progresión de fragilidad (y viceversa). La discapacidad viene determinada por cualquier limitación o restricción en la actividad o participación social de una persona debido a una condición de salud. Sin embargo, la fragilidad puede constituir el paso previo a la discapacidad y debe considerar un proceso dinámico dado que su gravedad puede fluctuar e incluso ser reversible12.
La evaluación de la fragilidad permite diferenciar las personas robustas de las prefrágiles, frágiles o con alguna discapacidad ya establecida. La prevalencia de la fragilidad en la población suele ser difícil de establecer ya que los datos disponibles son heterogéneos tanto por los métodos utilizados para su evaluación como por la población estudiada11. La prevalencia global de fragilidad en Europa se ha estimado en el 18%, oscilando entre el 12% en las personas en el ámbito de la comunidad y el 45% en otros ámbitos. Esta diferencia es el reflejo de la fluctuación de fragilidad en la enfermedad aguda y la presencia de elevada multimorbilidad crónica en los pacientes institucionalizados13.
La fragilidad se asocia a un mayor riesgo de resultados adversos en salud, incluyendo caídas, hospitalización, institucionalización y mortalidad, además del aumento exponencial en los costes sanitarios7. Aunque existe consenso general en relación al concepto teórico de fragilidad, la complejidad de su fisiopatología y la diversidad de factores predisponentes dificultan disponer de criterios diagnósticos universales y de un estándar de oro para su evaluación10,11 (fig. 1).
La detección y el manejo apropiado de la fragilidad conlleva ganancias significativas de los resultados en salud para los pacientes, pudiendo incrementar su independencia y reducir la carga sobre cuidadores y sistemas de salud. La valoración geriátrica integral (VGI) es la herramienta de referencia para evaluar la fragilidad.
La VGI constituye un proceso diagnóstico multidimensional, generalmente interdisciplinario, dirigido a cuantificar los problemas y las capacidades médicas, funcionales, psíquicas y sociales de cualquier individuo y que permite trazar un plan de tratamiento y seguimiento. Si bien su realización requiere tiempo y un aprendizaje especializado, la VGI realizada por un equipo multidisciplinar experto en geriatría mejora los resultados en salud, en comparación con el abordaje médico tradicional14.
Dado que no es viable realizar una VGI en todos los individuos de edad avanzada, el cribado de fragilidad permite detectar aquellos con un riesgo elevado y que requieren de derivación para una VGI completa. Los métodos más conocidos y utilizados para el cribado y la evaluación de la fragilidad en personas mayores son el fenotipo de Fried7 y los índices de fragilidad, que aportan información crucial sobre el estado de fragilidad y presentan ventajas particulares dependiendo del contexto de la evaluación15,16.
El fenotipo de Fried define la fragilidad como un síndrome clínico con criterios específicos, basado en la observación de 5 características físicas7. Una persona se considera frágil si cumple 3 o más de los siguientes criterios:
- 1.
Pérdida de peso no intencionada: específicamente, la pérdida superior a 4,5 kg o del 5% del peso corporal en el último año.
- 2.
Debilidad muscular: medida a través de la fuerza de prensión de la mano, ajustada por sexo y masa corporal. Se considera frágil cuando esta se sitúa en el quintil inferior.
- 3.
Lentitud al caminar: evaluada por el tiempo que se emplea en recorrer una distancia específica, ajustada por sexo y altura. La lentitud en el quintil inferior indica fragilidad.
- 4.
Fatiga o agotamiento autoinformado: los individuos reportan una sensación persistente de fatiga o agotamiento.
- 5.
Baja actividad física: medida por el gasto calórico en actividades físicas semanales, al igual que el resto de parámetros, el quintil inferior según sexo indica fragilidad.
El fenotipo de Fried es útil ya que identifica de manera precoz los individuos que presentan un mayor riesgo de resultados adversos en salud, como discapacidad, hospitalización, caídas y mortalidad 7.
Los índices matemáticos de fragilidad, también conocidos como modelos de acumulación de déficits, ofrecen una perspectiva distinta para evaluar y cuantificar la fragilidad en las personas mayores. Este enfoque fue popularizado por Rockwood y Mitnitski17 y mide la fragilidad como un índice que resume la cantidad de problemas de salud o déficits que una persona ha acumulado.
Uno de los índices de fragilidad más empleados y con amplia evidencia científica es el índice frágil-VIG (IF-VIG). Este fue diseñado específicamente para identificar y clasificar el grado de fragilidad en personas mayores y abarca diferentes dominios, incluyendo aspectos funcionales, nutricionales, cognitivos, emocionales, sociales, síndromes geriátricos, síntomas graves y enfermedades crónicas. El IF-VIG destaca por su aplicación práctica y ágil, permitiendo una rápida evaluación de la fragilidad mediante 22 preguntas sobre 25 déficits que incluyen desde problemas con actividades instrumentales de la vida diaria (como manejar el dinero o la medicación) hasta condiciones clínicas específicas (como malnutrición, deterioro cognitivo, depresión, insomnio o vulnerabilidad social). También considera la existencia de síndromes geriátricos como caídas o úlceras, el uso de múltiples medicamentos (polifarmacia) y enfermedades crónicas en diferentes órganos o sistemas. El IF-VIG facilita una puntuación que refleja el grado de fragilidad de forma complementaria al fenotipo de Fried; mientras que el fenotipo de Fried identifica la fragilidad basándose en la presencia de características físicas concretas, el IF-VIG ofrece una perspectiva más amplia y detallada que incluye aspectos clínicos, funcionales y sociales, permitiendo una valoración más integral de la condición de la persona. El IF-VIG es particularmente útil en entornos clínicos en los que se requiere un cribado rápido y eficaz de fragilidad para la toma de decisiones18. Existe una calculadora del IF-VIG accesible para su uso público a través de la página web del Grupo de Investigación en Cronicidad de la Cataluña Central (C3RG), en el siguiente enlace: https://es.c3rg.com/index-fragil-vig.
La escala de fragilidad clínica (EFC) es otra herramienta diseñada para evaluar la fragilidad en personas mayores, desarrollada inicialmente por Rockwood et al.19. A diferencia del IF-VIG, la EFC proporciona una medida cualitativa y más visual de la fragilidad a través de una escala visual simple basada en la observación y la evaluación clínica (fig. 2) que clasifica la fragilidad en 9 categorías, donde cada categoría está representada por imágenes y descripciones detalladas del nivel de actividad, independencia y salud. La EFC se utiliza ampliamente en entornos clínicos para evaluar de forma rápida el grado de fragilidad, lo que es especialmente de ayuda en situaciones de cuidados agudos para la toma de decisiones clínicas. Su formato intuitivo y fácil de entender facilita su uso por profesionales de la salud sin necesidad de aprendizaje en profundidad. A pesar de todo ello, la evaluación basada en la EFC puede resultar subjetiva y dependiente de la interpretación del evaluador, y no detectar cambios sutiles en el estado de fragilidad. La EFC también está disponible como aplicación móvil, en el siguiente enlace: https://www.scfn.org.uk/cfs-app20.
Los estudios poblacionales más recientes han observado un aumento en la incidencia de EII en países en vías de desarrollo y de su prevalencia a nivel mundial, estando a la cabeza Norteamérica y Europa (prevalencia del 0,3%)21,22. Este fenómeno probablemente obedezca a diversas causas, entre las que se han incluido la exposición a determinados factores ambientales como la dieta occidental y la contaminación23, y el incremento global de la esperanza de vida24.
Alrededor del 25-30% de los pacientes con EII tienen más de 60 años, y es esperable su incremento considerando el envejecimiento poblacional y el aumento de la incidencia de EII en mayores de 60 años25–30. Diversos estudios han observado un incremento de la incidencia de EII a nivel mundial en población mayor de 60 años, alcanzando un 10-20% de los casos incidentes y constituyendo el grupo con un aumento más acusado en las últimas décadas de forma que los casos incidentes no descienden con la edad, fundamentalmente en regiones de nivel socioeconómico alto27,31–40. En esta población, la mejora en las técnicas diagnósticas y el mayor conocimiento de la EII podría haber reducido en la tasa de pacientes no diagnosticados23.
En la práctica clínica, existen 2 poblaciones bien diferenciadas de los pacientes mayores con EII: aquellos con diagnóstico en edad joven que envejecen con la enfermedad (EII de larga duración) y aquellos que han sido diagnosticados a una edad avanzada (conocidos como EII de comienzo tardío). Aunque todos los pacientes diagnosticados por encima de los 40 años se agrupan dentro del grupo A3 de la clasificación de Montreal (en el caso de la EC), sabemos que la EII de comienzo tardío se presenta de forma fenotípicamente diferente, con un curso evolutivo más indolente y un mayor riesgo de toxicidad farmacológica23,24.
Algunos estudios revelan que existe una mayor proporción de los pacientes de edad avanzada con CU frente a EC (4:1,5)36,39. Respecto a los casos de diagnóstico en edad adulta más joven, la EII de inicio tardío presenta un mayor predominio de localización cólica, menor tendencia al patrón penetrante y tasas menores de enfermedad perianal en la EC, y un predominio de formas distales en la CU39,41–43. Las características diferenciales en la presentación de la EII de inicio tardío se muestran en la tabla 2.
Diferencias entre los pacientes con diagnóstico de enfermedad inflamatoria intestinal de inicio tardío respecto a los adultos jóvenes
| > 60 años | 16-40 años | |
|---|---|---|
| Extensión | - EC: mayor afectación de colon- CU: mayor afectación distal | - EC: mayor afectación íleo-cólica- CU: mayor afectación extensa |
| Patrón de la EC | - Menos patrón penetrante- No cambios en el patrón | - Más patrón penetrante- Cambios en el patrón |
| Hospitalización | - Más frecuente | - Menos frecuente |
| Infecciones | - Más frecuencia de infecciones por Clostridioides difficile e infecciones oportunistas | - Menos frecuencia y menos graves |
| Cáncer | - Riesgo aumentado de LNH y cáncer cutáneo no melanoma asociados a fármacos | - Menor riesgo global |
CU: colitis ulcerosa; EC: enfermedad de Crohn; LNH: linfoma no Hodgkin.
En una revisión sistemática se analizaron estudios que comparaban la evolución de la EII en población con diagnóstico en edad adulta (<60 años) y edad avanzada (>60 años) y se observaron tasas similares de uso de esteroides. Sin embargo, el uso de inmunosupresores y biológicos fue menor en los pacientes de edad avanzada43. Aunque clásicamente se ha descrito una enfermedad más leve en estos pacientes, las tasas de cirugía e ingresos hospitalarios suelen ser más elevadas, lo que, asociado a un menor uso de terapias avanzadas, podría corresponder a un abordaje más conservador.
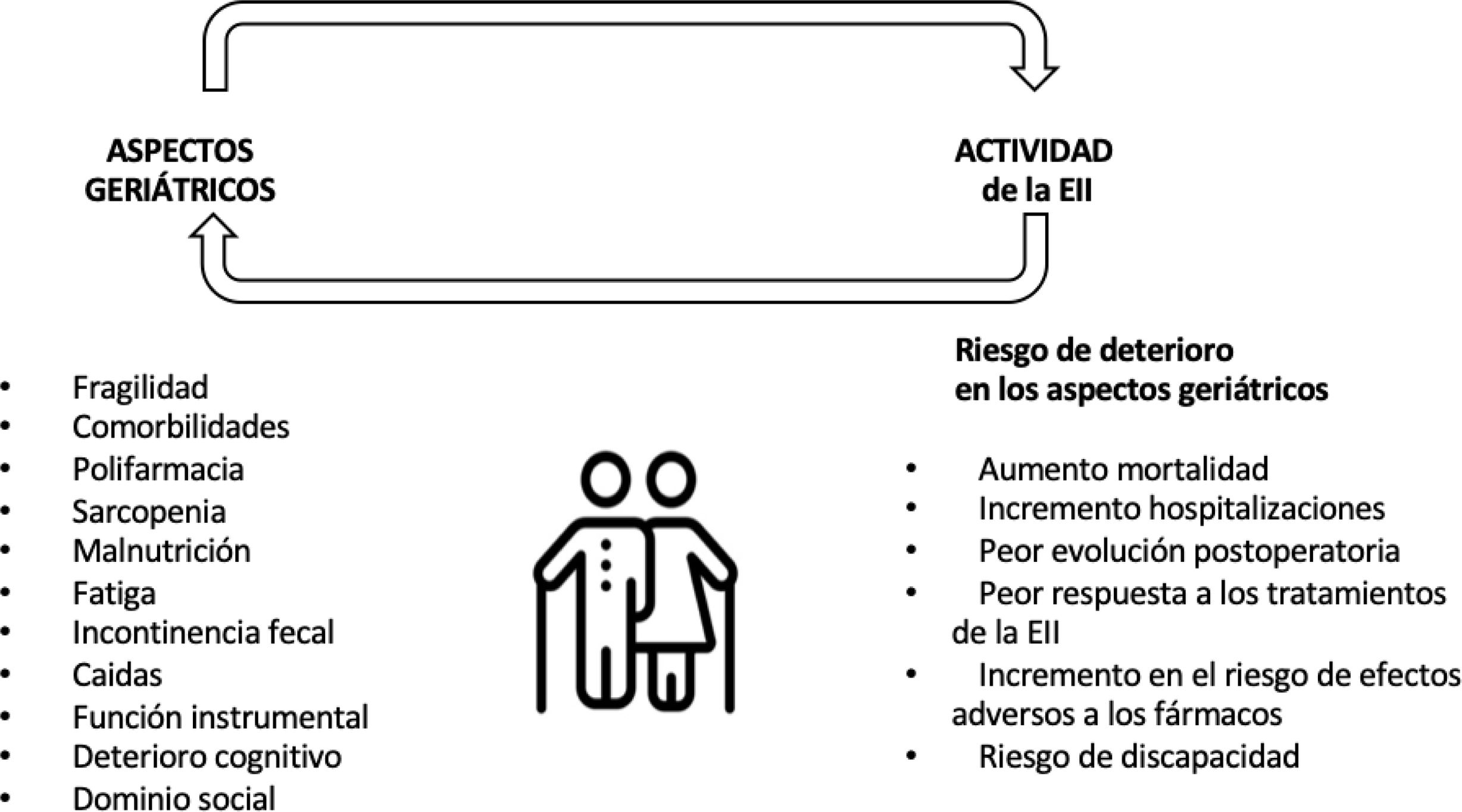
Fragilidad y su evaluación en la enfermedad inflamatoria intestinalLos pacientes con EII y edad avanzada presentan un incremento en la prevalencia de comorbilidades y polifarmacia y, por tanto, un mayor riesgo de desarrollar acontecimientos adversos. Por otra parte, los pacientes con EII desarrollan síndromes geriátricos como osteoporosis, fracturas de cadera, infecciones, neoplasias, así como también un incremento del riesgo de trastornos cognitivos y psicomotores, en edades más tempranas44–49 (fig. 3). Además, se ha constatado que los pacientes con EII presentan fragilidad a edades más tempranas, probablemente en relación a la inflamación crónica propia de la EII50. Sin embargo, la relación de causalidad entre fragilidad y EII es todavía controvertida. Aunque existen estudios que han observado que un fenotipo frágil puede favorecer el desarrollo de una EII51, también se ha reportado que la actividad de la EII interfiere en los estados de fragilidad y favorece su aparición52.
En una cohorte de 11.001 pacientes con EII de todas las edades, Kochar et al. observaron que la prevalencia de fragilidad se incrementaba con la edad, siendo del 4% entre los 20 y 29 años e incrementándose hasta el 25% en los pacientes mayores de 90 años53. Los resultados de un metaanálisis reciente que incluyó 9 estudios con un total de 1.495.695 pacientes mostraron una prevalencia de fragilidad en torno al 18% en los pacientes con EII54.
Los primeros estudios que evaluaron la fragilidad en la EII se realizaron en el ámbito quirúrgico y constataron que los pacientes más frágiles presentaban una mayor morbimortalidad y probabilidad de reintervención55–57. La relación entre fragilidad en la EII y el riesgo de infección es todavía controvertida; mientras algunos estudios sugieren un incremento del riesgo de infecciones asociadas al tratamiento anti-TNF e inmunosupresor57, otros no han hallado incremento alguno en el riesgo de infecciones graves o solo asociado a determinados tratamientos como vedolizumab58. Por último, también se ha descrito que los pacientes frágiles con EII presentan un mayor riesgo de hospitalización, y una disminución en la calidad de vida y estado funcional57,59.
Un reciente estudio prospectivo italiano sugirió que el único factor asociado a la fragilidad es la actividad de la EII60. Este mismo grupo mostró que la mejoría del fenotipo de fragilidad está directamente correlacionada con el uso de agentes biológicos e inversamente con la persistencia de la actividad clínica52. Este hecho ya había sido previamente observado en un estudio retrospectivo estadounidense de 1.210 pacientes con EII que iniciaban anti-TNF61, lo que refuerza el concepto de que la fragilidad es un estado dinámico que puede modificarse en relación a la actividad de la EII.
Índices de fragilidad en la EIIComo consecuencia de la falta de una definición ampliamente aceptada de fragilidad y de índices específicos y validados de fragilidad en los pacientes con EII, los estudios disponibles han utilizado índices diversos y los puntos de corte distintos para evaluar el grado de fragilidad. En los estudios que evalúan fragilidad en EII, mayoritariamente retrospectivos, se han empleado índices utilizando como principal fuente de datos los códigos diagnósticos (ICD) extraídos de las historias clínicas. Los principales índices de fragilidad y su punto de corte se resumen en la tabla 3. Más allá de los índices para evaluar la fragilidad, la evaluación geriátrica integral podría ayudar a determinar el estado funcional y de fragilidad del paciente con EII7,62. En un estudio reciente, el 40% de los pacientes con EII mayores de 65 años presentaba déficits moderados en su evaluación geriátrica63.
Recomendación:
- •
En los pacientes con EII mayores o con enfermedad activa, recomendamos evaluar la fragilidad regularmente y sugerimos el uso de herramientas sencillas como la escala de fragilidad clínica.
- •
En los pacientes con EII y fragilidad recomendamos priorizar el control de la actividad de la EII con el objetivo de mejorar la fragilidad.
Índices de fragilidad utilizados en los diferentes estudios de EII
| Autor, año | Índice de fragilidad | Definición de paciente frágil |
|---|---|---|
| Cohan et al.55, 2015 | «Frailty trait count» | Presencia de ≥1 de las 6 variables |
| Telemi et al.56, 2018 | Índice de Fragilidad modificado | Puntuación≥1 |
| Kochar et al.57, 2020 | Hospital Frailty Risk Score adaptado181 | ≥1 código ICD-9 relacionado con fragilidad |
| Qian et al.205, 2021 | Hospital Frailty Risk Score | Puntuación>5 |
| Faye et al.206, 2021 | Fragilidad por grupos | ≥1 código ICD-9-CM |
| Singh et al.58, 2021 | Hospital Frailty Risk Score | Puntuación>5 |
| Kochar et al.61, 2022 | Claims-based frailty index | Puntuación en el cuartil más alto en el período previo o posterior al tratamiento |
| Kochar et al.207, 2022 | Hospital Frailty Risk Score | 0-5 bajo riesgo de fragilidadPuntuación >5 alto riesgo de fragilidad |
| Salvatori et al.52,60, 2022-23 | Fried frailty phenotype | Puntuación≥3 |
| You et al.208, 2023 | Frail Scale validado en chino | Puntuación≥3 |
| Rozich et al.209, 2023 | Frailty index modificado | Puntuación≥2 |
| Zhang et al.51, 2023 | Fried frailty phenotype | Puntuación≥3 |
| Bedard et al.210, 2023 | Clinical frailty Scale | Puntuación≥4 |
| Wang et al.135, 2022 | Frailty Index | No especificado |
| Asscher et al.59, 2024 | Questionario G8 | Riesgo de fragilidad ≤14 |
El tratamiento de la EII en los pacientes de edad avanzada presenta desafíos únicos. Los pacientes de edad avanzada presentan una mayor susceptibilidad a experimentar efectos adversos con los fármacos utilizados para tratar la EII, lo que obliga a una monitorización más estrecha y una evaluación cuidadosa de riesgos y beneficios previo a su inicio61. La farmacocinética y farmacodinamia de los medicamentos pueden estar alteradas en los pacientes de edad avanzada debido a cambios fisiológicos asociados al envejecimiento, por lo que puede ser necesario el ajuste de dosis64 que podría influir en la eficacia terapéutica. Por otro lado, disponemos de pocos datos sobre el impacto de la fragilidad o comorbilidades sobre la eficacia y seguridad de los distintos fármacos. De hecho, la mayoría de ensayos clínicos excluyen pacientes con comorbilidades comunes observadas en los pacientes de edad avanzada65. Todo ello puede repercutir en la elección de objetivos terapéuticos menos ambiciosos en estos pacientes, lo cual, en último término, también puede repercutir en la evolución de la fragilidad y sus consecuencias.
AminosalicilatosConstituyen una buena alternativa terapéutica para el tratamiento de la CU por su eficacia y su excelente perfil de seguridad, por lo que constituyen el tratamiento más utilizado en los pacientes con CU de edad avanzada. El estudio TARGET-IBD, que incluyó casi 3.000 pacientes con EII, constató que en los pacientes de edad avanzada se utilizaban más aminosalicilatos y menos agentes antiTNF que en población joven66. Únicamente debe considerarse que la enfermedad cardiovascular y la diabetes68, pero no la edad67, pueden aumentar el riesgo de nefrotoxicidad por aminosalicilatos. Otro aspecto a considerar en pacientes de edad avanzada es que la administración tópica de aminosalicilatos puede resultar más dificultosa por el estado funcional del paciente y la mayor prevalencia de incontinencia fecal69,70.
CorticoidesLos corticoides todavía constituyen uno de los fármacos más ampliamente utilizados para el tratamiento de la EII. No obstante, existe una tendencia creciente a limitar su uso dada la elevada tasa de efectos adversos asociados, especialmente en tratamientos prolongados o repetidos. En los pacientes de edad avanzada con EII, la utilización de corticoides sistémicos es frecuente, habiéndose descrito en algunas series su uso como tratamiento de mantenimiento (tratamiento con prednisona superior a 6 meses) hasta en un tercio de esta población71. Esto es debido a la falsa percepción por parte de los médicos de que los corticoides son más seguros que las terapias avanzadas72 y contrasta con la elevada incidencia de eventos adversos relacionados, particularmente de infecciones graves en población de edad avanzada y tras uso prolongado (superior a 45 días)73. Respecto a la seguridad, es importante tener en consideración que tanto la edad (principalmente en mujeres) como el tratamiento con corticoides son factores de riesgo establecidos para el desarrollo de osteoporosis en los pacientes con EII74. En este sentido, son fundamentales su prevención mediante la suplementación con calcio y vitamina D y su diagnóstico precoz para prevenir fracturas osteoporóticas75.
TiopurinasA pesar de que en los ensayos clínicos con inmunosupresores y biológicos en EII se ha excluido la población de edad avanzada, disponemos de múltiples estudios en práctica clínica que sugieren que la eficacia del tratamiento tiopurínico no es inferior en esta población76,77. Por contra, la posibilidad de desarrollar efectos adversos asociados en población de edad avanzada motiva la limitación de su uso en los pacientes frágiles. En el registro poblacional francés EPIMAD la probabilidad acumulada de desarrollar efectos adversos asociados por inmunosupresores a 10 años fue del 27% en EC y 15% en CU35. En un estudio derivado del registro ENEIDA, se constató que en los pacientes de más de 60 años que iniciaban el tratamiento tiopurínico era más probable la aparición de mielotoxicidad y hepatotoxicidad, lo que condicionaba una menor persistencia del tratamiento78. Asimismo, en esta población se ha demostrado un mayor riesgo de desarrollar síndromes linfoproliferativos79 y otros tumores (tracto urinario, cutáneos)80–82.
BiológicosAnti-TNFSi bien algunos estudios iniciales sugerían una menor eficacia de los agentes antiTNF en edad avanzada83, estudios posteriores con seguimiento más amplio indican que la edad no es un factor determinante en su eficacia. En una comparación indirecta entre los distintos ensayos clínicos sobre anti-TNF en CU, no se demostró relación alguna entre la posibilidad de respuesta y la edad, pero sí con la posibilidad de desarrollar efectos adversos84. Algunos autores han sugerido que la hipotética peor respuesta a corto plazo a anti-TNF en los pacientes de edad avanzada pueda estar en relación con diferencias farmacocinéticas y otros factores relacionados con la edad23. Sin embargo, la aparición de efectos adversos asociados a agentes anti-TNF es más frecuente en población frágil y a menudo obliga a su retirada, lo que supone un sesgo a tener en cuenta en la valoración de la eficacia. De Jong et al. analizaron una cohorte de 895 pacientes con EII y encontraron que iniciar el tratamiento con anti-TNF a una edad más avanzada —lo cual suele implicar un inicio más tardío del tratamiento— se asociaba con una mayor probabilidad de fracaso terapéutico85. Sin embargo, cuando se tuvo en cuenta la causa de la suspensión del tratamiento, esta asociación se redujo, especialmente al diferenciar los casos en los que el fármaco se interrumpió por falta de eficacia frente a aquellos en los que se suspendió por efectos adversos.
Respecto a la seguridad, el tratamiento anti-TNF se ha asociado al incremento en la incidencia de infecciones y tumores en los pacientes mayores de 65 años y en los pacientes con comorbilidades respecto a población más joven e incluso respecto a población también de edad avanzada, pero sin exposición a anti-TNF86,87.
Por tanto, al igual que las tiopurinas, los agentes anti-TNF son tan eficaces en la población de edad avanzada como en los pacientes de menor edad, pero su perfil de seguridad obliga a individualizar su uso88.
VedolizumabVedolizumab, una anti-integrina de acción selectiva a nivel esplácnico, ha demostrado tanto en ensayos clínicos como en vida real un buen perfil de seguridad en el tratamiento de la EII89. Se ha sugerido que el uso de inmunosupresores más selectivos o con dianas menos ubicuas en el organismo podría tener ciertas ventajas en el paciente frágil. Sin embargo, los estudios sobre la seguridad de los tratamientos biológicos en el anciano arrojan resultados controvertidos ya que en su mayoría no observan diferencias en la tasa de infecciones entre los distintos agentes biológicos utilizados en EII en esta población89,90. Un estudio de cohortes que comparó directamente las tasas de infección entre vedolizumab y anti-TNF en los pacientes con EC mayores de 60 años no halló diferencias significativas tras un año de tratamiento91. No obstante, todos estos estudios presentan un sesgo de selección dada la tendencia a prescribir vedolizumab los en pacientes más frágiles, lo que podría influir en los resultados observados.
A pesar de las limitaciones mencionadas, dado el buen perfil de seguridad de vedolizumab en la población general y la mayor susceptibilidad de los pacientes de edad avanzada para desarrollar efectos adversos asociados a agentes anti-TNF, las recomendaciones de expertos siguen priorizando su uso en esta población92.
Inhibidores anti-IL-12 y 23De forma similar a lo comentado con vedolizumab, el buen perfil de seguridad de estos fármacos ha facilitado su posicionamiento teórico en líneas más precoces de tratamiento de la EII del paciente frágil. No se han objetivado diferencias en cuanto a las tasas de infección grave o de retirada de tratamiento por eventos adversos en los pacientes de edad avanzada93. La eficacia y seguridad del tratamiento con ustekinumab en EC han sido valoradas en diversas cohortes reuniendo un número elevado de pacientes y no se han observado diferencias ni en la respuesta al fármaco ni en la persistencia del tratamiento en los pacientes de edad avanzada94,95.
Por otro lado, los datos acerca de la eficacia y seguridad de risankizumab en población de edad avanzada son por el momento muy limitados dada su reciente aprobación para el tratamiento de la EII. A diferencia de otros fármacos, en los estudios de aprobación se permitió la inclusión de los pacientes de edad avanzada, aunque la edad media de los pacientes no superaba los 40 años, lo que no permitió un análisis adecuado por subgrupos de edad96–98. Sin embargo, se dispone de datos en psoriasis, en la que no se objetivan mayores efectos adversos en los pacientes de edad avanzada99. Con este mismo mecanismo de acción y, por tanto, con un perfil de seguridad similar ya se dispone de mirikizumab y, previsiblemente, guselkumab, con indicación en EII.
Inhibidores JAKEn cuanto a la eficacia de estos fármacos en los pacientes de edad avanzada, la evidencia en vida real es modesta. En los estudios de aprobación de tofacitinib y filgotinib el número de pacientes de edad avanzada incluidos fue escaso, pero no se intuyeron diferencias en cuanto a eficacia en este grupo de edad frente a población más joven100,101. Sin embargo, la utilización de estos fármacos debe realizarse con cautela dado que algunos de los efectos adversos asociados (infecciones, eventos cardiovasculares mayores y fenómenos tromboembólicos) son más frecuentes en los pacientes de edad avanzada102. Además, otro aspecto a tener en cuenta con el uso de estos fármacos en los pacientes con edad avanzada es su metabolismo renal (y también hepático en el caso de tofacitinib). Esto implica el ajuste de dosis en caso de insuficiencia renal o hepática y el mayor riesgo de interacción farmacológica, aspecto destacable en los pacientes con polifarmacia99.
Respecto a tofacitinib, el aumento de eventos cardiovasculares mayores en los pacientes con artritis reumatoide en ensayos clínicos, principalmente en los pacientes ≥ 65 años, condicionó una alerta de la European Medicines Agency restringiendo su uso en los pacientes de edad avanzada o que presenten factores de riesgo cardiovascular solo cuando se hayan agotado otras alternativas terapéuticas103,104. Sin embargo, en estudios de seguridad a largo plazo posteriores y de nuevo en los pacientes con artritis reumatoide no se constató un mayor riesgo de eventos cardiovasculares en los pacientes de edad avanzada a la dosis de 5mg/cada 12h105. En un metaanálisis reciente donde se analizó la seguridad de estos fármacos en los ensayos clínicos, tampoco se observó un mayor riesgo de eventos cardiovasculares con el uso de tofacitinib o upadacitinib frente a placebo o aumentado respecto a otros tratamientos biológicos106.
En lo que concierne a la posibilidad de sufrir fenómenos tromboembólicos, estudios poscomercialización de la Food and Drug Administration sugieren que la incidencia parece ser mayor con tofacitinib que con otros inhibidores de JAK más selectivos (como upadacitinib o filgotinib) en los pacientes mayores de 65 años107,108.
Otro aspecto esencial a tener en cuenta al iniciar estos tratamientos en los pacientes de edad avanzada es el riesgo de infecciones, principalmente herpes zóster. Esta infección se asocia a un incremento de la comorbilidad por la posibilidad de neuralgia posherpética y la polifarmacia por el consecuente uso de analgésicos mayores a medio y largo plazo109. Por tanto, es necesario implementar las medidas preventivas recomendadas para el uso de tratamientos inmunosupresores, con especial atención a la vacunación contra el herpes zóster en la edad avanzada110.
Moduladores del receptor de esgingosina-1-fosfatoLos moduladores del receptor de esfingosina-1-fosfato (S1P), como ozanimod y etrasimod, han emergido como una nueva opción terapéutica para la CU. Estos agentes actúan modulando la migración linfocitaria desde los ganglios linfáticos111,112. Sin embargo, la evidencia sobre su eficacia y seguridad en los pacientes de edad avanzada o con fragilidad es muy limitada. Antes de iniciar el tratamiento con inhibidores S1P en los pacientes de edad avanzada o frágiles con EII es fundamental considerar algunos aspectos para minimizar riesgos. Estos fármacos pueden causar bradicardia transitoria y alteraciones en la conducción cardíaca, por lo que se recomienda realizar un electrocardiograma basal y, en los pacientes con antecedentes cardiovasculares, una evaluación cardiológica previa. Debido a su mecanismo de acción, estos fármacos aumentan el riesgo de infecciones oportunistas; en este sentido, es esencial evaluar el estado de vacunación del paciente con especial atención a la inmunización contra varicela, neumococo y COVID-19, así como descartar tuberculosis latente y otras infecciones crónicas antes de iniciar el tratamiento113, al igual que con el resto de tratamiento biológicos. Por último, debe realizarse la monitorización de la función hepática antes y durante el tratamiento, así como una evaluación oftalmológica en los pacientes con diabetes y/o uveítis con riesgo a tener edema de papila.
En conclusión, el uso de moduladores de S1P en los pacientes frágiles o de edad avanzada requiere una evaluación exhaustiva y un seguimiento estrecho para minimizar complicaciones.
Otras terapiasLa aféresis por adsorción de granulocitos (GMA) es una técnica no farmacológica que consiste en la circulación extracorpórea de la sangre a través de una columna con microesferas que eliminan selectivamente granulocitos y monocitos activados, reduciendo así la inflamación intestinal. En los pacientes con EII de edad avanzada o en situación de fragilidad, donde el riesgo de efectos adversos por inmunosupresores y corticoides es mayor, la GMA puede representar una opción terapéutica segura. Esta estrategia permite controlar la inflamación sin incrementar significativamente el riesgo de infecciones o neoplasias. Disponemos de datos que han demostrado que la GMA puede inducir remisión clínica en un porcentaje considerable de pacientes mayores con CU moderada o grave, con un perfil de seguridad favorable y sin eventos adversos graves, incluso en presencia de múltiples comorbilidades114.
Tratamiento en los pacientes con enfermedad inflamatoria intestinal y comorbilidades concretasComo ya se ha comentado, la comorbilidad suele ser un criterio de exclusión en la mayoría de ensayos clínicos, lo que limita la evidencia de su uso en determinadas situaciones. El antecedente de neoplasia que, independientemente de la edad, debe considerarse en la elección del tratamiento inmunosupresor, ha sido evaluado en un estudio ENEIDA que analizó la seguridad de iniciar tratamiento inmunosupresor (tiopurinas y/o anti-TNF) en los pacientes con antecedente de neoplasia115, sin observar un mayor riesgo de presentar recurrencia de la neoplasia previa ni el diagnóstico de un nuevo cáncer, siempre que el inicio del tratamiento sea tras un mínimo de 2 años de haber finalizado el tratamiento oncológico. Estos hallazgos se ven reforzados por el estudio prospectivo SAPPHIRE, que incluyó pacientes con EII y antecedentes de cáncer, sin encontrar un aumento significativo en el riesgo de cáncer incidente tras la exposición a inmunosupresores, incluyendo biológicos y pequeñas moléculas. Estos datos apoyan la seguridad de estas terapias en los pacientes seleccionados116. Por otra parte, las nuevas terapias más selectivas podrían ser incluso más seguras en este contexto, y las guías clínicas recomiendan su uso frente a tiopurinas y anti-TNF117.
CirugíaPese a que a priori el paciente frágil constituye un peor candidato a cirugía por la morbilidad asociada, los estudios disponibles indican que existe una mayor tasa de cirugía (tanto en CU como en EC) en la población de edad avanzada, principalmente poco después del diagnóstico41,118, lo que podría demostrar cierta infrautilización del tratamiento médico adecuado para la EII.
Por otro lado, los pacientes frágiles candidatos a cirugía deberían seguir una preparación prequirúrgica óptima para reducir al máximo el riesgo de complicaciones postquirúrgicas119, incluyendo la evaluación y optimización del estado nutricional y evitar el uso de esteroides120. Lamentablemente, no existen protocolos específicos para el manejo perioperatorio en los pacientes con EII. Una revisión sistemática reciente constató la falta de evidencia sobre la utilidad de la implementación de un protocolo Enhanced Recovery After Surgery en estos pacientes121, a pesar de haber demostrado sus beneficios en los pacientes sometidos a cirugía colorrectal.
Recomendación:
- •
Recomendamos considerar las limitaciones funcionales y la posible incontinencia fecal en lospacientes de edad avanzada ante el uso de tratamientos por vía tópica y tener en cuenta el soporte familiar.
- •
En los pacientes de edad avanzada o frágiles, se recomienda evitar el uso de corticoides sistémicos en la medida de lo posible e implementar el diagnóstico precoz y medidas de prevención de la osteoporosis.
- •
Sugerimos considerar la sustitución de tiopurinas y agentes anti-TNF por alternativas terapéuticas más seguras en los pacientes de edad avanzada debido a su mayor potencial carcinogénico.
- •
Sugerimos priorizar el uso de vedolizumab y bloqueadores de la vía IL-23 o IL-12-23 en lospacientes con EII edad avanzada o frágiles con indicación para terapias avanzadas.
- •
Recomendamos usar los inhibidores de JAK con cautela en lospacientes de edad avanzada o frágiles, debido a su mayor riesgo de infecciones, eventos cardiovasculares mayores y fenómenos tromboembólicos.
- •
Recomendamos valorar el uso de GMA en lospacientes frágiles o de edad avanzada con EII corticodependientes por su seguridad.
- •
Recomendamos aplicar las medidas preventivas generales aconsejadas en el tratamiento con biológicos e inmunosupresores, priorizando la vacunación contra el herpes zóster.
- •
En lospacientes frágiles con EII candidatos a cirugía, recomendamos optimizar la preparación prequirúrgica, incluyendo evaluación y suplementación nutricional y evitar el uso de esteroides; sugerimos la implementación sistemática de protocolos de recuperación postoperatoria rápida en estos pacientes.
La nutrición en personas con EII es un aspecto muy importante, con matices específicos en los pacientes frágiles. La prevalencia de desnutrición se encuentra incrementada en los pacientes de edad avanzada y más aún ante la existencia de fragilidad, por la combinación de múltiples factores122. Así, la edad avanzada en sí misma está asociada con cambios fisiológicos en la composición corporal, producto del envejecimiento123. También es frecuente la coexistencia de comorbilidades importantes (diabetes, enfermedades pulmonares, renales, hepáticas, cardio o cerebrovasculares y trastornos neurológicos) y, en ocasiones, ingresos hospitalarios. Otro factor asociado con frecuencia suele ser la pérdida de apetito o las modificaciones del patrón dietético por dificultades en la masticación124,125. Tampoco debemos olvidar el papel que desempeñan los factores neuropsiquiátricos (depresión, ansiedad o deterioro cognitivo)126 o sociales (soledad, aislamiento, imposibilidad para comprar o cocinar y llevado al extremo, la dependencia), que pueden llevar a la pérdida de peso y malnutrición, incluso en ausencia de otros problemas orgánicos. En el caso de los pacientes frágiles o de edad avanzada con EII, todo esto se puede ver agravado por la enfermedad digestiva, aunque los escenarios individuales potenciales son muy diversos, en función de factores relacionados con la propia EII (localización y actividad de la EII, cirugías previas). La interacción entre inflamación, comorbilidad y fragilidad determina en gran medida el efecto en el estado nutricional. Corregir la malnutrición de un paciente frágil puede mejorar su fragilidad, esencialmente a través de su dominio físico, por lo que indirectamente puede minimizar los riesgos de algunos tratamientos de la EII y optimizar sus resultados en salud.
Evaluación diagnóstica del estado nutricional en el paciente frágilEn los pacientes con EII (y con mayor motivo en los de edad avanzada o frágiles) debe realizarse una valoración nutricional que puede ir seguida de una valoración más profunda que incluya la evaluación de la composición corporal. Los métodos de cribado de malnutrición (e incluso los criterios diagnósticos) inciden en medidas clínicas «groseras» como el índice de masa corporal (IMC) y la pérdida de peso. Así, en el estado de salud, el IMC presenta una buena correlación con la composición corporal y por ello es ampliamente utilizado como criterio de clasificación e incluso de pronóstico. Sin embargo, en los estados de enfermedad se pierde parte de esa correlación. Por un lado, en los pacientes de edad avanzada o con enfermedades orgánicas crónicas establecidas se puede dar la «paradoja de la obesidad» (IMC más altos se correlacionan con mejores pronósticos). Por otro, en la desnutrición relacionada con enfermedad se pierde la linealidad, en diferentes sentidos, en la relación entre IMC y masa grasa o masa magra, dificultando estimar a partir del IMC, la masa magra y muscular127. La valoración nutricional requiere como mínimo una adecuada exploración física (antropometría), anamnesis dirigida (evaluación de la ingesta), analítica con determinación de parámetros nutricionales (pre-albúmina) y vitamínicos, e idealmente se completará con alguna prueba complementaria para valorar objetivamente la composición corporal127. Las pruebas útiles en este sentido podrían ser la bioimpedancia eléctrica, dual energy X-ray absorptiometry (DEXA), tomografía computarizada (TC) y resonancia magnética (RM), así como quizá la ecografía, con importancia emergente en este campo (tabla 4).
Herramientas prácticas de valoración de la composición corporal
| Permite o se basa en… | Ventajas | Inconvenientes | Otros | |
|---|---|---|---|---|
| Antropometría | Exploración física. Diversas fórmulas propuestas | Sencillez, mínimo coste, disponible | Consume tiempo, es poco reproducible | Permite fácilmente monitorizar |
| Bioimpedancia eléctrica | Diferente resistencia de los tejidos al paso de una corriente eléctrica | Sencillo, aparataje mínimo, no invasivo, barato | En estados de desnutrición, al depender de ecuaciones de regresión y del estado de salud del paciente, las estimaciones individuales (de composición corporal) son menos precisas | Interés creciente por el valor en el diagnóstico nutricional de los parámetros eléctricos crudos (y el análisis vectorial), independientes de las ecuaciones de regresión |
| DEXA | Absorción de la radiación diferente según los tejidos. | Precisa y rápida, no necesario post procesamiento. Valoración directa | Necesidad de aparataje y software específico (escasa disponibilidad) | Analiza la cantidad de grasa, hueso y masa magra, de forma conjunta y por áreas anatómicas |
| TC | Absorción radiación según umbrales (unidades Hounsfield) | Posibilidad de uso sobre exploración realizada por otro motivo («oportunista»)Valoración directa | Radiación | Patrón oroDiversos parámetros potenciales (SMA, SMI, PMI) |
| RM | Similar a la TC (diferentes unidades) | Posibilidad de uso sobre exploración realizada por otro motivo. Valoración directa. No radiación | Disponibilidad | Similar a la TC |
| Ecografía nutricional | Medición de diversas áreas | Disponibilidad. No radiación, sencillez | No estandarizada |
PMI: índice de psoas, o suma de las áreas seccionales del músculo psoas ilíaco a la altura de L3 dividido por la altura al cuadrado; RM: resonancia magnética; SMA: área muscular total; SMI: área muscular total indexada al cuadrado de la altura; TC: tomografía computarizada.
Nota: también se pueden calcular el área de grasa total, el área de grasa visceral y la grasa intramuscular (con la TC mediante segmentación por unidades Hounsfield. De hecho, se elige L3 porque es la zona que mejor representa globalmente esos 3 compartimentos).
El abordaje nutricional en estos pacientes, incluso más que en el resto de sujetos con EII, tiene que ser multidisciplinar, conjuntamente con expertos en nutrición y otros especialistas. Tras evaluar la situación nutricional se plantearán objetivos y alternativas para conseguirlos. Las herramientas de las que disponemos son la dieta y sus adaptaciones, la suplementación nutricional e incluso el ejercicio físico. Por supuesto, la actividad de la EII es una causa importante de malnutrición por lo que debe tenerse siempre presente, indicando el tratamiento adecuado.
Dieta en los pacientes frágiles con enfermedad inflamatoria intestinalDe forma general, la dieta como tratamiento en la EII tiene un interés creciente, con estudios de mejor calidad, pero con resultados difíciles de interpretar. En el paciente frágil con EII carecemos de estudios específicos. El objetivo principal en estos casos es normalizar la situación nutricional para mejorar la fragilidad. Las dietas evaluadas como tratamiento de la EII en general son diversas, siendo la dieta mediterránea la que está ganando un mayor protagonismo, al menos por sus efectos beneficios adicionales sobre la salud en general. En el paciente frágil individual, las recomendaciones tendrán en cuenta tanto el estado nutricional como la situación específica de la EII y sus comorbilidades. Las necesidades energéticas son, en general, de 30 a 35kcal/kg de peso por día, utilizando el peso corregido en valores extremos de IMC. El aporte de proteínas diario recomendado en los pacientes con EII en remisión es de 1mg/g/día y de 1,2 a 1,5g/kg/día si la enfermedad está activa128. Por supuesto, se deben corregir déficits específicos, como la ferropenia, el déficit de vitamina B12 o folatos. Para conseguir cubrir todas estas necesidades, como «dieta base» de los pacientes frágiles con EII sugerimos el uso de la dieta mediterránea, con las modificaciones individuales necesarias. Así mismo, puede ser necesario llevar a cabo adaptaciones de la dieta, como la modificación de la consistencia de los alimentos o el cambio de las fuentes proteicas, por otras de alto valor biológico. Por supuesto, se tendrán en cuenta los gustos y preferencias del paciente, sino nuestras recomendaciones estarán condenadas al fracaso.
Suplementos nutricionales en los pacientes frágiles con enfermedad inflamatoria intestinalLos suplementos nutricionales pueden ser necesarios para complementar a la dieta cuando existe desnutrición (criterios Global Leadership Initiative on Malnutrition [GLIM]-completos) o riesgo de presentarla (criterios GLIM incompletos o test de cribado positivo de desnutrición sin cumplir criterios GLIM) y si esta situación no mejora con medidas de adaptación de la dieta (incremento de su aporte calórico o proteico y de su palatabilidad o digestibilidad)129. Los suplementos nutricionales orales recomendados son los poliméricos, en general hipercalóricos e hiperproteicos, para que con uno o 2 suplementos al día pueda conseguirse un efecto nutricional sin reducir la ingesta alimentaria previa. Podría existir una cierta ventaja de los suplementos con alteraciones cualitativas y cuantitativas de la grasa en fases de actividad de la enfermedad (reducción de triglicéridos de cadena larga y <20g de grasa por 1.000 calorías) pero ninguna diferencia en fases quiescentes. Los suplementos enriquecidos en leucina podrían tener un mayor efecto ergogénico (en los pacientes frágiles sarcopénicos) y los enriquecidos en omega 3 una mayor modulación inflamatoria, pero en ambos casos pueden tener una peor palatabilidad que puede disminuir la adherencia y por tanto su efecto130.
Actividad físicaEl ejercicio o actividad física, adaptado a las posibilidades reales individuales, resulta muy útil. Aunque se olvida con frecuencia, bien utilizado tiene efectos beneficiosos en el estado nutricional a través de diversos mecanismos. Mejora específicamente la sarcopenia, aumenta el apetito y añade otros efectos positivos sobre la salud general. Estudios recientes sugieren que la ingesta adecuada de proteínas previene la pérdida de masa muscular y podría evitar el círculo vicioso desnutrición-fragilidad130. La actividad física será un buen aliado de la dieta.
Recomendaciones:
- •
Recomendamos evaluar el estado nutricional con exploración física, análisis de ingesta y medición de parámetros nutricionales (pre-albúmina) y vitamínicos.
- •
Recomendamos priorizar la dieta mediterránea en lospacientes con EII, debido a sus beneficios adicionales para la salud.
- •
Recomendamos ajustar el requerimiento energético a 30-35kcal/kg/día, asegurar un aporte proteico adecuado con 1g/kg/día en remisión y 1,2-1,5g/kg/día en enfermedad activa y corregir déficits nutricionales específicos.
- •
Recomendamos utilizar suplementos nutricionales orales poliméricos, hipercalóricos e hiperproteicos, 1 o 2 al día, sin sustituir la alimentación habitual.
El término sarcopenia proviene del griego y significa «escasez de carne» y fue acuñado por primera vez en 1989 para definir la pérdida de músculo. Inicialmente carecía de una definición y criterios de diagnóstico, pero posteriormente se ha establecido como una entidad diferenciada (código M62)131,132. Así, la sarcopenia se define como un trastorno progresivo y generalizado del músculo esquelético con una reducción significativa de la masa muscular, asociada a pérdida de fuerza y rendimiento físico.
La prevalencia de la sarcopenia en la EII parece ser superior a la de la población general. De acuerdo con una revisión sistemática reciente, un tercio de los pacientes adultos con EII presentaría miopenia y presarcopenia y casi una quinta parte, sarcopenia133. En el caso de pacientes con EII frágiles o de edad avanzada, esta prevalencia se intuye todavía mayor. En general, la sarcopenia implica pérdida de autonomía, un mayor riesgo de caídas y fracturas, hospitalizaciones e incluso de mortalidad, con el consiguiente aumento en los gastos sanitarios. En los pacientes frágiles o con comorbilidades, estas consecuencias negativas resultan evidentes, incrementando su vulnerabilidad134,135. Resulta muy complicado diferenciar el efecto de la edad, fragilidad, comorbilidades y sarcopenia, pero esta última se ha asociado a una mayor tasa de recaídas y una menor tasa de remisión en los pacientes con EII, independientemente de la edad y fragilidad136,137. Otros estudios sugieren que los riesgos o efectividad de algunos tratamientos, incluidos inmunomoduladores y biológicos, podría verse modificada, de forma independiente, por la sarcopenia138. También se ha relacionado con un aumento en las complicaciones postoperatorias. El porqué de estos potenciales efectos negativos se desconoce, pero es interesante recordar que el músculo parece desempeñar algunas funciones relacionadas con la regulación de la inflamación y quizás el sistema inmune139.
Mecanismo de aparición de la sarcopenia en la población general y en la enfermedad inflamatoria intestinalLa masa muscular se mantiene mediante un equilibrio regulado entre la síntesis y la degradación de proteínas y la alteración de este equilibrio puede conducir a la sarcopenia. De acuerdo con los factores que causan un deterioro en la cantidad y calidad muscular, la sarcopenia se clasifica en primaria (propia del envejecimiento) o secundaria (asociada a enfermedades crónicas inflamatorias, neoplásicas, neurológicas o a inactividad y desnutrición). La sarcopenia primaria es una manifestación fisiológica del envejecimiento (se estima una pérdida de 1-2% de masa muscular anual a partir de los 50 años). La sarcopenia secundaria asociada a enfermedades inflamatorias puede ser consecuencia de varios factores. El primero, y posiblemente el principal, es la liberación de citocinas proinflamatorias con efectos negativos sobre el músculo, como el TNF-α o la interleucina-6 (IL-6), que promueven su degradación. El segundo, una reducción de niveles de IGF-1 (que implica catabolismo de proteínas musculares) que pueden ser normalizados por algunos tratamientos como los anti-TNF140,141 y, el tercero, la desnutrición. No obstante, si bien la desnutrición se asocia con sarcopenia en estudios de cohortes en los pacientes de edad avanzada142,143 los datos en la EII no son tan homogéneos y es posible que la interacción entre factores sea más compleja. Así, en un estudio en 88 pacientes con EC, el 21% presentaba malnutrición mientras que casi el 33% presentaba sobrepeso. La mayoría de los pacientes con miopenia tenían un IMC normal o sobrepeso/obesidad (49 y 16%, respectivamente)144, datos replicados en otra cohorte similar145. La correlación entre el IMC y el índice de músculo esquelético en la EII es «regular» y muchos pacientes con sarcopenia pueden tener un IMC normal.
Evaluación diagnóstica de la sarcopenia en la enfermedad inflamatoria intestinalLa identificación precoz de la sarcopenia es importante para que cualquier intervención sea efectiva. El cribado es posible mediante algunas herramientas, a destacar el cuestionario simple SARC-F C, autovalorado por el paciente. Este cuestionario interroga por el «grado de dificultad» que supone a un adulto mayor realizar 4 actividades funcionales (tabla 5). Su puntuación oscila entre 0-10 puntos; si es mayor o igual a 4 sugiere sarcopenia. Cuando el paciente es incapaz de levantar 4,5kg, subir un tramo de 10 escaleras, cruzar una habitación o levantarse de la silla, muy probablemente la sarcopenia es grave. Es relativamente específico, aunque poco sensible146.
Test de cribado de la sarcopenia SARC-F
| Componente | Pregunta/ítem | Puntuación |
|---|---|---|
| Fuerza | ¿Qué grado de dificultad tiene para levantar y cargar con 4,5kg? | Ninguna dificultad=0Alguna dificultad=1Mucha o incapaz=2 |
| Asistencia en el paseo | ¿Qué grado de dificultad tiene para cruzar caminando por una habitación? | Ninguna dificultad=0Alguna dificultad=1Mucha o incapaz sin ayuda=2 |
| Levantarse de una silla | ¿Qué grado de dificultad tiene para levantarse desde una silla o cama? | Ninguna dificultad=0Alguna dificultad=1Mucha o incapaz sin ayuda=2 |
| Subir escaleras | ¿Qué grado de dificultad tiene para subir 10 escaleras? | Ninguna dificultad=0Alguna dificultad=1Mucha o incapaz=2 |
| Caídas | ¿cuántas veces se ha caído en el último año? | Ninguna=01-3=1≥4=2 |
Fuente: Malmstrom et al.146.
Tras el cribado, una valoración más exhaustiva, confirmará y valorará la gravedad de la sarcopenia, así como sus consecuencias para el paciente. Se propone llevarlo a cabo en 3 fases, también mediante diversas herramientas, algunas muy sencillas y otras más complicadas:
- •
Evaluación de la fuerza muscular: es el síntoma guía inicial. Normalmente se cuantifica la fuerza de agarre de mano (hand-grip) mediante un dinamómetro, por su sencillez y correlación moderada con la fuerza de otros compartimentos musculares. Otra alternativa sencilla es el «test de la silla», en el que se solicita al sujeto que se levante 5 veces de una silla estándar sin apoyo y con los brazos flexionados y se cronometra el tiempo (otra alternativa es el número de veces que puede hacerlo en 30s).
- •
Evaluación de la masa muscular: se puede evaluar directamente mediante TC, RM o DEXA, o indirectamente mediante análisis de impedancia bioeléctrica u otras técnicas. La normalidad hay que adaptarla al morfotipo del sujeto, altura e IMC. Dada la frecuencia con la que se dispone de TC o RM de abdomen en los pacientes con EII, esto permitiría valorar la masa muscular. En este caso, se suele medir el área muscular a nivel de L3 por su buena correlación con la masa muscular total.
- •
Evaluación del rendimiento físico: integra capacidad muscular con estado cardiorrespiratorio y sistema nervioso. La velocidad de la marcha es una medida sencilla del rendimiento físico, con capacidad de predicción de resultados adversos relacionados con la sarcopenia. Se ha propuesto que una evaluación compuesta de velocidad de la marcha, prueba de soporte en silla y prueba de equilibrio permite evaluar el rendimiento físico de forma sencilla y relativamente rápida130.
El manejo de la sarcopenia, al igual que en el paciente con desnutrición y EII, debe considerar tanto la fragilidad como el estado nutricional y la propia EII. Optimizaremos el estado nutricional (dieta y suplementos si es preciso), recomendaremos actividad/ejercicio físico adaptados y trataremos la EII, ya que controlar la inflamación mejora la sarcopenia, a través de diversos mecanismos.
Dieta y suplementosEn el paciente con sarcopenia se debe asegurar una ingesta adecuada de proteínas para la regeneración y el mantenimiento muscular. Para ello, la dieta debe incluir fuentes proteicas como carnes rojas, pescado, pollo, huevos y legumbres. En caso de dificultad para alcanzar las necesidades requeridas se podría considerar la suplementación de proteínas e incluso aminoácidos esenciales. Los datos sobre el efecto de la suplementación con proteínas en la salud muscular en los pacientes con EII son muy limitados y no siempre homogéneos147. También se asegurará un aporte adecuado de las vitaminas y minerales especialmente relacionados con la salud muscular, como la vitamina D y el calcio. En este sentido, aunque se trata de un grupo de pacientes muy diferente, la suplementación de vitamina D (2.000UI/día de colecalciferol, durante un período promedio de 14 meses) en niños con EII mejoró tanto su densidad mineral ósea (DMO) como su potencia muscular148.
Ejercicio físicoLos datos disponibles sugieren que realizar actividad física puede mejorar la sarcopenia, si bien los estudios en los pacientes de edad avanzada o frágiles con EII son mínimos. Así, un estudio piloto en los pacientes con EC inactiva o con actividad leve, demostró que el entrenamiento muscular durante 3 meses mejoró la fuerza y la calidad de vida, sin efecto sobre la actividad de la enfermedad149. Un ensayo controlado en los pacientes con EC, aleatorizados a un programa de entrenamiento de resistencia e impacto o a una vida sedentaria durante 6 meses, confirmó que los pacientes incluidos en el programa de ejercicio tuvieron una DMO y función muscular significativamente mejores que los pacientes del grupo control150. En general, la actividad o el ejercicio que recomendemos será más eficaz si se orienta a la mejora de la fuerza y resistencia muscular, cuyos pueden esperarse tras 10-12 semanas de entrenamiento. El ejercicio aeróbico no suele ser realista en estos pacientes y su efecto positivo quizá menor. Dentro de la estrategia de promoción de la salud y calidad de vida en la Unión Europea, disponemos del proyecto Vivifrail, ampliamente utilizado, que consiste en diferentes tablas de ejercicios dirigidas y adaptadas a las personas mayores de fácil aplicación para poderlas realizar en domicilio151.
Recomendaciones:
- •
Recomendamos evaluar el rendimiento físico de forma sencilla y rápida con la velocidad de la marcha, prueba de soporte en silla y prueba de equilibrio
- •
En caso de sarcopenia, recomendamos asegurar la ingesta de proteínas y fomentar el entrenamiento de fuerza con ejercicios durante al menos 10-12 semanas para lograr mejoras en la fuerza y resistencia muscular. Para ello sugerimos utilizar programas adaptados como Vivifrail para facilitar la realización de ejercicios en domicilio.
La comorbilidad se define como la presencia de una o más enfermedades o trastornos adicionales que coexisten con una enfermedad primaria en un mismo paciente, independientes o no de la enfermedad primaria. La comorbilidad puede influir en el curso clínico, el pronóstico, y el tratamiento de la EII. En los pacientes de edad avanzada con EII, la presencia de comorbilidades supera el 13%56; lo que podría estar relacionado con la inflamación asociada al envejecimiento152,153. Además, la multimorbilidad se asocia a una mayor complejidad en el manejo clínico, así como a una reducción de la calidad y de la esperanza de vida.
Independientemente de la edad, las comorbilidades suelen suponer un criterio de exclusión en ensayos clínicos, lo que conlleva su infrarrepresentación y una importante laguna en la evidencia disponible53,154. De hecho, se ha descrito que en los pacientes con EII de edad avanzada, son las comorbilidades- y no la edad- las que se asocian a un retraso en el inicio de los tratamientos inmunosupresores, especialmente en EC155.
Los pacientes con EII y comorbilidades tienen más probabilidades de sufrir algunas complicaciones, como trombosis, en comparación con los que no presentan comorbilidades156. Varios estudios han demostrado un mayor riesgo de enfermedad cardiovascular en los pacientes con EII, junto con factores de riesgo no tradicionales encontrados en la población general, como una edad más joven, el sexo femenino y la actividad de la EII 157,158. En este contexto, se ha observado que el control de la inflamación con agentes como los anti-TNF podría contribuir a reducir el riesgo cardiovascular, más allá de su efecto inmunológico directo 159.
En relación con las enfermedades metabólicas, estudios recientes indican que los pacientes con EII tienen el doble de riesgo de desarrollar diabetes tipo 2160–163. Se ha planteado la hipótesis que las alteraciones de la microbiota intestinal podría ser la causa 161, aunque la correlación causal no está bien establecida. Los cambios en la microbiota intestinal pueden conducir a cambios en la inmunidad local y sistémica que podrían dar lugar a trastornos sistémicos como la obesidad, la aterosclerosis o la diabetes. De hecho, en las últimas décadas está aumentando la prevalencia de obesidad en los pacientes con EII, estimándose que entre el 15-40% de los pacientes adultos con EII son obesos, sin diferencias según el tipo de EII164,165.
El riesgo de neoplasias también se ve incrementado en los pacientes con EII independientemente del tratamiento166. Diversos estudios describen que la población con EII presenta un mayor riesgo de tumores por la propia inflamación crónica —como en el caso del cáncer colorrectal y del colangiocarcinoma—117. La edad avanzada es un factor de riesgo independiente para muchos cánceres asociados a la EII y a su tratamiento, especialmente con tiopurinas 84. Por otro lado, una revisión sistemática y un metaanálisis más reciente167 mostraron que el riesgo global de cáncer en los pacientes con EII de edad superior a 60 años no aumentaba con el uso de anti-TNF [OR: 0,90; IC 95%: 0,64-1,26].
Asimismo, se ha identificado un mayor riesgo de trastornos neurológicos. La relación entre la EII y la neuroinflamación es compleja, pero la interacción bidireccional dentro del eje cerebro-intestino-microbioma puede desempeñar un papel fundamental en la patogénesis de las enfermedades relacionadas con la demencia168. De hecho, algunos estudios han mostrado un mayor riesgo de enfermedad de Parkinson, autismo o Alzheimer49,168,169.
Polifarmacia en el paciente con enfermedad inflamatoria intestinalLa Organización Mundial de la Salud define la polifarmacia como el uso concomitante y excesivo de varios medicamentos en un momento dado170. Sin embargo, la mayoría de los estudios la describen desde un punto de vista cuantitativo como el uso concomitante de 5 o más medicamentos, siendo grave cuando supera 10 fármacos171. Dentro de este concepto, es importante diferenciar la polifarmacia apropiada (medicaciones requeridas en el tratamiento de las enfermedades) de la inapropiada (uso fuera de indicación, automedicación, uso indebido de medicación de forma crónica), y del uso de medicaciones de riesgo por su potencial interacción con el resto, ya que cada tipo tendrá diferentes implicaciones172.
La polifarmacia representa en la actualidad un problema de salud, asociándose con efectos adversos, baja adherencia terapéutica, alteraciones mentales, caídas, infratratamiento de enfermedades crónicas, interacciones medicamentosas, hospitalizaciones e incluso, mortalidad173–178. Una revisión sistemática reciente establece una prevalencia de polifarmacia en población adulta del 37% (31-43%), incrementándose hasta el 45% (37-54%) en población mayor de 65 años, con la presencia de enfermedades crónicas y comorbilidades176–179.
La EII es un trastorno crónico que precisa de fármacos para su control y que se asocia a diferentes comorbilidades por lo que es esperable la presencia de polifarmacia178–183. A esto debemos añadir un factor de mayor relevancia como el envejecimiento de los pacientes y la evolución de la propia enfermedad184–186. A pesar de esto, la polifarmacia en la EII ha sido escasamente explorada y los datos publicados reflejan que afecta igualmente a esta población, con una prevalencia muy variable (18-50%), incidiendo de forma relevante en población de edad avanzada, donde se registran tasas de hasta el 86%, con un 45% de polifarmacia grave y un 35% de uso de medicación inapropiada187–189. Otros factores que se han asociado son la coexistencia de comorbilidades (especialmente enfermedades psiquiátricas), la dependencia del paciente o la larga evolución de la enfermedad187,189–191.
Los fármacos que se consumen con mayor frecuencia son analgésicos, antihipertensivos, inhibidores de la bomba de protones y psicofármacos181. Un estudio danés observó que el consumo de fármacos aparece relacionado con el diagnóstico reciente de EII, especialmente en población de edad avanzada, donde se incrementa el uso de antidepresivos, opioides o analgésicos, entre otros192.
Resulta menos conocido el pronóstico o las implicaciones que la polifarmacia puede tener en estos pacientes y en la evolución de la enfermedad. Más allá del papel perjudicial que puede representar el consumo de algunos fármacos de uso extendido, existen estudios que han relacionado la polifarmacia con una menor calidad de vida, falta de adherencia a los tratamientos e incluso con mayor probabilidad de recidivas clínicas de la EII187–189.
Es fundamental contar con herramientas adecuadas para gestionar la polifarmacia en los pacientes con enfermedades crónicas. Para ello, es imprescindible realizar una revisión exhaustiva de todos los fármacos que el paciente consume, con el fin de identificar la polifarmacia y abordarla mediante un enfoque multidisciplinario. La colaboración con distintas especialidades médicas, especialmente geriatría, es clave para minimizar el uso de medicación inapropiada o de riesgo, optimizando así el manejo integral de las enfermedades asociadas y mejorando el pronóstico del paciente.
De acuerdo con la evidencia disponible193, es recomendable realizar revisiones sistemáticas y periódicas de la medicación, priorizando únicamente los fármacos esenciales y evitando aquellos que puedan afectar negativamente la función gastrointestinal, como los antiinflamatorios no esteroideos (AINE) o ciertos antibióticos, o el uso de diuréticos en los pacientes portadores de ileostomía195. La tabla 6 muestra las interacciones con lo fármacos más habituales en EII.
Interacciones con los fármacos más habituales en EII
| Tratamiento | Riesgos potenciales | Medidas preventivas | Interacciones |
|---|---|---|---|
| Mesalazina | Daño renal | Control función renal | Tiopurinas |
| Esteroides | HTADMOsteoporosis/fracturasInfeccionesGlaucoma/cataratasTrastornos psiquiátricos | Tandas cortas y con dosis no superiores a 60mg/dVitamina D y calcioVacunación | — |
| Tiopurinas | InfeccionesLinfomaCCNMNeoplasias uroteliales | Evitar en mayores de 65 añosVacunaciónReducir la exposiciónControl dermatológico | AlopurinolWarfarinaMesalazinaCotrimoxazolIECACimetadina |
| Metotrexate | HepatoxicidadInfecciones | VacunaciónControl función hepáticaEvitar en caso de hepatitis crónica (VHB, VHC) | Sulfasalazina |
| Anti-TNF | InfeccionesRiesgo melanomaTBInsuficiencia cardiaca | VacunaciónControl dermatológicoCribado TB latenteValoración cardiológica | — |
| Vedolizumab | Infecciones respiratorias | Vacunación | — |
| UstekinumabRisankizumab | Ningún riesgo específico identificado | — | |
| TofacitinibFilgotinibUpadacitinib | Herpes zosterTromboembolismoEventos cardiacosNeoplasia | VacunaciónEvitar o dosis de 5mg (en caso de insuficiencia hepática)Valoración cardiológica | Ketoconazol, fluconazolValsartán |
CCNM: cáncer cutáneo no melanoma; DM: diabetes mellitus; HTA: hipertensión arterial; IECA: inhibidores de la enzima convertidora de angiotensina; TB: tuberculosis; VHB: virus de la hepatitis B; VHC: virus de la hepatitis C.
La desprescripción debe llevarse a cabo de manera segura y progresiva, evitando efectos adversos como el rebote o el síndrome de abstinencia, con un seguimiento cercano de la evolución clínica del paciente. Asimismo, la educación y el empoderamiento del paciente desempeñan un papel crucial, fomentando su participación activa en la optimización del tratamiento y promoviendo cambios en su estilo de vida como estrategia complementaria.
Por otro lado, la coordinación interdisciplinaria entre gastroenterólogos, médicos de atención primaria y farmacéuticos resulta esencial para reducir eficazmente la polifarmacia y mejorar la evolución clínica de los pacientes con EII.
Recomendaciones:
- •
Sugerimos simplificar los tratamientos farmacológicos siempre que sea posible, limitando el número de tomas y de comprimidos para mejorar la adherencia y disminuir los errores.
- •
Sugerimos tener en cuenta el tamaño de los comprimidos y valorar la capacidad de deglución del paciente.
- •
En lospacientes con polifarmacia, recomendamos revisar los fármacos prescritos, valorar su mantenimiento y considerar posibles interacciones farmacológicas.
Los aspectos psicosociales son cruciales en el manejo integral de los pacientes con EII, especialmente en aquellos que son frágiles y/o de edad avanzada. La interrelación de la fragilidad física y la vulnerabilidad psicológica en estos pacientes a menudo conduce a resultados clínicos subóptimos y una calidad de vida disminuida. La EII puede afectar significativamente la función psicosocial del paciente a través del estrés crónico que supone la gestión de una enfermedad a largo plazo. La fragilidad y la edad avanzada pueden exacerbar esta carga, lo que conlleva un mayor riesgo de enfermedades psiquiátricas como la depresión y la ansiedad191,192. La interconexión entre la mente y el intestino es bien conocida, con estudios que muestran que la inflamación sistémica puede afectar la función cerebral y viceversa195.
Por otra parte, el aislamiento social se considera un factor crítico que afecta negativamente la salud de los pacientes con EII de edad avanzada. La falta de una red de apoyo sólida se asocia con un seguimiento terapéutico más pobre y una menor adherencia al tratamiento196. Algunos estudios sugieren que el apoyo social contribuye de forma independiente a mejorar los resultados de salud197; de hecho, la falta de pareja se asocia a una mayor soledad y aislamiento social. Las parejas ofrecen un apoyo crucial, amortiguando potencialmente los efectos del estrés12,198. Entre los pacientes mayores con EII, el 24% experimenta un deterioro de los dominios sociales63. La creación de sistemas de apoyo, ya sean familiares, sociales o a través de grupos de pacientes, es vital para mejorar el bienestar emocional y social de estos pacientes198. Algún estudio indica que un apoyo social sólido reduce el riesgo de progresión de la enfermedad en los pacientes de mediana edad con EC199. Aunque mejorar el apoyo social a los pacientes con EII parece una buena medida, no se ha evaluado su impacto adecuadamente.
Otro punto a tener en cuenta desde la esfera social puede ser las nuevas modalidades de atención al paciente. Las nuevas tecnologías han supuesto un cambio en el manejo del paciente y se ha potenciado la atención telemática, bien telefónica o por mail. Por una parte, este tipo de atención evita desplazamientos en los pacientes que quizá tienen la movilidad restringida y reduce el estrés asociado con los desplazamientos. Sin embargo, su eficacia depende de factores como la alfabetización digital del paciente y su acceso a dispositivos adecuados. Por otro lado, la atención presencial sigue siendo indispensable en situaciones que requieren una evaluación clínica detallada o una intervención inmediata. En este sentido, es importante individualizar y valorar en cada situación concreta las necesidades médicas del paciente y su situación social199,200.
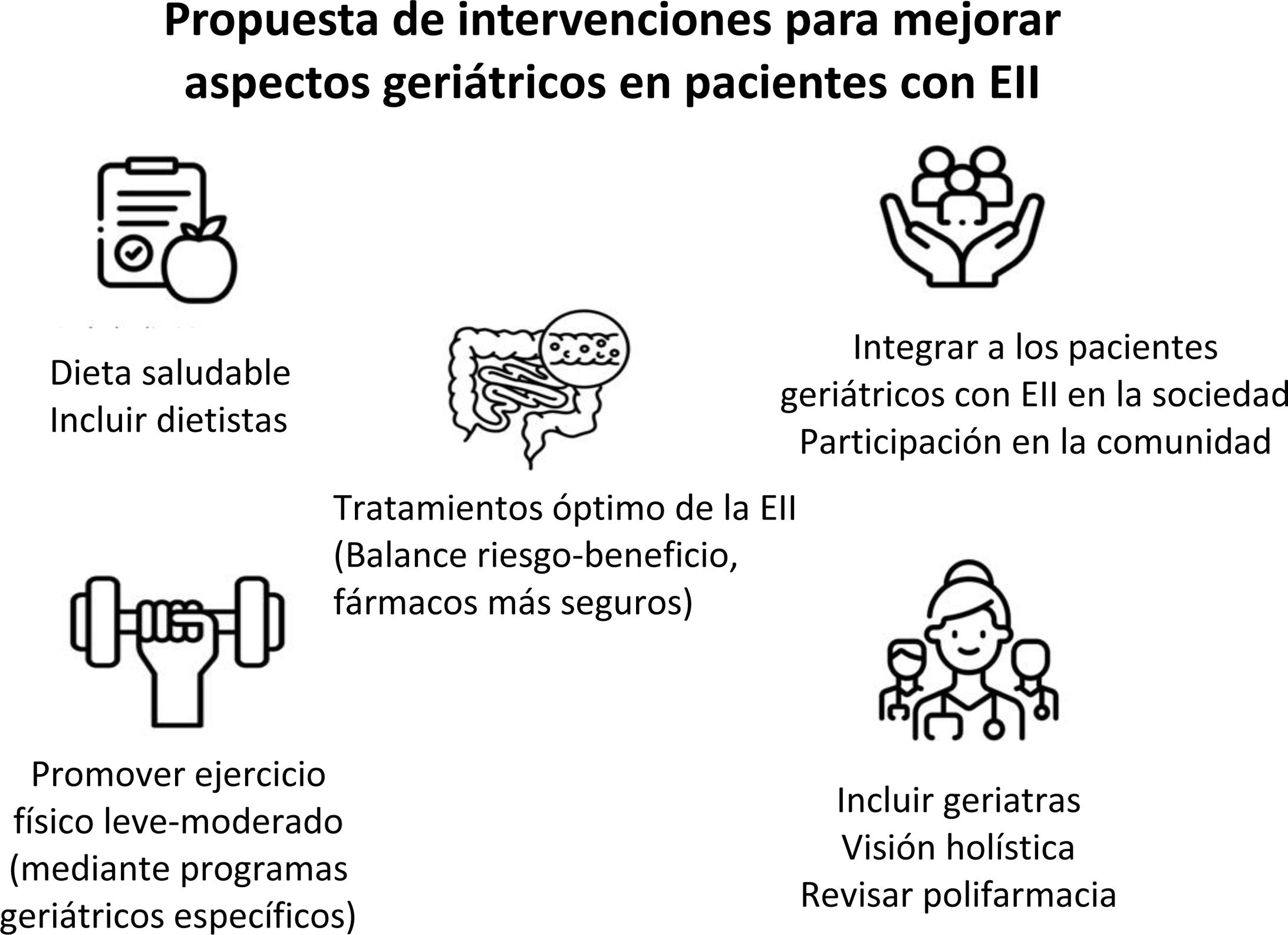
Por último, las intervenciones psicosociales adaptadas, como la terapia cognitivo-conductual, el manejo del estrés y las intervenciones grupales, han demostrado mejorar la calidad de vida en los pacientes con EII182,201. Es necesario implementar estrategias que fomenten la resiliencia psicológica y la autonomía del paciente, y que se aborden las barreras específicas a las que se enfrentan los pacientes frágiles y de edad avanzada. Los profesionales deben ser conscientes del impacto de la fragilidad y la edad en la salud mental y social, y trabajar para integrar estrategias de apoyo en su cuidado rutinario202 (fig. 4).
Recomendaciones:
- •
Recomendamos evaluar las necesidades médicas y sociales del paciente
- •
Sugerimos fomentar la creación de sistemas de apoyo multidimensionales promoviendo redes de apoyo familiares, sociales y comunitarias que permitan una atención más personalizada y reducir el riesgo de aislamiento y depresión.
- •
Sugerimos desarrollar estrategias que refuercen la resiliencia y autonomía del paciente para prevenir la fragilidad.
La indicación de exploraciones en el paciente frágil con EII es un tema extremadamente complejo. El principio fundamental para abordarlo es que es necesaria la individualización de la decisión de indicar o no la exploración. No existe una guía ni un método que nos pueda dar una certeza absoluta sobre si una determinada exploración está indicada en un paciente concreto. Sí podemos definir los factores que debemos evaluar y los principios básicos para tomar una decisión. En este apartado, nos centraremos en la colonoscopia como ejemplo ya que es la exploración invasiva más frecuente en estos pacientes203; sin embargo, lo que se expone es extrapolable a cualquier otra exploración que podamos considerar. Así, los factores fundamentales que debemos tener en cuenta para la establecer la idoneidad de una exploración son los siguientes:
- 1.
Grado de fragilidad: existen clasificaciones relativamente sencillas que nos permiten establecer el grado de fragilidad del paciente. Si bien en casos concretos es necesaria una VGI en general una clasificación rápida como el EFC será suficiente para tomar una decisión. En base al grado de fragilidad estableceremos 3 grandes grupos:
- a.
Fragilidad avanzada. Son aquellos pacientes con IF Frágil-VIG>0,5 o EFC≥7, es decir, totalmente dependientes, encamados o terminales. Los objetivos diagnóstico-terapéuticos se basan en garantizar el bienestar y el control sintomático. No son tributarios de exploraciones endoscópicas, debido a su esperanza de vida muy corta y el alto riesgo de complicaciones.
- b.
Fragilidad moderada leve. Con un IF Frágil-VIG 0,2-0,5 o EFC 5-6. Los objetivos diagnóstico-terapéuticos son obtener un beneficio clínico con el fin de promover y mantener la autonomía y la calidad de vida, pero no aumentar la supervivencia. Por lo tanto, no estarían indicadas exploraciones de cribado que ya no son útiles dada la esperanza de vida limitada. En caso de exploraciones diagnósticas o terapéuticas es necesario establecer que el resultado puede conducir a medidas que mejoren claramente el estado funcional o la calidad de vida del paciente.
- c.
Ausencia de fragilidad o prefragilidad. Con IF Frágil-VIG<0,2 o CFS 1-4. Los objetivos diagnóstico-terapéuticos son similares a los de la población general y no estableceríamos ninguna limitación.
- a.
- 2.
Indicación de la prueba: como ya se ha comentado parcialmente en el apartado previo, tendremos que determinar en qué categoría clasificamos la prueba. Distinguiremos:
- a
Exploraciones de cribado: Solo estarían indicadas en los pacientes sin fragilidad. En general, esto va relacionado con una esperanza de vida larga. En el caso infrecuente de pacientes sin fragilidad y esperanza de vida limitada por comorbilidades —p.ej., cardiovasculares— tendríamos que valorar el riesgo beneficio de la colonoscopia e indicarla solamente si este es inequívocamente favorable.
- b
Exploraciones diagnósticas y/o terapéuticas: Estarían indicadas en todos los pacientes que no presenten una fragilidad avanzada. En este caso, tendríamos que valorar el potencial riesgo de complicación y el beneficio esperado de la colonoscopia e indicar la exploración solamente si la relación riesgo-beneficio es inequívocamente favorable, siguiendo el principio clásico de «primum non nocere».
- a
- 3.
Principios, preferencias y valores de cada paciente: los criterios establecidos previamente ceden frente al principio de autonomía del paciente. Es decir, debemos respetar la decisión de un paciente que se niegue a cualquier exploración si prefiere mantener un estilo de vida menos medicalizado (independientemente de su fragilidad). Esto es especialmente importante si consideramos la escasa evidencia científica sobre la utilidad de la colonoscopia de cribado para disminuir la mortalidad en los pacientes con EII. En este caso, nuestra única obligación es ofrecer información no sesgada sobre los riesgos y beneficios de realizar o no la prueba y asegurarnos de que entiende la información. La única excepción a esta norma es que, de acuerdo con el principio ético de no maleficencia, tenemos la obligación ética de negarnos a indicar o realizar una exploración que, de acuerdo con nuestra valoración, tenga una relación entre riesgo y beneficio desfavorable para el paciente204.
Recomendaciones:
- •
Sugerimos realizar cualquier exploración si el balance riesgo-beneficio es claramente favorable, evitando intervenciones innecesarias en lospacientes con alto riesgo de complicaciones.
- •
Recomendamos respetar la autonomía del paciente en la toma de decisiones, asegurando información clara sobre riesgos y beneficios, pero evitando exploraciones con un riesgo claramente superior al beneficio.
- •
En pacientes con fragilidad avanzada (IF Frágil-VIG>0,5 o EFC≥7), recomendamos no indicar exploraciones endoscópicas.
- •
En pacientes con fragilidad moderada-leve (IF Frágil-VIG 0,2-0,5 o EFC 5-6), recomendamos evitar colonoscopias de cribado y realizar exploraciones diagnósticas o terapéuticas solo si hay un beneficio clínico claro.
Este documento de posicionamiento se ha elaborado a partir de una revisión crítica de la literatura y el consenso de expertos del Grupo Español de Trabajo en Enfermedad de Crohn y Colitis Ulcerosa (GETECCU). No se han utilizado datos individuales de los pacientes, ni se ha requerido la realización de estudios clínicos, por lo que no ha sido necesaria la aprobación por parte de un comité de ética en investigación. El desarrollo del documento se ha realizado siguiendo los principios éticos de independencia, transparencia y rigurosidad científica.
FinanciaciónEste trabajo no ha recibido ningún tipo de financiación.
Conflicto de interesesLos autores han recibido financiación para investigación, formación, asistencia a reuniones científicas y asesorías de las siguientes compañías:
M. Mañosa: MSD, AbbVie, Takeda, Janssen, Pfizer, Ferring, Kern Pharma, Dr. Falk Pharma, Galapagos, Tillots, Lilly y Faes Farma.
M. Calafat: Takeda, Johnson and Johnson, Faes Farma, Falk, Abbvie, Pfizer, Tillot's Pharma, Adacyte Therapeutics, Ferring, Gilead, Kern Pharma y MSD.
EF y FR no declaran conflictos de intereses.
F. Mesonero: MSD, AbbVie, Takeda, Janssen, Pfizer, Ferring, Kern Pharma, Dr. Falk Pharma, Celltrion Healthcare, Galapagos, Chiesi, Tillots Pharma, Lilly y Faes Farma.
C. Suárez: Abbvie, MSD, Lilly, Pfizer, Jansen, Takeda, Thillots, Ferring, Chiesi y Kern pharma.
SG-L y FL no declaran conflictos de intereses.
X. Calvet: MSD, Abbvie, Pfizer, Kern Pharma, Takeda, Janssen, Sandoz, Galapagos, Lilly, Shire Pharmaceuticals y Vifor Pharma.
E. Domènech: AbbVie, Adacyte Therapeutics, Biogen, Celltrion, Ferring, Galapagos, Gilead, GoodGut, Imidomics, Janssen, KernPharma, Lilly, MSD, Pfizer, Roche, Samsung, Takeda y Tillots.
A. Gutiérrez-Casbas: Abbvie, Lilly, J&J, Pfizer, Kern, MSD, Takeda, Adacyte, Falk, FAES, Sandoz, Fresenius Kabi, Ferring, Tillots, Roche y GSK.
I. Ordás: Abbvie, MSD, Pfizer, Takeda, Janssen, Kern Pharma, Chiesi, Falk Pharma, and Faes Farma. Research support from Abbvie y Faes Farma.
L. Menchén: MSD, Abbvie, Takeda, Janssen, Pfizer, Biogen, Galapagos, Kern Pharma, Lilly, Adacyte, Tillotts, Dr. Falk Pharma, Ferring, Medtronic y General Electric.
F. Rodríguez-Moranta: Lilly, Takeda, J&J, FAES Pharma, Falk, Abbvie, Pfizer, Tyllots, Ferring y Kern Pharma.
Y. Zabana: AbbVie, Adacyte, Alfasigma, Almirall, Amgen, Boehringer Ingelheim, Dr Falk Pharma, Faes Pharma, Fresenius Kabi, Ferring, Galapagos, Janssen, Johnson&Johnson, Kern, Lilly, MSD, Otsuka, Pfizer, Sanofi, Shire, Takeda, y Tillotts Pharma.