La incidencia de tuberculosis va descendiendo a nivel mundial. Sin embargo, en los países occidentales este descenso es más lento debido al impacto de la inmigración. La tuberculosis en la población inmigrante se relaciona con el estatus de salud en el país de origen y con las condiciones de hacinamiento y pobreza en el país de acogida.
Los inmigrantes con tuberculosis son más jóvenes, tienen mayor prevalencia de formas extrapulmonares, mayor proporción de casos de resistencia y tasas de abandono de tratamiento superiores a los autóctonos.
Las nuevas técnicas moleculares, además de reducir el tiempo de demora diagnóstica, permiten la identificación rápida de resistencias y mejoran el conocimiento de los patrones de transmisión.
Es necesario implementar medidas que mejoren la cumplimentación del tratamiento de este grupo de población como el uso de pautas fijas de tratamiento, el empleo de mediadores y agentes comunitarios de salud, facilitar el acceso a la tarjeta sanitaria y la gratuidad de los fármacos.
The incidence of tuberculosis worldwide is declining. However, in Western countries this decline is slower due to the impact of immigration. Tuberculosis in the immigrant population is related to health status in the country of origin and with overcrowding and poverty conditions in the host country.
Immigrants with tuberculosis are younger, have a higher prevalence of extrapulmonary forms, greater proportion of drug resistance and higher treatment default rates than those of natives.
New molecular techniques not only reduce diagnostic delay time but also allow the rapid identification of resistances and improve knowledge of transmission patterns.
It is necessary to implement measures to improve treatment compliance in this population group like facilitating access to health card, the use of fixed-dose combination drugs, the participation of cultural mediators and community health workers and gratuity of drugs.
De acuerdo con la Organización Mundial de la Salud, la tuberculosis (TB) es la principal causa de mortalidad en los adultos por enfermedades infecciosas curables1. Se calcula que en el año 2014 contrajeron la enfermedad 9,6 millones de personas, de las cuales fallecieron 1,5 millones. Más del 55% de los casos ocurrieron en países del sudeste asiático y Pacífico occidental. África presentó una cuarta parte de los casos, pero fue la región con las mayores tasas de incidencia y mortalidad en relación con el tamaño de la población. El 12% (1,2 millones) de las personas que adquirieron la enfermedad eran además VIH positivas. A pesar de estos datos, la incidencia de TB en el mundo va disminuyendo desde el año 2000 a un ritmo medio del 1,5% al año, y la tasa de mortalidad por la enfermedad ha descendido un 47% desde el año 19901.
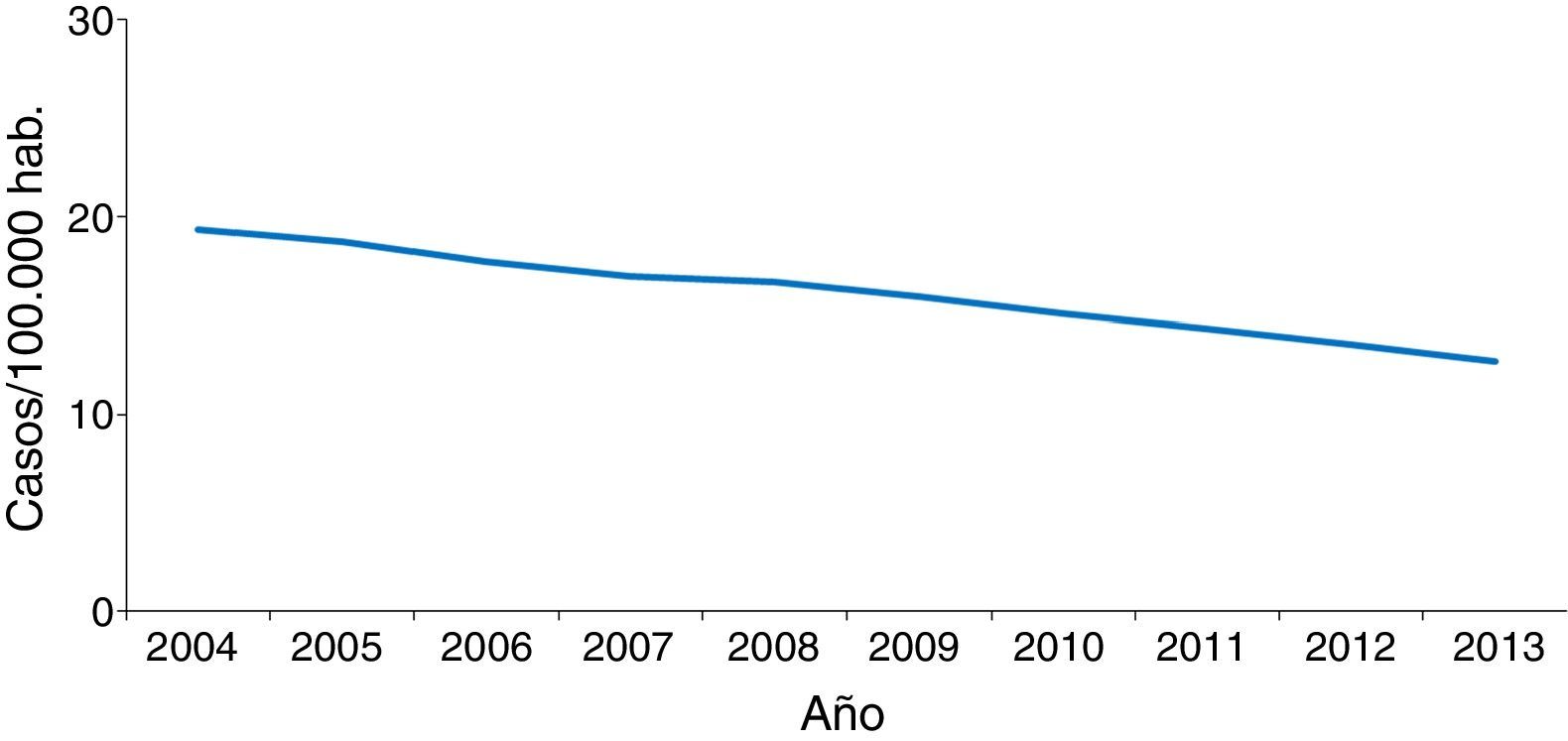
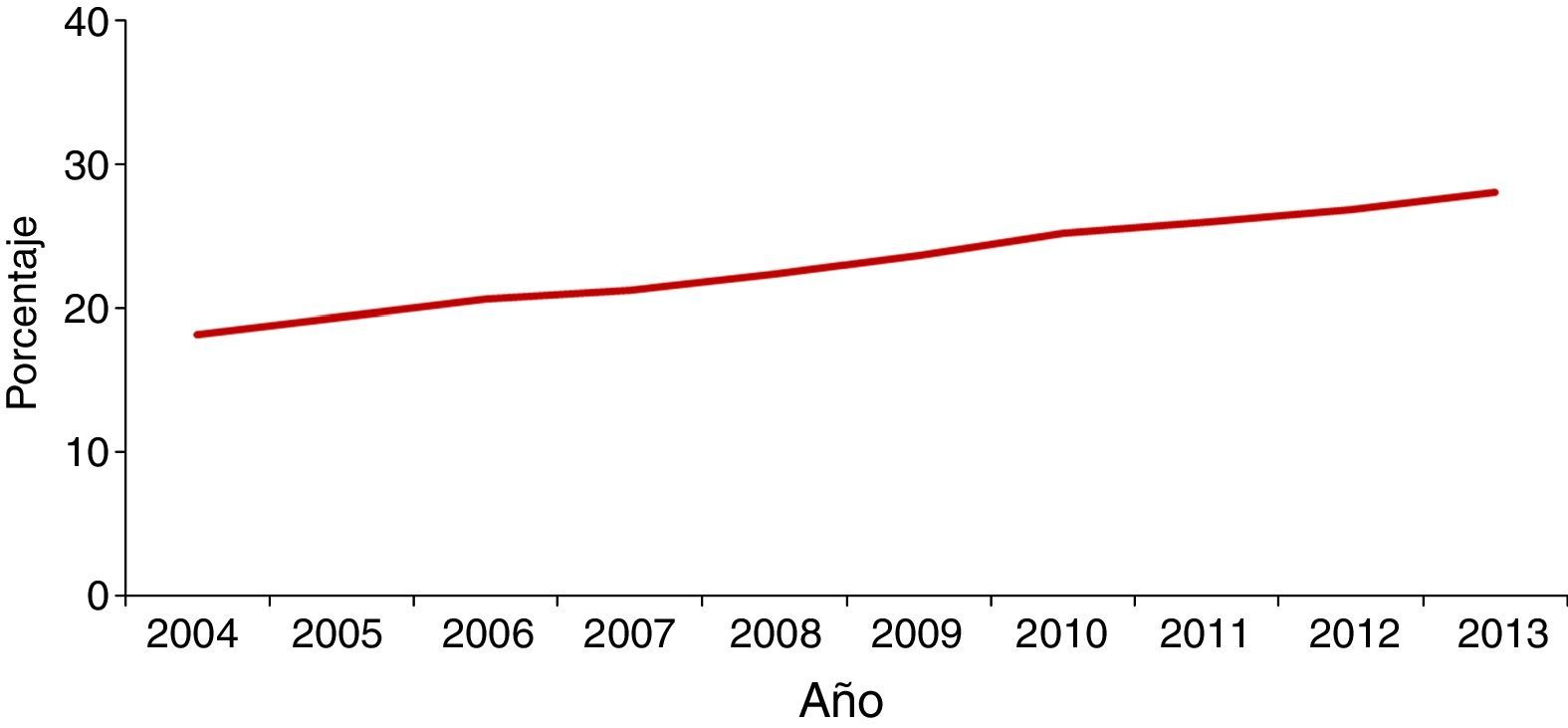
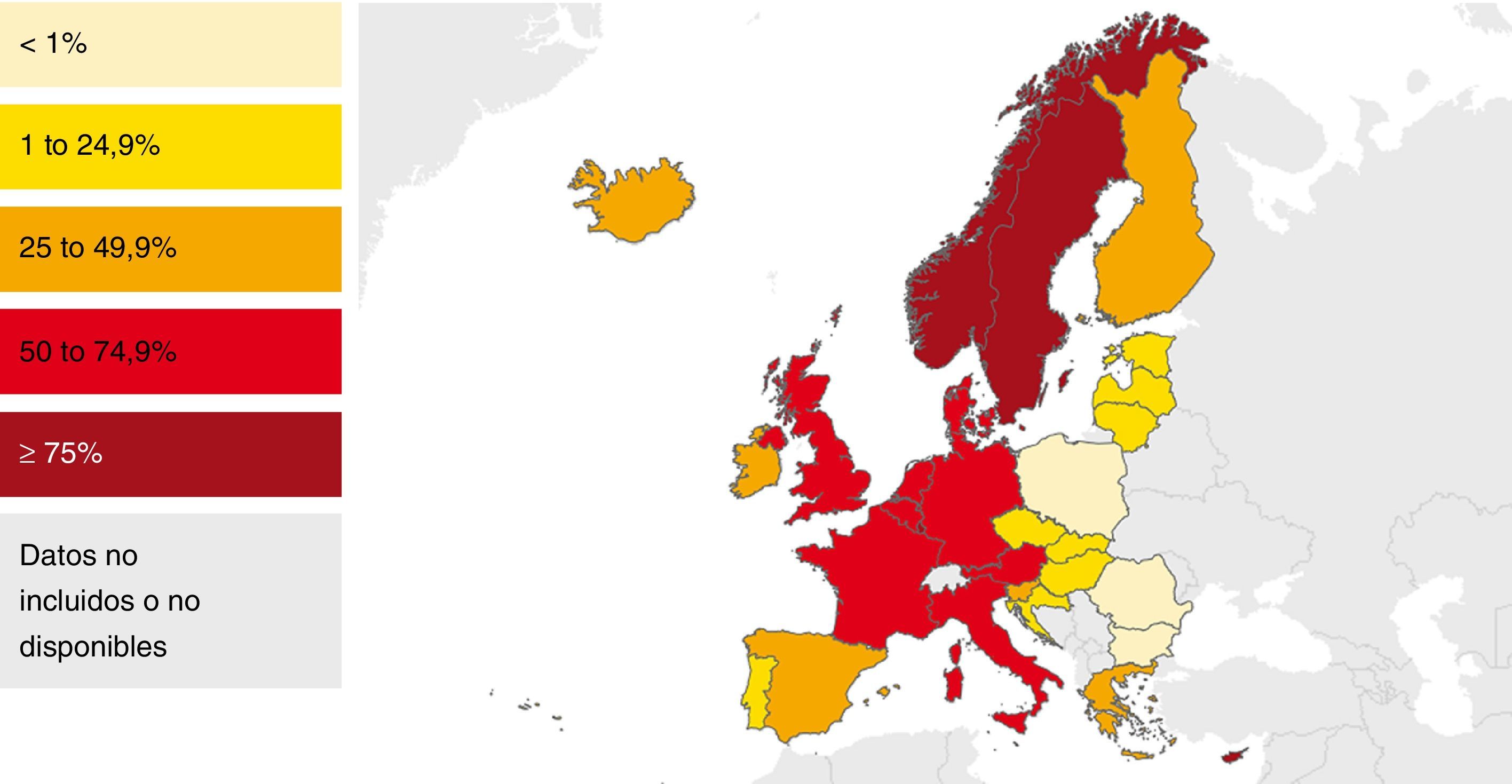
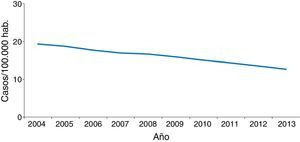
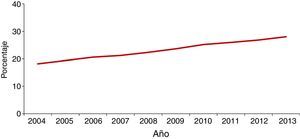
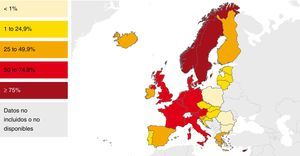
En la mayoría de los países occidentales se ha producido desde el final del siglo XX un descenso progresivo en el número de casos tras la introducción del tratamiento antirretroviral de gran actividad para los pacientes con infección por el VIH2. Sin embargo, esta disminución se ha enlentecido en los últimos años por la llegada de un gran número de inmigrantes procedentes de regiones endémicas de TB3–5. Aunque de forma global el número total de casos de TB disminuye, este se incrementa entre los nacidos en el extranjero (figs. 1 y 2). En Europa Occidental, alrededor del 30% de los casos ocurren actualmente en este colectivo aunque con una gran variabilidad, con un rango que va desde más del 80% en países como Suecia o Noruega al 16% de Portugal6 (fig. 3).
Porcentaje de casos de tuberculosis en extranjeros en los países de la UE/AEE. 2013. Modificada de: European Centre for Disease Prevention and Control6.
En España se notificaron 5.535 casos de TB en el año 2013, con una tasa de incidencia de 11,88 casos por 100.000 habitantes, siendo considerado un país de baja incidencia para el Centro Europeo para la Prevención y Control de Enfermedades. La llegada masiva de inmigrantes a partir del año 2000 supuso un incremento progresivo en el número de casos notificados en extranjeros en paralelo a una mejora de las fuentes de información, con una repercusión significativa en la epidemiología de la enfermedad. Es a partir del año 2008 cuando se observa un descenso tanto en casos españoles como extranjeros, si bien este último no es tan acusado. En el año 2013, el 32% de los casos notificados lo fueron en personas nacidas en el extranjero3, con grandes variaciones entre comunidades autónomas, que van desde menos del 8% en Asturias, Galicia o Extremadura hasta más del 40% en La Rioja, Cataluña, Murcia o Madrid. El origen de los casos es muy diverso y está en relación con la procedencia de la población inmigrante asentada en cada zona4,7–9. A nivel general, en España, el país de procedencia con mayor número de casos en 2013 fue Marruecos (23%), seguido de Pakistán (11%), Rumanía (10%) y Bolivia (7%)3.
Características diferenciadoras de la tuberculosis en la población inmigranteLa TB es una enfermedad ligada a la inmigración por su relación con la pobreza y las condiciones de hacinamiento en las que viven en muchas ocasiones en el país de acogida. Además, aunque la población que emigra es, por regla general, la más joven y saludable de cada país, presenta un riesgo mayor que la población receptora al provenir de zonas de elevada prevalencia de infección tuberculosa. Ambos factores dan lugar a un mayor riesgo de reactivaciones endógenas de la TB, pero también a una transmisión activa entre los mismos inmigrantes y la población autóctona10.
La TB en la población inmigrante tiene algunas peculiaridades:
- -
Es una constante en todas las publicaciones la diferencia de edad entre población inmigrante y autóctona, siendo los primeros mucho más jóvenes3,7,9. En el estudio de Ramos et al., realizado en Elche, la edad media de los casos en inmigrantes fue de 28,7 años frente a 45,8 en población nativa. A nivel nacional, en el año 2013, la edad media de los inmigrantes fue de 36±13 años, mientras que la de los españoles fue de 49±23 años (p=0,000).
- -
Las presentaciones extrapulmonares son proporcionalmente más frecuentes en población inmigrante. En la Unión Europea, en el periodo 2002-2011, los casos de TB extrapulmonar representaron el 19,3% de todos los casos notificados. Sin embargo, entre los inmigrantes, la TB extrapulmonar representó el 37,9%5. El patrón también varía entre autóctonos e inmigrantes. El 35,7% de los casos de TB extrapulmonar en extranjeros fueron adenopatías extratorácicas, 16,4% TB pleural y 13,6% linfadenopatías intratorácicas. En cambio, en los nativos, predomina la TB pleural (44,4%) y es menos frecuente la adenitis extratorácica (14,4%). Estas formas de enfermedad tienen una demora diagnóstica significativa, y aunque no suponen un gran riesgo para la salud pública, sí ocasionan una importante morbilidad y complicaciones, en muchos casos con graves secuelas a largo plazo.
- -
Algunos estudios han demostrado una mayor presencia de cavitación pulmonar9, probablemente en relación con un mayor retraso en el diagnóstico que en los nativos.
- -
La proporción de casos de resistencia y multirresistencia es muy superior entre inmigrantes que en los autóctonos. En la serie de Fortún et al.4 realizada en Madrid, la resistencia a isoniacida y la multirresistencia fue del 7,6 y 2,8% respectivamente en población autóctona, y del 16,5% (p<0,001) y 9,1% (p<0,001) entre inmigrantes, destacando el 28% de pacientes con resistencia aislada a isoniacida entre pacientes procedentes de Perú. Este hecho probablemente esté relacionado con tratamientos incompletos en sus países de origen debido a programas de control de la enfermedad poco efectivos7. La mayor tasa de resistencias ocasiona que el número de pacientes tratados con cuatro fármacos sea también superior al de la población autóctona9.
- -
Una mayor tasa de pérdida de seguimiento9, muy relacionado con la dificultad para acudir a las consultas programadas por motivos laborales y la gran movilidad.
La infección tuberculosa latente (ITL) se define como un estado de respuesta inmunitaria persistente a antígenos de Mycobacterium tuberculosis (M. tuberculosis) adquiridos con anterioridad, que no se acompaña de manifestaciones clínicas. Durante el contacto con un enfermo de TB, una persona puede ser infectada o no, dependiendo del grado de exposición y de sus mecanismos inmunológicos innatos11. Aproximadamente el 60% de los sujetos expuestos a la fuente de contagio no desarrolla nunca una respuesta inmunológica (prueba de tuberculina [PT] negativa); en un 40% de los expuestos, algunos bacilos permanecen vivos pero sin capacidad de producir enfermedad, generándose así la ITL (PT positiva). Los bacilos inactivos pueden recuperar su capacidad de replicación y causar enfermedad si la respuesta inmune está alterada. De todos los individuos que son infectados, solo un 10% desarrollará enfermedad y la mayoría lo hace en los primeros años que siguen a la infección. Las personas con ITL tienen un riesgo de enfermar entre tres a cinco veces mayor que los individuos con PT negativa; esta circunstancia se puede evitar mediante el tratamiento preventivo11. El diagnóstico de ITL se realiza mediante la PT y la determinación de la producción de interferón gamma (interferon gamma release assay [IGRA]).
Prueba de la tuberculinaLa prueba estándar para el diagnóstico de la infección tuberculosa es la PT, en la que se utiliza un extracto concentrado del filtrado del cultivo de bacilos tuberculosos para detectar la existencia de una hipersensibilidad retardada a las proteínas de dichos bacilos. Este extracto proteico se conoce internacionalmente como purified protein derivative (PPD). La PT se realiza habitualmente siguiendo la técnica de Mantoux, que consiste en la inyección intradérmica en la cara ventral del antebrazo de 0,1ml de PPD, a la dosis de 2 UT, y la lectura se realiza a las 48-72h.
El PPD contiene proteínas que son comunes a M. tuberculosis, al bacilo de la vacuna, bacilo de Calmette-Guerin (BCG) y a algunas micobacterias ambientales, lo que le resta especificidad. Para considerar una PT como positiva e indicativa de infección tuberculosa se debe tener en cuenta la probabilidad de que el individuo se haya infectado por el bacilo tuberculoso, el riesgo que tenga para desarrollar la enfermedad y el antecedente de vacunación con BCG, práctica habitual en países con una alta prevalencia de la enfermedad.
En España la prueba se considera positiva cuando la induración es ≥ 5mm en las personas que no han sido vacunadas con BCG. En las vacunadas, la interpretación es más complicada por la dificultad de discernir entre el efecto de la vacuna y la infección tuberculosa. En la práctica clínica, se acepta que en los colectivos con elevado riesgo de enfermar tras infección no se tenga en cuenta el antecedente de vacunación. Con este criterio, en los vacunados una PT ≥ 5mm se considera positiva cuando se trata de contactos íntimos o frecuentes de pacientes tuberculosos bacilíferos, así como en las personas con lesiones residuales compatibles con TB en la radiografía de tórax. En el resto de vacunados con BCG, se considera infección y no reacción secundaria a la vacuna si el tamaño de la induración es>15mm. En personas con inmunodepresión importante (infectados por el VIH, trasplantados, tratamientos biológicos y con corticoides), se acepta como positiva cualquier induración de la PT12.
La prueba puede presentar falsos positivos (individuos vacunados con BCG, infección por micobacterias ambientales oportunistas, rotura de vaso o infección en la zona de inyección) y falsos negativos. Los resultados falsos negativos de la PT pueden deberse tanto a defectos de la técnica o errores en la lectura como a circunstancias dependientes del individuo, tales como enfermedades o situaciones que provoquen inmunodepresión, incluida la TB grave13. Otras limitaciones de la técnica son las dificultades para su abordaje en niños de corta edad, la necesidad de una segunda visita para la lectura de la prueba, un periodo ventana de entre 2 y 12 semanas y su ausencia de privacidad. Por otra parte, la PT no permite distinguir entre infección y enfermedad, ya que en ambos casos suele ser positiva.
Pruebas de determinación de la producción de interferón gamma (IGRA)Para intentar superar estos problemas, recientemente se han desarrollado diferentes técnicas de laboratorio para el diagnóstico de la infección tuberculosa. Las técnicas se basan en la detección del interferón gamma en sangre, una citocina fundamental en el control de la infección tuberculosa, que se libera como respuesta a la estimulación in vitro de las células T sensibilizadas con antígenos específicos de M. tuberculosis13. En la actualidad se dispone de 2 pruebas comercializadas: QuantiFERON-TB Gold In-Tube y T-SPOT-TB. Ambas pruebas presentan algunas ventajas respecto a la tuberculina14:
- -
Permiten discriminar a los individuos infectados por M. tuberculosis de los vacunados por BCG y de los infectados por la mayoría de otras especies de micobacterias.
- -
Son fáciles de estandarizar y aplicar en el laboratorio.
- -
Incorporan controles positivos para detectar anergia y excluir, así, a los falsos negativos por inmunosupresión.
- -
Pueden repetirse en caso necesario sin verse afectadas por el efecto booster.
- -
Se evita la subjetividad de la interpretación y la visita de lectura.
- -
Al realizarse en el laboratorio, se respeta la intimidad del individuo.
En ausencia de una auténtica prueba de referencia para el diagnóstico de la infección tuberculosa, es difícil establecer la sensibilidad y la especificidad de estas nuevas técnicas diagnósticas. En comparación con la PT, los datos sobre la generación actual de las IGRA sugieren mayor especificidad, menor número de falsos positivos debido a vacunación previa con BCG y una mayor sensibilidad en poblaciones con baja incidencia de TB15. El principal inconveniente de las IGRA es su mayor coste económico respecto a la PT. Aunque se necesitan más estudios en los distintos grupos de riesgo para determinar su nivel de eficiencia, se acepta que en países con elevada prevalencia de TB su empleo es la opción más coste efectiva12.
Su utilización en la práctica clínica está todavía en fases iniciales. Sin embargo, algunas sociedades científicas ya las han introducido en sus guías12,16. Los CDC recomiendan el uso indistinto de la tuberculina o de QuantiFERON-TB Gold para el diagnóstico de la infección tuberculosa, mientras que las demás sociedades aconsejan el empleo de la nueva tecnología en combinación con la tuberculina17.
Diagnóstico de la enfermedad tuberculosaLa tuberculosis pulmonar debe sospecharse en aquellos pacientes con clínica respiratoria de 2-3 semanas de duración, así como en pacientes con hemoptisis, independientemente de la duración13. La exploración física no debe limitarse al tórax, sino que debe ir dirigida, además, a descartar la afectación extrapulmonar y las formas diseminadas. El diagnóstico de certeza de la enfermedad tuberculosa es microbiológico, basado en el examen directo, cultivo de M. tuberculosis en muestras biológicas y técnicas moleculares13. En el diagnóstico de la TB pulmonar, el esputo es la muestra más importante. Con una serie de dos muestras consecutivas se puede identificar al 95-98% de los pacientes con tuberculosis y baciloscopia positiva18.
Examen directoLa microscopía es la herramienta diagnóstica de la TB más rápida y barata. Puede detectar de 5.000 a 10.000 bacilos/ml19,20, con una sensibilidad y valor predictivo positivo del 45 al 90% y del 50 al 80% respectivamente20. El número de bacilos/campo ofrece información sobre la infecciosidad del paciente y es útil para monitorizar el tratamiento13.
Técnicas de cultivoEl cultivo es el método diagnóstico de referencia (detecta hasta 10 bacilos/ml), con una sensibilidad y especificidad aproximadas del 80 y 95% respectivamente13. Las muestras son inoculadas en un sistema de cultivo líquido automatizado y en un medio sólido a base de huevo o agar. El crecimiento es más rápido en el medio líquido (1-3 vs. 3-8 semanas), pero el medio sólido es necesario para detectar cultivos mixtos21. El cultivo es necesario para la realización de las pruebas de sensibilidad a fármacos, permitiendo además obtener la CMI de los mismos.
Para documentar la respuesta al tratamiento se han de obtener muestras de esputo mensualmente, hasta que al menos dos consecutivas tengan un cultivo negativo.
Métodos molecularesLos métodos moleculares permiten un diagnóstico rápido (24-48 h), fundamental para la administración precoz de tratamiento e interrumpir la cadena de transmisión de la enfermedad22. Se basan en la amplificación de fragmentos genéticos específicos de M. tuberculosis (ARN o ADN) directamente en las muestras clínicas y su posterior detección. La mayoría de estos métodos se han aplicado a la TB pulmonar, utilizando la técnica PCR y la IS6110 como diana genética, siendo capaces de detectar tan solo de uno a 10 bacilos/ml23. La sensibilidad está relacionada con la carga microbiana. En muestras con baciloscopia positiva, la sensibilidad y especificidad de los métodos son del 95 y 98% respectivamente, con un valor predictivo positivo>95%. En muestras con baciloscopia negativa, la sensibilidad es inferior (75-88%), manteniendo una especificidad del 95%24. Un resultado negativo no es suficiente para excluir la TB25. En las formas extrapulmonares la sensibilidad es menor (50-70%), pero su positividad confirmaría la enfermedad con una especificidad del 90-95%26,27.
Estos métodos solo son apropiados para fines de diagnóstico, y sus resultados deben interpretarse en el contexto de factores clínicos y epidemiológicos. Cuando el grado de sospecha de TB es moderado o alto, un resultado positivo es indicativo de TB en el 80% o más de los casos, mientras que si la sospecha es baja, se reduce la especificidad a un máximo del 50%, no estando indicada su aplicación en estos casos24. No son útiles para la monitorización del tratamiento ya que pueden detectar bacterias no viables.
Identificación de M. tuberculosisTradicionalmente la identificación de micobacterias se ha basado en rasgos fenotípicos y características bioquímicas. Estos métodos son lentos y con bajo poder discriminatorio. Hoy día se utilizan métodos moleculares más precisos y rápidos, aplicados directamente en muestras clínicas o a partir del aislamiento del cultivo.
Las técnicas que presentan un mayor interés son aquellas basadas en la amplificación de secuencias de ADN específicas mediante PCR u otro sistema y un posterior análisis postamplificación mediante restricción o hibridación con sondas inmovilizadas en tiras de nitrocelulosa (line probe assay), muy difundidas en los laboratorios clínicos, o en técnicas de tipificación molecular o secuenciación de zonas variables de genes comunes al género, como el gen 16S rDNA que permite la identificación teórica de prácticamente todas las especies de micobacterias28.
Detección de resistenciasSe ha de realizar el antibiograma a todos los pacientes de reciente diagnóstico o previamente tratados. La detección rápida de cepas resistentes a los fármacos facilita el acceso temprano a la terapia adecuada, reduce las tasas de transmisión y mejora los resultados del tratamiento22.
El antibiograma por el método de las proporciones es la técnica de referencia para la detección in vitro de la resistencia de los aislados de M. tuberculosis a los fármacos antituberculosos de primera línea. Debido a la laboriosidad y lentitud de estos métodos (4-8 semanas desde la obtención de la muestra), se recomienda la detección molecular de resistencias a isoniacida (H) y/o rifampicina (R) en casos con baciloscopias positivas a partir de aislamientos de cultivos13,29,30. Estos métodos moleculares se basan en la demostración de mutaciones que confieren resistencia (p.ej. mutaciones en la región rpoβ se encuentran en alrededor del 96% de las cepas resistentes a R y la presencia de mutaciones en el gen katG y el operón mabA-inhA están presentes en el 60-65% de los casos de resistencia a H)31,32. Sus principales ventajas son la rapidez (resultados disponibles en 2-5h), que precisan una manipulación técnica mínima33,34 y que pueden diagnosticar infecciones mixtas no detectadas por el antibiograma tradicional.
Las técnicas tipo line probe assay y la tecnología PCR a tiempo real pueden detectar M. tuberculosis y resistencia a R o H tanto en cultivo como muestras clínicas directamente. La secuenciación de ADN permite el estudio de todo el gen, pero solo se realiza en laboratorios de referencia. Más recientemente se están desarrollando nuevas aplicaciones basadas en microarrays capaces de detectar simultáneamente un número importante de mutaciones para todos los fármacos35.
La epidemiología molecular ha transformado nuestro conocimiento de cómo se transmite la TB. El análisis de patrones genotípicos o huellas digitales, proporciona una imagen precisa de la dinámica de transmisión de M. tuberculosis. La identificación de clusters muestra que muchos eventos de transmisión no se identifican de manera eficiente mediante encuestas epidemiológicas basadas en la entrevista estándar36,37.
Manejo de la infección tuberculosa latenteIndicaciones de realización de cribado de la tuberculosisLas prioridades para el control de la TB en la población inmigrante deberían ser las mismas que para el resto de la población: la finalización del tratamiento en las personas con enfermedad o infección tuberculosa, el estudio de los contactos y el cribado y la administración de medicación preventiva a las personas en riesgo38.
En relación con este último punto, la prevalencia de ITL y los factores de riesgo asociados a una reactivación de la TB son los factores que van a condicionar en la población inmigrante una mayor probabilidad de presentar una enfermedad tuberculosa39. Sin embargo, realizar un cribado y tratamiento general a todos los inmigrantes recién llegados supondría implementar costosos programas de salud de dudosa eficacia. En experiencias desarrolladas en Canadá, el 47% (rango 11-72%) de los pacientes que iniciaron tratamiento para la ITL completaron el mismo39.
Como norma, no debería practicarse la PT ni las pruebas de determinación de interferón gamma si no se va a derivar una actuación posterior. Las indicaciones generales para llevar a cabo la PT se exponen en la tabla 1. Es por ello que el cribado, y sobre todo el inicio del tratamiento de la infección tuberculosa, debería limitarse a los colectivos inmigrantes con alto riesgo de infección y enfermedad tuberculosa, y cuando pudiera además garantizarse una buena cumplimentación del mismo38. Además de los factores de riesgo clásicos relacionados con la mayor probabilidad de desarrollo de la enfermedad, existen otros determinantes que van a estar muy relacionados con los perfiles epidemiológicos locales de la población inmigrante y los recursos sanitarios disponibles, como son:
- -
El tiempo desde su llegada al país de acogida. El periodo de máximo riesgo son los primeros 5 años39, y sobre todo el primer año, durante los que se alcanza un riesgo de 5-10 veces mayor.
- -
La región de origen. Las personas procedentes de África subsahariana y Asia, regiones con las mayores tasas de incidencia a nivel mundial de la enfermedad, tienen un mayor riesgo de haber sido expuestas a la infección y haber tenido una exposición reciente.
- -
La categoría de inmigrantes. Los refugiados tienen el doble de probabilidades de tener una infección tuberculosa y de haber tenido un contacto reciente que el resto de inmigrantes dadas las condiciones de hacinamiento que en la mayoría de los casos han sufrido39.
Indicaciones de la prueba de la tuberculina
| Convivientes y contactos de enfermos tuberculosos |
| Personas cuya radiografía de tórax presente imágenes compatibles con tuberculosis inactiva |
| Personas con sospecha clínica y/o radiológica de padecer enfermedad tuberculosa |
| Personas que si están infectadas tienen mayor riesgo para el desarrollo de enfermedad tuberculosa: |
| - Infección por el VIH |
| - Adictos a drogas por vía parenteral |
| - Marginados sociales |
| - Extranjeros procedentes de países de alta incidencia |
| Enfermedades inmunosupresoras: leucosis, linfomas, neoplasias y otras |
| Terapia inmunosupresora prolongada, anti-TNFα y candidatos a trasplante |
| Personas que constituyen un riesgo social y epidemiológico si desarrollan una TB activa: |
| - Cuidadores de guarderías infantiles |
| - Personal docente |
| - Personal sanitario |
| - Personal de prisiones |
| Estudios epidemiológicos y control de programas antituberculosos |
Con la información actual, la recomendación consiste en emplear la PT como técnica de base. Si esta resulta positiva y el individuo está vacunado con BCG, se empleará la técnica de detección de interferón gamma para descartar el efecto de la vacuna. Si la PT resulta negativa pero el individuo es un niño o está inmunodeprimido, para excluir un falso negativo se llevará a cabo la determinación de interferón gamma, dada su mayor sensibilidad respecto a la PT. También estaría indicada la realización de IGRA en aquellos casos con alta probabilidad de PT falsamente positivo (personas con bajo riesgo de infección TB)40.
En aquellos con un test positivo, se debe realizar una radiografía de tórax, y una historia clínica dirigida a los síntomas de la enfermedad y exploración física completa. En el caso de sospecha de TB activa, se deben recoger muestras de esputo o de otras localizaciones (adenopatías, pleura,...) antes de iniciar tratamiento para la ITL.
Tratamiento de la infección tuberculosa latenteEl tratamiento de la ITL siempre se iniciará una vez descartada la enfermedad. Se deben valorar además circunstancias como la presencia de hepatopatía, garantía de seguimiento del tratamiento, compromiso por parte del paciente de cumplimentarlo y si previamente ya se ha realizado tratamiento de enfermedad o de infección.
Los datos existentes indican que el estudio y el tratamiento de la ITL puede ser una intervención costoefectiva en grupos de población con una alta prevalencia de ITL o alto riesgo de progresión a TB activa, como los inmigrantes procedentes de países con alta incidencia de TB11.
Pautas convencionales y cortasEl tratamiento de la ITL más estudiado y con eficacia demostrada es con isoniacida 300mg/24h durante 6 meses; sin embargo, la larga duración de la pauta, unido a que el sujeto infectado se encuentra asintomático, hace muy difícil lograr una buena adherencia al tratamiento, por lo que son frecuentes los incumplimientos y abandonos.
Este inconveniente trata de evitarse con pautas más cortas que, generalmente, utilizan asociaciones de dos fármacos y que han demostrado eficacia similar a la pauta larga de H. Las que han demostrado su eficacia son:
- -
La H y la R durante 3 meses
- -
La R y la pirazinamida (Z) durante 2 meses
- -
R durante 4 meses, especialmente cuando hay resistencia a isoniacida.
Su mayor ventaja es la menor duración del tratamiento, lo que contribuye a una mayor adherencia, aunque en el caso de la pauta con R y Z el número de comprimidos diario aumenta notablemente al no existir un preparado comercial que incluya ambos fármacos.
En general, todas las pautas que incluyen H se asocian a un grado variable de hepatotoxicidad. Este aspecto es especialmente relevante debido a la elevada frecuencia de coinfección por el virus B de la hepatitis o la prevalencia de alcoholismo en la población inmigrante41.
En sujetos que han estado en contacto con tuberculosis multirresistente (TB-MDR) no existe ningún esquema recomendado y demostrado efectivo, por lo que es recomendable mantener una vigilancia con controles periódicos cada tres o seis meses durante al menos 2 años11,13,42.
Tratamiento de la tuberculosisSe considera que un régimen terapéutico reúne las condiciones para ser utilizado cuando cura a más del 95% de los pacientes y ocasiona menos del 5% de intolerancias graves que obliguen a su modificación13. El mejor tratamiento será el formado por fármacos que tengan un alto poder bactericida y esterilizante, con bajo número de recidivas, buena tolerancia, pocos efectos secundarios, administrados simultáneamente y en preparados que contengan todos los fármacos combinados. Esto facilita el cumplimiento y evita los fracasos y la aparición de resistencias. Los tratamientos antituberculosos no deberían tener un coste elevado para que puedan utilizarse incluso en países con bajo poder adquisitivo.
Los fármacos antituberculosos se clasifican en:
- -
Grupo 1: fármacos de primera línea orales: H, R, Z y etambutol (E).
- -
Grupo 2: inyectables: estreptomicina, capreomicina, kanamicina, amikacina.
- -
Grupo 3: quinolonas: moxifloxacino, levofloxacino, oxifloxacino, ciprofloxacino.
- -
Grupo 4: fármacos de segunda línea orales: etionamida/protionamida, cicloserina/terizidona y ácido paraaminosalicílico.
- -
Grupo 5: posibles fármacos de refuerzo: linezolid, clofazimina, carbapenemes, amoxicilina-clavulánico, claritromicina.
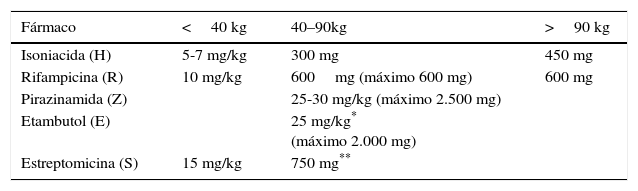
Las dosis recomendadas para cada fármaco se detallan en las tablas 2 y 3.
Dosificación orientativa de los fármacos de primera línea (diaria, según peso)
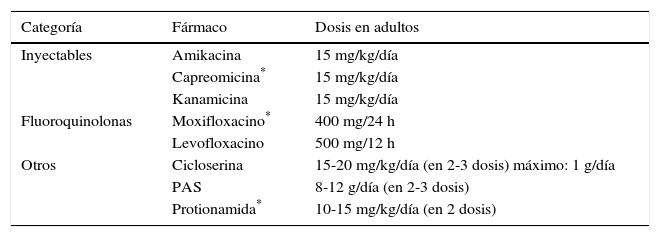
Fármacos de segunda línea. Dosis recomendadas
| Categoría | Fármaco | Dosis en adultos |
|---|---|---|
| Inyectables | Amikacina | 15 mg/kg/día |
| Capreomicina* | 15 mg/kg/día | |
| Kanamicina | 15 mg/kg/día | |
| Fluoroquinolonas | Moxifloxacino* | 400 mg/24 h |
| Levofloxacino | 500 mg/12 h | |
| Otros | Cicloserina | 15-20 mg/kg/día (en 2-3 dosis) máximo: 1 g/día |
| PAS | 8-12 g/día (en 2-3 dosis) | |
| Protionamida* | 10-15 mg/kg/día (en 2 dosis) |
PAS: ácido paraaminosalicílico.
Los esquemas de tratamiento que han sido recomendados universalmente son los de 6 meses de duración: 2 meses con R, H, Z y E, seguidos de 4 meses con R y H (2RHZE/4RH). Cuando se identifique, mediante el antibiograma, que el M. tuberculosis es sensible a estos fármacos se podrá retirar el etambutol13.
Como ya se ha indicado, se recomienda utilizar siempre los preparados que combinan dosis fijas de los fármacos de primera línea ya que facilitan el cumplimiento del tratamiento y previenen el desarrollo de resistencias al evitar la monoterapia en caso de abandono. Actualmente existen preparados con 4 fármacos (RHZE), 3 fármacos (RHZ) y 2 fármacos (RH). Las pautas iniciales de tratamiento se detallan en la tabla 4.
Tratamientos iniciales de la tuberculosis
| Localización | Pauta |
|---|---|
| Pulmonar y extrapulmonar | 2HRZE/4HR */** |
| Tratamientos iniciales alternativos | 2HRZS/4HR |
| 2HRE/7HR | |
| Situaciones especiales (gota, hepatopatía crónica grave) | 2HRE/7HR |
| Meningitis, tuberculomas | 2HRZE/10HR |
| Silicosis, espondilitis TB con afección neurológica | 2HRZE/7HR |
E: etambutol; H: isoniacida; R: rifampicina; S: estreptomicina; TB: tuberculosis; Z: Pirazinamida.
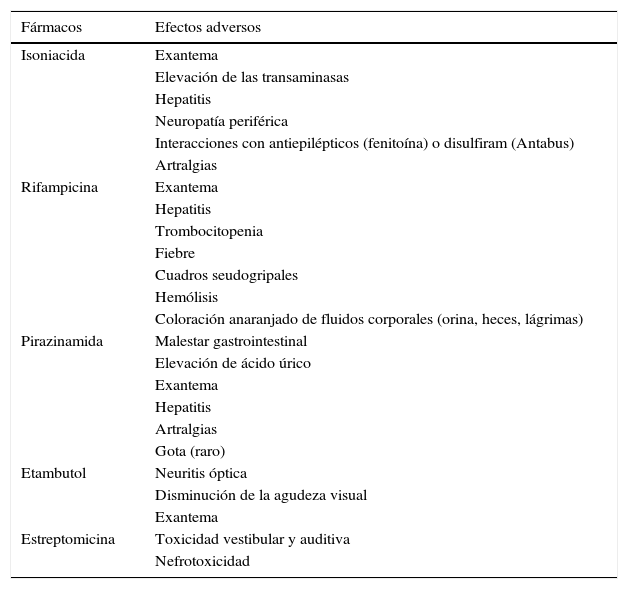
Los principales efectos secundarios se muestran en la tabla 5. Respecto a los fármacos de primera línea, el más frecuente es la intolerancia digestiva inicial, que puede inducir al abandono o cumplimiento irregular del tratamiento. Generalmente es suficiente con repartir la medicación en varias tomas durante unos días; en algunos casos se deberá añadir omeprazol o metoclopramida durante un período corto de tiempo hasta conseguir la tolerancia deseada. En casos más difíciles es preciso recurrir a la medicación por vía parenteral. Estas medidas deben ser lo más breves posible para conseguir en pocas semanas que toda la medicación se tome conjuntamente.
Efectos adversos de los fármacos antituberculosos de primera línea
| Fármacos | Efectos adversos |
|---|---|
| Isoniacida | Exantema |
| Elevación de las transaminasas | |
| Hepatitis | |
| Neuropatía periférica | |
| Interacciones con antiepilépticos (fenitoína) o disulfiram (Antabus) | |
| Artralgias | |
| Rifampicina | Exantema |
| Hepatitis | |
| Trombocitopenia | |
| Fiebre | |
| Cuadros seudogripales | |
| Hemólisis | |
| Coloración anaranjado de fluidos corporales (orina, heces, lágrimas) | |
| Pirazinamida | Malestar gastrointestinal |
| Elevación de ácido úrico | |
| Exantema | |
| Hepatitis | |
| Artralgias | |
| Gota (raro) | |
| Etambutol | Neuritis óptica |
| Disminución de la agudeza visual | |
| Exantema | |
| Estreptomicina | Toxicidad vestibular y auditiva |
| Nefrotoxicidad |
La toxicidad hepática puede estar causada por H, R o Z. La frecuencia y gravedad aumentan en presencia de factores de riesgo hepático (abuso de alcohol y otras drogas, hepatopatías, fármacos hepatotóxicos) y también con la edad.
Las reacciones cutáneas leves (acné, exantema o urticaria) son frecuentes, sobre todo durante el primer mes; generalmente no precisan tratamiento y remiten a las pocas semanas. Las reacciones de hipersensibilidad generalizadas son raras.
Otra complicación es la aparición de fiebre persistente por los fármacos. Una vez excluidas otras causas, debe determinarse el fármaco causante y sustituirlo; en algunas ocasiones puede ser necesario añadir pautas descendentes de corticoides.
En todos los cambios de medicación debe seguirse estrictamente la norma de mantener al menos una pauta de 3 fármacos durante la fase inicial del tratamiento y de 2 fármacos en la fase de continuación, evitando la monoterapia que podría provocar una selección de mutantes resistentes.
Pautas no estándarUna pauta no estándar (PNE) es la que contiene una combinación de fármacos distinta de la que se recomienda para los tratamientos iniciales, tiene siempre una duración superior que las pautas estándar (9-24 meses) y casi siempre incluye fármacos de segunda línea, que son menos efectivos, producen más efectos secundarios, son más caros y obligan a un cumplimiento muy estricto para no crear resistencias. Sus principales indicaciones son los pacientes con intolerancia o resistencia a uno o más de los fármacos de primera línea. Aunque las pautas de tratamiento son las mismas para la población inmigrante y la autóctona, dado que la proporción de casos de resistencia y multirresistencia es superior entre inmigrantes, se utilizarán tratamientos con PNE con mayor frecuencia que en la población autóctona1,43.
En el diseño de las PNE el régimen empleado debe constar de al menos 4 fármacos eficaces. Las más utilizadas son:
- -
Pacientes con resistencia o toxicidad por H: sustituir este fármaco por E y prolongar el tratamiento hasta un total de 12 meses (2 REZ/10 RE).
- -
Resistencia o toxicidad por R: sustituir la R por E y mantener el tratamiento durante 18 meses (2 HEZ/16 HE).
- -
Resistencia o toxicidad a Z: se recomienda una pauta de tratamiento de 9 meses de duración (2 HRE+7HR).
La TB-MDR ocurre en pacientes con resistencia simultánea al menos a H y R con o sin resistencia a otros antituberculosos. La tuberculosis extremadamente resistente es aquella en la que además se ha desarrollado resistencia a cualquier quinolona y al menos a uno de los tres fármacos inyectables de segunda línea (capreomicina, amikacina o kanamicina)4,13,44.
El tratamiento de la TB-MDR debe ser individualizado, guiado por antibiograma y teniendo en cuenta el historial farmacológico del paciente. El régimen empleado debe constar de al menos 4 fármacos eficaces y su duración debe prolongarse hasta cumplir 18-24 meses de cultivos consecutivamente negativos.
Seguimiento de los pacientesDado que el tratamiento de la TB es largo, incluye varios fármacos potencialmente tóxicos y debe hacerse de forma regular y sin interrupciones, el control debe ser estricto. No debería indicarse un tratamiento sin organizar un sistema de controles periódicos. En muchos casos, sería suficiente un sistema de controles a los 15 días, al mes, a los 2, 4 y 6 meses tras el inicio del tratamiento; sin embargo, en los pacientes con alto riesgo de abandono del tratamiento, como ocurre en la población inmigrante, se deben realizar controles más frecuentes (mensuales) para valorar el cumplimiento terapéutico, detectar posibles efectos adversos e incentivar la toma de medicación.
Tratamiento directamente observadoEl problema de la adherencia al tratamiento es muy frecuente en cualquier enfermedad que requiera la autoadministración de los fármacos de manera prolongada. En pacientes con especial riesgo de abandono precoz de la medicación (indigentes, presos, toxicómanos, inmigrantes, etc.) y en todos los casos en que se sospeche la posibilidad de incumplimiento, es preciso aplicar un sistema de tratamiento directamente observado (TDO), propugnado como clave en el abordaje de la TB en los países en desarrollo por las organizaciones internacionales y nacionales de control de la enfermedad13,45.
El TDO consiste en la toma de la medicación observada por personal sanitario adiestrado, aunque en casos especiales puede aceptarse que sea la familia o trabajadores sociales. Puede llevarse a cabo en el hospital durante el ingreso del paciente, en un centro sanitario al que acuda diariamente o en su domicilio o lugar de trabajo donde es visitado diariamente por el sanitario. El TDO no debe limitarse a la administración de fármacos y control clínico del paciente, ya que se precisa el manejo interdisciplinario de estos pacientes, proporcionándoles una atención integral (sanitaria, psicológica y social) y procurando corresponsabilizar al enfermo con su curación. Es necesario conocer las claves y los valores sobre salud y enfermedad, para influir sobre la motivación de seguir estos largos tratamientos, incluido el de la ITL, utilizando un programa de educación para la salud. En el caso de algunos pacientes, debe estructurarse con un sistema de tratamiento incentivado individualmente, procurando mejorar la confianza médico-paciente. Los mejores incentivos son abonos de transporte público, comida, alojamiento, en ocasiones retribuciones económicas, sin olvidar el apoyo de los servicios de asistencia social42,45,46.
Los TDO constituyen una estrategia coste eficiente y han sido propugnados como la mejor alternativa para el control de la enfermedad47.
Mediadores sociosanitarios y agentes comunitarios de saludEl control de la TB importada debe enfocarse desde una perspectiva general, contando con la colaboración de las diferentes administraciones, la participación de las ONG y con mediadores sociosanitarios y agentes comunitarios de salud que permitan identificar los problemas del colectivo inmigrante para desarrollar programas adaptados a sus necesidades, y que faciliten su integración social y sanitaria48.
Los agentes comunitarios de salud ponen a disposición del paciente los recursos de apoyo con los que cuentan los servicios locales, así como la propia comunidad (asociaciones, recursos administrativos, de asistencia social, etc.). Desarrollan además tareas encaminadas a solventar las dificultades generadas por las diferencias culturales entre el paciente y el personal sanitario, y realizan acciones encaminadas a aumentar el nivel de información, a fin de reducir el posible efecto negativo que las prácticas médicas o los procesos administrativos pueden provocar en el paciente por falta de experiencia previa. De este modo, se facilita en la población inmigrante la promoción de hábitos saludables, la realización de un examen básico de salud, el estudio de contactos de enfermos con TB, la búsqueda activa de pacientes infectados que puedan ser candidatos al tratamiento de la ITL y el TDO.
GratuidadUna medida de apoyo muy importante que ayuda a mejorar la adherencia al tratamiento es el acceso sencillo y rápido a los medicamentos, y especialmente su gratuidad10. No podemos olvidar que se trata de una población con escasos recursos económicos.
Tuberculosis en situaciones especialesTratamiento de la tuberculosis en el paciente con infección por el VIHLa infección bacteriana oportunista más frecuente en el inmigrante infectado por el VIH es, como en el paciente autóctono, la producida por M. tuberculosis. La coinfección TB-VIH debe ser manejada siempre por expertos en ambas infecciones.
El tratamiento estándar (2HRZE/4HR) en pauta diaria con combinaciones fijas de fármacos es el más eficaz para el paciente infectado por el VIH y para el que se desconoce si lo está o no. Se recomienda determinar la serología del VIH a todo paciente con TB49. Los problemas terapéuticos suelen derivar de la mayor prevalencia de resistencia a múltiples fármacos antituberculosos en estos pacientes, que se trata con las mismas directrices que en el no infectado por el VIH, de la gravedad y el momento evolutivo de ambas infecciones y de las posibles interacciones farmacológicas. Estas son especialmente relevantes en el caso de las rifamicinas, por ser potentes inductoras del sistema enzimático CYP3A4, implicado en el metabolismo de la mayoría de las familias de fármacos antirretrovirales. Como principio general, debe intentarse, siempre que se pueda, incluir R en el tratamiento de la TB y usar un régimen antirretroviral con fármacos sin problemas de interacciones con la misma, puesto que sin R el tratamiento antituberculoso es mucho menos efectivo12. Para el paciente que inicia TAR, la elección del régimen debe seguir las mismas normas que para la población sin TB y debe incluir, por tanto, dos análogos de nucleósidos y un tercer fármaco, considerándose hasta ahora efavirenz la opción de elección como dicho tercer fármaco para el tratamiento simultáneo de la TB y la infección VIH50. Se recomienda iniciar TAR siempre durante el tratamiento de la TB, independientemente del recuento de células CD4+, ya que se disminuye el riesgo de muerte, si bien el momento óptimo de iniciar el TAR depende de tal recuento: si el recuento es<50 células/μl, debe iniciarse lo antes posible, tras comprobar la tolerancia al tratamiento antituberculoso y no más tarde de las dos primeras semanas. Si el recuento de CD4+es>50 células/μl, puede retrasarse el inicio del TAR hasta finalizar la fase intensiva del tratamiento antituberculoso (8 semanas). Con estas recomendaciones se disminuye el riesgo de efectos adversos y de desarrollo de síndrome inflamatorio por reconstitución inmunológica, sin comprometer la supervivencia50.
Embarazo y lactanciaNi el embarazo ni la lactancia modifican el tratamiento estándar de la TB, y pueden añadirse pequeñas dosis de piridoxina para el lactante12. En el embarazo está contraindicada la estreptomicina, así como kanamicina, amikacina y capreomicina, por toxicidad fetal; se conoce poco la de otros fármacos de segunda línea, como la cicloserina, protionamida y fluoroquinolonas, que requerirán una valoración puntual de su riesgo y beneficio.
ConclusionesLos programas de control de TB en la población inmigrante deberían centrar sus esfuerzos en eliminar las barreras que pueden dificultar el diagnóstico y el tratamiento de la enfermedad. Solventar la barrera idiomática y cultural con el empleo de mediadores sociosanitarios y agentes comunitarios de salud, la facilitación del acceso al Sistema Nacional de Salud mediante la tarjeta sanitaria, el establecimiento de estrategias específicas con programas de control de la TB, la mejora del nivel educacional de este colectivo, la colaboración con asociaciones de inmigrantes y ONG y, en muchos casos, la gratuidad de los medicamentos, son medidas que han demostrado ser eficaces para el control de la enfermedad.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Este trabajo ha sido realizado dentro de las actividades desarrolladas por el grupo de investigación CTS-582 de la Consejería de Salud de la Junta de Andalucía y el CEMyRI (Centro de Estudio de las Migraciones y Relaciones Interculturales) de la Universidad de Almería.