valorar la prevalencia de colonización crónica por Staphylococcus aureus resistente a meticilina (SARM) en pacientes con fibrosis quística, describir la sensibilidad antibiótica de las cepas, así como comparar las características clínicas con los pacientes con S. aureus sensible a meticilina (SASM).
Pacientes y métodosde un total de 50 pacientes con FQ se seleccionó a los colonizados crónicamente por S. aureus. Las muestras de esputo se cultivaron según los procedimientos microbiológicos habituales, se consideró colonización bronquial crónica el aislamiento de un mismo microorganismo en más de 3 muestras respiratorias consecutivas con un intervalo mínimo de 1 mes entre ellas. Se compararon las siguientes variables entre los pacientes con SASM (n=17) y aquellos con SARM (n=8): sexo, índice de masa corporal, insuficiencia pancreática, colonización bacteriana, función pulmonar, puntuaciones radiológicas de Brasfield y clínica de Shwachman y número de exacerbaciones respiratorias en el año previo.
Resultadosla prevalencia de infección por SARM fue del 16%. El 100% de las cepas SARM fueron sensibles a vancomicina, teicoplanina y linezolid. Los enfermos con SARM tenían más edad, peor estado clínico y mayor número de exacerbaciones respiratorias que los pacientes con SASM.
Conclusioneshay un alto porcentaje de colonización por SARM en los pacientes adultos con fibrosis quística. Aunque el papel patogénico de esta bacteria está aún por determinar, parece que los pacientes con SARM tienen un peor estado clínico y presentan muchas exacerbaciones, por lo que la instauración de medidas de control y vigilancia es importante.
To determine the prevalence of chronic colonization with methicillin-resistant Staphylococcus aureus (MRSA) in patients with cystic fibrosis, describe antibiotic sensitivity of the strains, and compare the patients’ clinical characteristics with those of patients infected with methicillin-sensitive S. aureus (MSSA).
Patients and methodsPatients with chronic S. aureus colonization were selected from a total of 50 patients with cystic fibrosis. Sputum samples were cultured according to standard microbiological procedures. Patients were considered to have chronic bronchial colonization if the same microorganism was isolated in 3 consecutive sputum samples, separated by an interval of at least 1 month. The following variables were compared between patients with MSSA (17) and MRSA (8): sex, body mass index, presence of pancreatic insufficiency, bacterial colonization, pulmonary function, Brasfield radiological score, Shwachman clinical score, and number of respiratory exacerbations in the previous year.
ResultsThe prevalence of infection by MRSA was 16%. All the MRSA strains were sensitive to vancomycin, teicoplanin, and linezolid. Patients with MRSA were older and had a larger number of respiratory exacerbations than patients with MSSA.
ConclusionsThere is a high percentage of colonization by MRSA in adult cystic fibrosis patients. Although the pathogenic role of this microorganism remains unclear, patients with MRSA had more frequent exacerbations and poorer lung function. Thus, infection control is important and patients should be adequately monitored.
La fibrosis quística (FQ) es una enfermedad genética, autosómica recesiva, cuya incidencia, en estudios de detección precoz neonatal, es variable en los diferentes países y razas1. En los últimos 50 años la supervivencia de los pacientes con FQ se ha visto incrementada por los avances en el tratamiento de la infección pulmonar crónica y por el seguimiento en unidades monográficas multidisciplinarias. La alteración o la ausencia de la proteína de membrana (cystic fibrosis conductance transmembrana regulator) ocasionan secreciones espesas en las vías aéreas que favorecen las infecciones bacterianas por Staphylococcus aureus, Haemophilus influenzae o Pseudomonas aeruginosa que, a su vez, estimulan una respuesta inflamatoria mediada básicamente por neutrófilos, y se incrementa aún más el daño tisular1.
Como consecuencia de los múltiples ciclos antibióticos que reciben los pacientes con FQ para tratar las infecciones respiratorias se aíslan cada vez con más frecuencia microorganismos multirresistentes. Entre éstos cabe destacar, aunque con importancia patógena aún por determinar, S. aureus resistente a meticilina (SARM), Achromobacter xylosoxidans, Stenotrophomonas maltophilia y micobacterias ambientales2.
En general, SARM es unos de los patógenos nosocomiales de mayor relevancia. Es un patógeno virulento que puede originar infecciones invasoras que conllevan mayores morbimortalidad y coste económico que S. aureus sensible (SASM). La epidemiología del SARM está cambiando. Ello lleva a clasificar los clones según el modo de adquisición en: nosocomiales, nosocomiales importados, relacionados con los cuidados sanitarios y comunitarios; este último grupo presenta sensibilidad a la mayoría de los antimicrobianos no betalactámicos3.
El objetivo de nuestro trabajo fue valorar la prevalencia de colonización crónica de la vía aérea por SARM en pacientes diagnosticado de FQ, describir la sensibilidad antibiótica de las cepas, así como comparar las características clínicas y el número de exacerbaciones respiratorias entre los pacientes con SARM y SASM.
Pacientes y métodosSe realizó un estudio transversal en 50 pacientes diagnosticados de FQ de la Unidad de Adultos del Hospital Universitario de la Princesa. Se seleccionaron dos grupos, colonizados crónicamente en el año previo por S. aureus sensible o resistente a meticilina.
Se registraron en estos dos grupos las variables siguientes: edad, sexo, índice de masa corporal, insuficiencia pancreática, colonización bacteriana de la vía aérea, función pulmonar, puntuaciones radiológicas de Brasfield y clínica de Shwachman y número de exacerbaciones respiratorias registradas en el año previo; en los pacientes con SARM se valoraron los tratamientos recibidos para esas exacerbaciones. Se consideró que el enfermo presentaba insuficiencia pancreática cuando la determinación de grasa en heces de 72h o la prueba de Van de Kamer estaba alterada y precisaba enzimas pancreáticas para la digestión de los alimentos. Se recogieron los valores absolutos y porcentajes sobre el valor teórico estándar de los siguientes parámetros de función pulmonar: capacidad vital forzada (FVC), volumen espirado máximo en el primer segundo (FEV1) y FEV1/FVC. Dichas variables se compararon entre los dos grupos.
En la puntuación de Brasfield se evalúa de 0-5 (de menor a mayor afectación) 5 signos radiológicos: atrapamiento aéreo, sombras lineales, lesiones nódulo-quísticas, consolidaciones segmentarias o lobulares y la impresión general de gravedad. La puntuación global obtenida se restaba a 25. A menor valor conseguido, mayor gravedad radiológica. La radiografía de tórax, con su correspondiente puntuación de Brasfield, se realiza anualmente.
En la puntuación clínica de Shwachman se evalúa 4 ítems con puntuación máxima de 25 cada uno de ellos: actividad general, exploración física, crecimiento y nutrición y radiografía de tórax. La puntuación ideal es 100 y el estado de los pacientes se clasificó, según esta puntuación, en excelente (86–100 puntos), bueno (71–85), leve (56–70), moderado (40–55) o grave (⩽40).
Las muestras de esputo para el estudio microbiológico se habían recogido en cada visita clínica de los pacientes, incluidas las exacerbaciones respiratorias. Se definió como colonización bronquial el aislamiento de un mismo microorganismo en más de 3 muestras respiratorias consecutivas, con un intervalo mínimo de 1 mes entre ellas. Los pacientes debían llevar al menos 1 año colonizados por S. aureus para incluirlos en el estudio.
Las muestras de esputo se procesaron siguiendo los procedimientos microbiológicos habituales; se realizó tinción de Gram y cuantificación de colonias en los medios de oxidación-fermentación polimyxina bacitracina lactosa (OFPBL), Sabouraud cloranfenicol, agar sangre, agar chocolate con bacitracina, MacConkey y manitol sal. Las cepas aisladas se identificaron por pruebas convencionales y mediante el sistema automatizado Micro-scan (Dade-Behring). La sensibilidad a antimicrobianos se determinó mediante el sistema automático y pruebas de difusión disco-placa siguiendo las recomendaciones del Clinical and Laboratory Standard Institute (CLSI). En los casos en que la resistencia a meticilina era dudosa, principalmente variantes de S. aureus de colonia pequeña, se realizó un test de aglutinación comercial para la detección de PBP 2′ (Oxoid PBP 2′ test)4. Si aún persistía un resultado no concluyente, se llevaba a cabo un test de PCR a tiempo real utilizando un kit comercial, LightCycler MRSA (Roche Diagnostics, España), para la detección del gen mecA.
Análisis estadísticoSe describieron las variables cuantitativas mediante la media y sus desviaciones estándar y las variables cualitativas calculando los porcentajes de las distintas categorías. Las comparaciones de las variables cuantitativas entre los dos grupos se realizaron por el análisis de la variancia y las de las cualitativas mediante la prueba de la χ2. Todos los cálculos estadísticos se realizaron con el programa SPSS 11.5 y se consideraron estadísticamente significativos los valores de p<0,05.
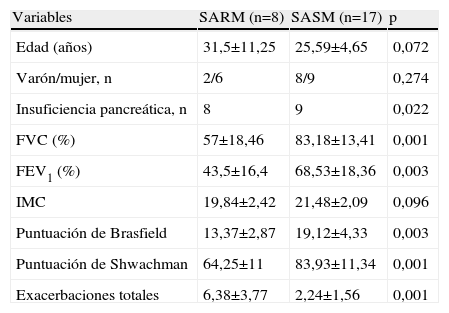
ResultadosDe los 50 pacientes evaluados con FQ, 25 (10 varones y 15 mujeres, con una media de edad de 27,48 años) estaban colonizados por S. aureus, 8 SARM y 17 SASM (tabla 1). En el 100% de los casos había otra bacteria colonizante: P. aeruginosa en 4 de cada grupo, H. influenzae en 2 y 16 pacientes y otros bacilos gramnegativos en 2 y 5 pacientes con SARM y SASM. respectivamente. No hubo diferencias entre los dos grupos en cuanto a la colonización de P. aeruginosa y otros bacilos gramnegativos, mientras que sí se constataron con H. influenzae (p<0,01).
Comparación entre los pacientes con SARM y SASM
| Variables | SARM (n=8) | SASM (n=17) | p |
| Edad (años) | 31,5±11,25 | 25,59±4,65 | 0,072 |
| Varón/mujer, n | 2/6 | 8/9 | 0,274 |
| Insuficiencia pancreática, n | 8 | 9 | 0,022 |
| FVC (%) | 57±18,46 | 83,18±13,41 | 0,001 |
| FEV1 (%) | 43,5±16,4 | 68,53±18,36 | 0,003 |
| IMC | 19,84±2,42 | 21,48±2,09 | 0,096 |
| Puntuación de Brasfield | 13,37±2,87 | 19,12±4,33 | 0,003 |
| Puntuación de Shwachman | 64,25±11 | 83,93±11,34 | 0,001 |
| Exacerbaciones totales | 6,38±3,77 | 2,24±1,56 | 0,001 |
FEV1: volumen espiratorio en el primer segundo; FVC: capacidad vital forzada; IMC: índice de masa corporal; SARM: Staphylococcus aureus resistente a meticilina; SASM: S. aureus sensible a meticilina.Los datos indican media±desviación estándar, excepto donde se indica.
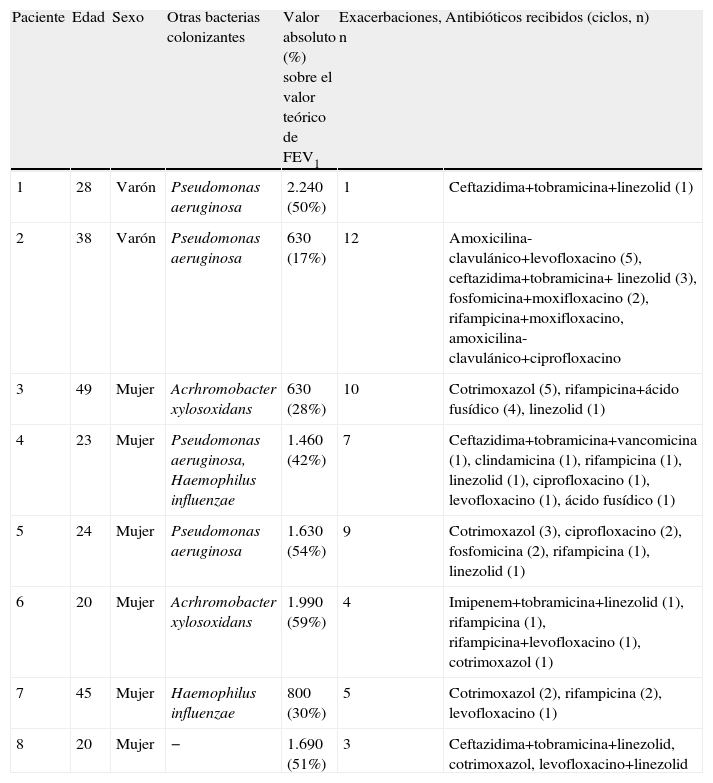
Las características de cada uno los pacientes con SARM, así como el número de exacerbaciones respiratorias y los antibióticos que recibieron en el año previo, se muestran en la tabla 2. A 7 de los 8 pacientes con SARM, con la intención de erradicar las bacterias y/o disminuir el número de exacerbaciones respiratorias, se les había administrado vancomicina inhalada de forma continua a dosis de 250mg/12h diluidos en 10ml de suero fisiológico, con mala tolerancia (broncospasmo) en 5 de ellos, lo que obligó a la suspensión del tratamiento; sólo los pacientes números 1 y 8 continúan recibiendo el glucopéptido en la actualidad y son los que tuvieron menos exacerbaciones.
Características de los pacientes con fibrosis quística colonizados por Staphylococcus aureus resistente a meticilina
| Paciente | Edad | Sexo | Otras bacterias colonizantes | Valor absoluto (%) sobre el valor teórico de FEV1 | Exacerbaciones, n | Antibióticos recibidos (ciclos, n) |
| 1 | 28 | Varón | Pseudomonas aeruginosa | 2.240 (50%) | 1 | Ceftazidima+tobramicina+linezolid (1) |
| 2 | 38 | Varón | Pseudomonas aeruginosa | 630 (17%) | 12 | Amoxicilina-clavulánico+levofloxacino (5), ceftazidima+tobramicina+ linezolid (3), fosfomicina+moxifloxacino (2), rifampicina+moxifloxacino, amoxicilina-clavulánico+ciprofloxacino |
| 3 | 49 | Mujer | Acrhromobacter xylosoxidans | 630 (28%) | 10 | Cotrimoxazol (5), rifampicina+ácido fusídico (4), linezolid (1) |
| 4 | 23 | Mujer | Pseudomonas aeruginosa, Haemophilus influenzae | 1.460 (42%) | 7 | Ceftazidima+tobramicina+vancomicina (1), clindamicina (1), rifampicina (1), linezolid (1), ciprofloxacino (1), levofloxacino (1), ácido fusídico (1) |
| 5 | 24 | Mujer | Pseudomonas aeruginosa | 1.630 (54%) | 9 | Cotrimoxazol (3), ciprofloxacino (2), fosfomicina (2), rifampicina (1), linezolid (1) |
| 6 | 20 | Mujer | Acrhromobacter xylosoxidans | 1.990 (59%) | 4 | Imipenem+tobramicina+linezolid (1), rifampicina (1), rifampicina+levofloxacino (1), cotrimoxazol (1) |
| 7 | 45 | Mujer | Haemophilus influenzae | 800 (30%) | 5 | Cotrimoxazol (2), rifampicina (2), levofloxacino (1) |
| 8 | 20 | Mujer | − | 1.690 (51%) | 3 | Ceftazidima+tobramicina+linezolid, cotrimoxazol, levofloxacino+linezolid |
FEV1: volumen espiratorio en el primer segundo.
La sensibilidad antibiótica de las cepas fue la siguiente: sensibles 100% a vancomicina, teicoplanina, linezolid, cloranfenicol y tetraciclinas, 62,5% a gentamicina, 50% a rifampicina, 37,5% a fosfomicina, clindamicina y cotrimoxazol y resistentes a eritromicina, claritromicina y ciprofloxacino.
Cuando se compararon las características clínicas: edad, sexo, insuficiencia pancreática, puntuaciones de Brasfield y Shwachman, IMC, función pulmonar y exacerbaciones respiratorias en el año previo, se observó que los pacientes colonizados por SARM tenían mayor edad, peor función pulmonar y puntuaciones radiológicas y cínicas, así como mayor número de exacerbaciones que los enfermos con SASM (tabla 2).
DiscusiónEl análisis muestra una prevalencia del 16% de pacientes colonizados por SARM en nuestra unidad de FQ de adultos. Los enfermos con SARM tenían más edad, peor estado clínico y mayor número de exacerbaciones respiratorias que los pacientes con SASM.
S. aureus es un colonizador habitual de las vías respiratorias de sujetos con FQ y el más frecuentemente implicado en la edad infantil, que pasa a ser, en la edad adulta, el segundo patógeno tras P. aeruginosa. Las cepas resistentes a meticilina son un problema de frecuencia creciente, sobre todo en la población adulta, y variable entre diferentes centros, que se refleja en las tasas de resistencia a meticilina propias de cada hospital (el 32% en nuestro hospital en 2006), ya que la adquisición de este tipo de cepas es fundamentalmente hospitalaria, aunque en los últimos años hay un aumento de las cepas extrahospitalarias y las relacionadas con los cuidados sanitarios5–7. Según los datos del registro estadounidense de pacientes con FQ, en el año 2003 la prevalencia de SARM fue del 11,8%, mientras que 2 años más tarde aumentó hasta el 17,2%, similar a la nuestra; así SARM es la tercera bacteria colonizante después de P. aeruginosa y SASM, seguido de cerca por H. influenzae8,9.
Nadesalingam et al10 analizaron los factores de riesgo de SARM en los pacientes con FQ y concluyeron que disminuir las estancias hospitalarias y el uso juicioso de antibióticos, especialmente de ciprofloxacino, sería una estrategia muy útil para reducir su incidencia. Miall et al11 valoraron, en 10 de 300 niños con FQ, el efecto de la infección por SARM comparado con un grupo control. Concluyen que los pacientes con aislamientos de SARM tienen peores puntuaciones radiológicas, reciben más antibióticos y presentan mayor deterioro en la curva del crecimiento, aunque no en la función pulmonar. Una publicación reciente, sobre 20.451 pacientes, del registro estadounidense del año 2001, compara las características clínicas entre pacientes colonizados exclusivamente por SASM y SARM. Los enfermos con SARM tienen una peor función pulmonar, así como más hospitalizaciones y reciben más antibióticos, tanto por vía oral como inhalada e intravenosa, que aquellos colonizados con SASM12. Estos datos son coincidentes con los nuestros.
Aunque no está del todo claro que SARM, como colonizador bronquial del enfermo, implique necesariamente un aumento en la morbimortalidad4–7, sí es importante la limitación en las opciones terapéuticas disponibles ante posibles reagudizaciones de la sintomatología pulmonar, ya que la resistencia a meticilina, además de implicar la ineficacia de todos los antibióticos betalactámicos, suele estar ligada a mecanismos de resistencia a otros grupos de antibióticos, como quinolonas o aminoglucósidos, siendo el tratamiento intravenoso con vancomicina, hasta hace poco tiempo, el preferido para tratar las exacerbaciones pulmonares moderadas a graves13 y en el caso de las exacerbaciones más leves, con cotrimoxazol, minociclina, fosfomicina, rifampicina y ácido fusídico. No hay consenso sobre el modo de afrontar las exacerbaciones en pacientes con FQ colonizados por SARM5–7. La utilización de vancomicina presenta los inconvenientes de su uso exclusivo intravenoso, que ocasiona flebitis en un 10% de los casos, frecuentes efectos ototóxicos y nefrotóxicos, habitualmente potenciados con la administración concomitante de aminoglucósidos, de amplio uso en FQ. El uso de vancomicina por vía inhalada de forma continua, aunque se ha descrito algún caso con buena respuesta14, tiene el inconveniente de que, al ser un fármaco de uso intravenoso, la formulación tiene un pH muy ácido y con frecuencia causa broncospasmo, incluso con el uso previo de broncodilatadores15. A pesar de ello, se puede intentar bajo supervisión, ya que si el paciente la tolera, puede disminuir el número de exacerbaciones, como ocurrió en 2 de nuestros enfermos. La aparición del linezolid supone una buena, aunque cara, alternativa para el tratamiento de la infección pulmonar por SARM en pacientes afectos de FQ16.
Nuestro trabajo presenta algunas limitaciones. En primer lugar, se trata de un estudio transversal con miras retrospectivas sólo en el análisis de las exacerbaciones respiratorias y, por lo tanto, no compara de forma longitudinal los cambios observados en los otros parámetros de gravedad de los pacientes con SASM y SARM. En segundo lugar, el número de pacientes es escaso para poder determinar los factores de riesgo de adquisición de SARM, y no se puede afirmar definitivamente que el mayor número de exacerbaciones fuera originado únicamente por la colonización por SARM y no estuviera también influido por la mayor edad y la gravedad de los pacientes.
En espera de estudios multicéntricos bien diseñados que diluciden la implicación del SARM en la evolución clínica de los pacientes con FQ, es crucial seguir en estas unidades monográficas, ante la aparición de infección y/o colonización por esta bacteria, las medidas de control recomendadas recientemente por las sociedades GEIH-SEIMC y SEMPSPH17.