Las infecciones del tracto urinario (ITU) son frecuentes en la comunidad. Sin embargo, la información de aislamientos resistentes en este contexto es limitada en Latinoamérica. Este estudio tiene como objetivo determinar la prevalencia y los factores de riesgo asociados con ITU de inicio en la comunidad (ITU-IC) causadas por Escherichia coli productor de betalactamasas de espectro extendido (BLEE) en Colombia.
Materiales y métodosEntre agosto y diciembre de 2011 se realizó un estudio de casos y controles en 3 instituciones de salud de tercer nivel en Colombia. Se invitó a participar a todos los pacientes admitidos a urgencias con diagnóstico probable de ITU-IC, y se les pidió una muestra de orina. En los aislamientos de E.coli se realizaron pruebas confirmatorias para BLEE, susceptibilidad antibiótica, caracterización molecular (PCR en tiempo real para genes bla, repetitive element palindromic PCR [rep-PCR], multilocus sequence typing [MLST] y factores de virulencia por PCR). Se obtuvo información clínica y epidemiológica, y posteriormente se realizó el análisis estadístico.
ResultadosDe los 2.124 pacientes seleccionados, 629 tuvieron un urocultivo positivo, en 431 de estos se aisló E.coli, 54 fueron positivos para BLEE y 29 correspondieron a CTX-M-15.
La mayoría de los aislamientos de E.coli productor de BLEE fueron sensibles a ertapenem, fosfomicina y amikacina. La ITU complicada se asoció fuertemente con infecciones por E.coli productor de BLEE (OR=3,89; IC95%: 1,10-13,89; p=0,03). E.coli productor de CTX-M-15 mostró 10 electroferotipos diferentes; de estos, el 65% correspondieron al ST131. La mayoría de estos aislamientos tuvieron 8 de los 9 factores de virulencia analizados.
DiscusiónE.coli portador del gen blaCTX-M-15 asociado al ST131 sigue siendo frecuente en Colombia. La presencia de ITU-IC complicada aumenta el riesgo de tener E.coli productor de BLEE, lo cual debe tenerse en cuenta para ofrecer una terapia empírica adecuada.
Urinary tract infections (UTI) are common in the community. However, information of resistant isolates in this context is limited in Latin America. This study aims to determine the prevalence and risk factors associated with community-onset UTI (CO-UTI) caused by extended-spectrum β-lactamase (ESBL)-Producing Escherichia coli in Colombia.
Materials and methodsA case-control study was conducted between August and December of 2011 in three Colombian tertiary-care institutions. All patients who were admitted to the Emergency Department with a probable diagnosis of CO-UTI were invited to participate. All participating patients were asked for a urine sample. ESBL confirmatory test, antibiotic susceptibility, and molecular epidemiology were performed in these E.coli isolates (Real Time-PCR for bla genes, repetitive element palindromic PCR [rep-PCR], multilocus sequence typing [MLST] and virulence factors by PCR). Clinical and epidemiological information was recorded, and a statistical analysis was performed.
ResultsOf the 2124 recruited patients, 629 had a positive urine culture, 431 of which grew E.coli; 54 were positive for ESBL, of which 29 were CTX-M-15.
The majority of ESBL isolates were susceptible to ertapenem, phosphomycin and amikacin. Complicated UTI was strongly associated with ESBL-producing E.coli infections (OR=3.89; 95%CI: 1.10-13.89; P=.03). CTX-M-15-producing E.coli showed 10 different pulsotypes, 65% were PT1 or PT4, and corresponded to ST131. Most of these isolates had 8 out of the 9 analysed virulence factors.
DiscussionE.coli harbouring blaCTX-M-15 associated with ST131 is still frequent in Colombia. The presence of complicated CO-UTI increases the risk of ESBL-producing E.coli, and must be taken into account in order to provide an adequate empirical therapy.
Las infecciones del tracto urinario (ITU) son una de las infecciones más frecuentemente encontradas en la comunidad1. Estas infecciones representan una carga para la salud pública y la sociedad, pues cerca de 40% de las mujeres y el 12% de los hombres tendrán al menos un caso de ITU durante su vida adulta2; la infección se asocia con altas tasas de recurrencia y, si no se instaura un manejo antibiótico adecuado, puede progresar rápidamente a sepsis severa y muerte3. El patógeno más importante es Escherichia coli, que causa entre el 70 y el 95% de las ITU de inicio en la comunidad (ITU-IC)1.
Las opciones terapéuticas para la ITU-IC causada por E.coli se han reducido progresivamente por la presencia cada vez más frecuente de betalactamasas de espectro extendido (BLEE), las cuales son enzimas mediadas por plásmidos con la capacidad de hidrolizar penicilinas, oximino-cefalosporinas, cefalosporinas de espectro extendido y aztreonam. Adicionalmente, los organismos productores de BLEE pueden exhibir resistencia cruzada frente a otros antibióticos de uso común, como los aminoglucósidos, las tetraciclinas, el trimetoprim/sulfametoxazol y las quinolonas, como consecuencia de la co-expresión de otros genes de resistencia4-6.
Hasta la década de los noventa las BLEE prevalentes en el mundo eran tipo TEM y SHV, asociadas principalmente a brotes de origen hospitalario causados por Klebsiella pneumoniae. Sin embargo, a partir del año 2000 la enzima tipo CTX-M se convirtió en una de las BLEE más frecuentes, a la vez que E.coli productor de CTX-M emergió como un importante uropatógeno de la comunidad7-10. Actualmente, CTX-M-15 es la BLEE más identificada en el mundo6, asociándose con infecciones de inicio en la comunidad en varios países11. Su diseminación exitosa podría deberse a su asociación con clones internacionales con gran capacidad de diseminación, como el ST131, ST405 y ST61712. Desde el año 2011, cuando se describió por primera vez en Colombia E.coli productor de CTX-M-15 perteneciente a los clones ST131 y ST40513, se han publicado varios reportes con caracterizaciones moleculares, clínicas y epidemiológicas sobre infecciones causadas por este tipo de aislados14-27. Sin embargo, a pesar del incremento sostenido en el reporte de aislamientos de E.coli productor de CTX-M-15 por parte de varios sistemas de vigilancia alrededor del mundo, la información relacionada con los aislamientos provenientes de la comunidad en varios países de América Latina es limitada, ya que la mayoría de estos estudios están dirigidos a vigilar la susceptibilidad antibiótica de muestras urinarias.
Existen algunos factores asociados a la presencia de ITU por bacterias productoras de BLEE en la comunidad publicados en la literatura, y entre estos destacan: el uso previo de antibióticos (cefuroxima, cefalosporinas de tercera generación, aztreonam y quinolonas)28-30, infecciones recurrentes por E.coli, hospitalización reciente (en el último año), nutrición artificial30, presencia de 2 o más comorbilidades que requieran manejo en unidad de cuidados intensivos17, permanencia en hogares de paso y hemodiálisis31. Entre las limitaciones que presentan estos estudios están el hecho de que muchos de estos factores también se encuentran asociados a un riesgo aumentado de padecer ITU, por lo cual su asociación específica con aislados productores de BLEE puede estar siendo sobreestimada32; además, la naturaleza retrospectiva de estos estudios, muchos de cuales tienen tamaños de muestra pequeños, pueden hacer que los factores de riesgo menos prevalentes para BLEE hayan pasado desapercibidos28. Adicionalmente, la no diferenciación de pacientes colonizados de los infectados en los grupos control puede introducir sesgos dentro de los análisis de factores de riesgo30.
El propósito de este estudio fue determinar la prevalencia de ITU-IC causadas por E.coli productor de BLEE, identificando el perfil de susceptibilidad y los factores de riesgo asociados a este tipo de infecciones en hospitales de alta complejidad en Colombia. Adicionalmente, se realizó la tipificación molecular de los aislados productores de CTX-M-15 para conocer su distribución.
Pacientes y métodosSe realizó un estudio de prevalencia inicial en el que se incluyeron todos los aislamientos de E.coli obtenidos a partir de muestras donde se realizó el diagnóstico de ITU-IC. Posteriormente se llevó a cabo un estudio de casos y controles en un período de 5meses (agosto-diciembre de 2011) en 3 instituciones de salud de tercer nivel en Bogotá y Cali, Colombia. Durante 24h al día, los 7días de la semana, un grupo de enfermeras previamente entrenadas invitó a participar del estudio a pacientes de todas las edades y ambos sexos, admitidos al servicio de urgencias con un diagnóstico probable de ITU-IC.
Se consideraron como casos a todos los pacientes con ITU-IC causada por E.coli productor de BLEE, y como controles a los pacientes con ITU-IC causada por E.coli no productor de BLEE. Se definió el diagnóstico de ITU cuando un paciente presentaba un urocultivo positivo, y al menos uno de los siguientes signos o síntomas: disuria, urgencia miccional, aumento de la frecuencia miccional (referida por el paciente), dolor suprapúbico, dolor en flanco, sensación de vaciamiento incompleto y fiebre o escalofríos. Un cultivo de orina se consideró positivo cuando el recuento bacteriano era superior a 100.000 unidades formadoras de colonia (UFC)/ml de una muestra de orina limpia, por encima de 100UFC/ml cuando la muestra era obtenida por catéter, o por encima de 1UFC/ml cuando se obtenía a través de punción suprapúbica. El término ITU-IC incluyó todas las infecciones diagnosticadas durante las primeras 48h después del ingreso al hospital. Adicionalmente, estas fueron clasificadas como ITU-IC propiamente dicha o ITU adquirida en la comunidad (ITU-AC), según la presencia o ausencia de antecedentes asociados a la atención en salud, respectivamente. En este sentido, los episodios de ITU-IC (adquisición relacionada con los cuidados sanitarios) fueron definidos ante la presencia de al menos uno de los siguientes antecedentes en los últimos 3meses: historia de hospitalización ≥48h, infección urinaria asociada a catéter, hemodiálisis, hospitalización en casa (p.ej.: medicación intravenosa o cuidado de heridas), residencia en un hogar geriátrico o institución de cuidado permanente. Los casos que no cumplieron con los anteriores criterios fueron considerados ITU-AC. Finalmente, se clasificó una ITU como complicada cuando se trataba de un paciente con pielonefritis, anomalía estructural o funcional del tracto urinario, inmunosupresión, infección en hombres o durante el embarazo.
Un formato de reporte de caso (CRF) con datos clínicos y epidemiológicos fue utilizado para obtener las siguientes variables: edad, género, convivencia con un trabajador de la salud, comorbilidades, embarazo, antecedentes urológicos, antecedentes farmacológicos en los últimos 3meses, antecedentes asociados a la atención en salud (todos aquellos que definían ITU-IC), tipo de ITU y microorganismo aislado con su respectivo perfil de susceptibilidad antibiótica. Este estudio fue aprobado por los comités de ética de las instituciones participantes. Todos los pacientes enrolados dieron su consentimiento mediante un documento escrito. Todos los aislamientos fueron enviados al laboratorio de resistencia bacteriana del Centro Internacional de Entrenamiento e Investigaciones Médicas (CIDEIM) en Cali, Colombia.
La identificación inicial, las pruebas de susceptibilidad y las pruebas para la identificación de BLEE fueron realizadas por los laboratorios de cada hospital; los resultados fueron interpretados de acuerdo a los puntos de corte CLSI 201433 para los siguientes antibióticos: amikacina, amoxicilina/clavulanato, aztreonam, cefepima, cefotaxima, ceftazidima, ceftriaxona, ciprofloxacino, ertapenem, fosfomicina, nitrofurantoína, piperacilina/tazobactam y trimetoprim/sulfametoxazol. En CIDEIM, la identificación bacteriana fue confirmada a través del sistema automatizado Vitek2 (bioMérieux, Mercy l’Etoile, France) y la detección de BLEE se llevó a cabo fenotípicamente con ceftazidima-ceftazidima/clavulanato y cefotaxima-cefotaxima/clavulanato mediante la técnica de microdilución en caldo, según las recomendaciones CLSI33. La detección de genes blaTEM, blaSHV y blaCTX-MGRUPO1 se realizó a través de PCR en tiempo real de acuerdo al protocolo previamente publicado34; todos los aislamientos blaCTX-MGRUPO1 positivos fueron secuenciados para su identificación final.
Los aislados de E.coli portadores del gen blaCTX-M-15 fueron tipificados mediante repetitive element palindromic PCR [rep-PCR] utilizando el sistema DiversiLab (BioMérieux), según las instrucciones del fabricante, y multilocus sequence typing [MLST] de acuerdo al protocolo disponible para E.coli (http://mlst.ucc.ie/mlst/dbs/Ecoli). Por otro lado, se analizaron 9 genes de virulencia utilizando PCR convencional, como se ha descrito previamente35,36; estos genes correspondieron a mediadores de transporte de glucosa y maltosa (malX), proteína especifica uropatogénica (usp), proteasa de membrana externa (ompT), 2 genes codificadores de adhesinas (papC y fimH), 2 genes relacionados con sideróforos (iutA y fyuA), un gen relacionado con supervivencia sérica (traT), cápsula del grupo-2 LPS (kpsMTII). Determinantes de resistencia a quinolonas mediada por plásmidos fueron estudiados para los genes qnrA, qnrB, y qnrS, usando PCR múltiple según el protocolo descrito por Robicsek et al.37.
Para el análisis estadístico inicial se establecieron proporciones para las variables categóricas. Para comparar las variables categóricas entre los casos y controles se utilizó la prueba de Chi cuadrado o la prueba exacta de Fisher, y para las variables continuas se utilizó la prueba t de Student o Wilcoxon Mann Whitney dependiendo de la normalidad de la muestra. Los factores de riesgo para ITU-IC por E.coli productor de BLEE con un valor de p≤0,20 en el modelo bivariado fueron incluidos en el análisis multivariado mediante un modelo de regresión logística. Los OR y sus respectivos intervalos de confianza (IC) del 95% fueron calculados. Valores de p≤0,05 fueron considerados estadísticamente significativos. Todos los análisis fueron realizados usando el paquete estadístico STATA 9,0.
ResultadosUn total de 2.124 pacientes con ITU fueron captados para el estudio, de los cuales 629 cumplían con los criterios para ITU-IC. De estos, 431 (68,5%) fueron E.coli, y 54 aislamientos (12,5%) tenían resultados positivos para BLEE.
El gen blaCTX-M-15 fue detectado en 29/54 aislados, de los cuales 2/29 aislados co-expresaron blaCTX-M-15/SHV y 7/29 co-expresaron blaCTX-M-15/TEM; los demás aislados solo tenían blaCTX-M-15. La prevalencia total de aislamientos portadores del gen blaCTX-M-15 fue del 6,7% (29/431).
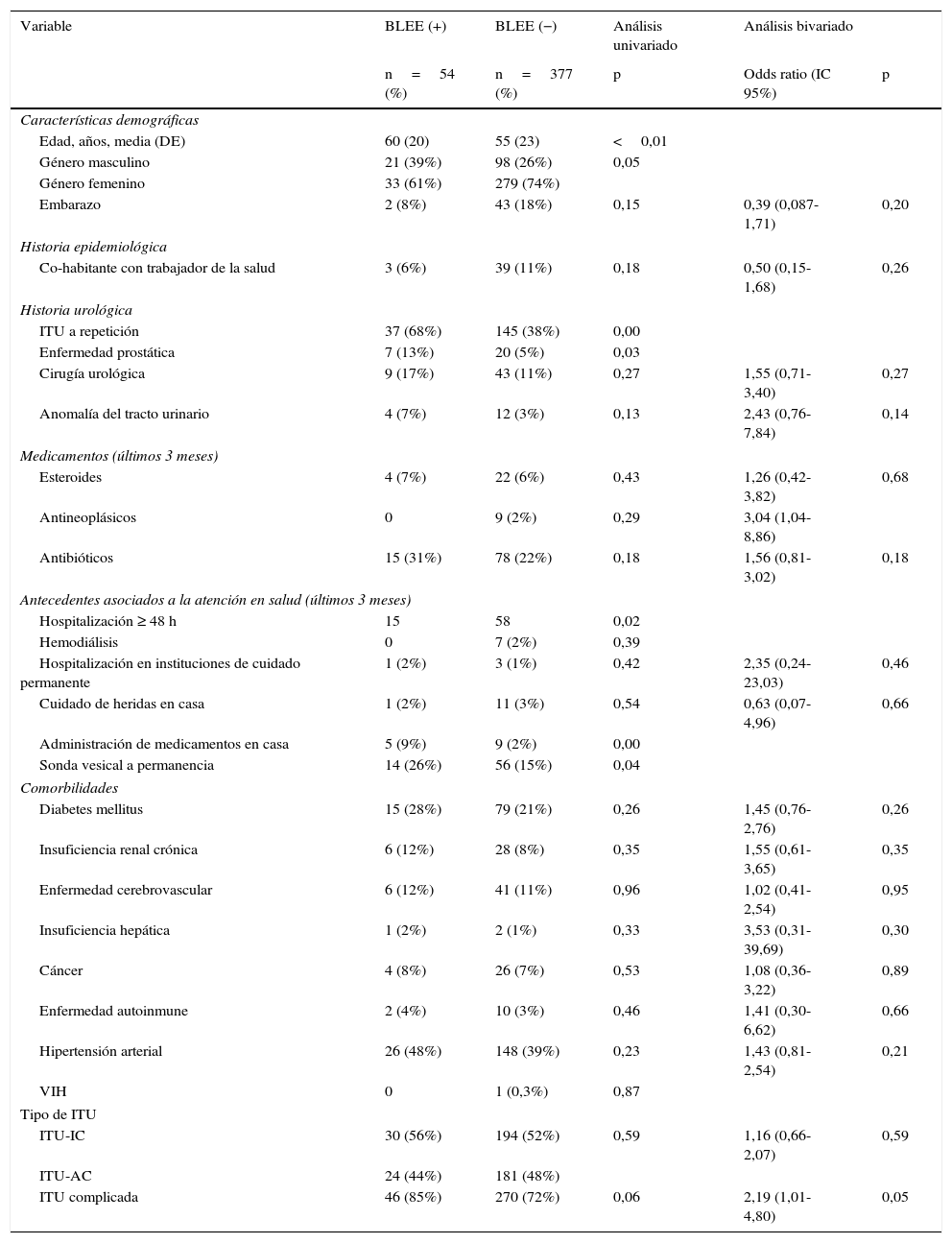
El análisis bivariado del estudio de casos y controles demostró que estar embarazada, tener una ITU complicada y el uso de antibióticos en los últimos 3meses fueron factores de riesgo estadísticamente significativos para ITU por E.coli productor de BLEE. Sin embargo, solo la ITU complicada fue identificada como un factor de riesgo independiente en el análisis multivariado (OR=3,89; IC95%: 1,10-13,89; p=0,03) (tabla 1).
Factores asociados con ITU causada por Escherichia coli productor de BLEE
| Variable | BLEE (+) | BLEE (−) | Análisis univariado | Análisis bivariado | |
|---|---|---|---|---|---|
| n=54 (%) | n=377 (%) | p | Odds ratio (IC 95%) | p | |
| Características demográficas | |||||
| Edad, años, media (DE) | 60 (20) | 55 (23) | <0,01 | ||
| Género masculino | 21 (39%) | 98 (26%) | 0,05 | ||
| Género femenino | 33 (61%) | 279 (74%) | |||
| Embarazo | 2 (8%) | 43 (18%) | 0,15 | 0,39 (0,087-1,71) | 0,20 |
| Historia epidemiológica | |||||
| Co-habitante con trabajador de la salud | 3 (6%) | 39 (11%) | 0,18 | 0,50 (0,15-1,68) | 0,26 |
| Historia urológica | |||||
| ITU a repetición | 37 (68%) | 145 (38%) | 0,00 | ||
| Enfermedad prostática | 7 (13%) | 20 (5%) | 0,03 | ||
| Cirugía urológica | 9 (17%) | 43 (11%) | 0,27 | 1,55 (0,71-3,40) | 0,27 |
| Anomalía del tracto urinario | 4 (7%) | 12 (3%) | 0,13 | 2,43 (0,76-7,84) | 0,14 |
| Medicamentos (últimos 3 meses) | |||||
| Esteroides | 4 (7%) | 22 (6%) | 0,43 | 1,26 (0,42-3,82) | 0,68 |
| Antineoplásicos | 0 | 9 (2%) | 0,29 | 3,04 (1,04-8,86) | |
| Antibióticos | 15 (31%) | 78 (22%) | 0,18 | 1,56 (0,81-3,02) | 0,18 |
| Antecedentes asociados a la atención en salud (últimos 3 meses) | |||||
| Hospitalización ≥ 48 h | 15 | 58 | 0,02 | ||
| Hemodiálisis | 0 | 7 (2%) | 0,39 | ||
| Hospitalización en instituciones de cuidado permanente | 1 (2%) | 3 (1%) | 0,42 | 2,35 (0,24-23,03) | 0,46 |
| Cuidado de heridas en casa | 1 (2%) | 11 (3%) | 0,54 | 0,63 (0,07-4,96) | 0,66 |
| Administración de medicamentos en casa | 5 (9%) | 9 (2%) | 0,00 | ||
| Sonda vesical a permanencia | 14 (26%) | 56 (15%) | 0,04 | ||
| Comorbilidades | |||||
| Diabetes mellitus | 15 (28%) | 79 (21%) | 0,26 | 1,45 (0,76-2,76) | 0,26 |
| Insuficiencia renal crónica | 6 (12%) | 28 (8%) | 0,35 | 1,55 (0,61-3,65) | 0,35 |
| Enfermedad cerebrovascular | 6 (12%) | 41 (11%) | 0,96 | 1,02 (0,41-2,54) | 0,95 |
| Insuficiencia hepática | 1 (2%) | 2 (1%) | 0,33 | 3,53 (0,31-39,69) | 0,30 |
| Cáncer | 4 (8%) | 26 (7%) | 0,53 | 1,08 (0,36-3,22) | 0,89 |
| Enfermedad autoinmune | 2 (4%) | 10 (3%) | 0,46 | 1,41 (0,30-6,62) | 0,66 |
| Hipertensión arterial | 26 (48%) | 148 (39%) | 0,23 | 1,43 (0,81-2,54) | 0,21 |
| VIH | 0 | 1 (0,3%) | 0,87 | ||
| Tipo de ITU | |||||
| ITU-IC | 30 (56%) | 194 (52%) | 0,59 | 1,16 (0,66-2,07) | 0,59 |
| ITU-AC | 24 (44%) | 181 (48%) | |||
| ITU complicada | 46 (85%) | 270 (72%) | 0,06 | 2,19 (1,01-4,80) | 0,05 |
BLEE: betalactamasas de espectro extendido; DE: desviación estándar; ITU: infección del tracto urinario; ITU-AC: ITU adquirida en la comunidad; ITU-IC: ITU de inicio en la comunidad; VIH: virus de la inmunodeficiencia humana.
Variables con valor de p ≤ 0,20 en el análisis bivariado se consideraron candidatas para el análisis multivariado usando un modelo de regresión logística.
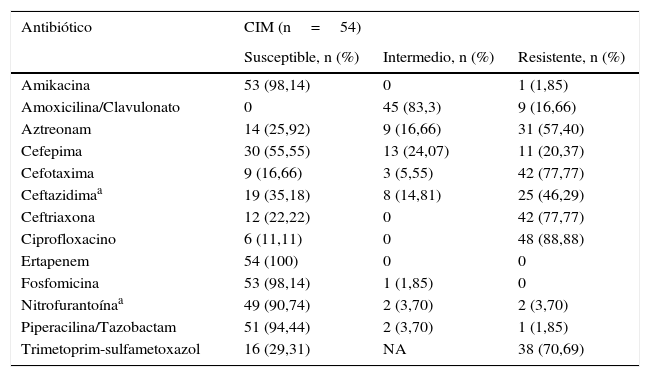
Los aislamientos de E.coli productor de BLEE fueron no susceptibles a varios antibióticos; sin embargo, todos los aislamientos presentaron susceptibilidad mayor al 90% frente a ertapenem, fosfomicina, nitrofurantoína, amikacina y piperacilina/tazobactam (tabla 2).
Perfil de susceptibilidad de Escherichia coli productor de BLEE
| Antibiótico | CIM (n=54) | ||
|---|---|---|---|
| Susceptible, n (%) | Intermedio, n (%) | Resistente, n (%) | |
| Amikacina | 53 (98,14) | 0 | 1 (1,85) |
| Amoxicilina/Clavulonato | 0 | 45 (83,3) | 9 (16,66) |
| Aztreonam | 14 (25,92) | 9 (16,66) | 31 (57,40) |
| Cefepima | 30 (55,55) | 13 (24,07) | 11 (20,37) |
| Cefotaxima | 9 (16,66) | 3 (5,55) | 42 (77,77) |
| Ceftazidimaa | 19 (35,18) | 8 (14,81) | 25 (46,29) |
| Ceftriaxona | 12 (22,22) | 0 | 42 (77,77) |
| Ciprofloxacino | 6 (11,11) | 0 | 48 (88,88) |
| Ertapenem | 54 (100) | 0 | 0 |
| Fosfomicina | 53 (98,14) | 1 (1,85) | 0 |
| Nitrofurantoínaa | 49 (90,74) | 2 (3,70) | 2 (3,70) |
| Piperacilina/Tazobactam | 51 (94,44) | 2 (3,70) | 1 (1,85) |
| Trimetoprim-sulfametoxazol | 16 (29,31) | NA | 38 (70,69) |
NA: no aplica.
Las pruebas de susceptibilidad fueron realizadas por el método de microdilución en caldo, y las concentraciones inhibitorias mínimas (CIM) fueron interpretadas de acuerdo a los puntos de corte CLSI 2014.
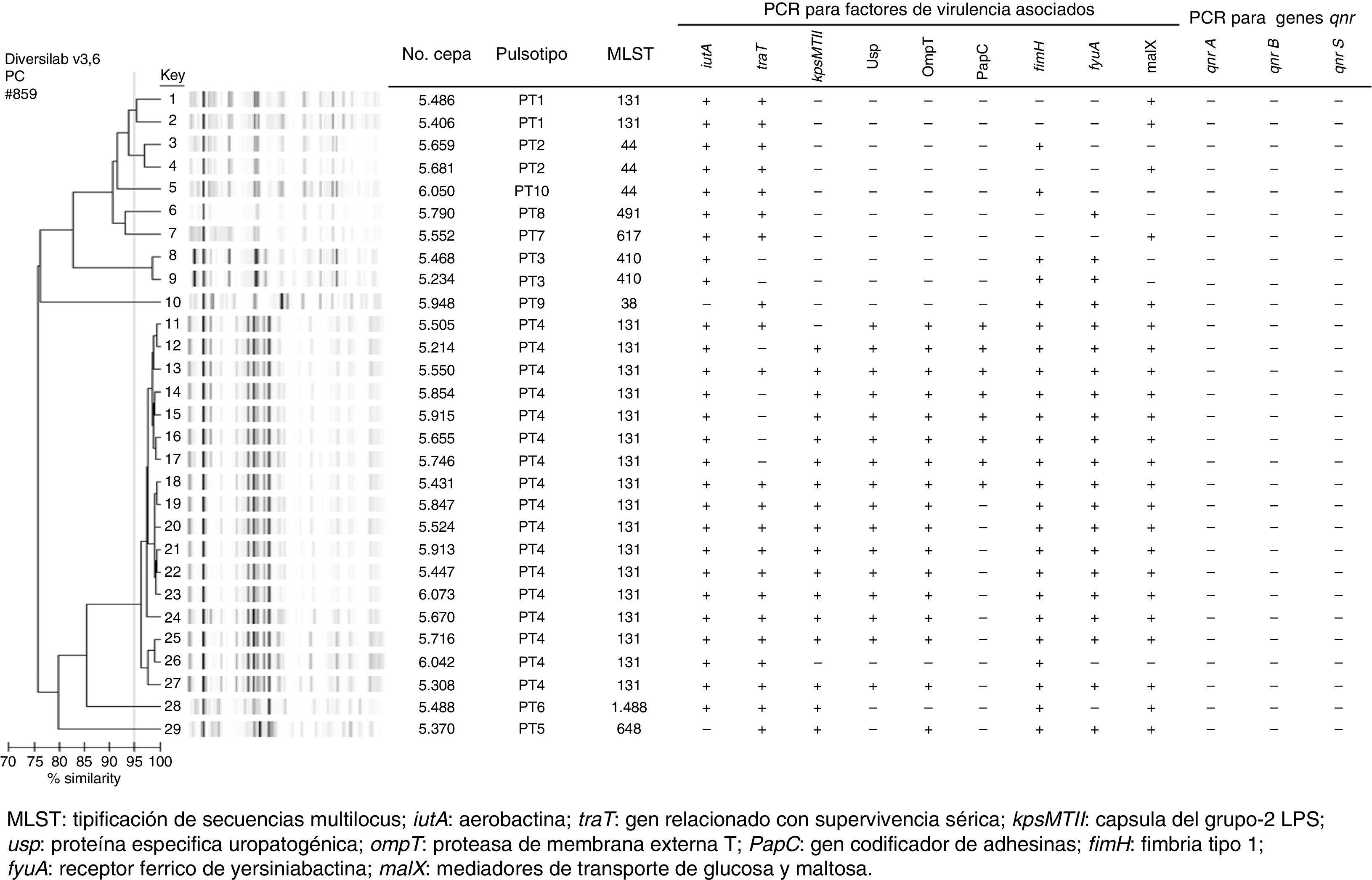
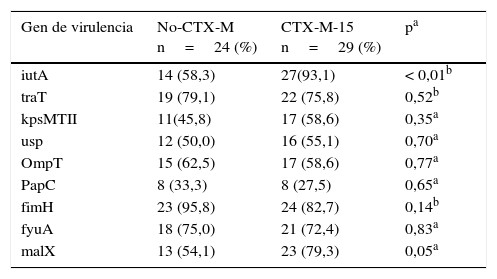
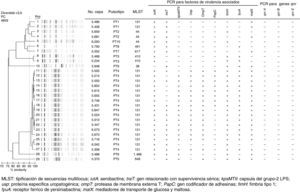
La tipificación molecular de E.coli productor de CTX-M-15 por rep-PCR mostró la presencia de 10 electroferotipos (PT) diferentes, donde 19 de 29 aislados estaban organizados en los PT1 al PT4; los 6 electroferotipos restantes fueron policlonales. Por otra parte, mediante el análisis de MLST se encontraron 8ST diferentes, dentro de los cuales el ST131 fue el más predominante. Al comparar los resultados de MLST con rep-PCR, se pudo identificar que los PT1 y PT4 (65%) pertenecían al ST131, el cual ha sido asociado a mayor virulencia. Sin embargo, vale la pena resaltar que el PT1 presentó un menor número de factores de virulencia en comparación al PT4; este mismo fenómeno se observó también para los demás electroferotipos (fig. 1). Los aislamientos productores de la enzima tipo CTX-M-15 se asociaron de manera significativa con los genes de virulencia iutA (p<0,01) y malX (p=0,05) (tabla 3).
Distribución de los genes de virulencia en Escherichia coli productor de BLEE según presencia de CTX-M-15
| Gen de virulencia | No-CTX-M n=24 (%) | CTX-M-15 n=29 (%) | pa |
|---|---|---|---|
| iutA | 14 (58,3) | 27(93,1) | < 0,01b |
| traT | 19 (79,1) | 22 (75,8) | 0,52b |
| kpsMTII | 11(45,8) | 17 (58,6) | 0,35a |
| usp | 12 (50,0) | 16 (55,1) | 0,70a |
| OmpT | 15 (62,5) | 17 (58,6) | 0,77a |
| PapC | 8 (33,3) | 8 (27,5) | 0,65a |
| fimH | 23 (95,8) | 24 (82,7) | 0,14b |
| fyuA | 18 (75,0) | 21 (72,4) | 0,83a |
| malX | 13 (54,1) | 23 (79,3) | 0,05a |
fimH: fimbria tipo 1; fyuA: receptor férrico de yersiniabactina; iutA: aerobactina; kpsMTII: cápsula del grupo-2 LPS; malX: mediadores de transporte de glucosa y maltosa; ompT: proteasa de membrana externa T; PapC: gen codificador de adhesinas; traT: gen relacionado con supervivencia sérica; usp: proteína especifica uropatogénica.
Las ITU causadas por E.coli productor BLEE han sido ampliamente descritas a nivel mundial, con estudios que demuestran una prevalencia alta en infecciones de origen hospitalario38,39. En los últimos años, un creciente número de reportes demuestran la presencia de estos microorganismos en aislamientos provenientes de la comunidad40-42.
En Latinoamérica, la presencia de E.coli productor de BLEE causando ITU-IC ha sido descrita en diferentes estudios, con prevalencias variables que van desde el 1,7% para países como Argentina, Brasil, Chile, México y Venezuela, según datos del SENTRY 200343, hasta el 16% según estudios locales realizados en Guatemala44. Por su parte, en Estados Unidos y Taiwán se han publicado prevalencias entre el 3 y el 8%45,46.
En el presente estudio, E.coli productor de BLEE causante de ITU-IC presentó una prevalencia del 12,5%, siendo superior a lo mencionado anteriormente en otras regiones. Varios estudios han descrito que CTX-M-15 es la enzima predominante (66-100%) en E.coli uropatogénico BLEE positivo, la cual ha sido descrita como la más común en aislamientos provenientes de la comunidad47. De manera similar, este estudio confirma que la enzima CTX-M-15 sigue siendo en Colombia el tipo más común de BLEE en E.coli (53,4%), correspondiendo a 6,7% de todas las ITU-IC. Este porcentaje es mayor a lo publicado previamente en Estados Unidos, donde se encontró una prevalencia del 1,66%45, y a lo descrito previamente en Colombia en el año 2013, con una prevalencia del 2,4%17. Sin embargo, en otro estudio nacional basado en reportes de laboratorio se encontró una prevalencia semejante a la nuestra, con el 6,8% de los aislamientos correspondientes al grupo CTX-M-148.
En el análisis bivariado se identificó que el embarazo, el uso de antibióticos en los últimos 3meses y tener criterios para ITU complicada fueron factores de riesgo significativos, lo cual concuerda con lo publicado en la literatura28,49-53. Sin embargo, algunas variables, como hospitalización reciente53, ITU recurrente o enfermedad prostática49, no estuvieron asociadas con la presencia de E.coli productor de BLEE, siendo la ITU complicada el único factor de riesgo que demostró ser independiente. Este resultado ya ha sido descrito por otros autores47,53,54 y refuerza la importancia de la detección y seguimiento de una ITU complicada en cualquier contexto clínico que se presente (infección de la comunidad u hospitalaria), pues su presencia implica en la mayoría de casos un contacto continuo con los servicios hospitalarios y puede favorecer la colonización y posterior infección por microorganismos resistentes. Es importante mencionar que el 44% de las ITU por E.coli productor de BLEE fueron adquiridas en la comunidad, siendo este porcentaje incluso más elevado que lo encontrado para instituciones de cuidado permanente28,49,55,56.
En nuestra serie, la mayoría de aislamientos portadores del gen blaCTX-M-15 pertenecieron al ST131 (65,5%); este ST ha sido descrito comúnmente en aislados provenientes de la comunidad47. Cabe resaltar que en este estudio no se encontró el ST405, el cual ha sido previamente publicado en Colombia y en el mundo57. A nivel mundial, se ha observado el aumento en la prevalencia de E.coli portador del gen blaCTX-M-15 asociado al ST131, lo cual confirma la diseminación exitosa de este clon denominado de alto riesgo19.
Otro de los aspectos preocupantes del clon ST131 de E.coli portador del gen blaCTX-M-15 es la alta tasa de resistencia a los antibióticos no betalactámicos, a las quinolonas y al trimetoprim-sulfametoxazol. En este estudio, los porcentajes de resistencia a ciprofloxacino y trimetoprim-sulfametoxazol en estos aislamientos fueron del 88,8 y del 70,6%, respectivamente, lo cual es comparable con porcentajes detectados en otros estudios, donde se han encontrado en promedio resistencias del 91 y del 65%, respectivamente49,58,59.
La alta prevalencia de resistencia a estos antimicrobianos, particularmente a fluoroquinolonas, es de gran relevancia considerando que estos son 2 de los antimicrobianos comúnmente usados cuando se sospecha una ITU54,60. Dentro de la resistencia a fluoroquinolonas se han postulado varios mecanismos, entre ellos la resistencia mediada por plásmidos, dentro de los cuales los genes qnrA, qnrB o qnrS han sido descritos con baja frecuencia61; sin embargo, en los aislados analizados no se encontraron estos genes. Resultados similares han sido descritos en nuestro país12. En consecuencia, estos resultados parecen indicar que en Colombia la resistencia a quinolonas no está asociada a estos genes.
En este estudio, los aislamientos de CTX-M-15 estuvieron asociados significativamente a los genes iutA (p<0,01) y malX (p=0,05). Varios autores han demostrado la asociación de diversos factores de virulencia con la presencia de genes de resistencia como blaCTX-MGRUPO1, entre los que se encuentran iutA y traT62,63. Sin embargo, el tipo de BLEE no parece ser determinante, pues estos hallazgos también se han descrito en aislados productores de otros tipos de enzimas36.
Finalmente, dado que en nuestro medio la prevalencia de ITU-IC causada por E.coli productor de BLEE es mayor al 10%, el uso de quinolonas o trimetoprim como terapia empírica en estos pacientes debería ser cuidadosamente considerado, como ha sido propuesto en algunas guías de tratamiento antibiótico, por la Sociedad Americana de Infectología, y por otros autores a nivel nacional17,64. Más aún, en los casos de ITU complicada o compromiso sistémico secundario a foco urinario de origen en la comunidad se debería evaluar también el riesgo-beneficio de utilizar cefalosporinas de tercera o cuarta generación, ya que estas últimas constituyen una de las opciones de tratamiento empírico en bacteriemias secundarias a ITU-IC65, y su baja susceptibilidad a estos antibióticos requiere considerar la epidemiología local antes de incluirlos en las guías de manejo empírico de cada institución.
LimitacionesUna de las limitaciones del presente estudio fue no alcanzar el tamaño de muestra calculado, por lo cual la prevalencia de E. coli productor de BLEE encontrada fue menor a la esperada (8,6% [54/629] frente al 10%). Esto pudo generar que otros factores de riesgo menos frecuentes no fueran detectados; sin embargo, la prevalencia publicada es comparable con resultados de otros estudios publicados en el país, que muestran prevalencias de E.coli productor de BLEE más bajas que la utilizada inicialmente para el cálculo del tamaño de muestra de este estudio17,48.
Aunque la definición de ITU complicada abarca situaciones clínicas distintas (inmunosupresión, anomalías del tracto urinario y pielonefritis) que podrían ser analizadas como factores de riesgo para BLEE independientes, se realizó un análisis en conjunto debido a que la mayoría de los sujetos del estudio (casos y controles) tenían más de una de estas situaciones clínicas, razón por la cual no se pudieron hacer grupos con cada una de estas situaciones de forma exclusiva, excepto embarazo y género masculino, que sí fueron analizadas de forma independiente. En consecuencia, la interpretación de los factores de riesgo para BLEE debe tener en cuenta esta consideración. Por otra parte, los resultados obtenidos pueden ser no extrapolables al resto del país, pues solo se tuvieron en cuenta pacientes provenientes de 3 instituciones de referencia en 2 ciudades, lo cual puede no reflejar la heterogeneidad de la población atendida en centros de atención primaria a nivel nacional.
FinanciaciónEste trabajo fue financiado por COLCIENCIAS (222951928995) y por una beca de investigación de Merck Sharp & Dohme.
Conflicto de interesesM.V. Villegas ha recibido apoyos de investigación de Merck Sharp & Dohme, Merck Colombia, Janssen-Cilag SA, Pfizer SA y AstraZeneca Colombia SA. Ninguno de los patrocinadores tuvo injerencia en el diseño, la recolección de datos, el análisis, la decisión de publicación o la preparación del manuscrito. Todos los demás autores declaran no tener conflictos de intereses relevantes al presente estudio.
Agradecemos al personal de salud y de investigación en los centros participantes, especialmente al Dr. Hernan Vargas y al Dr. Carlos Montoya, por su apoyo y colaboración. También agradecemos a los investigadores del Centro Internacional de Entrenamiento e Investigaciones Médicas (CIDEIM): Marta Vallejo, Elsa de la Cadena, Sory Ruiz, Robinson Pacheco y Mauricio Pérez, cuyos esfuerzos contribuyeron a la realización de este estudio.