Desde la década de 1990 se describen cepas de Staphylococcus aureus resistente a la meticilina adquirido en la comunidad (SARM-AC) que afectan con frecuencia a niños y a adultos jóvenes sin factores de riesgo y cuya incidencia en España está en aumento.
MétodosSe incluyó a los pacientes atendidos en el área pediátrica entre agosto de 2006 y enero de 2009 con cultivos positivos para SARM-AC. Los aislamientos de S. aureus se estudiaron mediante técnicas convencionales, su sensibilidad antimicrobiana mediante técnica de discodifusión y la presencia del gen mecA mediante reacción en cadena de la polimerasa (multiplex). La presencia de la leucocidina de Panton-Valentine se determinó mediante reacción en cadena de la polimerasa convencional. Se estudió el estado de portador en los pacientes y sus familiares.
ResultadosSe recogieron 15 aislamientos de SARM-AC de 12 pacientes sin factores de riesgo (entre 6 días y 14 años de edad). Ocho requirieron ingreso. La mitad de los enfermos eran de población no autóctona. La afectación de piel y partes blandas fue la forma clínica más frecuente (92%). Solo 2 tuvieron bacteriemia. Dos cepas tenían resistencia a macrólidos asociada a la resistencia a meticilina y una de ellas, además, a lincosamidas. Todas fueron productoras de leucocidina de Panton-Valentine. La evolución fue favorable. Se detectó una agrupación familiar de SARM-AC.
ConclusiónLa infección por SARM-AC constituye una enfermedad emergente en nuestro medio. Su incidencia en España es aún baja, por lo que no se debe cambiar el tratamiento empírico de las infecciones cutáneas. El drenaje de las lesiones tiene un papel importante en su curación. La clindamicina o el cotrimoxazol es el tratamiento de elección de las formas leves o moderadas. El control de la propagación de SARM-AC constituye un nuevo reto en la actualidad.
Community-acquired methicillin-resistant Staphylococcus aureus (CA-MRSA) infections were first reported in the 1990s. Young, healthy individuals are frequently affected. The incidence of CA-MRSA in Spain is increasing.
MethodsAll children seen between August 2006 and January 2009 with CA-MRSA infections were included. The S. aureus isolates were studied by conventional techniques, their antibiotic susceptibility by agar disk diffusion, the presence of mecA gene was detected by multiplex polymerase chain reaction (PCR) and the gene encoding the Panton-Valentine leukocidin (PVL) by conventional PCR. CA-MRSA colonization was studied both in patients and their family members.
ResultsCA-MRSA was isolated in 15 samples from 12 patients, aged between 6 days and 14 years. Half of them were not native. Eight patients required hospital admission. The most common clinical presentation was skin and soft tissue infection (92%). Secondary CA-MRSA bacteraemia was present in two patients. All strains were PVL producers and two were resistant to macrolides associated to methicillin resistance and one of them was also resistant to lincosamides. An intra-familial transmission was identified. The clinical outcome was favourable in all patients.
ConclusionCA-MRSA infections are emerging in Spain. Empirical treatment of skin and soft tissue infections should not be changed, since their incidence is still low. The drainage of CA-MRSA suppurative infections plays an important role in their treatment. Clindamycin or trimethoprim-sulfamethoxazole should be used for mild or moderate skin and soft tissue infections. Controlling the spread of these strains presents a challenge in the community today.
El Staphylococcus aureus se caracteriza por la capacidad de incorporar material genético de otras cepas, de especies estafilocócicas diferentes e incluso de bacterias de otros géneros. Esta excepcional plasticidad lo dota de nuevas características infectivas en relación con su virulencia y su resistencia a los antibióticos1. Las nuevas características adaptativas de este antiguo patógeno han determinado en los últimos años cambios epidemiológicos importantes en las infecciones estafilocócicas. En la década de 1990 se describió S. aureus resistente a la meticilina adquirido en la comunidad (SARM-AC) como patógeno emergente en individuos sin factores de riesgo conocidos2. En la actualidad, en Estados Unidos, el SARM-AC es el principal agente etiológico de las infecciones de la piel y las partes blandas con especial predominio del clon USA300, que se aísla en casi el 50% de las infecciones cutáneas de los pacientes atendidos en los servicios de urgencias3,4. En Europa, estas infecciones son menos frecuentes, pero su incidencia está aumentando y se observa una mayor variación genética de las cepas circulantes5. Las características clínicas y epidemiológicas de las infecciones producidas por estas cepas evidencian que su elevada virulencia se debe en gran parte a la leucocidina de Panton-Valentine (LPV)6. Las cepas productoras de LPV se han relacionado con infecciones piógenas de la piel y las partes blandas, así como con la neumonía necrosante7. Sin embargo, en los últimos años hay cierta controversia en la literatura médica con respecto a la capacidad de virulencia de la LPV8, ya que otros factores también contribuyen a la gravedad de estas infecciones. Un hecho para destacar es el especial predominio de estas infecciones en los niños y los adultos jóvenes sin factores de riesgo con transmisión intrafamiliar y con recurrencias9,10.
En este trabajo se describen 12 casos de infección por SARM-AC diagnosticados en nuestro centro.
MétodosPacientesSe incluyó a los pacientes menores de 16 años con al menos un cultivo positivo para SARM-AC atendidos en el área pediátrica del Hospital Universitario Vall d’Hebron durante el período comprendido entre agosto de 2006 y enero de 2009. Se recogieron datos demográficos, clínicos, microbiológicos y epidemiológicos de cada paciente mediante revisión de las historias clínicas. Se definió como SARM-AC cualquier cepa de S. aureus aislada en un paciente ambulatorio o en las primeras 48h de ingreso en el hospital, sin antecedentes de infección o colonización por S. aureus resistente a la meticilina (SARM) en el año previo ni de hospitalización o ingreso en un centro sociosanitario de larga estancia, de diálisis o cirugía, y no portador de un dispositivo intravascular o percutáneo11.
Microbiología y estudio molecularLas cepas de S. aureus se identificaron por técnicas convencionales (producción de catalasa, plasmacoagulasa y desoxirribonucleasa). El estudio de la sensibilidad antimicrobiana se realizó mediante el método de discodifusión en agar (discos de Neo-Sensitabs®, Rosco Diagnostica, Dinamarca) frente a penicilina, oxacilina, cefoxitina, eritromicina, clindamicina, rifampicina, vancomicina, teicoplanina, gentamicina, tobramicina, ciprofloxacino, cotrimoxazol, ácido fusídico, mupirocina y linezolid. La presencia del gen mecA se determinó mediante reacción en cadena de la polimerasa (multiplex), que amplificaba, además de este gen específico de resistencia a la meticilina, el gen nuc propio de S. aureus12. Los genes que codifican la LPV (lukS-PV y lukF-PV) se detectaron mediante reacción en cadena de la polimerasa convencional, según el protocolo establecido por Lina et al13.
Estudio de portadoresEl estudio del estado de portador se realizó a los pacientes y a sus familiares mediante cultivos de frotis nasal y de los pliegues axilar e inguinal.
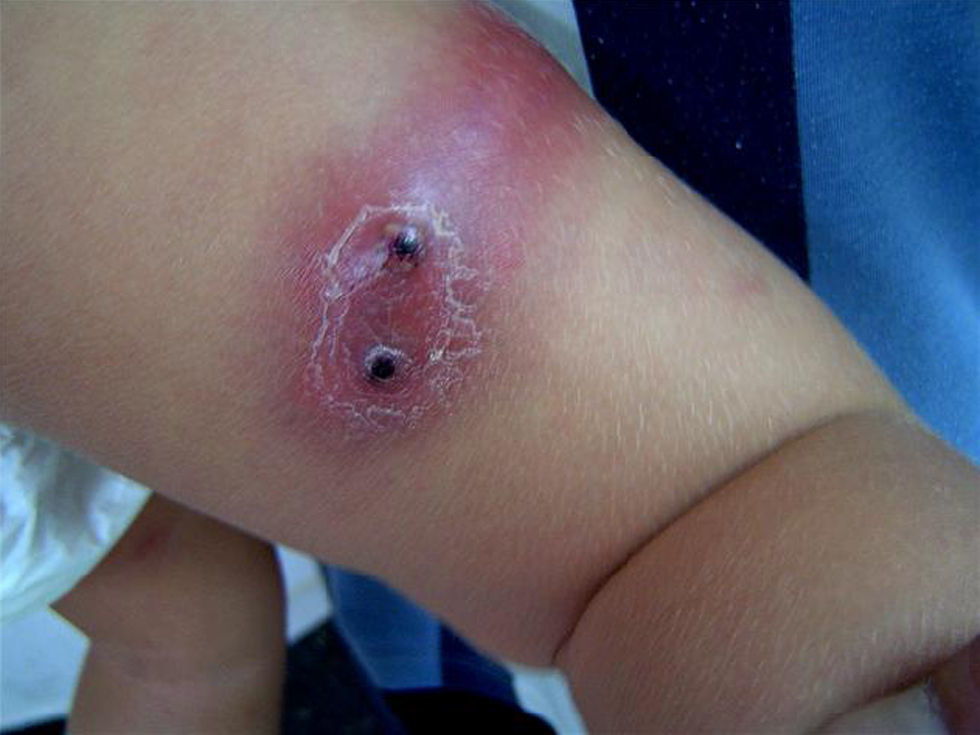
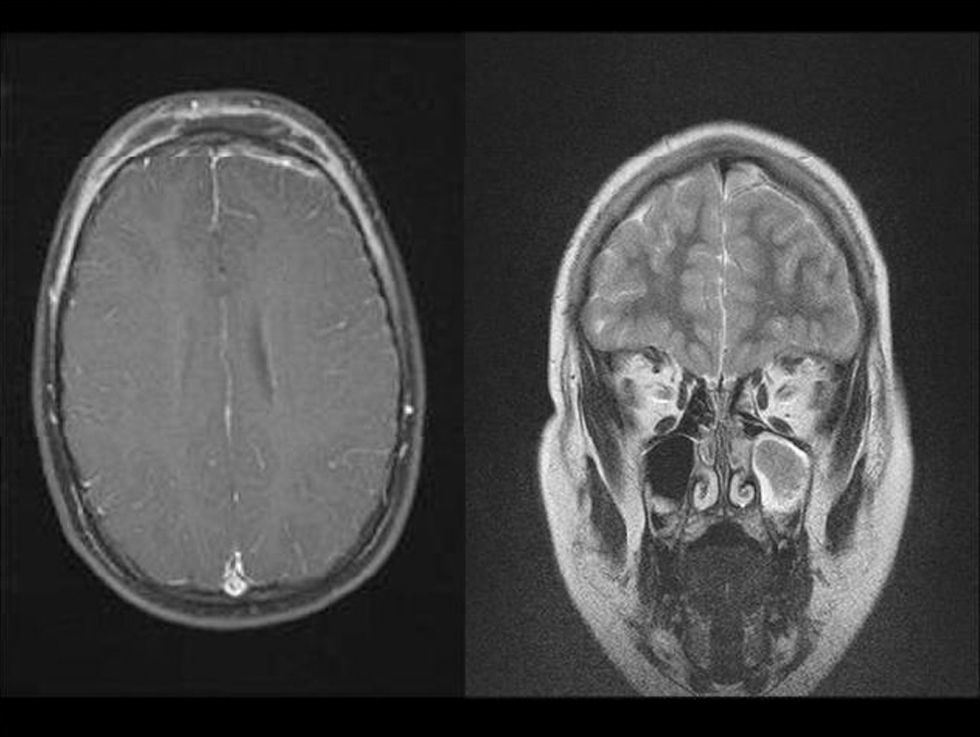
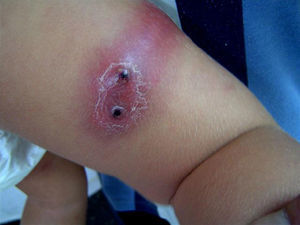
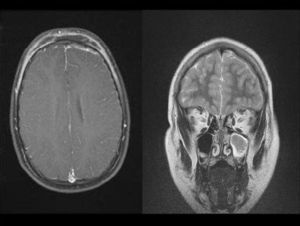
ResultadosDurante el período de estudio se realizaron 15 aislamientos de SARM-AC correspondientes a 12 pacientes (tabla 1): 3 durante el año 2006, 2 durante el año 2007, 6 durante el año 2008 y uno en enero de 2009. Siete eran niños y 5 eran niñas. La mediana de edad era de 7 años y 6 meses (rango: 6 días–14 años). El 50% de los pacientes eran autóctonos, 4 eran de Ecuador y 2 eran de Rumania. Ocho requirieron ingreso y a 4 se los atendió en urgencias y luego se controlaron de forma ambulatoria. En ninguno de ellos se detectaron factores de riesgo para infección por SARM. La presentación clínica de las infecciones fue la siguiente: abscesos subcutáneos en las extremidades (5 casos) (fig. 1) y absceso facial (un caso), fascitis necrosante (un caso), osteomielitis humeral asociada a neumonía (un caso), celulitis frontal con pansinusitis y empiema subdural (un caso) (fig. 2), onfalitis con impétigo diseminado (un caso), eccema impetiginizado (un caso) e impétigo con celulitis (un caso). Dos pacientes presentaron bacteriemia y en el resto el microorganismo se aisló únicamente en el cultivo de la lesión cutánea.
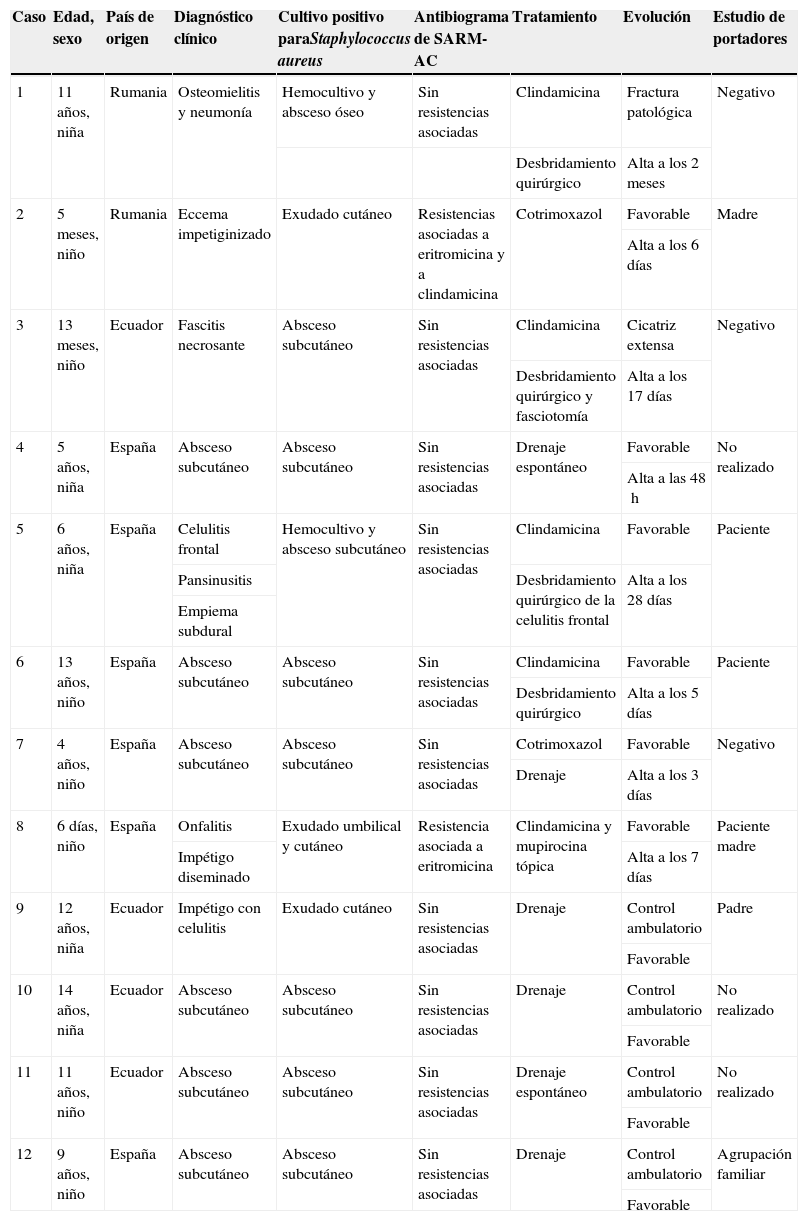
Características de los pacientes con infección por Staphylococcus aureus resistente a la meticilina adquirido en la comunidad productor de leucocidina de Panton-Valentine
| Caso | Edad, sexo | País de origen | Diagnóstico clínico | Cultivo positivo paraStaphylococcus aureus | Antibiograma de SARM-AC | Tratamiento | Evolución | Estudio de portadores |
| 1 | 11 años, niña | Rumania | Osteomielitis y neumonía | Hemocultivo y absceso óseo | Sin resistencias asociadas | Clindamicina | Fractura patológica | Negativo |
| Desbridamiento quirúrgico | Alta a los 2 meses | |||||||
| 2 | 5 meses, niño | Rumania | Eccema impetiginizado | Exudado cutáneo | Resistencias asociadas a eritromicina y a clindamicina | Cotrimoxazol | Favorable | Madre |
| Alta a los 6 días | ||||||||
| 3 | 13 meses, niño | Ecuador | Fascitis necrosante | Absceso subcutáneo | Sin resistencias asociadas | Clindamicina | Cicatriz extensa | Negativo |
| Desbridamiento quirúrgico y fasciotomía | Alta a los 17 días | |||||||
| 4 | 5 años, niña | España | Absceso subcutáneo | Absceso subcutáneo | Sin resistencias asociadas | Drenaje espontáneo | Favorable | No realizado |
| Alta a las 48h | ||||||||
| 5 | 6 años, niña | España | Celulitis frontal | Hemocultivo y absceso subcutáneo | Sin resistencias asociadas | Clindamicina | Favorable | Paciente |
| Pansinusitis | Desbridamiento quirúrgico de la celulitis frontal | Alta a los 28 días | ||||||
| Empiema subdural | ||||||||
| 6 | 13 años, niño | España | Absceso subcutáneo | Absceso subcutáneo | Sin resistencias asociadas | Clindamicina | Favorable | Paciente |
| Desbridamiento quirúrgico | Alta a los 5 días | |||||||
| 7 | 4 años, niño | España | Absceso subcutáneo | Absceso subcutáneo | Sin resistencias asociadas | Cotrimoxazol | Favorable | Negativo |
| Drenaje | Alta a los 3 días | |||||||
| 8 | 6 días, niño | España | Onfalitis | Exudado umbilical y cutáneo | Resistencia asociada a eritromicina | Clindamicina y mupirocina tópica | Favorable | Paciente madre |
| Impétigo diseminado | Alta a los 7 días | |||||||
| 9 | 12 años, niña | Ecuador | Impétigo con celulitis | Exudado cutáneo | Sin resistencias asociadas | Drenaje | Control ambulatorio | Padre |
| Favorable | ||||||||
| 10 | 14 años, niña | Ecuador | Absceso subcutáneo | Absceso subcutáneo | Sin resistencias asociadas | Drenaje | Control ambulatorio | No realizado |
| Favorable | ||||||||
| 11 | 11 años, niño | Ecuador | Absceso subcutáneo | Absceso subcutáneo | Sin resistencias asociadas | Drenaje espontáneo | Control ambulatorio | No realizado |
| Favorable | ||||||||
| 12 | 9 años, niño | España | Absceso subcutáneo | Absceso subcutáneo | Sin resistencias asociadas | Drenaje | Control ambulatorio | Agrupación familiar |
| Favorable |
SARM-AC: Staphylococcus aureus resistente a la meticilina adquirido en la comunidad.
Todas las cepas fueron productoras de LPV. Dos de ellas presentaron resistencias antibióticas asociadas: una a macrólidos y a lincosamidas (fenotipo MLSB inducible) y la otra únicamente a macrólidos (fenotipo M). Los pacientes controlados en el servicio de urgencias evolucionaron favorablemente con el drenaje de la lesión, sin requerir tratamiento antibiótico. De los enfermos que ingresaron, a 5 se los trató con clindamicina intravenosa y a 2 con cotrimoxazol oral, además de desbridamiento de la lesión en quirófano en 4 de ellos; en un paciente sólo se practicó drenaje. Los pacientes evolucionaron favorablemente, a excepción de la niña con osteomielitis humeral, que requirió múltiples desbridamientos quirúrgicos y presentó como complicación una fractura patológica de la extremidad, y el niño con fascitis necrosante, que requirió una fasciotomía urgente que dejó como secuela una cicatriz extensa en el antebrazo derecho.
En 10 casos se pudo realizar el estudio del estado de portador, que fue positivo en 6 de ellos. Se aisló SARM-AC en 12 muestras (8 frotis nasales, 3 frotis cutáneos y un exudado conjuntival). Se realizó un estudio epidemiológico de un «cluster familiar» con afectación de todos los convivientes: un niño de 9 años, sus padres y su hermana de 14 años. Todos referían antecedentes de abscesos cutáneos recurrentes de 2 años de evolución, que en ocasiones habían requerido drenaje. Se realizaron frotis nasal y cutáneo, que confirmaron el estado de portador en todos, excepto en el padre. Se practicó la descolonización con mupirocina nasal y jabón de clorhexidina para la higiene corporal durante 5 días, que resultó ineficaz para el control de las recurrencias, por lo que se instauró tratamiento con cotrimoxazol oral durante 7 días y con ello se logró prevenir la aparición de recidivas.
DiscusiónLos problemas actuales con el SARM-AC reflejan la biología básica de S. aureus. El estudio de su genoma muestra su capacidad de adquirir determinantes genéticos de otras cepas y especies para mejorar sus características biológicas14. La resistencia de S. aureus a los betalactámicos se adquiere por la presencia del gen mecA, que se localiza en el islote genómico de SCCmec. Este gen codifica una proteína fijadora de penicilina, la PBP-2a, con actividad transpeptidasa y baja afinidad por los betalactámicos, por lo que estas cepas deben considerarse resistentes a estos. Desde su aparición en la década de 1960, el SCCmec ha evolucionado a 8 tipos diferentes de elementos genéticos móviles (i–viii)15, de los que cada uno alberga un grupo distinto de genes. Los SCCmec I, II, III y más recientemente el SCCmec VIII son estructuralmente más grandes, incorporan genes de multirresistencia y se relacionan con las cepas de SARM hospitalario, mientras que el SCCmec IV (con más frecuencia) y los tipos restantes (v–vii) son más pequeños, no incorporan otros genes de resistencia antibiótica aparte del mecA y se relacionan con las cepas de SARM-AC16.
Las infecciones por SARM se vienen observando desde hace 40 años. Aunque al principio este microorganismo se relacionaba casi exclusivamente con infecciones nosocomiales o asociadas a contactos con el sistema sanitario, en los últimos años han aumentado las infecciones por SARM-AC en individuos sin factores de riesgo conocidos2, como es el caso de los pacientes de nuestra serie. En España, los aislamientos de SARM-AC son aún relativamente infrecuentes y predominan en población no autóctona, sobre todo de origen ecuatoriano17 (como 4 de nuestros casos). Por tanto, la emergencia de estas infecciones genera un nuevo reto en el ámbito de las enfermedades infecciosas pediátricas de origen comunitario.
El factor de virulencia que más se ha relacionado con SCCmec IV y, por tanto, con las cepas de SARM-AC ha sido la LPV. Descrita en 193218, es una toxina específica de S. aureus con actividad leucocitotóxica y dermonecrótica debida a la presencia de 2 componentes: la subunidad luk-S PV, codificada por el gen lukS-PV, que se une al receptor de los leucocitos y los macrófagos, y la subunidad luk-F PV, codificada por el gen lukF-PV, que produce la apertura de los canales de calcio de la membrana celular, altera la permeabilidad de esta y provoca la lisis celular19. La producción de LPV por parte de S. aureus es todavía poco frecuente, y se detecta sobre todo en SARM-AC20. Actualmente se cuestiona su papel en la gravedad de estas infecciones y se están investigando nuevos factores asociados que podrían conferir un mayor grado de virulencia o contribuir a la gravedad de las infecciones por S. aureus productor de LPV8. Recientemente se han descrito en modelos murinos otros determinantes que condicionan la gravedad, como las modulinas solubles en fenol y el elemento móvil catabólico de arginina21.
Las infecciones producidas por cepas de SARM-AC se localizan principalmente en la piel y las partes blandas22, y pueden ser graves, como la fascitis necrosante23. También, con menor frecuencia, producen neumonía necrosante7,24, osteomielitis25, trombosis venosa profunda26, meningitis27, endocarditis infecciosa, bacteriemia y sepsis28. En nuestra serie se recogen ejemplos de estas manifestaciones clínicas, con la afectación de la piel y las partes blandas como la más frecuente (92%) y con un caso de fascitis necrosante.
Un aspecto importante relacionado con las cepas de SARM-AC es su transmisibilidad. Un 20% de la población está colonizada de forma permanente por S. aureus y hasta un 30% de forma intermitente29. Las fosas nasales anteriores son la zona de colonización más habitual29. El mecanismo de transmisión más importante es por contacto íntimo30. La facilidad de transmisión de las cepas de SARM-AC ha favorecido la aparición de brotes de infección en diversos ámbitos. Inicialmente se habían descrito brotes en equipos deportivos31, en colectivos militares32 y en presos33, y más tarde se publicaron casos de transmisión intrafamiliar10,34 (como la agregación domiciliaria descrita en nuestra serie), de forma que los familiares sirven como reservorio de estas cepas virulentas, así como también entre compañeros de escuela21. Más preocupante es la diseminación de SARM-AC a los centros hospitalarios, que se ha descrito en los últimos años28, por lo que es importante extremar las medidas de control de la infección. Esto implica que se deba realizar aislamiento de contacto de estos pacientes hasta disponer de 2 o más cultivos seriados negativos35,36. En los individuos con infecciones cutáneas leves que no requieren hospitalización se extremarán las medidas de higiene, en especial de las manos, y se cubrirá la lesión con un apósito. No se recomienda el cribado de los contactos comunitarios para la identificación de portadores y su descolonización, excepto en situación de brote o de infecciones recurrentes. La descolonización se realiza con mupirocina nasal y lavado de la piel con jabón de clorhexidina durante 5 días. Si la cepa es resistente a la mupirocina, se recomienda la utilización de ácido fusídico tópico (2%) 2 veces al día o bacitracina tópica 3 veces al día con cotrimoxazol oral durante 7 días35,37,38.
El tratamiento empírico de las infecciones de la piel y las partes blandas depende de la prevalencia de SARM-AC en cada área geográfica; en nuestro medio, debido a que esta aún es baja, no se ha modificado. El cefadroxilo o la amoxicilina-ácido clavulánico son los fármacos de elección para cubrir Streptococcus pyogenes y S. aureus. El tratamiento de las formas leves o moderadas de infección por SARM-AC consiste en cotrimoxazol o clindamicina por vía oral, mientras que en las formas graves se usará la pauta secuencial. En la fascitis necrosante se administrará clindamicina o vancomicina por vía intravenosa; en caso de sepsis, afectación pulmonar o multifocal se utilizará vancomicina. Si esta última está contraindicada o se observa fallo terapéutico, se podría utilizar daptomicina si existe bacteriemia asociada o linezolid si hay afectación pulmonar. Se ha observado que la clindamicina, el linezolid y el ácido fusídico inhiben la producción de LPV y de otros factores de virulencia de las cepas de SARM39.
Hay que destacar la importancia del drenaje o el desbridamiento quirúrgico precoz de las infecciones supurativas de la piel y las partes blandas. Si se realiza de forma tardía o insuficiente, se favorece la bacteriemia persistente y la diseminación de la infección, lo que complica el curso de la enfermedad y alarga la duración del tratamiento antibiótico26. El drenaje quirúrgico fue el tratamiento de elección en el 67% de nuestros pacientes, que dada su buena evolución no precisaron tratamiento antibiótico.
Actualmente comienzan a aislarse cepas de S. aureus con una CMI de vancomicina elevada, por lo que se debe hacer especial énfasis en realizar un adecuado diagnóstico etiológico que comprenda el aislamiento y el estudio de la sensibilidad de estas cepas y un correcto uso de los antibióticos teniendo presente que el tratamiento con betalactámicos en las cepas de S. aureus sensible a meticilina siempre es de primera elección, tanto por su mayor eficacia como por su perfil de seguridad frente a otras familias de antimicrobianos40.
Los pediatras deben mantener la alerta sobre este cambio de sensibilidad antibiótica y la posibilidad de un incremento en la virulencia de S. aureus adquirido en la comunidad. La elevada frecuencia de infecciones leves que evolucionan favorablemente con drenaje y que no requieren hospitalización hace que, en muchas ocasiones, no se realice el diagnóstico microbiológico. Por tanto, es posible que la incidencia de las infecciones leves esté infraestimada. No obstante, no se debe olvidar que, aunque infrecuentes por el momento, las infecciones graves por SARM-AC no son excepcionales en nuestro medio. El control de la propagación de estas infecciones constituye un nuevo reto. Se debe reforzar la vigilancia epidemiológica y realizar estudios para determinar la prevalencia de la colonización y de las infecciones causadas por este microorganismo, de modo que se puedan definir estrategias de prevención de su transmisión en la comunidad.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
A la Dra. Nuria Mayolas por su ayuda en el diagnóstico por imagen.