La identificación rápida del patógeno es clave en el tratamiento de las bacteriemias. Los programas de optimización del uso de antibióticos (PROA) han demostrado reducir resistencias, efectos adversos y costes. MALDI-TOF MS permite una identificación microbiana rápida y precisa. Este estudio evalúa el impacto de su implementación en la adecuación del tratamiento antibiótico y la mortalidad en bacteriemias por Staphylococcus aureus.
MétodosEstudio cuasiexperimental pre-post en un hospital universitario, con 2 periodos: junio 2015/abril 2017 (pre) y junio 2021/abril 2023 (post). Se analizó el impacto de MALDI-TOF en la adecuación antibiótica y la mortalidad.
ResultadosSe incluyeron 176 episodios (85 pre, 91 post). No hubo diferencias epidemiológicas significativas entre grupos, aunque se observó mayor frecuencia de sepsis y shock séptico en la fase post. MALDI-TOF se asoció a un mejor ajuste antibiótico (3,51 vs. 1,75 días; p<0,001). Se observó una tendencia no significativa a menor mortalidad precoz en el grupo post (p=0,06). La mortalidad se asoció con mayor comorbilidad (índice de Charlson), sepsis/shock séptico y bacteriemia por SARM.
ConclusiónLa implementación de MALDI-TOF, junto a un PROA multidisciplinar, optimiza el ajuste precoz de la antibioterapia empírica, y podría estar asociada a una reducción de la mortalidad en las fases iniciales de la bacteriemia por Staphylococcus aureus. Implementar diagnósticos rápidos, especialmente para detectar SARM, es una estrategia clave para mejorar los resultados clínicos.
Rapid pathogen identification is key in the management of bloodstream infections. Antimicrobial stewardship programs (ASPs) have been shown to reduce resistance, adverse effects, and healthcare costs. MALDI-TOF MS enables fast and accurate microbial identification. This study evaluates the impact of its implementation on antibiotic therapy adequacy and mortality in Staphylococcus aureus bacteremia.
MethodsA quasi-experimental pre-post study was conducted at a university hospital, covering two periods: June 2015/April 2017 (pre) and June 2021/April 2023 (post). The impact of MALDI-TOF on antibiotic adequacy and mortality was analyzed.
ResultsA total of 176 episodes were included (85 pre, 91 post). No significant epidemiological differences were observed between groups, although higher rates of sepsis and septic shock were noted in the post phase. MALDI-TOF was associated with improved antibiotic adjustment (3.51 vs. 1.75 days; P<.001). A non-significant trend toward lower early mortality was observed in the post-intervention group (P=.06). Mortality was associated with higher comorbidity (Charlson index), sepsis/septic shock, and MRSA bacteremia.
ConclusionThe implementation of MALDI-TOF, in conjunction with a multidisciplinary ASP, enhances early adjustment of empirical antibiotic therapy and may be associated with reduced early mortality in Staphylococcus aureus bacteremia. Incorporating rapid diagnostics, especially for MRSA detection, is a key strategy to improve clinical outcomes.
A pesar de los avances y mejoras en el tratamiento antimicrobiano, las bacteriemias siguen siendo una de las principales causas de morbimortalidad entre todas las infecciones1. La antibioterapia precoz puede mejorar el pronóstico de los pacientes, reducir la mortalidad y los gastos sanitarios2,3. Sin embargo, no es infrecuente que se produzcan demoras en la administración de un tratamiento adecuado en ausencia de intervenciones especializadas específicas, incluso cuando se dispone de los resultados de sensibilidad3.
Los Programas de Optimización de Uso de los Antibióticos (PROA) desempeñan un papel crucial en la mejora de la adecuación del tratamiento antimicrobiano, minimizando al mismo tiempo las consecuencias no deseadas del uso de antimicrobianos, como la toxicidad, la selección de organismos patógenos como Clostridioides difficile y la aparición de resistencias4.
Los PROA han demostrado ser eficaces para reducir la resistencia a los antimicrobianos y la carga económica asociada, especialmente en entornos con recursos limitados5. Además, permiten incorporar una revisión precoz de los resultados microbiológicos y una intervención en tiempo real sobre el tratamiento de los pacientes, en comparación con la mera notificación de los resultados6. La identificación rápida del patógeno causante de la bacteriemia es fundamental, ya que un retraso en el diagnóstico microbiológico puede derivar en un tratamiento empírico subóptimo que no cubra cepas resistentes como el Staphylococcus aureus resistente a meticilina (SARM)7, así como en una exposición innecesaria a antibióticos de amplio espectro, lo que contribuye al desarrollo de resistencias y a un mayor riesgo de efectos adversos8.
Los programas de optimización del diagnóstico microbiológico (PRODIM), diseñados para mejorar la calidad del diagnóstico asegurando que los métodos sean los más precisos, fiables y rápidos permiten una intervención clínica más efectiva9. Una identificación microbiana rápida a partir de hemocultivos positivos mediante la espectrometría de masas, conocida como matrix-assisted laser desorption-ionization time-of-flight mass spectrometry (MALDI-TOF MS) permite a los clínicos adaptar de forma precoz el tratamiento antibiótico antes del resultado de susceptibilidad antimicrobiana10. Sin embargo, su aplicación aún no está sistematizada en la práctica diaria de todos los laboratorios de microbiología.
Estudios recientes han demostrado que la implementación de pruebas diagnósticas rápidas, como MALDI-TOF, combinadas con la intervención de equipos PROA, se asocia a mejoras clínicas relevantes como la reducción de la mortalidad y del tiempo hasta el tratamiento óptimo11,12. Sin embargo, el impacto clínico específico de esta intervención en bacteriemias por Staphylococcus aureus en contextos con un PROA ya consolidado no está claramente establecido.
En este escenario, nuestra hipótesis es que la identificación microbiana rápida mediante MALDI-TOF a partir de hemocultivos positivos, junto con su comunicación directa al clínico, permitiría optimizar precozmente la antibioterapia empírica antes de disponerse del resultado de susceptibilidad antimicrobiana, mejorando así las tasas de curación y reduciendo la mortalidad en los pacientes con bacteriemia por Staphylococcus aureus.
MétodosEl estudio se realiza en un hospital público de tercer nivel con 582 camas que presta atención sanitaria a un área sanitaria de unos 312.000 habitantes. Cuenta con un servicio de Microbiología que trabaja 24h al día, todos los días de la semana, y que dispone desde mayo 2017 con tecnología MALDI-TOF MS dentro de su flujo de trabajo con hemocultivos. Es por ello que se diseña un estudio retrospectivo, unicéntrico, pre-post cuasiexperimental donde se recogen variables, clínicas y analíticas de los pacientes con bacteriemia por Staphylococcus aureus registrada en el servicio de microbiología de nuestro centro durante el periodo comprendido entre junio de 2015 y abril de 2017, periodo considerado previo a la implementación del sistema de identificación microbiana a través de MALDI-TOF, y durante el periodo comprendido entre junio de 2021 y abril de 2023 considerándose los 2 últimos años completos como periodo representativo en el que la tecnología MALDI-TOF está implementada y consolidada dentro del flujo de trabajo en el laboratorio de microbiología. En el periodo previo (2015-2017), se realizaba identificación bacteriana mediante métodos convencionales basados en pruebas bioquímicas en subcultivo y antibiograma directo del hemocultivo positivo. Durante ambos periodos, el servicio de Microbiología mantiene actividad continua 24/7, incluyendo la lectura e interpretación de hemocultivos. La comunicación de resultados durante el horario laboral (lunes a viernes, de 8 a 15h) se realiza a través del equipo PROA (integrado por especialistas en microbiología, enfermedades infecciosas y farmacia hospitalaria), que revisa las prescripciones, actuando directamente o asesorando al especialista tratante presencial, telefónica y/o electrónicamente mediante recomendaciones en la historia clínica electrónica. Fuera del horario laboral, el laboratorio de microbiología notifica directamente por vía telefónica al especialista tratante de guardia o al equipo de medicina interna/enfermedades infecciosas en su defecto.
Se incluyen los pacientes con bacteriemia por Staphylococcus aureus durante los periodos comprendidos entre junio de 2015 y abril de 2017, y entre junio de 2021 y abril de 2023 que cumplan con todos los criterios de inclusión (primer episodio de bacteriemia monomicrobiana debida a Staphylococcus aureus) y ninguno de exclusión (pacientes pediátricos definidos con una edad inferior a 15 años, ausencia de datos clínicos en historia clínica electrónica como son la fecha y el antibiótico pautado, comorbilidades del paciente, lugar de adquisición o la evolución a los 30 días, episodios de bacteriemia polimicrobianas).
Para ello se estimó un tamaño muestral necesario de 80 pacientes por grupo para detectar diferencias significativas en la correcta adaptación de pautas antibióticas dirigidas entre las 2 técnicas diagnósticas, utilizando una odds ratio de 2,5, con un nivel de confianza del 95% y una potencia del 80%, asumiendo una pérdida del 5%, se aplicó un muestreo no probabilístico tipo consecutivo.
Se definió la presencia de inmunosupresión como la presencia de inmunodeficiencia innata o adquirida, tratamientos inmunosupresores (corticoterapia >3 meses, quimioterapia, fármacos biológicos), historia de trasplante de órgano o médula ósea. Se consideró riesgo para infección por SARM la procedencia centro sociosanitario, la presencia de hospitalización prolongada en los pacientes >65 años pluripatológicos, antibioterapia previa en los últimos 3 meses, paciente en programa de hemodiálisis, estancia en unidades de intensivos o procedimientos invasivos, mucositis en los paciente neutropénico o úlceras cutáneas o los pacientes quemados, así como la colonización o infección previa por SARM. La gravedad fue categorizada en bacteriemia aislada, sepsis (definida como infección junto 2 o 3 puntos en la escala qSOFA)13, o shock séptico (presencia de sepsis junto la necesidad de vasopresores para presión arterial media 65mmHg o lactato >2mmol/l tras resucitación con fluidos).
Se definió tratamiento empírico como el antibiótico administrado ante la sospecha clínica de infección, antes de disponer de resultados microbiológicos. Se consideró tratamiento dirigido el instaurado tras recibir la primera información microbiológica disponible: tinción de Gram en el periodo pre-MALDI-TOF, e identificación mediante MALDI-TOF en el periodo post-implementación.
Los criterios para categorizar como correcta, mejorable o incorrecta la adecuación de la antibioterapia se realizó siguiendo los protocolos de actuación creados por el grupo PROA de nuestro centro y disponibles para todos los profesionales del hospital en la intranet del centro. Se definió como correcta si coincidía con las recomendaciones del protocolo en función de sospecha foco infeccioso, lugar de adquisición y gravedad, incorrecto si la terapia no cubría el aislamiento y mejorable si la antibioterapia hubiese requerido algún ajuste bien de ampliación del espectro antibiótico o de racionalización. La adecuación del tratamiento empírico y dirigido se determinó a partir del tratamiento prescrito en la historia clínica electrónica, considerando el momento en que fue consignado por el facultativo responsable. El sistema de prescripción electrónica del hospital está supervisado en tiempo real por el servicio de Farmacia, de forma que cualquier modificación realizada en el horario de 8 a 00h genera automáticamente la preparación del tratamiento y su envío inmediato a la sala correspondiente. En horario nocturno (00 a 8h), una vez realizada la prescripción, el personal de enfermería contacta con Farmacia para solicitar la medicación.
La variable de resultado principal fue el estado clínico tras el episodio de bacteriemia categorizado por curación (resolución de los síntomas, negativización de hemocultivos al menos 48h después de antibioterapia, estabilidad hemodinámica y finalización tratamiento antibiótico sin observarse recurrencia de la infección en un seguimiento al menos 30 días después de finalizar antibiótico), exitus global (fallecimiento en los 30 días posteriores secundario al episodio de bacteriemia) y bacteriemia persistente.
El análisis estadístico se ha llevado a cabo utilizando el software estadístico Stata® versión 14.2.
Para la selección de la muestra se utilizó un emparejamiento por pares con una ratio de 1:1 entre ambos periodos ajustado a las variables edad, sexo, inmunosupresión y la resistencia a meticilina de Staphylococcus aureus. Para comparar las diferencias entre los grupos, se utilizaron las pruebas de Chi-cuadrado o prueba exacta de Fisher para muestras categóricas y la t de Student o la U de Mann-Whitney para comparar las diferencias entre medias y medianas. Para evaluar las asociaciones entre factores de riesgo y resultados, se realizó un análisis mediante regresión logística. Este modelo permitió calcular la odds ratio (OR) ajustada, junto con su correspondiente intervalo de confianza del 95% (IC 95%). Se utilizaron curvas de supervivencia Kaplan-Meier para estimar la probabilidad de supervivencia y las diferencias entre los grupos fueron comparadas utilizando la prueba log-rank, considerándose estadísticamente significativas aquellas diferencias con un valor de p inferior a 0,05.
De un total de 312 episodios de bacteriemia por Staphylococcus aureus, tras realizar un emparejamiento por pares con una ratio de 1:1 entre ambos periodos ajustado a las variables edad, sexo, inmunosupresión y la resistencia a meticilina de Staphylococcus aureus, se incluyeron 195 hemocultivos de los cuales 176 cumplían todos los criterios de inclusión y ninguno de exclusión. En total se recogieron 85 bacteriemias en el periodo de tiempo previo a la incorporación del sistema MALDI-TOF MS para la identificación microbiana y 91 bacteriemias incluidas en la etapa posterior (fig. 1).
ResultadosComparación de las características epidemiológicasNo hubo diferencias entre los grupos en cuanto a sexo, edad media, índice de Charlson, inmunosupresión, servicio procedente, lugar de adquisición o fuente de bacteriemia (tabla 1). Se observó una tendencia a mayor número de episodios de sepsis y shock séptico en el grupo post-MALDI-TOF MS, pero sin diferencias estadísticamente significativas. No hubo diferencias entre ambos grupos respecto al ser portador de catéter venoso central (CVC). Hay una tendencia a mayor proporción de pacientes con un dispositivo urológico en el grupo pre-MALDI-TOF MS con 32 casos (37,65%), en comparación con el grupo post-MALDI-TOF MS, que presentó 23 casos (25,27%). El foco principal de origen de las bacteriemias fue similar entre ambos grupos predominando las procedentes de catéteres, foco respiratorio y piel y partes blandas.
Datos demográficos y clínicos de los pacientes incluidos en el estudio
| Variable | Periodo pre-MALDI-TOF MS fase (%) | Periodo post-MALDI-TOF MS (%) | Valor de p |
|---|---|---|---|
| n=85 | n=91 | ||
| Edad media (DE) | 66,03 (14,84) | 66,47 (15,67) | 0,738 |
| Sexo | 0,844 | ||
| Varón | 55 (64,71) | 55 (60,42) | |
| Mujer | 30 (35,29) | 36 (39,56) | |
| Índice de Charlson media (DE) | 3,47 (2,62) | 3,6 (2,78) | 0,85 |
| Índice de Charlson >3 | 54 (63,53) | 49 (53,85) | 0,328 |
| Inmunosupresión | 17 (20) | 18 (19,78) | 0,971 |
| Servicio | 0,557 | ||
| Urgencias médicas | 41 (48,24) | 48 (52,75) | |
| Medicina interna | 8 (9,41) | 5 (5,49) | |
| Unidad medicina intensiva | 7 (8,24) | 3 (3,30) | |
| Nefrología | 6 (7,06) | 5 (5,49) | |
| Hematología | 5 (5,88) | 2 (2,20) | |
| Oncología | 4 (4,71) | 7 (7,69) | |
| Cardiología | 3 (3,53) | 2 (2,20) | |
| Cirugía general | 2 (2,35) | 4 (4,40) | |
| Traumatología y ortopedia | 2 (2,35) | 1 (1,10) | |
| Neumología | 2 (2,35) | 2 (2,20) | |
| Neurología | 2 (2,35) | 8 (8,79) | |
| Endocrinología | 1 (1,18) | 1 (1,10) | |
| Medicina digestiva | 1 (1,18) | 3 (3,30) | |
| Neurocirugía | 1 (1,18) | ||
| Adquisición | 0,640 | ||
| Adquirida en la comunidad | 57 (67,06) | 64 (70,33) | |
| Nosocomial | 28 (32,94) | 27 (29,67) | |
| Gravedad | 0,850 | ||
| Bacteriemia aislada | 53 (62,35) | 53 (58,24) | |
| Sepsis | 19 (22,35) | 24 (24,18) | |
| Shock séptico | 13 (15,29) | 16 (17,58) | |
| Fuente de bacteriemia | 0,375 | ||
| Catéter | 19 (22,35) | 18 (19,78) | |
| Respiratorio | 16 (18,82) | 15 (16,48) | |
| Piel y partes blandas | 17 (20) | 14 (15,38) | |
| Desconocido | 13 (15,29) | 19 (20,88) | |
| Endocarditis | 5 (5,88) | 8 (8,79) | |
| Abdominal | 5 (5,88) | 1 (1,10) | |
| Urinario | 4 (4,71) | 6 (6,59) | |
| SNC | 4 (4,71) | 2 (2,20) | |
| Articular | 2 (2,35) | 6 (6,59) | |
| Hepatobiliar | 0 (0) | 2 (2,20) | |
| Bacteriemia por SARM | 19 (22,35) | 18 (19,78) | 0,703 |
| Colonización previa por SARM | 2 (2,35) | 4 (4,40) | 0,313 |
| Factores de riesgo por SARM | 28 (32,94) | 47 (51,65) | 0,012 |
| Antibioterapia previa | 11 (12,94) | 16 (17,58) | 0,394 |
| Antecedentes infección de piel y partes blandas | 3 (3,53) | 7 (7,69) | 0,233 |
| Portador de catéter venoso central | 31 (36,47) | 27 (29,67) | 0,318 |
| Dispositivo urológico | 32 (37,65) | 23 (25,27) | 0,068 |
DE: desviación estándar; MALDI-TOF MS: matrix-assisted laser desorption-ionization time-of-flight mass spectrometry; SNC: sistema nervioso central; SARM: Staphylococcus aureus meticilin-resistente.
Se encontraron diferencias significativas con respecto a los factores de riesgo para SARM en el grupo post-MALDI-TOF, aunque los porcentajes de colonizaciones y bacteriemias por SARM fueron similares entre ambos grupos. El resto de las variables están reflejadas en la tabla 1.
Adecuación y uso de antibioterapiaLa proporción de pacientes que recibieron tratamiento antibiótico correcto, mejorable o incorrectos de forma empírica y de forma dirigida según el método de detección en cada periodo se muestran en la tabla 2. La proporción de tratamientos correctos fue similar en ambos periodos del estudio, aunque se observa una tendencia a una mayor proporción de tratamientos dirigidos correctos tras la implantación del sistema MALDI-TOF MS (p: 0,065).
Distribución por grupos según adecuación del tratamiento antibiótico empírico y dirigido en ambas etapas del estudio
| Tratamiento antibiótico empírico | ||
|---|---|---|
| Pre-MALDI-TOF MS | Post-MALDI-TOF MS | |
| Correcto, n (%) | 57 (67,05) | 53 (54,95) |
| Mejorable, n (%) | 14 (16,47) | 27 (29,67) |
| Incorrecto, n (%) | 10 (11,76) | 13 (14,29) |
| Tratamiento antibiótico dirigido | ||
|---|---|---|
| Pre-MALDI-TOF MS | Post-MALDI-TOF MS | |
| Correcto, n (%) | 75 (88,24) | 91 (100) |
| Mejorable, n (%) | 3 (3,52) | 0 (0) |
| Incorrecto, n (%) | 0 (0) | 0 (0) |
MALDI-TOF MS: matrix-assisted laser desorption-ionization time-of-flight mass spectrometry.
En las figuras A.1 y A.2 del material suplementario se observa la distribución de antibioterapia empírica y dirigida respectivamente utilizada en ambas fases del estudio. En el periodo post-MALDI-TOF MS predomina el uso piperacilina-tazobactam, linezolid y daptomicina con respecto al periodo pre-implantación. Respecto al uso de antibioterapia dirigida según el método de detección destaca el uso de vancomicina y amoxicilina-clavulánico en el periodo pre-MALDI-TOF MS, siendo daptomicina y cloxacilina la antibioterapia predominante en el periodo post-MALDI-TOF MS.
El tiempo medio de días hasta la corrección de la antibioterapia empírica fue de 3,51±2,15 en el periodo pre-implantación del sistema de identificación MALDI-TOF MS frente a 1,75±1,65 días en el periodo post-MALDI-TOF MS con diferencias estadísticamente significativas (p<0,001).
Hospitalización y evoluciónEn la figura 2 se representan las diferencias en la evolución clínica entre los 2 períodos estudio. No se identificaron diferencias significativas en curación (p: 0,997), bacteriemia persistente (p: 0,999) o exitus a los 30 días posteriores al episodio de bacteriemia (p: 0,676).
La mayor parte de los pacientes con curación al final del episodio fueron pacientes sin criterios de sepsis o shock séptico en ambos grupos (pre-MALDI-TOF MS: 47 [48,18%] y post-MALDI-TOF MS: 44 [48, 35%]; p: 0,775). La mayor parte de los pacientes con shock séptico fueron los de mayor mortalidad en ambos periodos del estudio (pre-MALDI-TOF MS: 8 [9,41%] y post-MALDI-TOF MS 10 [10,9%]; p: 0,683). La media de días de hospitalización fue de 21,49±22,11 durante el periodo pre-implantación sistema MALDI-TOF MS frente a 21,19±20,47 días en el periodo posterior con una p: 0,911.
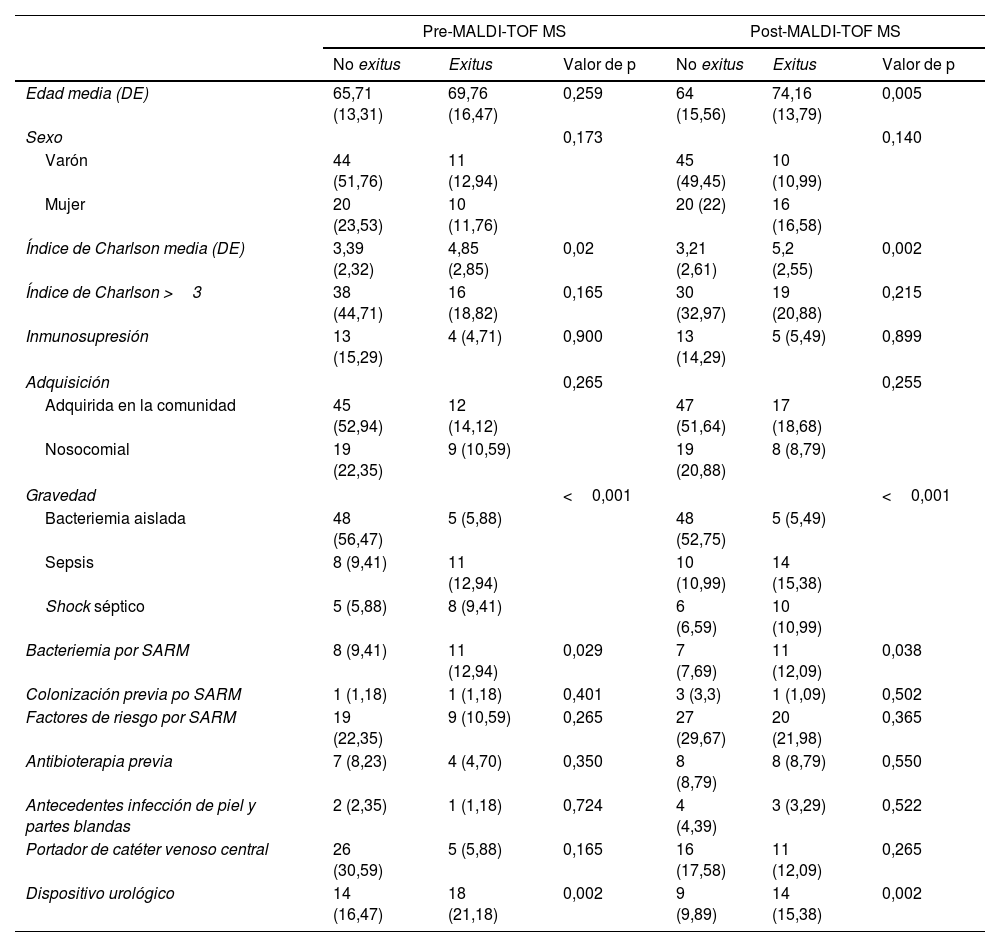
Mortalidad y factores de riesgo asociadosEn la tabla 3 se muestran las características clínicas y demográficas comparadas entre los grupos de pacientes según mortalidad a los 30 días de cada uno de los periodos de nuestro estudio (pre y post-MALDI-TOF MS), registrándose la magnitud del efecto sobre la mortalidad de las variables significativas asociadas a mortalidad en ambos grupos de intervención. Destacan el efecto en la mortalidad de las bacteriemias producidas por Staphylococcus aureus meticilin-resistente (OR: 3,32 y 2,68 en grupos pre y post-MALDI-TOF MS, respectivamente), así como la presencia de dispositivos de derivación urológica (OR: 5 y 2,72 en grupos pre y post-MALDI-TOF, respectivamente). En un modelo de regresión logística ajustado por gravedad, la presencia de sonda vesical no se asoció significativamente con la mortalidad (OR: 1,45; IC 95%: 0,62-3,39; p=0,395). En cambio, tanto la sepsis (OR: 3,67; IC 95%: 1,50-8,98; p=0,004) como el shock séptico (OR: 9,31; IC 95%: 3,21-27,05; p<0,001) se asociaron con un incremento significativo en el riesgo de fallecimiento.
Mortalidad según las características clínico-epidemiológicas y el período de estudio
| Pre-MALDI-TOF MS | Post-MALDI-TOF MS | |||||
|---|---|---|---|---|---|---|
| No exitus | Exitus | Valor de p | No exitus | Exitus | Valor de p | |
| Edad media (DE) | 65,71 (13,31) | 69,76 (16,47) | 0,259 | 64 (15,56) | 74,16 (13,79) | 0,005 |
| Sexo | 0,173 | 0,140 | ||||
| Varón | 44 (51,76) | 11 (12,94) | 45 (49,45) | 10 (10,99) | ||
| Mujer | 20 (23,53) | 10 (11,76) | 20 (22) | 16 (16,58) | ||
| Índice de Charlson media (DE) | 3,39 (2,32) | 4,85 (2,85) | 0,02 | 3,21 (2,61) | 5,2 (2,55) | 0,002 |
| Índice de Charlson >3 | 38 (44,71) | 16 (18,82) | 0,165 | 30 (32,97) | 19 (20,88) | 0,215 |
| Inmunosupresión | 13 (15,29) | 4 (4,71) | 0,900 | 13 (14,29) | 5 (5,49) | 0,899 |
| Adquisición | 0,265 | 0,255 | ||||
| Adquirida en la comunidad | 45 (52,94) | 12 (14,12) | 47 (51,64) | 17 (18,68) | ||
| Nosocomial | 19 (22,35) | 9 (10,59) | 19 (20,88) | 8 (8,79) | ||
| Gravedad | <0,001 | <0,001 | ||||
| Bacteriemia aislada | 48 (56,47) | 5 (5,88) | 48 (52,75) | 5 (5,49) | ||
| Sepsis | 8 (9,41) | 11 (12,94) | 10 (10,99) | 14 (15,38) | ||
| Shock séptico | 5 (5,88) | 8 (9,41) | 6 (6,59) | 10 (10,99) | ||
| Bacteriemia por SARM | 8 (9,41) | 11 (12,94) | 0,029 | 7 (7,69) | 11 (12,09) | 0,038 |
| Colonización previa po SARM | 1 (1,18) | 1 (1,18) | 0,401 | 3 (3,3) | 1 (1,09) | 0,502 |
| Factores de riesgo por SARM | 19 (22,35) | 9 (10,59) | 0,265 | 27 (29,67) | 20 (21,98) | 0,365 |
| Antibioterapia previa | 7 (8,23) | 4 (4,70) | 0,350 | 8 (8,79) | 8 (8,79) | 0,550 |
| Antecedentes infección de piel y partes blandas | 2 (2,35) | 1 (1,18) | 0,724 | 4 (4,39) | 3 (3,29) | 0,522 |
| Portador de catéter venoso central | 26 (30,59) | 5 (5,88) | 0,165 | 16 (17,58) | 11 (12,09) | 0,265 |
| Dispositivo urológico | 14 (16,47) | 18 (21,18) | 0,002 | 9 (9,89) | 14 (15,38) | 0,002 |
MALDI-TOF MS: matrix-assisted laser desorption-ionization time-of-flight mass spectrometry; SNC: sistema nervioso central; SARM: Staphylococcus aureus meticilin-resistente.
En la figura 3 se presentan las curvas de supervivencia de Kaplan-Meier para los períodos pre-MALDI-TOF MS (azul) y post-MALDI-TOF MS (rojo). Se observa una mayor tasa de mortalidad en el grupo pre-MALDI-TOF MS en los primeros días, con una disminución más rápida de la supervivencia en comparación con el grupo post-MALDI-TOF MS. Sin embargo, hacia el final del seguimiento, las curvas tienden a converger, lo que sugiere que las diferencias en la mortalidad disminuyen a lo largo del tiempo. El análisis mediante la prueba de log-rank mostró una diferencia en la supervivencia cercana a la significación estadística (p=0,06). Aunque no se alcanza el umbral convencional de significación estadística, el valor obtenido sugiere que la implementación del MALDI-TOF podría estar asociada con una mejora en la supervivencia, particularmente en los primeros días, aunque esta diferencia no es concluyente.
DiscusiónLos PROA han demostrado mejoras significativas en aquellos hospitales donde se han implementado consiguiendo beneficios tanto a nivel clínico como reducciones de los costes sanitarios5. Existen diferentes estrategias para conseguir estas mejoras, como la priorización de oportunidades de mejora basada en principios de uso de antibióticos, en servicios asistenciales, en fármacos o en síndromes infecciosos14. En este ámbito se incluyen los PRODIM quienes promueven actuaciones orientadas a optimizar el uso de las técnicas diagnósticas, propiciando la toma de decisiones terapéuticas y clínicas adecuadas9. El uso de la tecnología MALDI-TOF MS para la identificación directa de hemocultivos positivos ha demostrado reducir sustancialmente el tiempo si se comparan con métodos convencionales donde el resultado puede demorarse entre 24 y 48h permitiendo un ajuste precoz de la terapia empírica15.
En nuestro estudio, el alto nivel de comorbilidad representado con la escala validada de Charlson, donde más del 60% de los pacientes tuvieron una puntuación mayor de 3, fue similar a otros estudios16,17. El foco clínico más frecuente fueron las bacteriemias relacionadas con catéter seguidas por el foco respiratorio y piel y partes blandas. El tratamiento empírico correcto predominó sobre aquellos regímenes mejorables o incorrectos en ambas fases. Sin embargo, destacó una tendencia a pautas más apropiadas gracias a la información recibida a través de la identificación con el sistema MALDI-TOF MS. Estos datos son similares a los ya publicados por Osthoff et al., aunque con algunas diferencias en el diseño del estudio en el que se evaluaba la terapia antimicrobiana en las 24h posteriores a su positividad, o los resultados de Torres et al., aunque con un enfoque más global, incluyendo no solo Staphyloccus aureus y centrado en unidades de oncohematología y unidades de medicina intensiva15,18. Además, en nuestro centro ya estaba en funcionamiento un equipo PROA especializado en la revisión y el ajuste antibioterápico precoz y, por tanto, la validez externa en otros entornos sanitarios distintos puede verse reducida. Un ejemplo de ello se plasma en el trabajo publicado por Yong Duk et al. donde, con un diseño muy similar, aunque en un entorno sin un equipo PROA, no se observaron resultados positivos a la información precoz obtenida por el sistema MALDI-TOF MS19. En cualquier caso, pese a la detección precoz a través del sistema MALDI-TOF MS, la mortalidad aumentó en los pacientes con mayores comorbilidades evaluadas con escalas validadas como el índice de Charlson, siendo este índice un predictor independiente de la mortalidad20. La presencia de un dispositivo de derivación urológica como factor de riesgo asociado a mortalidad no se confirmó en el análisis por regresión logística ajustando por gravedad por lo que probablemente esta observación se debió a que los pacientes con dispositivos urológicos eran aquellos que mostraban una mayor gravedad, requiriendo monitorización continua de la diuresis. La presencia de sepsis o shock séptico está fuertemente asociada a peores resultados con tasas de mortalidad del 38-86%21–23. Aunque en la literatura las definiciones de sepsis y shock séptico son variables, los datos recogidos en otros estudios publicados son similares a los obtenidos en nuestro estudio.
Respecto a la mortalidad asociada a la bacteriemia por SARM respecto a SAMS, encontramos datos en la literatura que refuerzan estos hallazgos24. Las posibles causas que potencialmente explicarían esta asociación son varias. En primer lugar, relacionado específicamente con las características del patógeno, los factores de virulencia asociados al cassette cromosómico estafilocócico (SCCmec), siendo el SCCmec tipo II un predictor independiente de la mortalidad en el estudio de cohortes publicado por Chen SY et al.23. Por otra parte, las diferencias en la prescripción empírica de vancomicina pueden explicar la diversidad de resultados, ya que la vancomicina tiene una actividad bactericida in vitro más lenta, especialmente en las infecciones con alto inóculo y con una distribución tisular variable25. Por último, es posible que en las infecciones por SARM, la resistencia a la meticilina per se sea un factor confusor y realmente refleje el impacto de los factores relacionados con el huésped, como las comorbilidades. En nuestro estudio, no se contempló el efecto de la detección rápida de PBP2a por inmunocromatografía, práctica actualmente habitual para la detección precoz de resistencia a meticilina26, ya que no se realizaba de forma sistemática durante el periodo estudiado y se buscaba analizar específicamente el impacto de MALDI-TOF y la intervención PROA.
Respecto a la importancia del tiempo hasta la adecuación del tratamiento antibiótico como factor de supervivencia, múltiples publicaciones observan un efecto nocivo en el retraso del tratamiento adecuado27,28. En esta línea, un estudio reciente de Fidalgo et al. en una cohorte de más de 6.000 episodios de bacteriemia evidenció que el retraso en la notificación de resultados microbiológicos clínicamente relevantes se asocia a un aumento significativo de la mortalidad en los pacientes con bacteriemia29. Sin embargo, otros estudios no han podido detectar diferencias en la mortalidad o tan solo en grupos de pacientes seleccionados con una APACHE II elevada, con bacteriemia por Staphyloccus aureus complicada30 o en los pacientes con un foco no erradicable en comparación con los focos erradicables31. Las diferentes definiciones de tratamiento empírico adecuado, los grupos de pacientes estudiados o los posibles sesgos de los estudios podrían explicar estas discrepancias. En cualquier caso, es razonable pensar que la prescripción temprana de antibióticos adecuados resulte beneficiosa en grupos de pacientes seleccionados.
Este estudio cuenta con varias limitaciones. En primer lugar, se trata de un estudio cuasiexperimental que carece de aleatorización, motivo por el cual se aplicaron técnicas de emparejamiento entre ambos grupos según variables clave como edad, sexo, inmunosupresión y resistencia a meticilina de Staphylococcus aureus. En segundo lugar, la experiencia se limita a un único centro, lo que reduce la validez externa del estudio y limita la generalización de sus conclusiones a otros entornos hospitalarios con estructuras diferentes. En tercer lugar, la implementación de la identificación rápida mediante MALDI-TOF MS se produjo en un contexto en el que ya existía un equipo PROA consolidado, con intervención precoz en el manejo de bacteriemias, lo cual podría haber reducido el margen de mejora observable y, en consecuencia, dificultado la identificación de diferencias estadísticamente significativas. Por último, como se detalla en la sección de métodos, el momento de inicio del tratamiento se estableció en función del registro de la prescripción electrónica, lo que podría introducir una ligera imprecisión respecto al momento exacto de administración del antibiótico.
En resumen, nuestros hallazgos refuerzan la utilidad clínica del diagnóstico rápido mediante MALDI-TOF MS en combinación con programas PROA consolidados para optimizar la antibioterapia en bacteriemias por Staphylococcus aureus. Aunque la mejora en la adecuación del tratamiento no se tradujo en una reducción estadísticamente significativa de la mortalidad global, los beneficios observados en la adecuación precoz y la tendencia en la supervivencia temprana subrayan la relevancia de estas intervenciones. Futuros estudios multicéntricos, con mayor tamaño muestral y diseño prospectivo, serán clave para confirmar estos resultados y definir con mayor precisión su impacto en los desenlaces clínicos.
Aspectos éticosEste estudio fue revisado y aprobado por el Comité Ético de Investigación del Hospital Clínico Universitario de Valencia (orden 2024/197). El estudio se llevó a cabo de acuerdo con los principios de la Declaración de Helsinki y las normativas locales sobre investigación en seres humanos. CBS cuenta con un contrato Río Hortega (CM23/00282), financiado por el Instituto de Salud Carlos III (ISCIII).
FinanciaciónEste trabajo no ha estado financiado con ningún otro presupuesto adicional.
Conflicto de interesesEste trabajo no está sujeto a ningún conflicto de intereses.