La prevalencia de la infección por el virus de la inmunodeficiencia humana (VIH) en gestantes en Guinea Ecuatorial (GE) es alta (7,3%). En 2008 se actualizó el protocolo de prevención de transmisión vertical (PTMH) de VIH para adaptarlo a las guías de la OMS vigentes. El objetivo de nuestro trabajo es describir las características y la evolución de los niños expuestos al VIH tras la introducción del protocolo.
MétodosEstudio descriptivo retrospectivo de los hijos de madres con infección por VIH, en el Hospital Regional y Centro de Salud María Rafols en Bata (GE) seguidos desde junio de 2008 hasta noviembre de 2011. El diagnóstico de infección por VIH en los niños se basó en el protocolo de test rápidos serológicos.
ResultadosSe incluyeron 103niños, y de ellos 47eran varones. Un total de 53pacientes (51%) completaron el seguimiento. Catorce niños (26%) fueron diagnosticados de infección por VIH (11 por diagnóstico presuntivo, 3 por persistencia de anticuerpos después de los 18meses de vida). Seis niños (12%) fallecieron antes de un diagnóstico definitivo. El 52% de las madres recibieron tratamiento antirretroviral (TAR) durante el embarazo. La transmisión vertical en los niños cuyas madres recibieron TAR fue del 16% (3/19), frente al 43% (10/23) en los niños cuyas madres no lo recibieron (p=0,05), y del 8% (1/13) en los niños cuyas madres recibieron TAR y el niño profilaxis posnatal (p<0,05).
ConclusionesEn nuestra cohorte el cumplimiento del protocolo de PTMH ha sido todavía muy bajo. El tratamiento antirretroviral en mujeres embarazadas disminuyó la tasa de transmisión vertical, pero esta aún sigue siendo muy alta. Una elevada proporción de niños se perdieron durante el seguimiento, así que es prioritario desarrollar estrategias para evitarlo, así como medidas de diagnóstico virológico precoz.
The prevalence of human immunodeficiency virus (HIV)-infected pregnant women in Equatorial Guinea (EG) has been reported as 7.3%. In 2008 an updated version of the PMTCT protocol was accepted according to the current WHO guidelines. The aim of this study was to describe the characteristics and outcome of children exposed to HIV after the introduction of the protocol.
MethodsA retrospective review was conducted on the clinical characteristics of the infants born to HIV-infected mothers in the Hospital Regional de Bata and Primary Health Care Centre Maria Rafols in Bata (EG) between June 2008 and November 2011. The diagnosis of HIV infection in children was based on rapid serology tests.
ResultsA total of 103children were included, of which 47 were males. Fifty three patients (51%) completed the follow-up (51%). Fourteen children (26%) were diagnosed with HIV infection (11 presumptive diagnosis, 3 due to persistence of antibodies at 18months). Six children (12%) died before a definitive diagnosis. Just over than half (52%) of mothers received antiretroviral therapy (ART) during pregnancy. The transmission rate in children whose mothers received ART was 16% (3/19), compared with 43% (10/23) in children whose mothers did not receive it. Only one child was infected (8%) when the mother received ART, and child received postnatal prophylaxis.
ConclusionsThe PMTCT protocol compliance was still very low. Antiretroviral therapy in pregnant women decreased the rate of vertical transmission, but the rate still remains very high. Many children were lost to follow-up. Strategies to prevent loss to follow-up and methods for earlier virological diagnostic are needed.
En diciembre de 2010, según datos de la Organización Mundial de la Salud (OMS), en África subsahariana vivían 3.100.000niños con el virus de la inmunodeficiencia humana (VIH)1. La transmisión del VIH de la madre al recién nacido, intraútero, en el canal del parto y a través de la lactancia materna, son las vías principales de infección por VIH en niños2.
Según las estimaciones del Programa Nacional de lucha contra el VIH de Guinea Ecuatorial, en 2010 vivían en el país unas 13.316personas con el virus del VIH3. La prevalencia en la población comprendida entre 15 y 49años es del 3,2% (IC95%: 2,0-4,4). La prevalencia de la infección por VIH en el grupo de mujeres embarazadas se ha incrementado de manera muy preocupante, pasando del 1,49% en 1997 al 7,3% (IC95%: 6,0-8,8) en 2008. En cuanto a la población infantil, se estimó que existe una población acumulada que vive con el VIH en el país de unos 2.000niños menores de 14años3.
Los esfuerzos en la creación e implementación de protocolos de prevención de la transmisión del VIH de la madre al hijo (PTMH) en países de África subsahariana han permitido aumentar las coberturas de tratamiento antirretroviral en las gestantes con infección por VIH, así como disminuir la transmisión vertical1,4,5. En Guinea Ecuatorial, el Plan Nacional de Lucha contra el Sida, con el apoyo técnico del Centro Nacional de Medicina Tropical del Instituto de Salud CarlosIII de España, actualizó el protocolo nacional de PTMH en 20086. Siguiendo los protocolos internacionales, en esta actualización se recomienda el cribado de infección VIH en toda mujer embarazada. En caso de confirmarse la infección en la gestante, se valoraba la indicación de TAR de gran efectividad (TARGA) o de profilaxis con antirretrovirales según recomendaciones de la OMS vigentes. De igual forma, este protocolo incluía recomendaciones para el seguimiento del niño expuesto, así como un protocolo diagnóstico de infección por VIH en el hijo de madre infectada por VIH, basado en recomendaciones de la OMS7,8.
El objetivo de este estudio es describir las características de los niños expuestos a la infección por VIH y el cumplimiento del protocolo Nacional de PTMH en la zona continental de Guinea Ecuatorial.
MétodosSe realizó un estudio descriptivo, retrospectivo, de los hijos de madres con infección por VIH, en seguimiento desde junio de 2008 hasta noviembre de 2011, en el Hospital Regional de Bata y en el Centro de Salud María Rafols, en Bata (Guinea Ecuatorial). Se consideraron infectadas por VIH todas las mujeres que tenían 3test rápidos serológicos positivos seriados, según la recomendación del Protocolo de diagnóstico y seguimiento de laboratorio del VIH/Sida en Guinea Ecuatorial9. Actualmente en este país, y avalado por las recomendaciones de la OMS10, para el diagnóstico de VIH en países de recursos limitados sin acceso a métodos virológicos se emplea un protocolo de diagnóstico en acto único con 3test rápidos: en el momento del estudio la serie de test utilizados fueron Determine® (Abbott Laboratories, EE.UU.), Unigold® (Michigan Regional Laboratory System), Hexagon® (Acon Laboratories, San Diego, California, EE.UU.). Antes de realizar la prueba las madres recibían educación sanitaria sobre la infección por VIH y debían dar su consentimiento escrito para la realización de los test diagnósticos.
Cuando el resultado de los 3 test era positivo, se consideraba confirmada la infección por VIH y la madre recibía educación sanitaria y apoyo psicosocial. Tras la valoración clínica e inmunológica se indicaba TARGA o profilaxis con antirretrovirales según las recomendaciones de PTMH del Plan Nacional de Lucha contra el VIH/Sida. Según este protocolo, las gestantes con estadios clínicos3 y 4 de la OMS o con CD4 menores de 350células/mm3 tenían indicación de inicio de TARGA, mientras que las gestantes con estadios clínicos1 o 2 de la OMS o CD4 mayores de 350células/mm3 tenían indicación de profilaxis. El Protocolo Nacional establece que la profilaxis con antirretrovirales consiste en la administración de zidovudina (AZT) desde la semana 28 de gestación, con la administración de AZT, lamivudina (3TC) y nevirapina (NVP) en el momento del parto, seguido de la administración de AZT y 3TC durante una semana en el posparto para evitar la selección de resistencias a NVP en dosis única. El TARGA de primera línea recomendado incluía AZT+3TC+NVP. El tipo de parto generalmente era vaginal, siendo la cesárea una técnica no generalizada. El protocolo recomienda que, tras el nacimiento, el niño reciba dosis única de NVP y profilaxis con AZT durante 1 a 4semanas, según el tiempo total de tratamiento antirretroviral que recibiese la madre durante la gestación.
Durante la gestación se realizaba educación sanitaria sobre los tipos de alimentación recomendados en el recién nacido: lactancia materna exclusiva o lactancia artificial. En Guinea Ecuatorial existe un programa de lactancia artificial gratuito para estas madres coordinado y financiado por el gobierno. En caso de que la madre optase por la lactancia artificial, se valoraba que se cumplieran los criterios AFASS (aceptable, factible, asequible, sostenible, segura) recomendados por la OMS11. El seguimiento del niño expuesto se basa en las revisiones protocolizadas desde el nacimiento hasta descartar o confirmar la infección por VIH. Las revisiones estaban incluidas en el calendario de visitas de seguimiento del niño sano con visita al nacimiento, a las 2, 6 y 10semanas de vida y a los 3, 6, 9, 12, 15 y 18meses. En cada visita se realizaba una valoración clínica del paciente, con especial atención a la aparición de síntomas y/o signos de enfermedad por VIH, se daban consejos sobre alimentación y se actualizaba el calendario vacunal. A partir de la sexta semana de vida se recomendaba tratamiento profiláctico con cotrimoxazol a todos los niños expuestos.
Se consideraba descartada la infección por VIH con la negativización del test rápido (Determine®) a partir del sexto mes de vida en al menos 2ocasiones, siempre y cuando el niño no recibiera lactancia materna. Se consideró como fecha de desaparición de anticuerpos la primera fecha en la que el test fue negativo. En caso de recibir lactancia materna, se consideraba que el niño no estaba infectado cuando el test era negativo, en al menos 2ocasiones, a partir de los 6meses del cese de la lactancia materna. Se consideraba confirmada la infección por VIH cuando los 3test rápidos (Determine®, Unigold® y Hexagon®) eran positivos después de los 18meses de vida. Se consideró diagnostico presuntivo de VIH, según las recomendaciones de la OMS, un lactante menor de 18meses con test rápido positivo y 2 o más síntomas/signos de los siguientes: candidiasis oral persistente, neumonía grave, malnutrición grave, sepsis grave o estadio4 de la OMS. Se consideró abandono del seguimiento cuando el niño dejaba de acudir más de 6meses y no se pudo descartar o confirmar la infección por VIH.
Se recogieron datos sociodemográficos y clínicos, incluyendo raza, sexo, fecha de nacimiento, edad al iniciar el seguimiento, tratamiento antirretroviral (TAR) a la madre durante el embarazo, ausencia de TAR durante el embarazo, causa de ausencia de TAR durante el embarazo, edad gestacional, peso del recién nacido (PRN), tipo de parto (vaginal/cesárea), profilaxis con antirretrovirales en el recién nacido, tiempo de tratamiento del recién nacido, tipo de lactancia (artificial, materna, mixta), duración de la lactancia materna, profilaxis con cotrimoxazol, asistencia y evolución clínica en las revisiones. Los datos fueron extraídos de las hojas de seguimiento de los pacientes. El análisis estadístico fue realizado con el soporte informático del programa SPSS 15.0 para Windows. Se analizaron la mediana y el rango intercuatílico de las variables cuantitativas. Con las variables cualitativas se obtuvieron las frecuencias absolutas y los porcentajes correspondientes a cada una de las categorías que componían dichas variables. Se utilizó el test exacto de Fisher para el análisis de variables cualitativas.
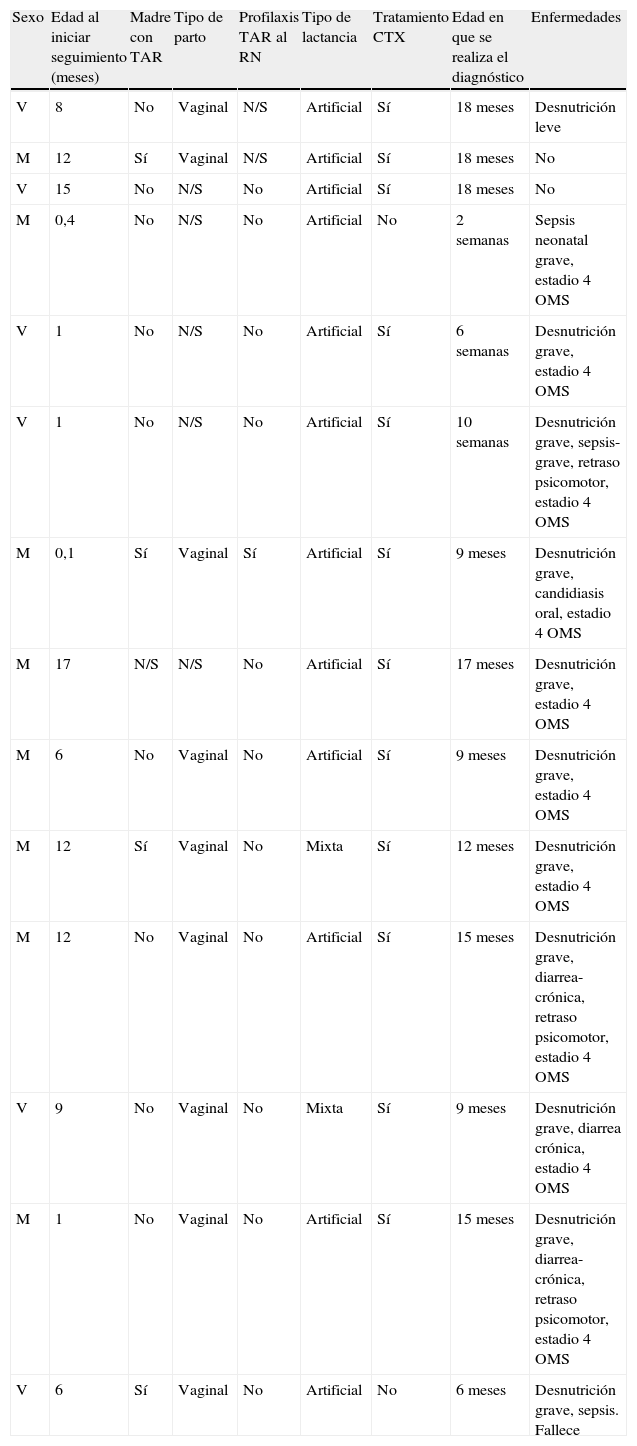
ResultadosSe incluyeron 103niños expuestos, hijos de madres que vivían con el VIH. Todos los niños fueron de raza negra, nacidos en Guinea Ecuatorial. El 46% de los pacientes fueron varones (47/103). Un total de 53niños (51%) completaron el seguimiento, el resto se consideraron perdidos. En 14 de los 53niños que completaron el seguimiento (26%) se consideró que los niños estaban infectados. En 3casos se confirmó la infección por VIH al persistir los anticuerpos con más de 18meses de edad, y 11niños fueron diagnosticados de infección por VIH por diagnóstico presuntivo (tabla 1). En el 62% (33/53) de los niños que completaron el seguimiento se descartó la infección al confirmar la desaparición de los anticuerpos a los 18meses de vida o antes. El 12% (6/53) de los niños falleció antes de poder confirmar su diagnóstico.
Características clínicas de los niños infectados por VIH
| Sexo | Edad al iniciar seguimiento (meses) | Madre con TAR | Tipo de parto | Profilaxis TAR al RN | Tipo de lactancia | Tratamiento CTX | Edad en que se realiza el diagnóstico | Enfermedades |
| V | 8 | No | Vaginal | N/S | Artificial | Sí | 18 meses | Desnutrición leve |
| M | 12 | Sí | Vaginal | N/S | Artificial | Sí | 18 meses | No |
| V | 15 | No | N/S | No | Artificial | Sí | 18 meses | No |
| M | 0,4 | No | N/S | No | Artificial | No | 2 semanas | Sepsis neonatal grave, estadio 4 OMS |
| V | 1 | No | N/S | No | Artificial | Sí | 6 semanas | Desnutrición grave, estadio 4 OMS |
| V | 1 | No | N/S | No | Artificial | Sí | 10 semanas | Desnutrición grave, sepsis-grave, retraso psicomotor, estadio 4 OMS |
| M | 0,1 | Sí | Vaginal | Sí | Artificial | Sí | 9 meses | Desnutrición grave, candidiasis oral, estadio 4 OMS |
| M | 17 | N/S | N/S | No | Artificial | Sí | 17 meses | Desnutrición grave, estadio 4 OMS |
| M | 6 | No | Vaginal | No | Artificial | Sí | 9 meses | Desnutrición grave, estadio 4 OMS |
| M | 12 | Sí | Vaginal | No | Mixta | Sí | 12 meses | Desnutrición grave, estadio 4 OMS |
| M | 12 | No | Vaginal | No | Artificial | Sí | 15 meses | Desnutrición grave, diarrea-crónica, retraso psicomotor, estadio 4 OMS |
| V | 9 | No | Vaginal | No | Mixta | Sí | 9 meses | Desnutrición grave, diarrea crónica, estadio 4 OMS |
| M | 1 | No | Vaginal | No | Artificial | Sí | 15 meses | Desnutrición grave, diarrea-crónica, retraso psicomotor, estadio 4 OMS |
| V | 6 | Sí | Vaginal | No | Artificial | No | 6 meses | Desnutrición grave, sepsis. Fallece |
AR: antirretroviral; CTX: cotrimoxazol; M: mujer; N/S: dato no recogido; RN: recién nacido; TAR: tratamiento antirretroviral; V, varón.
El 52% (54/103) de las madres recibieron algún tipo de TAR durante el embarazo. De las madres que recibieron TAR, el 67% (36/54) recibieron TARGA, todas ellas con AZT, 3TC y NVP. El 15% (8/54) recibieron monoterapia con AZT en el embarazo, pero solo una de ellas recibió además una dosis única de NVP en el momento del parto. El 11% (6/54) recibieron exclusivamente una dosis única de nevirapina en el momento del parto. En el 7% (4/54) no se pudo determinar qué tipo de tratamiento antirretroviral recibieron. De las madres que no recibieron TAR, solo el 27% (10/37) desconocían estar infectadas durante el embarazo.
El 41% (42/103) de los recién nacidos recibieron TAR antes de las primeras 72h de vida. De los que recibieron TAR, el 52% (22/42) recibieron AZT durante al menos una semana y dosis única de nevirapina; y los niños restantes recibieron solo una dosis única de NVP.
El 79% (81/103) de los niños nacieron por parto vaginal, el 5% (5/103) nacieron por cesárea y en el 16% (17/103) no estaba recogido el tipo de parto. La mediana de la edad gestacional fue de 38semanas (rango intercuartílico, 37-39semanas). La mediana de peso al nacimiento fue de 2.900g (rango intercuartílico, 2.500-3.300g). La mediana de edad al iniciar el seguimiento fue de 3semanas de vida (rango intercuartílico, 0-5,7meses). Ningún niño recibió lactancia materna exclusiva, 4 recibieron lactancia mixta y 99 lactancia artificial exclusiva. La mediana de duración de la lactancia mixta fue de 3meses (rango intercuartílico, 1-7meses). Todos los pacientes que recibieron lactancia mixta no habían iniciado el seguimiento previamente y recibieron lactancia artificial exclusiva tras iniciar este.
La tasa de transmisión vertical de la infección por VIH en los niños que terminaron el seguimiento y cuyas madres recibieron TAR fue del 16% (3/19), frente al 43% (10/23) en los niños expuestos cuyas madres no recibieron TAR (p=0,05; OR=0,229; IC95%: 0,052-1,006). La tasa de transmisión vertical en los niños cuyas madres recibieron TAR durante el embarazo y el recién nacido profilaxis antes de las primeras 72h de vida fue significativamente menor que en los niños expuestos cuyas madres no recibieron TAR: 8% (1/13) vs 43% (10/23), p=0,028. De los 3niños que recibieron lactancia mixta y terminaron el seguimiento, 2iniciaron TARGA por diagnóstico presuntivo, y en el otro niño se confirmó la desaparición de anticuerpos maternos a los 18meses de vida, cuando habían pasado más de 6meses tras la retirada de la lactancia materna.
La mediana de desaparición de anticuerpos frente al VIH fue a los 9meses de vida (rango intercuartílico, 6,5-12meses). El 24% de los pacientes (8/33) negativizaron anticuerpos a los 6meses de vida, y el 79% (26/33), a los 12meses de vida.
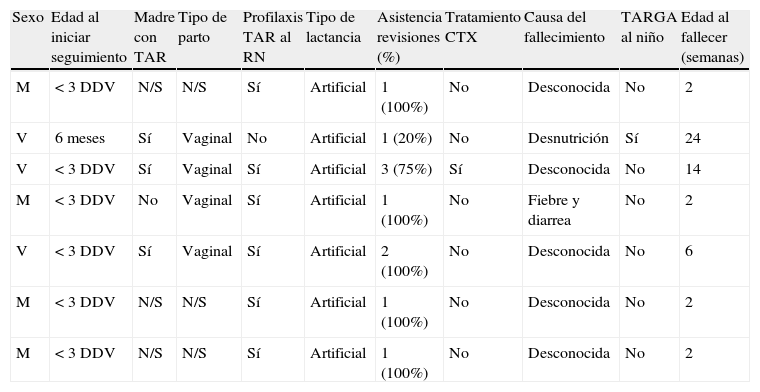
En 31casos (0,3eventos/niño) se registró un proceso médico por el que el paciente tuvo que ser valorado en el Centro de Salud o en el Hospital. En 17 casos (53%) estos procesos fueron graves, en 11casos se inició TARGA tras realizarse diagnóstico presuntivo de infección por VIH y en 7casos (22%) los pacientes fallecieron. Uno de estos 7niños se encontraba recibiendo TARGA por diagnóstico presuntivo. De los 7niños que fallecieron, 6 no estaban recibiendo profilaxis con cotrimoxazol, ya que 5 eran menores de 6semanas, y el niño restante no había acudido a la visita de seguimiento para iniciar el cotrimoxazol (tabla 2).
Características clínicas de los niños fallecidos
| Sexo | Edad al iniciar seguimiento | Madre con TAR | Tipo de parto | Profilaxis TAR al RN | Tipo de lactancia | Asistencia revisiones (%) | Tratamiento CTX | Causa del fallecimiento | TARGA al niño | Edad al fallecer (semanas) |
| M | < 3 DDV | N/S | N/S | Sí | Artificial | 1 (100%) | No | Desconocida | No | 2 |
| V | 6 meses | Sí | Vaginal | No | Artificial | 1 (20%) | No | Desnutrición | Sí | 24 |
| V | < 3 DDV | Sí | Vaginal | Sí | Artificial | 3 (75%) | Sí | Desconocida | No | 14 |
| M | < 3 DDV | No | Vaginal | Sí | Artificial | 1 (100%) | No | Fiebre y diarrea | No | 2 |
| V | < 3 DDV | Sí | Vaginal | Sí | Artificial | 2 (100%) | No | Desconocida | No | 6 |
| M | < 3 DDV | N/S | N/S | Sí | Artificial | 1 (100%) | No | Desconocida | No | 2 |
| M | < 3 DDV | N/S | N/S | Sí | Artificial | 1 (100%) | No | Desconocida | No | 2 |
CTX: cotrimoxazol; DDV: días de vida; M, mujer; N/S: dato no recogido; RN: recién nacido; TAR: tratamiento antirretroviral; TARGA: tratamiento antirretroviral de gran efectividad; V: varón.
De los 50pacientes perdidos en el seguimiento, el 52% dejaron de acudir a las revisiones en los primeros 6meses de vida y el 72% en el primer año. Se obtuvieron los datos del domicilio de 90 de los niños en seguimiento. No se observaron diferencias estadísticamente significativas en el porcentaje de pérdidas de pacientes según que la distancia al centro sanitario fuese mayor o menor de 2h a pie (29/58 vs 16/32, p>0,05).
DiscusiónLos programas de PTMH en África han demostrado ser eficaces y han permitido un control progresivo de la infección4,12–14. Nuestro estudio aporta los primeros datos recogidos en el programa de PTMH en Guinea Ecuatorial.
Se trata de una evaluación retrospectiva para conocer los primeros resultados de dicho programa. El protocolo vigente de PTMH en Guinea Ecuatorial es previo a las recomendaciones de la OMS de 2012. Aunque con una diferencia en el tiempo de profilaxis con AZT (14semanas vs 28semanas), esta estrategia correspondería por todo lo demás a la opciónA de prevención de la transmisión vertical de VIH de las guías actuales publicadas por OMS15.
El primer dato importante es que en nuestra cohorte, considerando los niños con diagnóstico presuntivo, hasta el 26% de los niños en seguimiento resultaron infectados. Se trata de una cifra muy elevada, muy superior a las de publicaciones similares sobre programas nacionales, bien implementados, que están en torno al 10-15%. Un trabajo en Uganda encontró una transmisión acumulada del 8% pero que aumentaba al 15% si se incluían los niños no confirmados fallecidos16. En Botswana, uno de los países donde se han realizado mayores esfuerzos en el control de la transmisión vertical de VIH, se han registrado tasas de infección del 7%17.
La explicación para una cifra de transmisión materno-infantil tan elevada está probablemente en el bajo cumplimiento del protocolo nacional en el periodo de estudio. Los resultados son del periodo inmediatamente posterior al establecimiento del protocolo, por lo que muchos profesionales todavía no lo conocían o no lo aplicaban. Esto se puede comprobar al valorar que solo el 52% de las madres recibió tratamiento antirretroviral durante el embarazo o que solo el 41% de los niños expuestos recibiese la profilaxis antes de las primeras 72h y menos de la mitad de manera completa según el protocolo. Además, como han referido otros autores, puede que acudan más a las consultas los niños que estén enfermos que los que estén sanos, por lo que habría un sesgo al alza en la tasa de transmisión vertical18.
Otros estudios en África subsahariana que evalúan la implementación inicial de los protocolos de PTMH también encuentran elevadas tasas de transmisión vertical cuando la madre y el niño no reciben tratamiento antirretroviral comparado a cuando lo reciben. Así, en Zambia, en un estudio de más de 8.000 niños la tasa de transmisión vertical fue del 20,9% (12,3-29,5%) cuando no hubo intervención frente a 6,5% (5,1-7,8%) con intervención19, y en un estudio en Angola las tasas de transmisión vertical y/o muerte en el seguimiento a las 74semanas en 107niños expuestos a la infección por VIH fueron del 38,9 vs 8,5%, respectivamente20.
En nuestro estudio las tasas de transmisión vertical disminuyen con el tratamiento antirretroviral durante la gestación y la profilaxis del recién nacido (43% frente al 8%). La tasa de transmisión disminuye del 43% en los niños cuyas madres no recibieron TAR, al 16% en el caso de los niños cuyas madres sí recibieron TAR, y de una forma significativa hasta el 8% en los niños cuyas madres recibieron TAR y ellos recibieron profilaxis antes de las primeras 72h. Probablemente el pequeño tamaño muestral no permita que se observen mayores diferencias estadísticas.
Por otro lado, el alto porcentaje de transmisión vertical en nuestra cohorte se debe fundamentalmente a los niños con diagnóstico presuntivo de VIH (11/14, 78%). Para tener un diagnóstico exacto y precoz que permita iniciar el tratamiento antirretroviral lo antes posible, la OMS recomienda realizar un test virológico a todo niño expuesto al VIH entre las 4 y 6semanas de vida7. Las recomendaciones de la OMS sobre diagnóstico de la infección por VIH en niños establecen que en caso de que no se disponga de pruebas virológicas, se podrá realizar un diagnóstico presuntivo de infección basado en síntomas y signos y test rápido serológico positivo, con confirmación posterior de la infección basada en técnicas serológicas a partir de los 18meses de edad. Sin embargo, la sensibilidad y la especificidad de esta aproximación diagnóstica son muy variables21,22. Además, los niños con infección por VIH que inician TAR precoz pueden no tener respuesta serológica y presentar anticuerpos frente al VIH negativos, a pesar de estar realmente infectados23. En un estudio reciente en Lesoto, un porcentaje significativo (20%) de los niños con diagnóstico confirmado por PCR ADN para VIH, que iniciaron TARGA de forma precoz, presentaron resultados de test rápidos negativos a los 18meses24. Por estas razones, en medios donde no están disponibles las técnicas virológicas puede ser difícil determinar con exactitud qué niños con diagnóstico presuntivo en TARGA están verdaderamente infectados a los 18meses. Actualmente no existen recomendaciones de actuación específicas en esta situación, aunque sí se insiste en la implementación progresiva de técnicas virológicas para el diagnóstico. Por este motivo, en nuestro análisis, incluimos como infectados todos los niños con diagnóstico confirmado y presuntivo.
Otro resultado a destacar, por su relevancia en cuanto a la eficacia de las estrategias, es la alta tasa de abandonos en el seguimiento de los niños expuestos, que en nuestro estudio alcanza el 49%. Esto no es exclusivo de nuestra cohorte, y hace unos años, en una descripción de una cohorte en Malawi, se hablaba de la «inaceptable pérdida en el seguimiento» al describir que tenían una pérdida en el seguimiento en el momento del parto del 68%, una semana tras el parto del 70% y a los 6meses del 81%25. Un grupo en el oeste de Kenia ha estudiado en detalle los niños perdidos en el seguimiento: ellos encuentran en su cohorte una tasa de abandono del 20% y enumeran como factores independientes asociados al abandono la malnutrición, el ser huérfano y el haber recibido profilaxis antirretroviral26. En un artículo posterior del mismo grupo hacen una búsqueda activa de los niños perdidos en el seguimiento mediante llamadas telefónicas y/o visitas al domicilio. De esta manera consiguen localizar y rescatar al 85% de los niños perdidos. Al preguntar a las familias por el motivo para no acudir a la consulta, la respuesta más frecuente (30%) es que se trata de un problema de revelación de la infección por miedo a discriminación por parte de la familia o de la comunidad. Otros motivos frecuentes fueron: creer que el niño no precisaba más visitas (13%) y creer que el niño se había curado por la fe o por medicina tradicional (9%). El 4% habían fallecido y solo un 2% no acudió por el coste del transporte27. En Gabón, un estudio encontró una asociación clara entre el bajo nivel de estudios y el bajo nivel socioeconómico con una mayor pérdida en el seguimiento28. En nuestro estudio llama la atención que aunque más de la mitad de los niños vivían distantes del centro hospitalario de atención, no se encontró que hubiese más pérdidas del seguimiento en niños que viviesen alejados.
Es también notable que la mayoría de las pérdidas se producen antes de la finalización de la administración gratuita de fórmula artificial, que se administra durante el primer año de vida, ya que el 72% de los niños que abandonan el seguimiento lo hacen antes de los 12meses de vida, por lo que en nuestra cohorte la administración de formula artificial gratuita no ha demostrado ser claramente un factor facilitador.
Estas barreras y facilitadores, tal como se ha expuesto, pueden ser de índole social, económica, sanitaria o cultural. En este sentido se pone de manifiesto que, tanto en el VIH como el proceso de salud y enfermedad, intervienen otros factores que no son meramente clínicos.
Se estima que sin tratamiento, cerca del 50% de los niños infectados fallecerán en los 2primeros años de vida, por lo que el diagnóstico y el tratamiento precoces son clave para su supervivencia. Además, el estudio CHER estableció que el inicio precoz de los antirretrovirales en el lactante disminuía el riesgo de muerte y de progresión de la enfermedad29. Debido a esto, la OMS recomienda desde 2010 iniciar tratamiento antirretroviral en todos los niños infectados menores de 24meses, independientemente de su estadio clínico o inmunológico30. En nuestro trabajo es de destacar que un número elevado de niños fallecidos (85,7%) lo fueron a una edad muy temprana, y no conocemos en detalle la causa de la muerte de la mayoría de los niños.
Nuestro estudio tiene limitaciones, ya que es un estudio retrospectivo basado en datos recogidos por médicos, enfermeras y técnicos, con los diferentes sesgos que implica. Así mismo, las pérdidas del seguimiento no permiten conocer el resultado final de todos los pacientes que lo inician. Sin embargo, creemos que aporta información valiosa, pues es un primer estudio sobre PTMH en Guinea Ecuatorial que permite establecer un diagnóstico de la situación real inicial.
En los últimos años se están impulsando acciones que permitan la mejora de la situación. Ha aumentado el número de centros que ofrecen el test de VIH y de centros que prestan servicio completo para la PTMH. En el periodo 2000-2011 existe un aumento progresivo de mujeres embarazadas que realizan la prueba de VIH en el primer control prenatal, pasando de 199 en el año 2000 a 4.698 en el año 2008. En los años siguientes, el número de pruebas en mujeres embarazadas sigue aumentando. Solamente en la Región Continental, 4.708mujeres embarazadas realizaron la prueba en 2009, 5.927 en 2010 y 6.695 en 2011. Sin embargo, todavía queda mucho por hacer. El programa de PTMH precisa de la colaboración de un número elevado de profesionales. Por ello, no será más eficaz en este contexto si no existe más coordinación entre los profesionales, sin intervenciones en el entorno social, apoyo a las madres infectadas, minimización del estigma y facilidad para acceder al seguimiento y al tratamiento.
ConclusionesEn nuestra cohorte el cumplimiento del protocolo de PTMH ha sido todavía muy bajo. El tratamiento antirretroviral en mujeres embarazadas disminuyó la tasa de transmisión vertical, pero esta aún sigue siendo muy alta. Muchos niños se perdieron durante el seguimiento, así que es prioritario desarrollar estrategias de apoyo psicosocial y educación sanitaria para combatir el estigma, así como programas de rescate de pacientes perdidos. De igual forma, el desarrollo de programas que permitan un diagnóstico más precoz en la población infantil, como la introducción de la PCR, podría aumentar la adherencia y modificar de manera muy significativa la progresión de la infección y la mortalidad.
Conflicto de interesesLos autores L.P.T. (Luis Prieto-Tato), A.V.B. (Antonio Vargas-Brizuela) y P.R.C. (Pablo Rojo-Conejo) participaron como asesores técnicos del Ministerio de Sanidad de Guinea Ecuatorial en la elaboración de las guías nacionales para la prevención materno-infantil. Esta actividad no afecta a la calidad del presente documento ni entra en conflicto de interés con lo recomendado en él. El resto de los autores declaran no tener ningún conflicto de interés.