Elaborar un documento de consenso sobre recomendaciones clínicas para los trastornos neurocognitivos (TNC) asociados al virus de la inmunodeficiencia humana (VIH).
MétodosSe reunió a un panel de expertos designados por GeSIDA y la Secretaría del Plan Nacional sobre el Sida (SPNS) que incluyó médicos especialistas en medicina interna o enfermedades infecciosas, neuropsicólogos, psiquiatras, neurólogos y neurorradiólogos. Se revisó información científica hasta octubre de 2012 a partir de publicaciones y comunicaciones a congresos. Como apoyo a las recomendaciones se utilizaron 2niveles de evidencia: la fuerza de la recomendación según opinión del experto (A, B, C) y el nivel de evidencia empírica (I, II, III), ambos niveles basados en los criterios de la Infectious Disease Society of America, ya utilizados en documentos previos de GeSIDA/SPNS.
ResultadosSe proporcionan múltiples recomendaciones para el manejo clínico de estos trastornos, incluyendo 2algoritmos gráficos, considerando tanto el proceso diagnóstico como posibles estrategias terapéuticas.
ConclusionesLos TNC asociados a la infección por el VIH son altamente prevalentes en la actualidad, y están asociados a empeoramiento de la calidad de vida y de la actividad diaria. Dada la posibilidad de que se produzca un aumento de los mismos en los próximos años, existe la necesidad de manejar adecuadamente estos trastornos tanto desde el punto de vista diagnóstico como terapéutico, y siempre desde una perspectiva multidisciplinar.
To develop a consensus document containing clinical recommendations for the management of human immunodeficiency virus (HIV)-associated neurocognitive disorder (HAND).
MethodsWe assembled a panel of experts appointed by GeSIDA and the Secretariat of the National AIDS Plan (PNS), including internal medicine physicians with expertise in the field of HIV, neuropsychologists, neurologists and neuroradiologists. Scientific information was reviewed to October 2012 in publications and conference papers. In support of the recommendations using two levels of evidence: the strength of the recommendation in the opinion of the experts (A, B, C) and the level of empirical evidence (I, II, III), two levels based on the criteria of the Infectious Disease Society of America, already used in previous documents GeSIDA/SPNS.
ResultsMultiple recommendations for the clinical management of these disorders are provided, including two graphics algorithms, considering both the diagnostic and possible therapeutic strategies.
ConclusionsNeurocognitive disorders associated with HIV infection is currently highly prevalent, are associated with a decreased quality of life and daily activities, and given the possibility of occurrence of an increase in the coming years, there is a need to adequately manage these disorders, from a diagnostic as well as therapeutic point of view, and always from a multidisciplinary perspective.
El sistema nervioso central (SNC) es uno de los órganos diana donde el virus de la inmunodeficiencia humana (VIH) puede ser detectado a las pocas semanas de la infección, causando daño a través de mecanismos directos e indirectos. En la primera década tras el descubrimiento del VIH, junto a enfermedades infecciosas o tumorales oportunistas eran también frecuentes las complicaciones graves a nivel del SNC provocadas por el VIH y denominadas en conjunto encefalopatía o demencia asociada al VIH. Afortunadamente, con la aparición del tratamiento antirretroviral (TAR) combinado o de gran actividad, la incidencia de todas estas severas complicaciones se ha reducido significativamente.
No obstante, múltiples estudios han mostrado que en la actualidad continúa existiendo una alta frecuencia de alteraciones neurocognitivas en personas con el VIH. También es cierto que hay cierta controversia sobre los datos publicados, y especialmente sobre su significado clínico. La tasa de prevalencia para este tipo de complicaciones ha sido descrita entre el 20 y el 50% de las personas infectadas, independientemente del uso de TAR, y se han identificado diferentes factores demográficos y clínicos que pueden aumentar el riesgo de su presentación. Aunque el TAR se ha mostrado eficaz para prevenir y tratar formas graves de encefalopatía por VIH, en la actualidad son escasas las guías clínicas para el manejo de pacientes con formas leves/moderadas de trastornos neurocognitivos (TNC) asociados a la infección por el VIH. Por todo ello, es importante abordar la investigación, la prevención y el manejo de los TNC en pacientes infectados por el VIH con el objetivo de ofrecer recomendaciones prácticas, de utilidad clínica y basadas en la evidencia científica disponible.
MetodologíaPara la elaboración de este documento en marzo de 2012 se constituyó un grupo de expertos designados por la Junta Directiva de GeSIDA y la Secretaría del Plan Nacional sobre el Sida, siendo el rol de las 2 instituciones de coordinación.
Este grupo está compuesto por especialistas de medicina interna con experiencia en el ámbito del VIH, especialistas en neurología, neurorradiología y psiquiatría. Tres miembros del panel actúan como coordinadores. Cada miembro del panel ha emitido un informe de conflicto de intereses depositado en la SPNS. Todos ellos han aceptado participar de forma voluntaria y altruista.
Cada redactor ha realizado una revisión de la evidencia científica disponible de cada uno de los aspectos que se incluyen en el documento, siendo la última fecha de revisión octubre de 2012. Con ella ha escrito su capítulo, que ha sido revisado por todo el panel. Posteriormente el documento se ha discutido y consensuado en una reunión de los coordinadores y redactores para posteriormente someterlo a revisión externa, exponiéndose durante un periodo de tiempo en la web de las entidades promotoras para que los profesionales a los que va dirigido y cualquier persona interesada pueda sugerir matices o cambios que posteriormente serán valorados por el Panel para decidir su inclusión o no en el documento.
La clasificación de la fuerza y la calidad de las recomendaciones se realiza aplicando una modificación del sistema utilizado por la Sociedad Americana de Enfermedades Infecciosas (IDSA) y el Servicio de Salud Pública de Estados Unidos.
Fuerza de la recomendaciónNivel A: Buen nivel de evidencia para apoyar la recomendación de uso.
Nivel B: Moderado nivel de evidencia para apoyar la recomendación de uso.
Nivel C: Escasa evidencia para apoyar la recomendación.
I: Evidencia procedente de al menos un ensayo clínico aleatorizado.
II: Evidencia procedente de al menos un ensayo no aleatorizado, bien diseñado, o bien de estudios de cohortes, o de estudios analíticos de casos y controles (preferiblemente de más de un centro), o de series temporales, o de resultados concluyentes obtenidos en estudios experimentales no controlados.
III: Evidencia de opiniones de expertos/as basadas en la experiencia clínica o en estudios descriptivos.
Para la realización de los capítulos se ha efectuado una búsqueda bibliográfica en español y en inglés, en diferentes bases de datos, y se han revisado las revistas científicas relacionadas con el tema, incluyendo artículos desde el año 2007 a 2012. También se ha revisado el apartado correspondiente de las Guías internacionales y congresos.
Introducción. Cambios neurocognitivos y virus de la inmunodeficiencia humanaEn 1991 el grupo de trabajo de la Academia Americana de Neurología (AAN) publicó la nomenclatura y definición de caso para guiar el diagnóstico de las manifestaciones neurológicas de la infección por VIH1. A partir de entonces, de la propia demencia asociada a VIH (HIV associated dementia [HAD]) se separó otra entidad, a la que se denominó alteración cognitiva motora menor (minor cognitive motor disorder [MCMD]), en la que no se cumplían los criterios de demencia pero sí se presentaban alteraciones leves que interferían con las actividades de la vida diaria.
Un grupo de expertos internacionales en esta área actualizó en 2007 la nomenclatura de las alteraciones cognitivas («criterios de Frascati»)2, siendo englobadas en el término HIV-associated neurocognitive disorder (HAND) (tabla 1), y que incluía, además de la demencia (HAD), la separación del trastorno cognitivo menor en 2 trastornos de tipo más leve (mild neurocognitive disorder [MND] y asymptomatic neurocognitive impairment [ANI]), basándose ambos en la existencia de alteración neuropsicológica y diferenciados en función de la afectación de la vida diaria.
Categorías clínicas de HAND (HIV-associated neurocognitive disorder)
| Alteración cognitiva asintomática (ANI: HIV-associated asymptomatic neurocognitive impairment) | • Alteración de ≥2dominios neurocognitivosa con ≥1DE debajo de la mediab• La alteración cognitiva no interfiere con las actividades de la vida diaria, incluidas en el trabajo, tareas del hogar y actividades sociales evaluadas a través del propio sujeto o de medidas objetivas estandarizadas• El deterioro cognitivo está presente desde hace al menos un mes• No cumple criterios para diagnosticar demencia o delirio asociados al VIH• No se evidencia otra causa preexistente para la alteración, incluida enfermedad neurológica previa, trastorno psiquiátrico o abuso de consumo de sustancias tóxicas |
| Trastorno cognitivo leve (MND: HIV-associated mild neurocognitive disorder) | • Similar a ANI, pero con leve-moderada interferencia con las actividades de la vida diaria: incluidas en el trabajo, tareas del hogar y actividades sociales evaluadas a través del propio sujeto o de medidas objetivas estandarizadas• El empeoramiento está presente desde hace al menos un mes• No cumple criterios para diagnosticar demencia o delirio asociados al VIH• No se evidencia otra causa preexistente para la alteración, incluida enfermedad neurológica previa, trastorno psiquiátrico o abuso de consumo de sustancias tóxicas |
| Demencia asociada a VIH (HAD: HIV-associated dementia) | • Existe un marcado empeoramiento adquirido en el funcionamiento cognitivo con alteración en ≥2dominios neurocognitivosa con ≥2DE debajo de la mediab.• Marcada interferencia con las actividades de la vida diaria incluidas en el trabajo, tareas del hogar y actividades sociales evaluadas a través del propio sujeto o de medidas objetivas estandarizadas• El empeoramiento cognitivo está presente desde hace al menos un mes• No cumple criterios para diagnosticar delirio• No existe otra causa que lo justifique |
Las formas leves del HAND, es decir, los trastornos ANI y MND, se suelen caracterizar por cambios sutiles en la memoria de trabajo, la velocidad del procesamiento de la información, la dificultad en la fluencia verbal, la mayor lentitud en el aprendizaje, o incluso implicar la memoria verbal. Los síntomas motores son menos comunes, aunque pueden implicar igualmente la velocidad psicomotora o la motricidad fina. La HAD, en cambio, se suele caracterizar por ser una demencia clásicamente subcortical, implicando pérdida severa de memoria, alteración motriz más evidente y funcionamiento ejecutivo alterado, si bien las fases más avanzadas presentan también afasias, agnosias y apraxias más típicas de demencias corticales, como la enfermedad de Alzheimer. En estas fases más avanzadas la HAD puede ser adicionalmente identificada por señales clínicas, hallando en la exploración neurológica pérdida de los movimientos sacádicos de los ojos, adiadococinesia, hiperreflexia y signos de liberación frontal, tales como hociqueo, grasping o reflejo glabelar. En ocasiones pueden aparecer síntomas psicóticos, frecuentemente enmascarados por síntomas depresivos o alteración del estado de ánimo.
Se desconoce por ahora la evolución que tendrán los pacientes con alteraciones cognitivas leves. La mayoría permanecen estables, algunos mejoran y otros pueden evolucionar a demencia. En cualquier caso, diversos trabajos han observado que el deterioro cognitivo leve en la infección por VIH está asociado a un mayor riesgo de mortalidad3, peor adherencia al tratamiento4, mayores tasas de fracaso virológico5, mayores dificultades en el desarrollo de las actividades de la vida diaria6, pérdida del empleo7, peor calidad de vida8 y peor pronóstico de progresión a demencia9
DiagnósticoEl diagnóstico diferencial de los TNC asociados a la infección por el VIH, en cualquiera de sus categorías, presenta 2 dificultades: a)descartar todas aquellas patologías, asociadas o no a la infección por el VIH, que pueden producir deterioro cognitivo en la población general; b)conocer el grado de contribución de determinadas comorbilidades asociadas a la infección por el VIH al TNC, antes de atribuir el daño neurológico al propio VIH. Este grupo de comorbilidades pueden actuar como verdaderos factores de confusión cuando se pretende diagnosticar a un paciente de TNC asociado a la infección por el VIH. En la tabla 2 se describen las principales causas de TNC diferentes al VIH y su diagnóstico.
Diagnóstico de las enfermedades asociadas a trastorno neurocognitivo en pacientes con infección por VIH y en población general
| Causas frecuentes de deterioro neurocognitivo | Diagnóstico |
| Enfermedades psiquiátricas y patología adictiva | |
| Depresión y ansiedad | • Escala Hospitalaria de Ansiedad y Depresión (HADS) |
| Otras enfermedades psiquiátricas como el trastorno esquizofrénico o el trastorno bipolar | • Criterios diagnósticos del DSM o de la CIE para las enfermedades mentales |
| Abuso de alcohol | • Alcoholemia o alcoholuria |
| Consumo de sustancias de abuso (ilegales) | • Cribado de tóxicos en orina |
| Consumo de fármacos | |
| • Antihistamínicos• Fármacos anticolinérgicos• Medicación psicotrópica e hipnóticos | • Niveles plasmáticos de fármacos |
| Enfermedad hepática grave | |
| • VHC o VHB• Alcohol• Otras causas | • ARN VHC• ADN VHB• Child-Pugh clase B/C• MELD score |
| Patología estructural del SNC | |
| • Hematoma subdural (TCE) | • TC de SNC |
| • Hidrocefalia normotensiva | • RM de SNC, test de drenaje LCR (5-10ml/h), monitorización de la presión intracraneal, etc. |
| • Linfoma de SNC• Neoplasias primarias• Metástasis SNC | • TC o RM• Biopsia cerebral• RM por espectroscopia• PET corporal |
| Demencias y otras enfermedades degenerativas de SNC | |
| • Enfermedad de Alzheimer• Demencia por cuerpos de Lewy• Demencia frontotemporal• Enfermedad de Parkinson con demencia | • Historia clínica• TC/RM SNC• PET corporal• Tau total (LCR) |
| Enfermedad cardiovascular | |
| • Demencia vascular | • Factores de riesgo cardiovascular• Ecocardiografía• Ultrasonografía carotídea• TC/RM SNC |
| Infecciones del SNC (excluido VIH) | |
| • Neurosífilis | Estudio LCR:• Celularidad y bioquímica (glucosa y proteínas)• Serología luética (sangre y LCR) |
| • Infecciones oportunistas: TB, toxoplasmosis, LMP, criptococosis, etc. | • Recuento de linfocitos CD4+ <200/μl• TC/RM SNC• Estudios microbiológicos: cultivos (bacterias, micobacterias, hongos), tinciones específicas para hongos, antígeno criptococócico• Estudios serológicos: B.burgdorferi• Estudios moleculares: PCR HSV, M.tuberculosis, virus JC, etc.• Biopsia cerebral |
| Otras patologías | |
| • Hipotiroidismo | • Determinación de TSH |
| • Déficit de vitaminaB12 | • Determinación de vitaminaB12 |
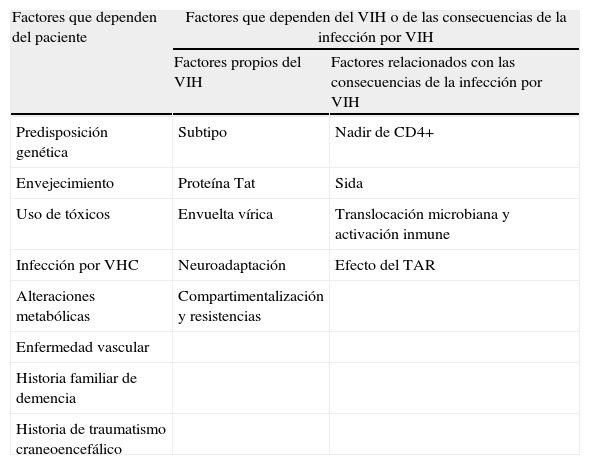
Se han descrito distintos factores de riesgo para el desarrollo de HAND, los cuales se recogen en la tabla 3, agrupados en 2 tipos: los que dependen del paciente y los que dependen del VIH o de las consecuencias de la infección por el VIH.
Factores de riesgo para desarrollo de HAND
| Factores que dependen del paciente | Factores que dependen del VIH o de las consecuencias de la infección por VIH | |
| Factores propios del VIH | Factores relacionados con las consecuencias de la infección por VIH | |
| Predisposición genética | Subtipo | Nadir de CD4+ |
| Envejecimiento | Proteína Tat | Sida |
| Uso de tóxicos | Envuelta vírica | Translocación microbiana y activación inmune |
| Infección por VHC | Neuroadaptación | Efecto del TAR |
| Alteraciones metabólicas | Compartimentalización y resistencias | |
| Enfermedad vascular | ||
| Historia familiar de demencia | ||
| Historia de traumatismo craneoencefálico | ||
Si bien es cierto que el diagnóstico neuropsicológico cuenta con limitaciones derivadas de su coste a la hora de incorporarlo a la atención clínica diaria, la necesidad de realizar un estudio cognitivo de los individuos infectados con el VIH parece cada vez más evidente. En esta línea, el uso de baterías neuropsicológicas es complejo, tanto en la aplicación como en la interpretación, de modo que se hace imprescindible que el diagnóstico cognitivo sea realizado por profesionales especializados en neuropsicología clínica10.
Actualmente no existe una batería neuropsicológica única y universal específica para la evaluación de personas con VIH. Sin embargo, ha existido en varias ocasiones la intención de realizarla por importantes grupos de investigación como el National Institute of Mental Health (NIMH)11, el Multicenter AIDS Cohort Study (MACS)12 y la Organización Mundial de la Salud (OMS)13,14. Cabe resaltar la aportación reciente del HIV Neurobehavioral Research Center (HNRC)15, que además de aconsejar la evaluación de los dominios cognitivos anteriormente mencionados recogen, por un lado, la importancia de incluir tests normalizados en la población y, por el otro, la recomendación de la utilización de al menos 2 test por área o dominio cognitivo. Según estos autores, hay que considerar que una persona presenta alteración cognitiva cuando existe afectación en al menos un dominio. Además, se deben controlar otras posibles causas del HAND o la afectación en las actividades de la vida diaria.
En la tabla 4 se resumen los tests neuropsicológicos más utilizados en la valoración cognitiva de personas con VIH.
Funciones recomendadas en la evaluación cognitiva en la infección por VIH y ejemplos de pruebas neuropsicológicas más utilizadas
| Función cognitiva | Prueba | Referencias recientes sobre normas de administración y baremos |
| Atención/memoria de trabajo | Dígitos (WAIS-III) | • Wechsler D. WAIS-III. Escala de Inteligencia de Wechsler para adultos-III. Manual de aplicación y corrección. Madrid: TEA Ediciones; 1999 |
| Letras y Números (WAIS-III) | • Wechsler D. Escala de Memoria de Wechsler-III. Manual de aplicación y puntuación. Madrid: TEA Ediciones; 2004 | |
| Velocidad de procesamiento de la información | Trail Making Tests (TMT) Parte A | • Tombaugh TN. Trail Making Test A and B: normative data stratified by age and education. Arch Clin Neuropsychol. 2004;19:203-14.• Peña-Casanova J, Quiñones-Ubeda S, Quintana-Aparicio M, et al. NEURONORMA Study Team. Spanish Multicenter Normative Studies (NEURONORMA Project): norms for verbal span, visuospatial span, letter and number sequencing, trail making test, and symbol digit modalities test. Arch Clin Neuropsychol. 2009;24:321-41a• Peña-Casanova J, Casals-Coll M, Quintana M, Sánchez-Benavides G, Rognoni T, et al. Estudios normativos españoles en población adulta joven (Proyecto NEURONORMA jóvenes): métodos y características de la muestra. Neurologia. 2012;27:513-23 |
| Clave numérica (WAIS-III) | • Wechsler D. WAIS-III. Escala de Inteligencia de Wechsler para adultos-III. Manual de aplicación y corrección. Madrid: TEA Ediciones; 1999 | |
| Stroop (Lectura) | • Golden CJ. Stroop. Test de colores y palabras. Manual. Madrid: TEA Ediciones; 1994• Peña-Casanova J, Quiñones-Ubeda S, Gramunt-Fombuena N, et al. NEURONORMA Study Team. Spanish Multicenter Normative Studies (NEURONORMA Project): norms for the Stroop color-word interference test and the Tower of London-Drexel. Arch Clin Neuropsychol. 2009;24):413-29a• Peña-Casanova J, Casals-Coll M, Quintana M, Sánchez-Benavides G, Rognoni T, et al. Estudios normativos españoles en población adulta joven (Proyecto NEURONORMA jóvenes): métodos y características de la muestra. Neurologia. 2012;27:513-23 | |
| Memoria/aprendizaje | California Verbal Learning Test (CVLT-II)/Test de Aprendizaje Verbal España-Complutense (TAVEC) | • Delis DC, Kaplan E, Kramer JH, Ober BA. California Verbal Learning Test. Second edition (CVLT-II). San Antonio, TX: The Psychological Corporation; 2000• Benedet MJ, Alejandre MA. TAVEC Test de Aprendizaje Verbal España-Complutense. Madrid: TEA Ediciones; 1998 |
| Hopkins Verbal Learning Test-Revised (HVLT-R) | • Brandt J, Benedict R. Hopkins Verbal Learning Test-revised. Lutz, FL: Psychological Assessment Resources, Inc.; 2001 | |
| Historietas y reproducción visual (WMS-III) | • Wechsler D. Escala de Memoria de Wechsler-III. Manual de aplicación y puntuación. Madrid: TEA Ediciones; 2004 | |
| Figura Compleja de Rey | • Rey A. Test de copia de una figura compleja. Manual. Adaptación española. Madrid: TEA Ediciones; 1997• Peña-Casanova J, Gramunt-Fombuena N, Quiñones-Ubeda S, et al. NEURONORMA Study Team. Spanish Multicenter Normative Studies (NEURONORMA Project): norms for the Rey-Osterrieth complex figure (copy and memory), and free and cued selective reminding test. Arch Clin Neuropsychol. 2009;24:371-93a• Peña-Casanova J, Casals-Coll M, Quintana M, Sánchez-Benavides G, Rognoni T, et al. Estudios normativos españoles en población adulta joven (Proyecto NEURONORMA jóvenes): métodos y características de la muestra. Neurologia. 2012;27:513-23 | |
| Funciones ejecutivas | Stroop Color and Word Test | • Golden CJ. Stroop. Test de colores y palabras. Manual. Madrid: TEA Ediciones; 1994• Peña-Casanova J, Quiñones-Ubeda S, Gramunt-Fombuena N, et al. NEURONORMA Study Team. Spanish Multicenter Normative Studies (NEURONORMA Project): norms for the Stroop color-word interference test and the Tower of London-Drexel. Arch Clin Neuropsychol. 2009;24:413-29a• Peña-Casanova J, Casals-Coll M, Quintana M, Sánchez-Benavides G, Rognoni T, et al. Estudios normativos españoles en población adulta joven (Proyecto NEURONORMA jóvenes): métodos y características de la muestra. Neurologia. 2012;27:513-23 |
| Trail Making Tests (TMT) Parte B | • Tombaugh TN. Trail Making Test A and B: normative data stratified by age and education. Arch Clin Neuropsychol. 2004;19:203-14• Peña-Casanova J, Quiñones-Ubeda S, Quintana-Aparicio M, et al. NEURONORMA Study Team. Spanish Multicenter Normative Studies (NEURONORMA Project): norms for verbal span, visuospatial span, letter and number sequencing, trail making test, and symbol digit modalities test. Arch Clin Neuropsychol. 2009;24:321-41a• Peña-Casanova J, Casals-Coll M, Quintana M, Sánchez-Benavides G, Rognoni T, et al. Estudios normativos españoles en población adulta joven (Proyecto NEURONORMA jóvenes): métodos y características de la muestra. Neurologia. 2012;27:513-23 | |
| Wisconsin Card Sorting Test (WCST) | • Heaton RK, Chelune GJ, Talley JL, Kay GG, Curtiss G. WCST. Test de Clasificación de Tarjetas de Wisconsin. Adaptación española de María Victoria de la Cruz López. Madrid: TEA Ediciones; 2001 | |
| Fluencia Verbal(fonémica, y semántica) | • Peña-Casanova J, Quiñones-Ubeda S, Gramunt-Fombuena N, Quintana-Aparicio M, Aguilar M, et al. NEURONORMA Study Team. Spanish Multicenter Normative Studies (NEURONORMA Project): norms for verbal fluency tests. Arch Clin Neuropsychol. 2009;24:395-411a• Rami L, Serradell M, Bosch B, Villar A, Molinuevo JL. Valores normativos de tests de función cognitiva frontal para la población mayor de 60 años. Rev Neurol. 2007;45:268-71.• Buriel Y, Gramunt N, Bohm P, Rodes E, Peña-Casanova J. Fluencia verbal. Estudio normativo piloto en una muestra española de adultos jóvenes (20 a 49 años). Neurología. 2004;19:153-9• Benito-Cuadrado MM, Esteba-Castillo S, Böhm P, Cejudo-Bolívar J, Peña-Casanova J. Semantic verbal fluency of animals: A normative and predictive study in a Spanish population. J Clin Exp Neuropsychol. 2002;24:1117-22• Peña-Casanova J, Casals-Coll M, Quintana M, Sánchez-Benavides G, Rognoni T, et al. Estudios normativos españoles en población adulta joven (Proyecto NEURONORMA jóvenes): métodos y características de la muestra. Neurologia. 2012;27:513-23 | |
| Test de Denominación de Boston | • Kaplan E, Goodglass H, Weintraub S. Boston Naming Test, 2nd ed. Philadelphia: Lippincott Williams and Wilkins; 2001• Kent PS, Luszcz MA. A review of the Boston Naming Test and multiple-occasion normative data for older adults on 15 item versions. Clin Neuropsyhologist. 2002;16:555-74• Garcia JE, Sánchez ML. La evaluacion de la afasia y de trastornos relacionados. 2.ª ed. Madrid: Panamericana; 1996 | |
| Habilidades motoras | Grooved Pegboard Test | • Grooved Pegboard Test. User instructions. Lafayette: Lafayette Instrument Company; 2002• Bornstein, RA. Normative data on intermanual differences on three tests of motor performance. J Clin Exp Neuropsychol. 1986;8:12-20 |
Fuentes: Woods SP, Moore DJ, Weber E y Grant I. Cognitive Neuropsychology of HIV-Associated Neurocognitive Disorders. Neuropsychol Rev. 2009;19:152-68./Dawes S, Grant I. Neurocognitive assessment of persons with HIV disease. Handb Clin Neurol. 2007;85:93-121./Grant I. Neurocognitve disturbances in HIV. International Review of Psychiatry. 2008;20:37-47./Muñoz-Moreno JA, Fumaz CR, Ferrer MJ, Prats A, Negredo E, Garolera M, et al. Nadir CD4 Cell Count Predicts Neurocognitive Impairment in HIV-Infected Patients. AIDS AIDS Res Hum Retroviruses. 2008;24:1301-7./Muñoz-Moreno JA, Fumaz CR, Prats A, Ferrer MJ, Negredo E, Pérez-Álvarez N, et al. Interruptions of antiretroviral therapy in human immunodeficiency virus infection: Are they detrimental to neurocognitive functioning? J Neurovirol. 2010;16:208-18./Muñoz-Moreno J, Prats M, Fumaz CR, Ferrer MJ, Negredo E, González-García, et al. Prevalence of HIV-Related Neurocognitive Complications in Catalonia: Results from Cross-Sectional Multicenter Study. 10th International Symposium on Neurology, Milan, 2010.
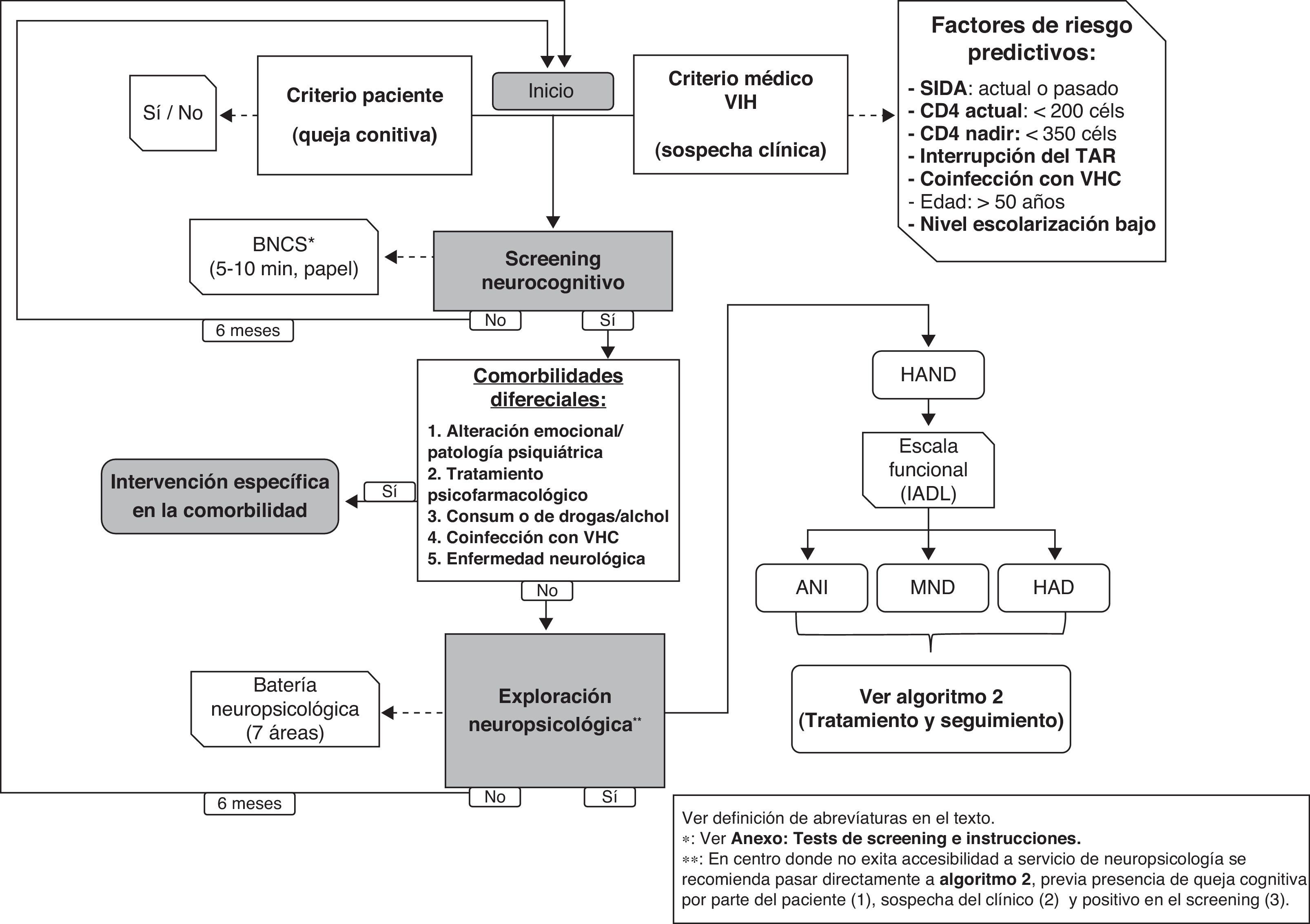
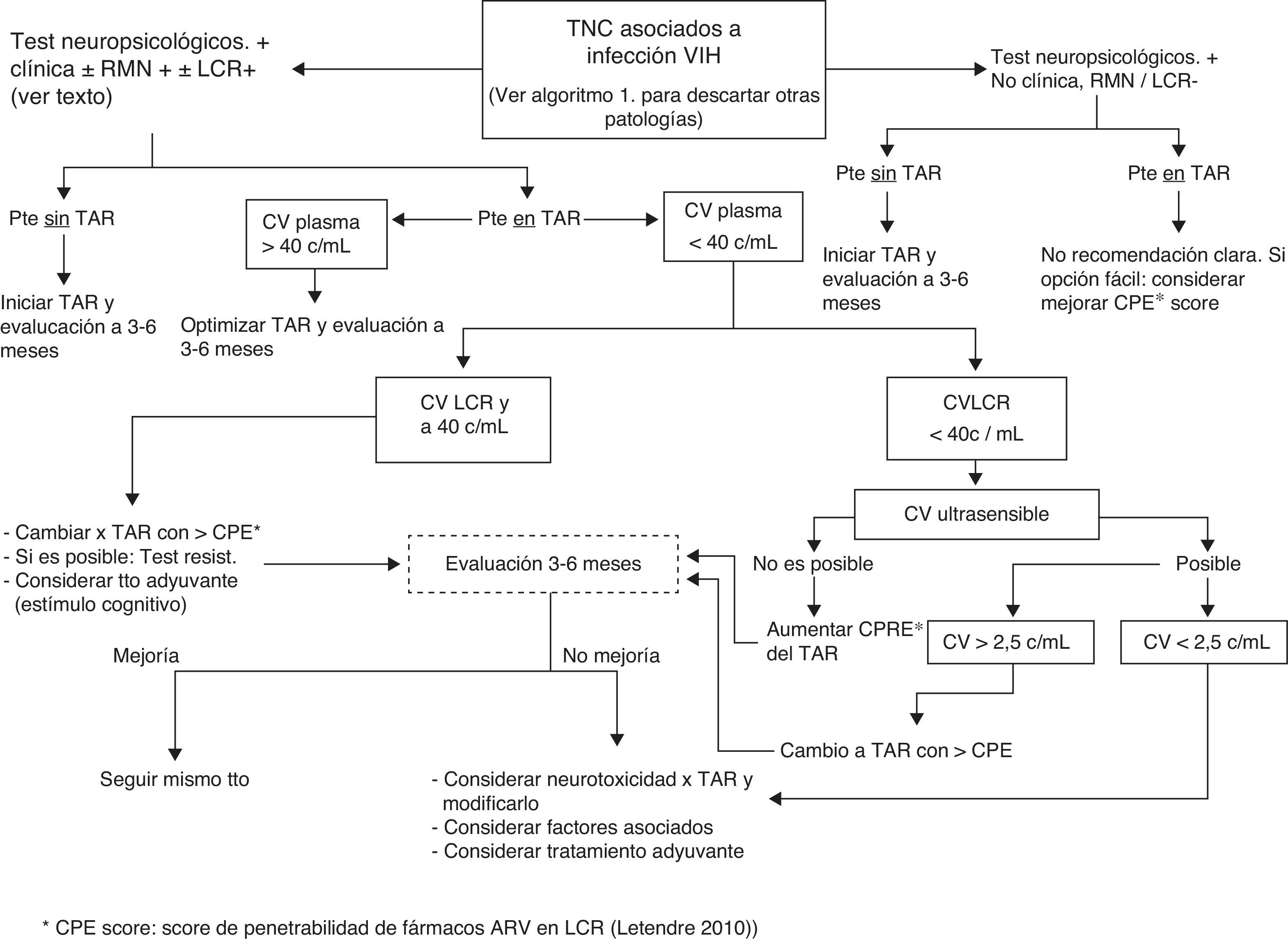
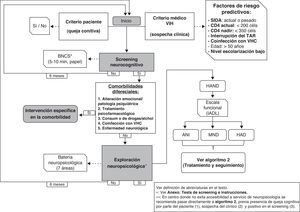
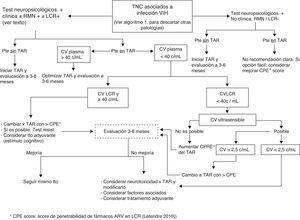
Tal como se especifica en la figura 1, en centros donde no se disponga de neuropsicólogos se pueden realizar tests de cribado (ver anexo http://www.gesida-seimc.org/pcientifica/fuentes/DcyRc/gesidadcyrc2013-ManejoclinicodelasalteracionesNC.pdf), y en caso de confirmarse la sospecha de TNC se recomienda pasar entonces al segundo algoritmo (fig. 2), en el cual se indica cómo continuar con la evaluación del paciente mediante técnicas de imagen y estudio del líquido cefalorraquídeo (LCR).
No es infrecuente que a lo largo del curso de la infección por VIH aparezcan alteraciones en el estudio básico de LCR, como leve hiperproteinorraquia y discreta pleocitosis a expensas de un aumento de células mononucleares (habitualmente menos de 50células/mm3)16,17. Este aumento de celularidad se ha correlacionado positivamente con la carga viral del VIH en LCR y puede revertirse con un adecuado TAR17.
El virus puede estar presente en el LCR de sujetos cognitivamente asintomáticos, por lo que su detección, incluso en altas concentraciones, no es diagnóstica de HAND17. Sin embargo, una carga viral detectable en el LCR en un paciente con TNC y carga viral indetectable en plasma, o más de 1log mayor en el LCR que en plasma, apoya el diagnóstico de TNC asociado al VIH, mientras que una carga viral indetectable en el LCR no iría a favor de que el VIH sea el causante del TNC. También es cierto que, en un estudio de la cohorte CHARTER, el 40% de los pacientes con cargas virales en LCR <40copias/ml tenían cargas virales entre 2,5 y 40copias, lo que parece asociarse a cierta inflamación e inmunoactivación y se acompañaba en dicho estudio de un mayor grado de TNC comparado con los pacientes con cargas virales <2,5copias/ml18.
Técnicas de neuroimagen utilizadas en la práctica diaria: tomografía computarizada y resonancia magnéticaLa tomografía computarizada (TC) y la resonancia magnética (RM) son técnicas fácilmente accesibles habitualmente utilizadas para evaluar diferentes patologías causantes de TNC en pacientes infectados por el VIH (infecciones o tumores oportunistas, enfermedad cardiovascular y otras lesiones inflamatorias o estructurales). Aunque no existen hallazgos radiológicos patognomónicos de HAND, la RM es más sensible para observar lesiones sugestivas de esta patología, mostrando anormalidades (atrofia, alteraciones de señal) en áreas específicas del SNC como ganglios basales, sustancia blanca periventricular y del centro semioval, con preservación de regiones subcorticales.
Recomendaciones- 1.
Cuando el paciente presenta historia previa o actual de comorbilidades asociadas a TNC, se recomienda utilizar los criterios de Antinori para clasificar el impacto de las comorbilidades. El tratamiento de estas co-morbilidades puede mejorar el TNC en estos pacientes. (C-III)
- 2.
El diagnóstico diferencial de un paciente VIH con TNC debe incluir como mínimo la determinación de concentraciones plasmáticas de vitamina B12, tiamina, ácido fólico, TSH, calcio sérico, glucosa, hemograma completo y pruebas de función hepática. Serología de lúes y, en casos seleccionados, de Borrellia burgdorferi en sangre, y un estudio del LCR que incluya recuento de células, proteínas, glucosa y serología de lúes. Las exploraciones complementarias básicas consistirían en RM del SNC. Interrogar sobre el consumo actual o pasado de sustancias de abuso y de fármacos con efectos sobre el SNC. (C-III)
- 3.
Ante la sospecha de síntomas relacionados con TNC debería realizarse un cribado neurocognitivo validado en población con VIH (se recomienda el instrumento BNCS, ver anexos http://www.gesida-seimc.org/pcientifica/fuentes/DcyRc/gesidadcyrc2013-ManejoclinicodelasalteracionesNC.pdf). En caso de un resultado positivo, y descartadas otras comorbilidades, se aconseja realizar una exploración neuropsicológica completa (fig. 1). En caso de que no sea posible realizar esa exploración se recomienda continuar con la evaluación/manejo del paciente (pasar a la fig. 2). (B-II)
- 4.
La exploración neuropsicológica completa debe ser realizada por un profesional especializado, el cual principalmente llevará a cabo una batería de pruebas neuropsicológicas validadas y estandarizadas con las que podrá determinar la existencia de alteración neurocognitiva. (A-II)
- 5.
Los dominios cognitivos recomendados para ser evaluados en las personas con VIH son los siguientes: atención/memoria de trabajo, velocidad de procesamiento de la información, memoria (aprendizaje/evocación), abstracción/función ejecutiva, lenguaje/verbal y habilidades motoras. Los resultados en estos dominios deben ofrecer siempre puntuaciones estandarizadas, según la disponibilidad de datos normativos, y principalmente de acuerdo con la edad, el sexo y el nivel educativo. (B-II)
- 6.
Se considerará existencia de alteración cognitiva cuando: a)exista una puntuación en un test estandarizado de al menos –1desviación estándar por debajo de la media en al menos 2dominios cognitivos; b)se descarte la ausencia de delirios o de causas previas a la infección del VIH que puedan haber producido la alteración cognitiva, y c)se evalúe la interferencia en el funcionamiento de la vida diaria, lo cual sirve para diferenciar entre alteración neurocognitiva subclínica o ANI de los otros 2TNC asociados al VIH, MND y HAD. (B-II)
- 7.
Es necesario diferenciar entre la existencia de alteración cognitiva por la propia acción del virus o, en cambio, por la acción de otras condiciones de riesgo (o de ambas situaciones). (B-II)
- 8.
La punción lumbar (PL) se debería hacer ante un paciente con sospecha de TNC, primero para descartar otras patologías asociadas (infecciones oportunistas, etc.) y segundo para apoyar el diagnóstico de TNC asociados al VIH mediante las características celulares/bioquímicas y carga viral en LCR. (B-I)
- 9.
A pesar del potencial de los biomarcadores en sangre y LCR y la utilidad demostrada en otras entidades que cursan con deterioro cognitivo, en este momento no puede establecerse una recomendación de uso de biomarcadores en plasma ni en el LCR para el diagnóstico de los TNC asociados a la infección por VIH. (C-II)
- 10.
Ante un paciente con sospecha de TNC asociados al VIH, la práctica de RM cerebral forma parte del protocolo diagnóstico y es preferible, por su mayor sensibilidad, a la TC. (A-II)
El TAR combinado se ha asociado con una notable reducción en la incidencia de demencia establecida en pacientes infectados por el VIH, sugiriendo un papel directo o indirecto en la prevención de esta grave complicación de la enfermedad19,20. Sin embargo, a pesar de ello, diversos estudios han mostrado en los últimos años la persistencia de formas asintomáticas o leves/moderadas de TNC21-23, dando a entender que diferencias de penetración —y por lo tanto de actividad antiviral a nivel de SNC— podrían jugar un papel en la evolución de los TNC24,25.
El paso de fármacos a través de la barrera hematoencefálica está ampliamente limitado, y depende de múltiples factores. En relación a los fármacos antirretrovirales (ARV), los niveles alcanzados en LCR dependen de varios factores, como el peso molecular, la liposolubilidad, la ionización y la unión a proteínas plasmáticas26-28.
En general, los ARV tienen un peso molecular relativamente bajo, especialmente los análogos de nucleósido (AN), seguidos de los inhibidores no nucleósidos de la transcriptasa inversa (INNTI) y, en último lugar, de los inhibidores de la proteasa (IP).
La forma más habitual de evaluar la capacidad de penetración de un fármaco al sistema nervioso es comparar la relación entre la concentración obtenida en el LCR y la concentración plasmática del mismo. Sin embargo, ello no se hace en la práctica rutinaria, y teniendo en cuenta que el LCR normal tiene muy pocas proteínas, y que la fracción de fármaco que atraviesa la barrera es la fracción libre, se asume que una gran proporción de fármaco hallado es libre y, por lo tanto, activo.
La técnica más utilizada es la cromatografía líquida con espectrometría de masa (liquid chromatographic-tandem mass spectrometry), que permite detectar pequeñas concentraciones en el LCR, habitualmente inferiores a las halladas en plasma o en otros líquidos corporales.
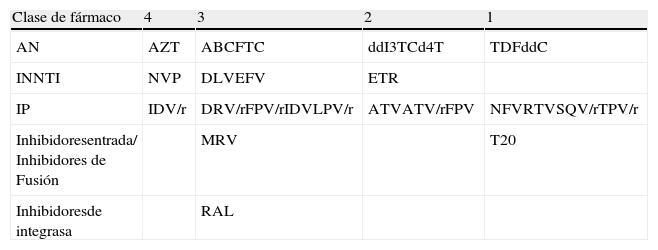
Los investigadores de la cohorte CHARTER han propuesto una escala de penetrabilidad de los fármacos ARV en el LCR (tabla 5). Aunque existen algunos datos contradictorios, varios estudios han demostrado una correlación entre el grado de penetrabilidad de una pauta triple o cuádruple de TAR con la evolución virológica y de los TNC.
Clasificación de los antirretrovirales según su penetración en el SNC
| Clase de fármaco | 4 | 3 | 2 | 1 |
| AN | AZT | ABCFTC | ddI3TCd4T | TDFddC |
| INNTI | NVP | DLVEFV | ETR | |
| IP | IDV/r | DRV/rFPV/rIDVLPV/r | ATVATV/rFPV | NFVRTVSQV/rTPV/r |
| Inhibidoresentrada/ Inhibidores de Fusión | MRV | T20 | ||
| Inhibidoresde integrasa | RAL |
AN: Análogos de nucleósidos/nucelótidos; INNTI: Inhibidores no nucleósidos de la transcriptasa inversa; IP: Inhibidores de la proteasa. Una mayor puntuación indicaría una mayor penetrabilidad del fármaco en SNC.
Modificado de Letendre et al.5
Por otra parte, se ha sugerido que algunos fármacos ARV podrían causar cierta neurotoxicidad, lo que explicaría la no mejoría o incluso el empeoramiento de tests neurocognitivos en pacientes con pauta con mayor puntuación de penetración o que continúan TAR frente a los que lo suspenden29.
Con respecto al momento del inicio del tratamiento, se ha observado una estrecha relación entre un recuento de CD4 nadir más bajo y mayores tasas de alteraciones cognitivas30-32. En este sentido, a pesar de que no existen ensayos clínicos aleatorizados que hayan valorado esta cuestión, sí existen recomendaciones que defienden el inicio más temprano de la terapia antirretroviral como medida de prevención para la aparición de problemas del SNC33-35. Otro escenario en el que han aparecido recomendaciones parecidas ha sido el manejo de las interrupciones del tratamiento. Es bien sabido en la actualidad que el uso de las interrupciones de la terapia antirretroviral está asociado con un peor estado clínico de los pacientes, y en el caso del SNC, a pesar que de nuevo no existen ensayos aleatorizados, resultados preliminares sugieren una posible relación entre la interrupción del TAR y un peor funcionamiento neurocognitivo36.
Tratamientos coadyuvantesLa ineficacia del TAR para prevenir el desarrollo o la evolución del deterioro cognitivo asociado al VIH en algunos individuos ha favorecido el desarrollo de nuevas estrategias terapéuticas adyuvantes al TAR. Son muchas y diversas las moléculas con propiedades neuroprotectoras in vitro que se han evaluado como posibles tratamientos adyuvantes, entre las que destacan la minociclina, la memantina, la selegilina, el litio, etc. A pesar de algunos resultados interesantes con alguna de ellas, como la memantina o el litio —consiguen mejorar los marcadores de daño neuronal e inflamación a nivel de SNC—, no existen datos suficientes que permitan su uso en la práctica diaria.
Intervenciones no farmacológicasLos estudios indican que nuestro cerebro y nuestras funciones cognitivas pueden ser influidos por factores modificables a través de mecanismos de neuroplasticidad, y por tanto podemos intervenir sobre ellos aun ante la presencia de trastornos cognitivos37. Por lo tanto, deberemos realizar actuaciones preventivas sobre comorbilidades, factores asociados al estilo de vida y rehabilitación cognitiva.
En la figura 1 se resumen las enfermedades y los hábitos saludables que pueden tener un efecto sobre la cognición. Se ha añadido además la rehabilitación cognitiva como técnica de intervención nofarmacológica útil en diferentes patologías que cursan con trastornos cognitivos.
Recomendaciones- 1.
No existen datos para priorizar el grado de penetrabilidad en el LCR a la hora de escoger una pauta de inicio de TAR, excepto en pacientes en los que se sospeche una encefalopatía por VIH o presenten síntomas o signos sugestivos de TNC y posiblemente también en presencia de tests neuropsicológicos alterados. (B-II)
- 2.
En pacientes que toman TAR y que durante su evolución se diagnostique un cuadro de TNC asociado a la infección por el VIH (ver el apartado correspondiente), si existe replicación viral en plasma se debe adecuar el TAR para conseguir la supresión virológica. (B-II)
- 3.
Si los TNC aparecen en pacientes en tratamiento y supresión virológica en plasma, en caso de carga viral detectable en LCR se debería intentar cambiar la pauta de TAR a una con un mayor grado de penetrabilidad. (B-II) (fig. 2).
- 4.
El inicio temprano de la terapia antirretroviral (>350células) puede estar asociado a una mayor protección del SNC, aunque se desconoce cuál sería el intervalo inmunológico ideal para esta intervención). (A-II)
- 5.
La interrupción del TAR está desaconsejada también a nivel de protección del SNC y, por tanto, se debería promover una correcta adherencia a la terapia antiviral, así como una óptima adaptación al tratamiento y sus posibles implicaciones. (B-III)
- 6.
No existen datos que justifiquen el uso de ningún tratamiento adyuvante al TAR para el tratamiento de los TNC asociados con la infección por VIH en la práctica clínica habitual. (B-I)
- 7.
Algunos fármacos que, como la memantina, han demostrado mejorar los marcadores de daño neuronal y de inflamación a nivel del SNC, podrían recomendarse de forma experimental (uso compasivo) a los pacientes con deterioro cognitivo asociado al VIH y marcadores de inflamación cerebral elevados en sangre y/o LCR que presenten progresión del deterioro cognitivo a pesar del uso de una pauta de TAR efectiva a nivel del SNC. (C-II)
- 8.
En la prevención de los TNC deben valorarse los factores comórbidos que pueden afectar a la cognición: hipertensión arterial, diabetes, hiperlipidemia, coinfecciones por VHC/VHB, depresión, así como insuficiencia renal crónica, déficit de vitaminaB12, déficit de vitaminaD, deficiencia de testosterona, disfunción tiroidea subclínica, estrógenos, hipotiroidismo subclínico, síndrome metabólico y obesidad; y por ello, intentar corregir o tratar estos factores con el objetivo de minimizar o evitar la aparición de TNC. (A-II)
- 9.
Los hábitos saludables —ejercicio, dieta mediterránea, actividades de ocio, reducción de estrés, abandono de tabaco, alcohol y tóxicos— pueden tener un efecto beneficioso en la prevención de TNC en personas VIH+. (B-III)
- 10.
Existen técnicas de rehabilitación cognitiva que podrían ser útiles en las personas VIH+ con trastornos cognitivos. (B-III)
- 11.
Las intervenciónes no farmacológicas para las personas VIH+ con TNC deberían integrarse en un plan de tratamiento integral que incluya objetivos definidos y valore el tratamiento de las comorbilidades, técnicas que ayuden al paciente a realizar hábitos saludables, intervenciones sobre la cognición, manejo de los síntomas conductuales y las alteraciones del humor, así como actuaciones sobre el entorno y los familiares. (B-III)
Es fundamental conocer cómo realizar el seguimiento de los pacientes VIH desde el punto de vista de los TNC.
Hasta ahora no existen estudios sistemáticos bien realizados que respondan de forma adecuada a la pregunta sobre cuándo y cómo monitorizar a los pacientes VIH con TNC, o incluso sobre la historia natural de la afectación neurocognitiva en pacientes con infección por VIH. Por ello, todas las recomendaciones son inferidas y formuladas de estudios longitudinales sobre deterioro o progresión de la afectación, muchos de ellos realizados en los tiempos previos al uso del TAR, o incluyendo pacientes con distintas situaciones clínicas, en fracaso virológico o sin tratamiento.
De forma global, parece evidente pensar que la frecuencia de monitorización de los pacientes puede variar dependiendo de las características de los pacientes o del diagnóstico inicial. Por ello, entre los distintos factores que debemos considerar en el seguimiento hay que mencionar:
- -
Presencia y persistencia de factores de riesgo para progresión (especialmente CD4+ nadir, diagnóstico de sida previo, alta carga viral) y otros factores asociados a deterioro neurocognitivo (comorbilidades).
- -
Diagnóstico previo de TNC y su severidad (trastorno leve o demencia).
- -
Inicio de TAR, considerando especialmente el momento de inicio, si se ha adaptado como tratamiento frente al deterioro previo o no, y en este caso, si existe supresión virológica mantenida o fracaso virológico.
- -
Metodología utilizada, ya que muchos estudios se han realizado con escaso número de pacientes, a distintos intervalos, y con diferentes baterías de tests neuropsicológicos, independientemente de los métodos estadísticos. De especial importancia es el «efecto de la práctica o repetición» y la fiabilidad test-retest en los resultados durante el seguimiento.
El seguimiento de los pacientes debería hacerse con los mismos métodos que se han utilizado para el diagnóstico, al menos, teniendo en cuenta el efecto de la práctica y la fiabilidad test-retest. Dado que el diagnóstico de TNC se realizó mediante una batería completa de tests neuropsicológicos, idealmente se debería monitorizar la evolución del paciente con el mismo método. En caso de no ser posible, se recomienda utilizar los tests empleados en el cribado (fig. 1)
¿Cuándo repetir los tests? (fig. 2)- -
En pacientes con TNC que inician TAR: a los 3-6 meses, con vistas a demostrar mejoría, especialmente en caso de TNC severo (MND o HAD).
- -
En pacientes con TNC en TAR y carga viral (CV) detectable en plasma: a los 3-6meses, tras optimizar el TAR.
- -
En pacientes con TNC y CV plasmática suprimida pero detectable en LCR: a los 3-6meses, tras modificar el TAR de acuerdo con el CPE score.
- -
En pacientes con TNC leve/moderado estable tras optimización del TAR (CV indetectable en plasma y LCR): 6-12meses.
- 1.
En el seguimiento de un HAND se recomienda hacer una evaluación del paciente con una batería completa de pruebas. Si no fuera posible, utilizar método de cribado. (B-II)
- 2.
Se recomienda realizar seguimiento con la siguiente periodicidad: cada 3-6 o 6-12meses, dependiendo de la situación del paciente. (B-III)
La realización de este documento ha sido financiada con fondos propios de la SPNS.
Conflicto de interesesCon el fin de evitar y/o minimizar los posibles conflictos de intereses, las personas que forman el panel de expertos han realizado una declaración formal de intereses. En esta declaración parte de los/as autores/as han recibido financiación para participar en congresos y para la realización de investigaciones, así como han recibido pagos como ponentes por parte de instituciones públicas y laboratorios farmacéuticos. Estas actividades no afectan a la claridad del presente documento, por no entrar en conflicto de intereses lo recomendado con los honorarios y/o ayudas recibidas. Cabe resaltar que, con respecto a los fármacos, en el documento solamente se habla de principio activo y no de marca comercial.
Agradecemos sinceramente la colaboración de Nerea Rozas, de la Unidad de VIH del Hospital Universitari de Bellvitge, en la ayuda de la confección del manuscrito.
Daniel Podzamczer Palter. Especialista en Medicina Interna. Hospital Universitari de Bellvitge. L’Hospitalet de Llobregat, Barcelona.
José A. Muñoz-Moreno. Doctor en Psicología. Hospital Universitari Germans Trias i Pujol. Badalona, Barcelona.
Daniel Alcolea Rodríguez. Especialista en Neurología. Hospital de la Santa Creu i Sant Pau. Barcelona.
Carlos Alonso Villaverde. Especialista en Medicina Interna. Hospital Sant Pau i Santa Tecla. Tarragona.
Antonio Antela López. Especialista en Medicina Interna. Hospital Clínico Universitario. Santiago de Compostela, La Coruña.
Jordi Blanch Andreu. Especialista en Psiquiatría. Hospital Clínic de Barcelona. Barcelona.
José Luis Casado Osorio. Especialista en Medicina Interna, Hospital Ramón y Cajal. Madrid.
M. José Galindo Puerto. Especialista en Medicina Interna. Hospital Clínico de Valencia. Valencia.
Maite Garolera i Freixa. Doctora en Psicología. Consorci Sanitari de Terrassa. Terrasa, Barcelona.
Jaime Locutura Rupérez. Especialista en Medicina Interna. Hospital General Yagüe. Burgos.
Albert Lleó Bisa. Especialista en Neurología. Hospital de la Santa Creu i Sant Pau. Barcelona.
Anna Prats París. Máster en Neuropsicología. Hospital Universitari Germans Trias i Pujol. Badalona, Barcelona. Centro Médico Teknon. Barcelona.
Ignacio Pérez-Valero. Especialista en Medicina Interna. Hospital Universitario La Paz - IDIPAZ. Madrid.
Joaquín Portilla Sogorb. Especialista en Medicina Interna. Hospital General Universitario de Alicante. Alicante.
Alex Rovira Cañellas. Especialista en Radiología. Hospital Vall d’Hebron. Barcelona.
M. Jesús Téllez Molina. Especialista en Medicina Interna. Hospital Clínico San Carlos. Madrid.
Juan Manuel Tiraboschi. Especialista en Medicina Interna. Hospital Universitari de Bellvitge. L’Hospitalet de Llobregat, Barcelona.
Esperanza Vergara Moragues. Doctora en Psicología. Hospital Universitario Puerto Real, Puerto Real, Cádiz.
José Ramón Arribas López. Especialista en Medicina Interna. Hospital Universitario La Paz. Madrid.
Miguel Ángel Goenaga Sánchez. Especialista en Medicina Interna. Hospital Universitario Donostia. Donostia-San Sebastián.
Fernando Lozano de León-Naranjo. Especialista en Medicina Interna. Hospital Universitario Nuestra Señora de Valme. Sevilla.
Esteban Martínez Chamorro. Especialista en Medicina Interna. Hospital Clínic de Barcelona. Barcelona.
Rosa Polo Rodríguez. Especialista en Medicina Interna. Secretaría del Plan Nacional sobre el Sida. Ministerio de Sanidad, Servicios Sociales e Igualdad. Madrid.
José A. Muñoz-Moreno y Daniel Podzamczer han contribuido en la misma medida en la redacción de este documento.
Algunas de las recomendaciones terapéuticas indicadas en este documento no están aprobadas en ficha técnica, pero el Panel las recomienda en función de los datos publicados al respecto. Cada facultativo prescriptor debe conocer las condiciones para la prescripción de medicamentos cuando se utilizan en indicaciones distintas a las autorizadas (Real Decreto 1015/2009, de 19 de junio, por el que se regula la disponibilidad de medicamentos en situaciones especiales).
Todos los miembros del grupo de trabajo son autores de este documento. El comité de redacción se detalla en el anexo 1.
Corresponding e-mail: dpodzamczer@bellvitgehospital.cat (D. Podzamczer)