Desde la aparición de las sulfonamidas para el tratamiento de la infección gonocócica en la década de 1930, Neisseria gonorrhoeae ha desarrollado resistencia a todos los antibióticos empleados. El aumento global de casos de gonorrea, así como de la resistencia a los fármacos de primera línea, hacen de N. gonorrhoeae una de las 3 amenazas antimicrobianas «urgentes» para la que se necesitan tratamientos opcionales1. Como alternativas a la terapia actual, se están probando antibióticos conocidos como la gentamicina y el gemifloxacino2–4, y nuevos fármacos como la solitromicina, la zoliflodacina y la gepotidacina que están en diferentes fases de desarrollo.
Con el objetivo de aportar información sobre la tasa de resistencia de N. gonorrhoeae a la gentamicina y otros antibióticos, estudiamos la sensibilidad antimicrobiana de todas las cepas aisladas a partir de las muestras recibidas en el Departamento de Microbiología del Hospital Universitario i Politècnic La Fe, entre marzo de 2013 y marzo de 2019.
Las muestras se sembraron en agar chocolate (bioMérieux) y en medio selectivo Martin Lewis (Becton Dickinson). Las cepas aisladas se identificaron mediante MALDI-TOF VITEK® MS (bioMérieux). En paralelo se realizó una PCR múltiple en tiempo real (Anyplex™ II STI-7 Detection, Seegene) a partir de muestra directa confirmando los aislamientos. La sensibilidad a bencilpenicilina, ceftriaxona, cefotaxima, cefixima, azitromicina y gentamicina se determinó mediante el método E-test® (bioMérieux). A excepción de la gentamicina, las concentraciones mínimas inhibitorias (CMI) se interpretaron según el Comité de Guías de Ensayo de Sensibilidad a Antimicrobianos (EUCAST) vigente en 20195,6. Las CMI de la gentamicina se clasificaron como sigue: sensible: ≤4mg/l; sensibilidad reducida (intermedia): 8-16mg/l, y resistente: ≥32mg/l4. Se estableció como resistencia de alto nivel a azitromicina cuando la CMI≥256mg/l7. Para determinar la sensibilidad a ciprofloxacino y tetraciclina se empleó el método de difusión en disco cuyo resultado se interpretó según el CLSI6. La resistencia de alto nivel a penicilina se testó mediante la producción de beta-lactamasa con un método cromogénico (Cefinasa®, Becton-Dickinson).
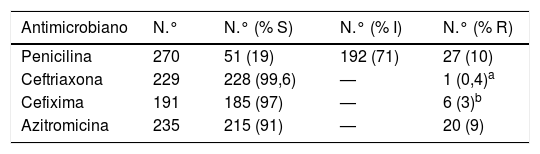
Se aislaron un total de 278 cepas correspondientes a 218 exudados uretrales, 53 vagino-cervicales, 4 rectales, 2 muestras de semen y un dispositivo intrauterino. En la tabla 1 se muestra un resumen de la sensibilidad a los antibióticos testados a excepción de la gentamicina. De las 65 cepas en las que se testó la gentamicina, 59 (90%) fueron sensibles y 6 (10%) mostraron sensibilidad reducida o intermedia. El 6,3% (15/238) de las cepas fueron productoras de beta-lactamasa. De las 20 (9%) cepas resistentes a azitromicina, una de ellas mostró resistencia de alto nivel (CMI≥256mg/l).
Estudio de sensibilidad de las cepas de N. gonorrhoeae aisladas (EUCAST, 2019)
| Antimicrobiano | N.° | N.° (% S) | N.° (% I) | N.° (% R) |
|---|---|---|---|---|
| Penicilina | 270 | 51 (19) | 192 (71) | 27 (10) |
| Ceftriaxona | 229 | 228 (99,6) | — | 1 (0,4)a |
| Cefixima | 191 | 185 (97) | — | 6 (3)b |
| Azitromicina | 235 | 215 (91) | — | 20 (9) |
I: sensibilidad reducida o intermedia; R: resistente; S: sensible; -: no definido.
La recomendación actual para el tratamiento de la infección gonocócica incluye azitromicina junto con ceftriaxona en dosis única. La cefixima dejó de recomendarse como primera opción tras notificarse mayores tasas de resistencia con esta cefalosporina. Se han descrito alteraciones genéticas en el genoma de N.gonorrhoeae que podrían explicar estos hallazgos8. El que se dejara de recomendar cefixima como primera opción redujo considerablemente su tasa de resistencia, pasando de un 8,7% en el 2010 a un 2,1% en el 20179, valor muy cercano al 2% detectado en nuestro estudio. Según el último informe del ECDC del 2017, las tasas de resistencia de la cefixima, la ceftriaxona y la azitromicina se mantuvieron estables en los últimos 4 años9. En nuestro estudio, encontramos una cepa resistente a ceftriaxona y 6 a cefixima, correspondientes a muestras obtenidas en el 2015 en el primer caso y al 2016 y 2017 en el segundo. Con respecto a la azitromicina, el alto porcentaje de resistencia encontrado, coincide con lo descrito por otros autores en nuestro país10. Sin embargo, creemos que esta podría ser la primera vez que se describe en España una cepa con resistencia de alto nivel a azitromicina. En cuanto a la gentamicina, no observamos ninguna cepa resistente.
Como conclusión, aunque en nuestro entorno, la terapia combinada con ceftriaxona y azitromicina parece ser efectiva en el tratamiento de infección gonocócica, es importante continuar vigilando la aparición de resistencias a estos antibióticos, especialmente las cepas con resistencia de alto nivel a azitromicina que podrían comprometer la eficacia del tratamiento.