El objetivo de la investigación fue estudiar la epidemiología de la colonización nasofaríngea por Streptococcus pneumoniae (S. pneumoniae) tras la introducción de la vacuna conjugada neumocócica heptavalente (VCN7).
MétodosSe obtuvieron muestras NF en 848 niños > 6 meses y<6 años atendidos en cuatro centros de salud (niños sanos) y en dos urgencias hospitalarias (niños enfermos) de Sevilla durante el período comprendido entre el 1/2/2005 y el 31/6/2008.
ResultadosDe forma global 278 (33%) niños estaban colonizados por S. pneumoniae, la asistencia a guardería o colegio (OR: 2,21; IC 95%: 1,54-3,15; p=0,0001) y la edad < 3 años (OR: 1,87; IC 95%: 1,3-2,69; p=0,001) fueron predictores independientes de la colonización neumocócica. La utilización reciente de antibióticos tuvo un efecto protector (OR: 0,68; IC 95%: 0,48-0,94; p=0,02). Cobertura vacunal VCN7 41%. Se encontró una menor frecuencia de colonización por serotipos vacunales (SV) en aquellos niños con ≥ 1 dosis de VCN7 (7% vs 29%; [OR: 0,21; IC 95%: 0,09-0,49; p=0,0001]). La proporción de cepas neumocócicas no sensibles a la penicilina oral y resistentes a la amoxicilina fue del 33 y 3%, respectivamente. La resistencia a la amoxicilina se asoció con la antibioterapia previa (OR: 4,29; IC 95%: 1,09-20,02).
ConclusionesLa prevalencia de SV en niños inmunizados y no vacunados fue baja en comparación con estudios previos a la introducción de la VCN7. La edad temprana y el hacinamiento incrementaron el riesgo de portar neumococos. La utilización de antibioterapia previa disminuyó la probabilidad de colonización pero incrementó el riesgo de portar neumococos resistentes a la amoxicilina.
The aim of this investigation was to study the epidemiology of nasopharyngeal (NP) colonization with Streptococcus pneumoniae after the introduction of the heptavalent pneumococcal conjugate vaccine (PCV7).
MethodsNP swabs were obtained from 848 children aged 6 months to six years seen in four primary care centres (healthy children) and in two emergency depeartments (sick children) from Seville. The study was conducted between February 2005 and June 2008.
ResultsA total of 278 (33%) children carried S. pneumoniae. Pneumococcal colonization was independently predicted by school attendance or child care participation (OR 2.21; 95% CI 1.54- 3.15; P=.0001) and younger age. Recent antibiotic use was protective (OR 0.68; 95% CI 0.48-0.94; P=.02). PCV7 uptake was 41%. Risk of carriage of PCV7- type pneumococci was lower among children who had received ≥1 dose of PCV7 (7% vs 29%; [OR 0.21; 95% CI 0.09-0.49; P=.0001]). The proportion of pneumococcal isolates with oral penicillin non-susceptibility and amoxicillin resistance were 33% and 3%, respectively. Amoxicillin resistance in colonized children was associated with prior antibiotic usage (OR 4.29; 95% CI 1.09-20.02).
ConclusionsNP colonization rates with PCV7- type pneumococci were low compared to those found in studies prior to PCV7 introduction, both in vaccinated and unvaccinated subjects. Factors related to age and overcrowding increased the prevalence of pneumococcal carriage. Use of antibiotics reduced the overall carriage of pneumococci, but was a risk factor for colonization with amoxicillin resistant pneumococci.
Streptococcus pneumoniae (S. pneumoniae) es uno de los patógenos más frecuentes de las infecciones adquiridas en la comunidad, tanto en la población pediátrica como en adultos1. La colonización de la nasofaringe (NF) es un paso previo al desarrollo de enfermedad neumocócica y las tasas más elevadas de colonización se encuentran en los niños, especialmente en aquellos de edad preescolar2. En la población infantil, los aislados que se encuentran colonizando la nasofaringe constituyen el reservorio ecológico principal a partir del cual surgen y se diseminan las resistencias del microorganismo y reflejan los aislados circulantes en la comunidad3.
Los factores de riesgo para la colonización de la NF por S. pneumoniae han sido ampliamente estudiados. Ciertos factores como la edad, las condiciones que favorecen el hacinamiento, como asistencia a guardería o el mayor tamaño familiar y la existencia de procesos infecciosos de vías respiratorias altas son determinantes generalmente asociados a un mayor riesgo de colonización neumocócica, aunque no son considerados hallazgos universales4–6.
La introducción de la vacuna conjugada heptavalente antineumocócica (VCN7) ha producido un importante impacto sobre la colonización de la NF. Ésta se introdujo en España en junio del 2001 para el mercado privado y se incorporó al calendario oficial de vacunación por primera vez en una comunidad autónoma (Madrid) en octubre del 2006. Se ha observado una reducción en las tasas de colonización por serotipos vacunales, generalmente asociados con resistencias de más alto nivel, compensada por un aumento proporcional en la proporción de serotipos no vacunales5,7. Además se ha sugerido que la vacunación con VCN7 podría estar modificando alguno de los factores de riesgo más comunes, como la edad y las infecciones del tracto respiratorio superior, para la colonización neumocócica a nivel poblacional8.
Para una mejor comprensión de los cambios evolutivos en la epidemiología de la enfermedad neumocócica tras la introducción de VCN7 hemos realizado un estudio transversal de la colonización de la NF por S. pneumoniae en una amplia población de niños atendidos en urgencias hospitalarias y centros de salud de la ciudad de Sevilla. Los objetivos del estudio han sido: a) determinar la prevalencia de colonización neumocócica en esta población; b) establecer los predictores para portar S. pneumoniae y serotipos vacunales neumocócicos y c) analizar los factores asociados con colonización por neumococos resistentes a los antimicrobianos entre los individuos portadores. A este último respecto y teniendo en cuenta que los compuestos basados en la amoxicilina constituyen el principal grupo de antibiótico consumido en nuestro país a nivel comunitario, se han evaluado las resistencias a amoxicilina, lo cual no se suele investigar de forma específica en este tipo de estudios9.
MétodosÁmbito de estudioSe obtuvieron muestras NF en niños atendidos en cuatro centros de salud y en las urgencias del hospital universitario infantil Virgen del Rocío (HUIVR) y del hospital Sagrado Corazón (HSC) de la ciudad de Sevilla durante el período comprendido entre el 1/2/2005 y el 31/6/2008. Los centros de salud estaban geográficamente separados y se seleccionaron por criterios logísticos (facilidades para el adecuado almacenamiento y transporte de las muestras). Los servicios de urgencias escogidos son los que atienden a un mayor número de pacientes pediátricos en la ciudad de Sevilla y corresponden a un hospital público terciario pediátrico y otro con financiación privada.
Procedimientos de toma de muestras y recogida de datosSe incluyeron niños con edades comprendidas entre 6 meses y 6 años en el momento de la obtención de la muestra. En los centros de salud participantes se incluyeron niños atendidos en la consulta programada del niño sano. En las urgencias se incluyeron pacientes que habían acudido a estos servicios en demanda de atención sanitaria y que presentaban los cuadros de menor gravedad de acuerdo con la prioridad de atención establecida en el triage (i.e: infecciones respiratorias del tracto respiratorio superior, incluyendo rinosinusitis, faringitis y otitis media y gastrointestinales leves, traumatismos banales y episodios dermatológicos agudos no graves). Se consideraron criterios de exclusión la existencia de enfermedad crónica de base o la existencia de alguno de los siguientes signos o síntomas: fiebre > 39°C, afectación del estado general, dificultad respiratoria, vómitos significativos, deshidratación y/o evidencia de proceso neumónico. No hubo aleatorización previa en ninguno de los ámbitos de estudio. Se reclutaron los niños en el período de tiempo con mayor disponibilidad de los profesionales participantes y con menor presión asistencial, al tratarse de un proceso relativamente laborioso, con las consiguientes distorsiones en la atención sanitaria en servicios de urgencia habitualmente saturados y ser pruebas con baja aceptabilidad.
A los padres se les explicó verbalmente y por escrito los procedimientos del estudio y se les solicitó consentimiento informado por escrito. El estudio fue aprobado por el Comité Ético del Hospital Universitario Virgen del Rocío (HUVR). Previamente a la obtención de la muestra NF se obtuvo información mediante cuestionario estructurado sobre los siguientes factores de riesgo potenciales para portar neumococos: edad, sexo, asistencia a guardería o colegio, número de hermanos y edad de éstos, administración de antibióticos en los dos meses previos y tipo de antibiótico administrado, tabaco pasivo y estado vacunal frente al neumococo. La información sobre las variables del estudio se recogió de las historias electrónicas cuando estuvo disponible y en los restantes casos a partir de la información verbal transmitida por los padres. Se consideró la asistencia a guardería o colegio cuando esta se producía de forma regular (≥ 3 horas diarias y al menos tres días a la semana). Las muestras NF se obtuvieron por médicos pediatras o residentes de pediatría que habían sido previamente adiestrados en este procedimiento. Se obtuvo una sola muestra NF de cada uno de los sujetos participantes siguiendo la metodología recomendada por el grupo de trabajo de la OMS para la detección de la colonización NF por S. pneumoniae10.
Procesamiento microbiológico de las muestrasLas muestras se sembraron en placas de Columbia agar-sangre suplementadas con 5μg/ml de colistina-ácido nalidíxico (Beckton Dickinson, San Agustín del Guadalix, España) y se incubaron a 36°C en 5% de CO2. Las colonías α-hemolíticas se identificaron presuntivamente como neumococos en base a su morfología y susceptibilidad a la optoquina. La identificación definitiva, la serotipación y determinación de la sensibilidad antimicrobiana se realizaron en el Laboratorio Nacional de Referencia de Neumococos. La identificación definitiva se realizó por solubilidad en bilis y fue confirmada mediante genotipación por MLST11. La serotipación se realizó por medio de la reacción de Quellung. Se consideraron a efectos del análisis como serotipos vacunales a los incluidos en la vacuna conjugada neumocócica heptavalente (VCN7) (serotipos 4, 6B, 9V, 14, 18C, 19F, 23F). El resto de serotipos se clasificó como no vacunales. Las sensibilidades a los antibióticos se determinaron por dilución en agar, excepto para la clindamicina que se realizó por difusión en disco, según recomendaciones del CLSI12. Se consideraron los siguientes puntos de corte actualizados por el CLSI13 para la determinación de: no sensibilidad a penicilina oral (sensibilidad intermedia+resistencia) (≥ 0,12μg/ml), resistencia a penicilina oral (≥ 2μg/ml), resistencia a eritromicina y clindamicina (≥ 1μg/ml), sensibilidad intermedia a amoxicilina (4μg/ml) y resistencia a la amoxicilina (≥ (8μg/ml).
Análisis estadísticoEl procesamiento estadístico se realizó utilizando el paquete SSPS 17.0 para Windows. En primer lugar se realizó estadística descriptiva mediante frecuencias absolutas y relativas. Se analizó por análisis bivariante la asociación entre las características de los pacientes y: 1) estado de portador de S. pneumoniae, 2) ser portador de serotipos vacunales, 3) portar neumococos con falta de sensibilidad a la penicilina, 4) con resistencias a la eritromicina, y 5) con resistencia a la amoxicilina. Este análisis se realizó por medio del test del χ2 o test exacto de Fisher, según fuera adecuado. Los factores potencialmente relacionados con los estados de portador (p<0,15) y el lugar de origen (por tratarse de dos poblaciones no balancedas para algunas de las características analizadas) se introdujeron en modelos de regresión logística múltiple, para evaluar sus contribuciones independientes expresadas como odds ratio (OR) con intervalos de confianza del 95%. Se consideró en todos los modelos prueba significativa cuando el valor de p fue menor de 0,05.
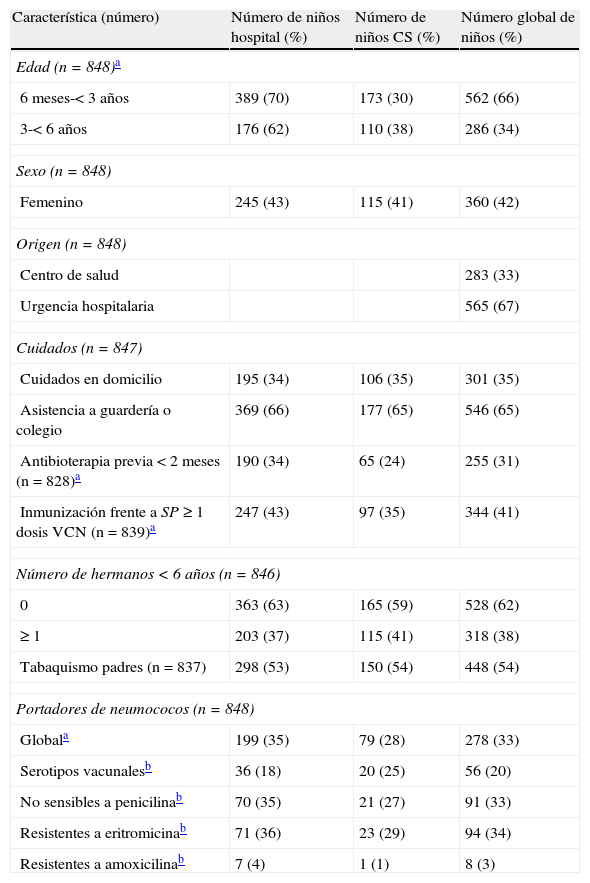
ResultadosPacientes del estudioDurante el período de estudio se incluyeron 848 niños de entre 6 meses y 6 años de edad. Las características demográficas de la población estudiada se muestran en la tabla 1. La proporción de niños reclutados en cada año del estudio fue del 34% en 2005, 27% en 2006, 25% en 2007 y 14% en 2008. Se obtuvieron 565 (67%) muestras de pacientes atendidos en las urgencias hospitalarias de los dos centros incluidos en el estudio, de las que 441 (78%) procedían del HUIVR y las restantes 124 (22%) del HSC, y 283 (33%) de los pacientes reclutados procedían de los centros de salud. Los sujetos del estudio de los centros de salud y las urgencias hospitalarias fueron diferentes para la edad, utilización de antibioterapia previa y la tasa de vacunación con VCN7. De acuerdo a la revisión de las historias clínicas y la información recibida de los padres, habían recibido algún tipo de tratamiento antibiótico durante los dos meses previos un total de 255 (31%) niños. Las aminopenicilinas (amoxicilina±clavulánico) fueron el grupo antimicrobiano más frecuentemente utilizado (78%). La proporción media de niños que habían recibido al menos una dosis de VCN fue del 41%. La cobertura vacunal se incrementó desde un 31% en 2005 hasta un 55% en 2008. En la mayoría (62%) de los grupos familiares, el participante era el único hijo<6 años. Dentro de los niños estudiados hubo 4 parejas de hermanos.
Características de los 848 niños a los que se investigó el estado de portador nasofaríngeo de S. pneumoniae
| Característica (número) | Número de niños hospital (%) | Número de niños CS (%) | Número global de niños (%) |
| Edad (n=848)a | |||
| 6 meses-< 3 años | 389 (70) | 173 (30) | 562 (66) |
| 3-< 6 años | 176 (62) | 110 (38) | 286 (34) |
| Sexo (n=848) | |||
| Femenino | 245 (43) | 115 (41) | 360 (42) |
| Origen (n=848) | |||
| Centro de salud | 283 (33) | ||
| Urgencia hospitalaria | 565 (67) | ||
| Cuidados (n=847) | |||
| Cuidados en domicilio | 195 (34) | 106 (35) | 301 (35) |
| Asistencia a guardería o colegio | 369 (66) | 177 (65) | 546 (65) |
| Antibioterapia previa < 2 meses (n=828)a | 190 (34) | 65 (24) | 255 (31) |
| Inmunización frente a SP≥1 dosis VCN (n=839)a | 247 (43) | 97 (35) | 344 (41) |
| Número de hermanos < 6 años (n=846) | |||
| 0 | 363 (63) | 165 (59) | 528 (62) |
| ≥ 1 | 203 (37) | 115 (41) | 318 (38) |
| Tabaquismo padres (n=837) | 298 (53) | 150 (54) | 448 (54) |
| Portadores de neumococos (n=848) | |||
| Globala | 199 (35) | 79 (28) | 278 (33) |
| Serotipos vacunalesb | 36 (18) | 20 (25) | 56 (20) |
| No sensibles a penicilinab | 70 (35) | 21 (27) | 91 (33) |
| Resistentes a eritromicinab | 71 (36) | 23 (29) | 94 (34) |
| Resistentes a amoxicilinab | 7 (4) | 1 (1) | 8 (3) |
CS: centro de salud.
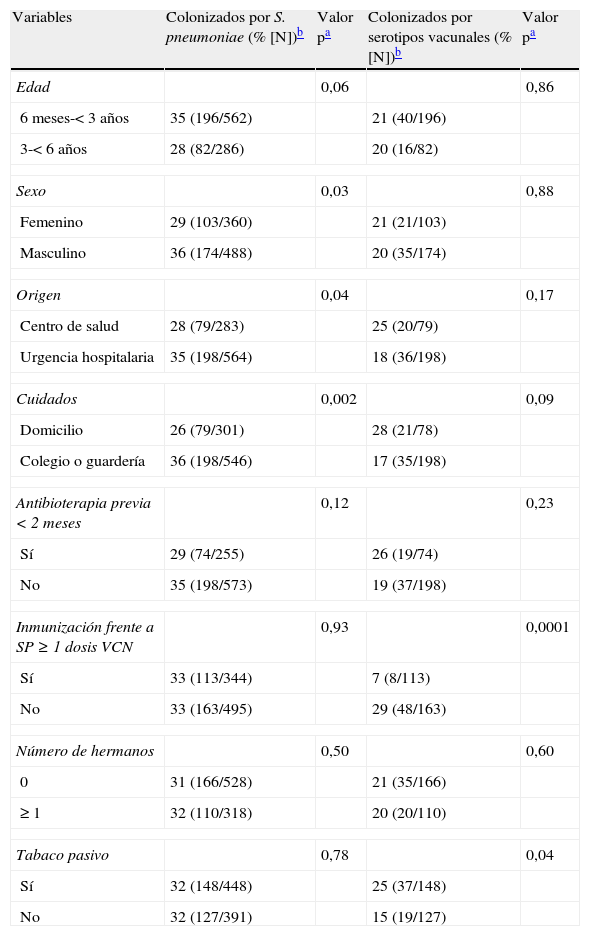
De forma global, 278 (33%) niños estaban colonizados por S. pneumoniae. En el análisis bivariante se encontró que la prevalencia de colonización neumocócica fue más elevada en niños que acudían a guardería o escolarizados comparada con los niños cuidados en domicilio (36% vs 26%; p=0,002) (tabla 2). Los niños atendidos en el centro de salud tenían menores tasas de colonización que los atendidos en las urgencias hospitalarias (28% vs 35%; p=0,04), así como el sexo femenino en comparación con el masculino (29% vs 36%; p=0,03). El estado vacunal frente a S. pneumoniae no tuvo impacto significativo sobre la colonización total neumocócica.
Análisis bivariante de los factores de riesgo para la colonización global
| Variables | Colonizados por S. pneumoniae (% [N])b | Valor pa | Colonizados por serotipos vacunales (% [N])b | Valor pa |
| Edad | 0,06 | 0,86 | ||
| 6 meses-< 3 años | 35 (196/562) | 21 (40/196) | ||
| 3-< 6 años | 28 (82/286) | 20 (16/82) | ||
| Sexo | 0,03 | 0,88 | ||
| Femenino | 29 (103/360) | 21 (21/103) | ||
| Masculino | 36 (174/488) | 20 (35/174) | ||
| Origen | 0,04 | 0,17 | ||
| Centro de salud | 28 (79/283) | 25 (20/79) | ||
| Urgencia hospitalaria | 35 (198/564) | 18 (36/198) | ||
| Cuidados | 0,002 | 0,09 | ||
| Domicilio | 26 (79/301) | 28 (21/78) | ||
| Colegio o guardería | 36 (198/546) | 17 (35/198) | ||
| Antibioterapia previa < 2 meses | 0,12 | 0,23 | ||
| Sí | 29 (74/255) | 26 (19/74) | ||
| No | 35 (198/573) | 19 (37/198) | ||
| Inmunización frente a SP≥1 dosis VCN | 0,93 | 0,0001 | ||
| Sí | 33 (113/344) | 7 (8/113) | ||
| No | 33 (163/495) | 29 (48/163) | ||
| Número de hermanos | 0,50 | 0,60 | ||
| 0 | 31 (166/528) | 21 (35/166) | ||
| ≥ 1 | 32 (110/318) | 20 (20/110) | ||
| Tabaco pasivo | 0,78 | 0,04 | ||
| Sí | 32 (148/448) | 25 (37/148) | ||
| No | 32 (127/391) | 15 (19/127) | ||
NF por S. pneumoniae y por serotipos vacunales.
En el análisis multivariante fueron predictores independientes de la colonización neumocócica la asistencia a guardería o colegio (OR: 2,21; IC 95%: 1,54-3,15; p=0,0001) y la edad preescolar (OR: 1,87; IC 95%: 1,3-2,69; p=0,001). La utilización reciente de antibióticos tuvo un efecto protector (OR: 0,68; IC 95%: 0,48-0,94; p=0,02). Cincuenta y seis (20%) de los 278 aislamientos neumocócicos en portadores correspondían a serotipos incluidos en VCN7. Se encontró una menor frecuencia de colonización por serotipos vacunales en aquellos niños con ≥ 1 dosis administrada de VCN en comparación con los no vacunados (7% vs 29%; p=0,0001) y esta asociación se confirmó como independiente en modelo multivariante (OR: 0,21; IC 95%: 0,09-0,49; p=0,0001). La tasa de colonización por serotipos vacunales se asoció significativamente en análisis bivariante con el hábito tabáquico en alguno de los padres, pero no en el modelo multivariante.
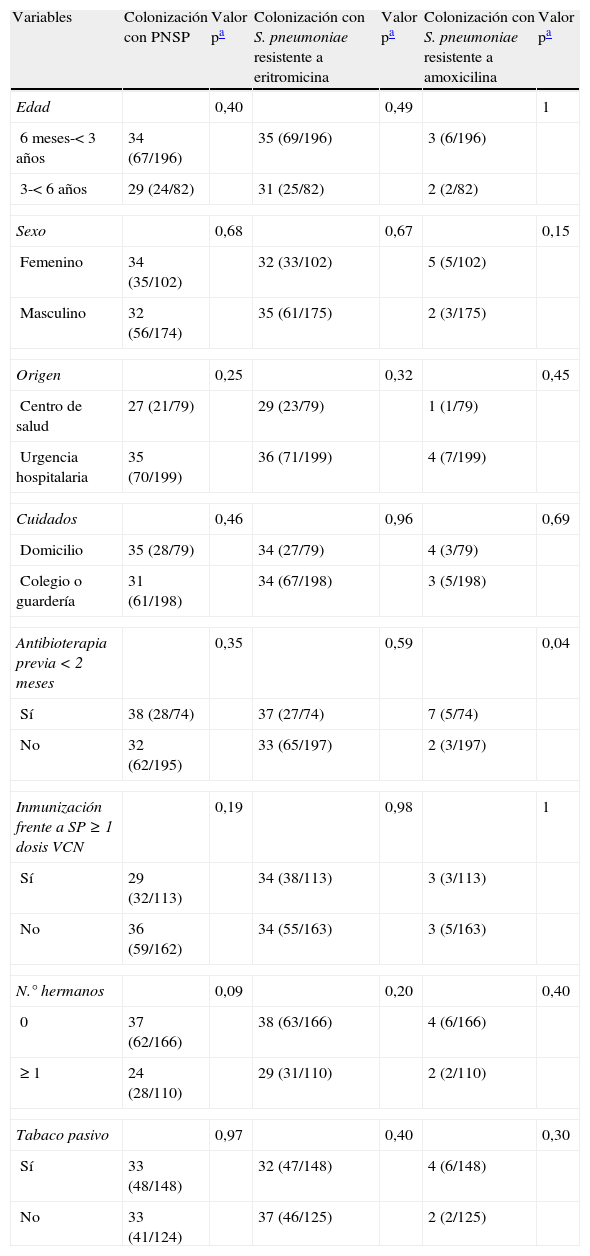
Colonización por Streptococcus pneumoniae con resistencias antibióticasEn el subgrupo de niños portadores de neumococos en la NF, la prevalencia de las cepas no sensibles a la penicilina oral fue del 33% y se detectaron resistencias de alto nivel a la penicilina oral en el 3% de los colonizados. Entre los 278 aislamientos NF de S. pneumoniae se identificaron 94 (34%) cepas con resistencia a eritromicina, de las que 76 (81%) eran también resistentes a clindamicina. Las tasas de sensibilidad intermedia y de resistencias a la amoxicilina fueron del 1 y 3%, respectivamente. No se encontró en el análisis bivariante asociación de ninguna de las variables analizadas con la colonización por cepas de S. pneumoniae con falta de sensibilidad a la penicilina (CMI ≥ 0,12μg/ml) o resistencias a eritromicina (tabla 3). La resistencia a la amoxicilina se asoció significativamente con la utilización de antibioterapia previa ajustada por estado vacunal (VCN7) y origen (OR: 4,29; IC 95%: 1,09-20,02; p=0,04).
Análisis bivariante de los factores de riesgo para la colonización NF por cepas de S. pneumoniae no sensibles a penicilina (PNSP) y resistentes a eritromicina y amoxicilina
| Variables | Colonización con PNSP | Valor pa | Colonización con S. pneumoniae resistente a eritromicina | Valor pa | Colonización con S. pneumoniae resistente a amoxicilina | Valor pa |
| Edad | 0,40 | 0,49 | 1 | |||
| 6 meses-< 3 años | 34 (67/196) | 35 (69/196) | 3 (6/196) | |||
| 3-< 6 años | 29 (24/82) | 31 (25/82) | 2 (2/82) | |||
| Sexo | 0,68 | 0,67 | 0,15 | |||
| Femenino | 34 (35/102) | 32 (33/102) | 5 (5/102) | |||
| Masculino | 32 (56/174) | 35 (61/175) | 2 (3/175) | |||
| Origen | 0,25 | 0,32 | 0,45 | |||
| Centro de salud | 27 (21/79) | 29 (23/79) | 1 (1/79) | |||
| Urgencia hospitalaria | 35 (70/199) | 36 (71/199) | 4 (7/199) | |||
| Cuidados | 0,46 | 0,96 | 0,69 | |||
| Domicilio | 35 (28/79) | 34 (27/79) | 4 (3/79) | |||
| Colegio o guardería | 31 (61/198) | 34 (67/198) | 3 (5/198) | |||
| Antibioterapia previa<2 meses | 0,35 | 0,59 | 0,04 | |||
| Sí | 38 (28/74) | 37 (27/74) | 7 (5/74) | |||
| No | 32 (62/195) | 33 (65/197) | 2 (3/197) | |||
| Inmunización frente a SP≥1 dosis VCN | 0,19 | 0,98 | 1 | |||
| Sí | 29 (32/113) | 34 (38/113) | 3 (3/113) | |||
| No | 36 (59/162) | 34 (55/163) | 3 (5/163) | |||
| N.° hermanos | 0,09 | 0,20 | 0,40 | |||
| 0 | 37 (62/166) | 38 (63/166) | 4 (6/166) | |||
| ≥ 1 | 24 (28/110) | 29 (31/110) | 2 (2/110) | |||
| Tabaco pasivo | 0,97 | 0,40 | 0,30 | |||
| Sí | 33 (48/148) | 32 (47/148) | 4 (6/148) | |||
| No | 33 (41/124) | 37 (46/125) | 2 (2/125) | |||
En esta investigación se ha analizado la epidemiología de la colonización NF por S. pneumoniae en una amplia muestra de niños de centros de salud y urgencias hospitalarias. La prevalencia global de colonización por S. pneumoniae fue del 33% y estaba asociada de forma significativa con la edad y lugar de cuidados, mientras que la utilización previa de antibióticos mostró un efecto protector. Entre los colonizados, la antibioterapia previa se asoció con un mayor porcentaje de resistencias a la amoxicilina. La prevalencia de colonización encontrada es comparable a la registrada en estudios contemporáneos de países desarrollados para este grupo de población4,7,9,14. La menor edad y los cuidados en guardería son predictores de riesgo incrementado de colonización en la mayoría de estudios4,7,14–16. Se ha hipotetizado que la asistencia a guardería tendría un efecto sobre la prevalencia de colonización neumocócica tanto a nivel individual, como comunitario, de modo que en comunidades con una alta proporción de niños en guardería los que reciben cuidados en domicilio tendrían también mayor probabilidad de estar colonizados, aunque no se han realizado estudios específicos que lo confirmen17. Se ha encontrado generalmente asociación entre la antibioterapia previa y las tasas de colonización neumocócica, aunque con diferencias en los estudios que la han analizado, lo que podría obedecer a los tipos de antimicrobianos utilizados y las tasas de resistencias de alto nivel en portadores NF4,6,7,14,18,19. A este respecto, en poblaciones como las del presente estudio, con predominio en el consumo de antimicrobianos de elevada actividad intrínseca frente a los neumococos y bajas tasas de resistencias de alto nivel frente a penicilina, el impacto de los antibióticos sobre la prevalencia colonización sería de mayor relevancia20. El origen hospitalario se asoció en el análisis bivariante con mayores tasas de colonización, pero no se confirmó como factor independiente por análisis multivariante. Las urgencias hospitalarias serían marcadores en parte de infecciones del tracto respiratorio superior de etiología viral y estas se han asociado previamente con mayores tasas de colonización neumocócica4. Es posible que el presente estudio carezca de potencia estadística suficiente para detectar esta asociación.
No hubo asociación entre el hábito tabáquico en alguno de los padres y el estado de portador neumocócico. La tasa de colonización por serotipos vacunales fue significativamente más elevada en niños con hábito tabáquico en alguno de los padres en el análisis bivariante, pero no en el modelo multivariante. No descartamos que al tratarse de una cuestión sensible existan sesgos de información. En un reciente metaanálisis, se encontró una asociación positiva entre exposición pasiva al tabaco y estado de portador neumocócico (OR: 1,66; IC 95%: 1,33-2,07)21. Serían de utilidad, aunque de difícil realización estudios de alta calidad metodológica que determinaran de forma adecuada la intensidad de exposición pasiva al tabaco por medio de la determinación de los niveles de cotinina, lo que obviaría las inexactitudes en la recogida de la información.
Se registraron tasas de portadores muy similares en los niños con independencia del estado de inmunización frente al neumococo, en consonancia con los resultados de estudios de vigilancia postcomercialización, que han mostrado la falta de impacto de la vacuna conjugada sobre la prevalencia total de colonización4,9,14,19.
La prevalencia global de colonización por serotipos vacunales fue de un 20%. Esta fue significativamente menor entre los niños inmunizados, en concordancia con los estudios sobre efectividad vacunal4,9,14,19. La tasa de colonización por serotipos vacunales en los niños no inmunizados en nuestra investigación fue tan solo de un 30%, muy inferior a la de estudios en poblaciones similares sin impacto vacunal y menor incluso que la tasa global de colonización del 36% registrada en un estudio realizado en Massachussets al año del inicio de la comercialización de VCN7 y con coberturas vacunales del 71% en niños < 2 años4,22,23. Este hallazgo sugiere que pese a las tasas parciales de vacunación, existe una menor circulación de los serotipos vacunales entre la la población no inmunizada y sería evidencia indirecta de un potencial efecto rebaño vacunal en nuestra población24.
La proporción de resistencias a la penicilina registradas en la población del estudio es muy inferior a las comunicadas en las series históricas nacionales en la época más reciente sin impacto vacunal y similar a la de estudios tras introducción de VCN725. En el caso del S. pneumoniae se ha encontrado una relación significativa entre el uso de antibióticos y las resistencias26. En la presente investigación se observó un riesgo incrementado tras la utilización reciente de antibióticos para portar neumococos resistentes a amoxicilina, pero no para los neumococos con sensibilidad disminuida a la penicilina. Estos hallazgos se podrían explicar por el efecto diferencial de los distintos antibióticos sobre la población de neumococos en función de los niveles de sensibilidad a la penicilina26. El estado vacunal no influyó en el riesgo para portar cepas resistentes. Los resultados de estudios similares son contradictorios4,9. Las discrepancias pueden explicarse porque factores como la tasa de resistencias entre las cepas no vacunales, la diseminación clonal de cepas resistentes y la presión antibiótica pueden modular el impacto de VCN7 sobre resistencias antibióticas, y también, por la existencia de un efecto dilucional en los estudios de vigilancia epidemiológica postcomercialización debido la menor circulación de los serotipos vacunales en población no inmunizada27.
Esta investigación tiene varias limitaciones. En primer lugar, los sujetos estudiados no tienen por qué ser del todo representativos de la población local, por la no aleatorización previa de los centros ni de los sujetos participantes. Este tipo de limitación es común a los estudios de colonización NP, que son logísticamente complejos. La selección de los centros participantes representó el espectro socioeconómico de la ciudad y se han limitado los sesgos derivados del mayor grado de hacinamiento registrado en estudios realizados en guarderías o colegios28. En segundo lugar, la información sobre las variables analizadas se recogió en una proporción significativa de casos a partir del recuerdo verbal de los padres. En tercer lugar, no se obtuvieron de forma sistemática los datos de las dosis y duración de la antibioterapia previa que tienen un impacto significativo en el riesgo de portar neumococos resistentes29. Finalmente, no se evaluaron las colonizaciones múltiples, por su mayor complejidad técnica, lo que de haberse llevado a cabo, podría haber modificado el sentido de alguno de los resultados del estudio30. En resumen, nuestra investigación ha encontrado que existe una circulación reducida de serotipos vacunales neumocócicos, incluso entre población no inmunizada, con coberturas vacunales parciales. Factores dependientes de edad y hacinamiento incrementaron el riesgo de portar neumococos y la utilización de antibioterapia ejerció un efecto dual, disminuyó la posibilidad de colonización y entre los colonizados favoreció la posibilidad de portar neumococos con resistencia a la amoxicilina, antibiótico de elección en la terapia ambulatoria de las infecciones por este germen. Este tipo de estudios es fundamental para una mejor comprensión de los cambios epidemiológicos en una población tan dinámica como son los neumococos colonizantes de la NF en la población pediátrica.
FinanciaciónEste proyecto ha sido financiado por el Fondo de Investigaciones sanitarias (PI050924).
Conflicto de interesesIgnacio Obando y Asunción Fenoll han recibido honorarios de Pfizer por conferencias y reuniones de asesoramiento y de GlaxoSmithKline por conferencias. El resto de los autores declaran no tener ningún conflicto de intereses.