La introducción de las vacunas conjugadas antineumocócicas ha supuesto un cambio en la epidemiología de la enfermedad neumocócica invasiva (ENI). El objetivo de nuestro estudio ha sido describir la evolución de la ENI en la Comunidad Valenciana durante el periodo 2007-2012.
Material y métodosEstudio descriptivo longitudinal retrospectivo de ENI en la Comunidad Valenciana durante el periodo 2007-2012. Las fuentes de información utilizadas han sido el sistema de Análisis de la Vigilancia Epidemiológica (AVE) y la Red Microbiológica Valenciana (RedMIVA) de la Conselleria de Sanitat.
ResultadosLa incidencia de ENI ha disminuido entre 2007 y 2012 en todos los grupos de edad, mayoritariamente en menores de 5años, pasando de 30,5 a 12,3 casos por 105 habitantes (p<0,001). La neumonía constituye la principal forma de presentación de la enfermedad, con disminución de sus cifras de 6,9 a 4,1 casos por 105 (p<0,001). Se ha observado una reducción progresiva no significativa de la proporción de casos por serotipos contenidos en la vacuna heptavalente (PCV7), principalmente en menores de 5años, del 26 al 12% (p=0,23). Los casos por serotipos adicionales de la vacuna conjugada 13-valente (1, 3, 5, 6A, 7F y 19A) también muestran tendencia descendente, principalmente en menores de 5años vacunados (52,6% vs 14,3%; p=0,03), mientras que se incrementa significativamente la proporción de casos por serotipos no vacunales, del 42,3 al 56,7% en población general (p=0,002), y del 47,4 al 78,6% en menores de 5años vacunados (p=0,08).
ConclusionesLos resultados de este estudio muestran una reducción de la incidencia de ENI, con disminución de la proporción de casos producidos por serotipos vacunales e incremento de la proporción de los no vacunales. La vigilancia epidemiológica resulta necesaria para monitorizar la evolución de la enfermedad.
The introduction of conjugated anti-pneumonia vaccines has led to a change in the epidemiology of Invasive Pneumococcal Disease (IPD). The aim of this study is to describe the trends in IPD in the Community of Valencia during the period 2007-2012.
Material and methodsA retrospective, descriptive and longitudinal study was conducted on IPD in the Community of Valencia during the period 2007-2012, The information sources used were the Epidemiological Surveillance Analysis (Análisis de la Vigilancia Epidemiológica (AVE)) and the Valencian Microbiology Network (Red Microbiológica Valenciana (RedMIVA)) of the Valencia Health Department.
ResultsThe incidence of IPD decreased between 2007 and 2012 in all age groups, mainly in the under 5 year-olds, dropping from 30.5 cases to 12.3 cases per 105 inhabitants (p< .001). Pneumonia was the principal presentation of the disease, with a decrease in its rates from 6.9 to 4.1 cases per 105 inhabitants (p< .001). A gradual, non-significant, reduction from 26% to 12% (p=.23) was observed in the proportion of cases due to the serotypes contained in the heptavalent vaccine (PCV7), mainly in the under 5 year-olds. The cases due to additional serotypes in 13-valent conjugated vaccine (1, 3, 5, 6A, 7F and 19A) also showed a decreasing trend, mainly in vaccinated under 5 year-olds (52.6% vs 14.3%; p=.03), while the cases due to non-vaccine serotypes significantly increased from 42.3% to 56.7% in the general population (p=.002), and from 47.4% to 78.6% in vaccinated under 5 year-olds (p=.08).
ConclusionsThe results of this study show a reduction in the incidence of IPD, with a decrease in the proportion of cases produced by vaccine serotypes, and an increase in the proportion of those not vaccinated. Epidemiological Surveillance is necessary to monitor the trends in the disease.
El neumococo es un patógeno casi exclusivamente humano, causante de un gran número de infecciones y procesos invasivos que resultan más frecuentes en adultos mayores de 65años, niños menores de 5años y personas inmunodeprimidas o con determinadas patologías crónicas1.
Su patogenicidad depende de la fagocitosis y del potencial de estimular inflamación y lesión de tejidos, todo dado por su cápsula, compuesta por polisacáridos con capacidad antigénica. En función de las diferencias antigénicas del polisacárido capsular pueden distinguirse más de 90 serotipos diferentes, cuya distribución es heterogénea, experimentando variaciones temporales en una misma área geográfica.
La enfermedad neumocócica invasiva (ENI) representa la forma más grave de esta patología y depende del área geográfica y de los serotipos prevalentes, de la estacionalidad, de la edad de los sujetos, de la comorbilidad y del estado de vacunación previo1.
Desde la comercialización de las vacunas conjugadas, la epidemiología de la ENI ha experimentado grandes cambios, con disminución de la incidencia en la mayoría de las zonas que incorporaron las vacunas en sus calendarios de vacunación, con repercusión en todos los grupos de edad, principalmente en los menores de 2años2,3. Sin embargo, paralelamente a la reducción de las tasas se ha producido un cambio en la distribución de serotipos causantes de la enfermedad4-6 y en el patrón de resistencias7.
En España, la vacuna conjugada 13-valente (PCV13) reemplazó a la heptavalente (PCV7) en junio de 2010, e inicialmente fue aprobada para su uso en lactantes y niños pequeños de hasta 5años8. Fue ampliada por la Agencia Europea del Medicamento (EMA) en octubre del 2011 a adultos de 50años o más con determinadas patologías o condiciones de riesgo9. Desde entonces, algunas comunidades autónomas y sociedades científicas del país han actualizado sus recomendaciones, y recientemente, en julio de 2013, la EMA ha ampliado de nuevo la indicación a cualquier adulto de 18años o más con determinadas condiciones que favorecen la ENI10.
En la Comunidad Valenciana, hasta la fecha, no está incluida en el calendario de vacunación infantil y su uso se restringe a determinados grupos de riesgo, a efectos de prescripción y dispensación para su financiación pública, quedando la vacunación de los demás niños sujeta a las recomendaciones realizadas por los pediatras y sin financiación.
Aunque en España la ENI no es una enfermedad de declaración obligatoria, en los últimos años diversas comunidades autónomas la han incluido en sus sistemas de vigilancia. Tal es el caso de la Comunidad Valenciana, que desde 2007 realiza la vigilancia de la enfermedad mediante notificación de todos los casos confirmados a través del sistema del Análisis de la Vigilancia Epidemiológica (AVE)11 y la Red Microbiológica Valenciana (RedMIVA)12.
El objetivo de nuestro estudio es cuantificar la incidencia de ENI y estimar su evolución en nuestro entorno, así como describir la evolución de los serotipos circulantes.
MetodologíaEstudio descriptivo longitudinal retrospectivo de la incidencia de ENI en la Comunidad Valenciana durante el periodo 2007-2012.
Los casos y sus datos proceden de los registros de ENI notificados al sistema AVE desde 3 fuentes: los sistemas de información ambulatoria, los servicios de medicina preventiva hospitalarios y la RedMIVA, que incorpora al AVE, en tiempo real, los resultados de las pruebas microbiológicas de los hospitales de la Comunidad Valenciana.
Se definió como caso, para su inclusión en el registro, el aislamiento de Streptococcus pneumoniae o la detección de ácido nucleico o del antígeno en una localización habitualmente estéril como sangre, líquido cefalorraquídeo, líquido sinovial, exudado pleural o líquido pericárdico. En función de la localización del aislamiento y de la clínica asociada, se establecen las diferentes formas clínicas de presentación de la enfermedad: neumonía, meningitis, peritonitis, endocarditis, artritis y pericarditis. En los pacientes con aislamiento de Streptococcus pneumoniae en sangre sin foco infeccioso y acompañados de otros síntomas o signos (fiebre superior a 38°C, taquicardia, taquipnea y leucocitosis con desviación izquierda de la fórmula leucocitaria) la forma clínica queda definida como bacteriemia sin foco. De igual forma, la presencia de Streptococcus pneumoniae en sangre durante un tiempo limitado sin sintomatología o con pico febril aislado se ha considerado como bacteriemia oculta.
Cada uno de los laboratorios de microbiología adscritos a la RedMIVA decide el procedimiento bacteriológico de detección, aunque los métodos utilizados suelen estar sujetos a las mismas normas de interpretación.
El serotipado de Streptococcus pneumoniae se realizó mediante la prueba de la cápsula de Neufeld en el Servicio de Microbiología del Hospital la Fe de Valencia o en el Centro Nacional de Microbiología.
El estado vacunal de los casos fue contrastado mediante la consulta del Registro Nominal de Vacunas. Se han considerado casos vacunados, aunque no protegidos, aquellas personas que han recibido al menos una dosis de vacuna de cualquier tipo.
Se analizaron las características etarias de los casos, la forma clínica de presentación, la evolución, el ingreso hospitalario, la patología previa, el estado vacunal y el serotipo causante. Las variables cualitativas se describieron mediante frecuencias absolutas y relativas, y las cuantitativas, mediante media y desviación típica (DT).
Se calcularon las tasas de incidencia anuales, según grupos de edad y según la forma clínica. La población de referencia utilizada como denominador de estas tasas se extrajo de los datos del padrón que proporciona el Instituto Valenciano de Estadística.
Las desproporciones de las frecuencias comparadas fueron contrastadas mediante la prueba χ2 de Pearson o test exacto de Fisher para las variables cualitativas, y la prueba t de Student para las variables cuantitativas.
La tendencia temporal de la incidencia se ha valorado mediante el test χ2 de tendencia lineal, mientras que para la comparación de las tasas se ha utilizado el estadístico z.
Se consideraron significativos los valores de p<0,05. Se calcularon los intervalos de confianza al 95%
El análisis estadístico de los datos se ha realizado mediante los programas SPSS v15.0 para Windows y Epidat 3.1.
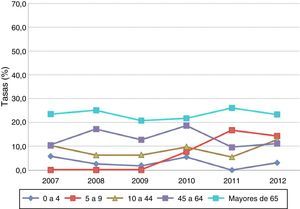
ResultadosEn los 6años de vigilancia de la ENI en la Comunidad Valenciana (2007-2012) se notificaron 3.024 casos, el 91,96% (2.781) confirmados por aislamiento, el 6,85% (207) por PCR, y únicamente el 1,19% de los casos (36) se confirmaron por detección de antígenos en líquido estéril. Un primer análisis descriptivo mostró que el 59,3% de los casos corresponden a varones. El grupo de edad que concentró la mayor proporción de casos fue el de mayores de 65años (42,7%). La neumonía fue la forma clínica de presentación más frecuente, con 1.706 casos (56,4%), seguida de la bacteriemia sin foco conocido, con 548 (18,1%), meningitis, con 332 (10,98%), y las bacteriemias ocultas, con 177 casos (5,85%). El 35,9% de los casos no presentaron ninguna enfermedad de base, mientras que 245 sujetos (8,1%) refirieron 3 o más patologías. La mayoría (92,1%) de los sujetos precisaron ingreso hospitalario con estancia media de 12,6días (DT: 14,59), y la letalidad global fue del 15,5%.
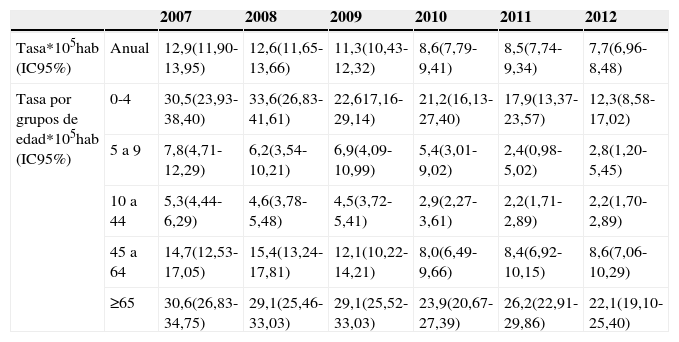
La incidencia de ENI mostró una tendencia descendente durante todo el periodo, pasando de 12,9 casos por 105 habitantes en 2007 a 7,7 en 2012 (test de tendencia lineal, p<0,001) (tabla 1).
Evolución de la tasa de incidencia de ENI, total y por grupos de edad. Periodo 2007-2012
| 2007 | 2008 | 2009 | 2010 | 2011 | 2012 | ||
|---|---|---|---|---|---|---|---|
| Tasa*105hab (IC95%) | Anual | 12,9(11,90-13,95) | 12,6(11,65-13,66) | 11,3(10,43-12,32) | 8,6(7,79-9,41) | 8,5(7,74-9,34) | 7,7(6,96-8,48) |
| Tasa por grupos de edad*105hab (IC95%) | 0-4 | 30,5(23,93-38,40) | 33,6(26,83-41,61) | 22,617,16-29,14) | 21,2(16,13-27,40) | 17,9(13,37-23,57) | 12,3(8,58-17,02) |
| 5 a 9 | 7,8(4,71-12,29) | 6,2(3,54-10,21) | 6,9(4,09-10,99) | 5,4(3,01-9,02) | 2,4(0,98-5,02) | 2,8(1,20-5,45) | |
| 10 a 44 | 5,3(4,44-6,29) | 4,6(3,78-5,48) | 4,5(3,72-5,41) | 2,9(2,27-3,61) | 2,2(1,71-2,89) | 2,2(1,70-2,89) | |
| 45 a 64 | 14,7(12,53-17,05) | 15,4(13,24-17,81) | 12,1(10,22-14,21) | 8,0(6,49-9,66) | 8,4(6,92-10,15) | 8,6(7,06-10,29) | |
| ≥65 | 30,6(26,83-34,75) | 29,1(25,46-33,03) | 29,1(25,52-33,03) | 23,9(20,67-27,39) | 26,2(22,91-29,86) | 22,1(19,10-25,40) |
Las tasas por edad disminuyeron en todos los grupos, siendo la reducción más marcada en los niños menores de 5años, que pasaron de 30,5 a 12,3 casos por 105 habitantes (test de tendencia lineal, p<0,001) (tabla 1).
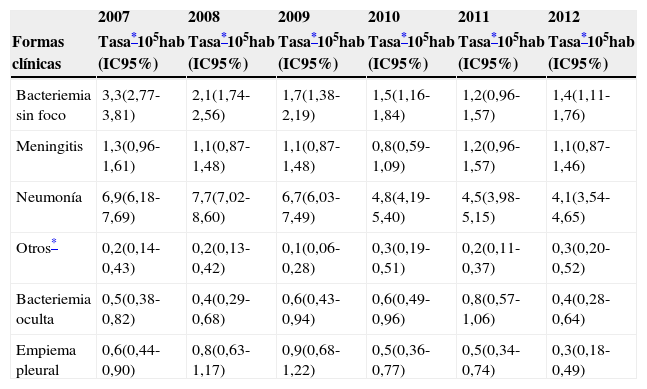
La evolución de las tasas según la forma clínica mostró estabilización de todos los cuadros a excepción de la bacteriemia sin foco y la neumonía, que experimentaron un descenso durante los años del estudio (3,3 a 1,4 por 105 para bacteriemia sin foco, test de tendencia lineal p<0,001; y 6,9 a 4,1 por 105 para la neumonía, test de tendencia lineal p<0,001) (tabla 2).
Evolución de las tasas de ENI según forma clínica
| 2007 | 2008 | 2009 | 2010 | 2011 | 2012 | |
|---|---|---|---|---|---|---|
| Formas clínicas | Tasa*105hab (IC95%) | Tasa*105hab (IC95%) | Tasa*105hab (IC95%) | Tasa*105hab (IC95%) | Tasa*105hab (IC95%) | Tasa*105hab (IC95%) |
| Bacteriemia sin foco | 3,3(2,77-3,81) | 2,1(1,74-2,56) | 1,7(1,38-2,19) | 1,5(1,16-1,84) | 1,2(0,96-1,57) | 1,4(1,11-1,76) |
| Meningitis | 1,3(0,96-1,61) | 1,1(0,87-1,48) | 1,1(0,87-1,48) | 0,8(0,59-1,09) | 1,2(0,96-1,57) | 1,1(0,87-1,46) |
| Neumonía | 6,9(6,18-7,69) | 7,7(7,02-8,60) | 6,7(6,03-7,49) | 4,8(4,19-5,40) | 4,5(3,98-5,15) | 4,1(3,54-4,65) |
| Otros* | 0,2(0,14-0,43) | 0,2(0,13-0,42) | 0,1(0,06-0,28) | 0,3(0,19-0,51) | 0,2(0,11-0,37) | 0,3(0,20-0,52) |
| Bacteriemia oculta | 0,5(0,38-0,82) | 0,4(0,29-0,68) | 0,6(0,43-0,94) | 0,6(0,49-0,96) | 0,8(0,57-1,06) | 0,4(0,28-0,64) |
| Empiema pleural | 0,6(0,44-0,90) | 0,8(0,63-1,17) | 0,9(0,68-1,22) | 0,5(0,36-0,77) | 0,5(0,34-0,74) | 0,3(0,18-0,49) |
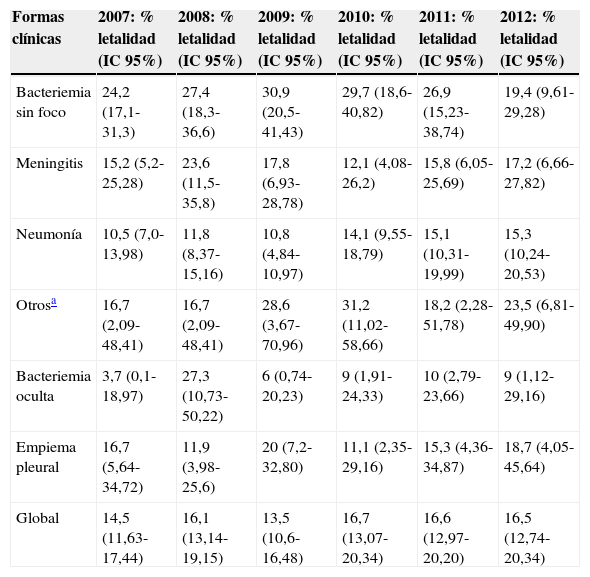
La letalidad global se mantuvo relativamente estable durante todo el periodo (test de tendencia lineal p=0,35) (tabla 3).
Evolución de la letalidad por ENI. Tasas globales y según forma clínica
| Formas clínicas | 2007: % letalidad (IC95%) | 2008: % letalidad (IC95%) | 2009: % letalidad (IC95%) | 2010: % letalidad (IC95%) | 2011: % letalidad (IC95%) | 2012: % letalidad (IC95%) |
|---|---|---|---|---|---|---|
| Bacteriemia sin foco | 24,2 (17,1-31,3) | 27,4 (18,3-36,6) | 30,9 (20,5-41,43) | 29,7 (18,6-40,82) | 26,9 (15,23-38,74) | 19,4 (9,61-29,28) |
| Meningitis | 15,2 (5,2-25,28) | 23,6 (11,5-35,8) | 17,8 (6,93-28,78) | 12,1 (4,08-26,2) | 15,8 (6,05-25,69) | 17,2 (6,66-27,82) |
| Neumonía | 10,5 (7,0-13,98) | 11,8 (8,37-15,16) | 10,8 (4,84-10,97) | 14,1 (9,55-18,79) | 15,1 (10,31-19,99) | 15,3 (10,24-20,53) |
| Otrosa | 16,7 (2,09-48,41) | 16,7 (2,09-48,41) | 28,6 (3,67-70,96) | 31,2 (11,02-58,66) | 18,2 (2,28-51,78) | 23,5 (6,81-49,90) |
| Bacteriemia oculta | 3,7 (0,1-18,97) | 27,3 (10,73-50,22) | 6 (0,74-20,23) | 9 (1,91-24,33) | 10 (2,79-23,66) | 9 (1,12-29,16) |
| Empiema pleural | 16,7 (5,64-34,72) | 11,9 (3,98-25,6) | 20 (7,2-32,80) | 11,1 (2,35-29,16) | 15,3 (4,36-34,87) | 18,7 (4,05-45,64) |
| Global | 14,5 (11,63-17,44) | 16,1 (13,14-19,15) | 13,5 (10,6-16,48) | 16,7 (13,07-20,34) | 16,6 (12,97-20,20) | 16,5 (12,74-20,34) |
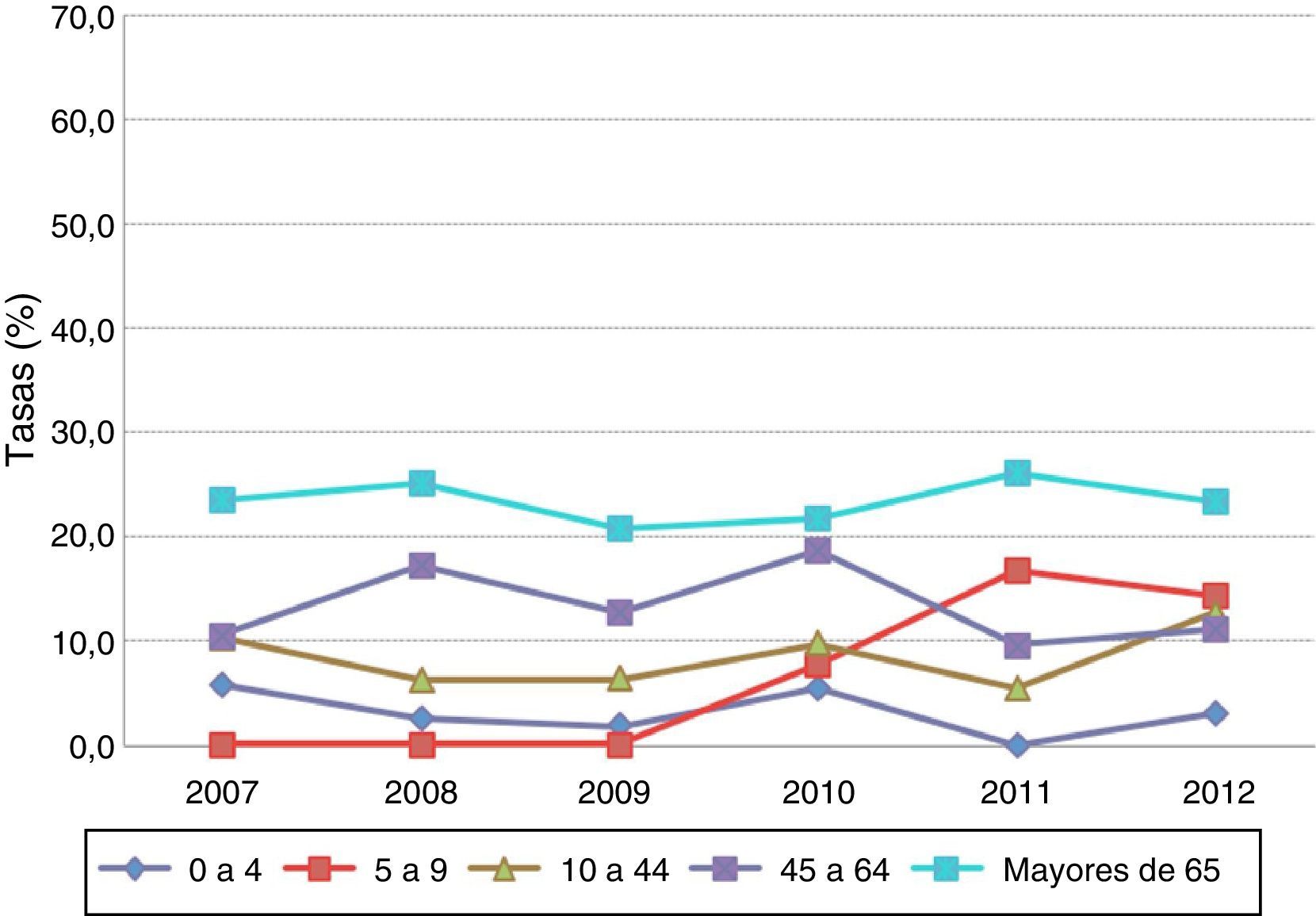
Por grupos de edad, las tasas de letalidad más elevadas correspondieron a los mayores de 65años con cifras superiores al 20% en todo el periodo (fig. 1).
La bacteriemia sin foco y la meningitis fueron las formas clínicas con mayores tasas de letalidad (27,3 y 17,1%, respectivamente). La evolución de la letalidad en la bacteriemia sin foco se incrementó hasta el año 2009, y posteriormente descendió hasta 2012, mientras que la letalidad por meningitis mostró cierta variabilidad durante todo el periodo (tabla 3).
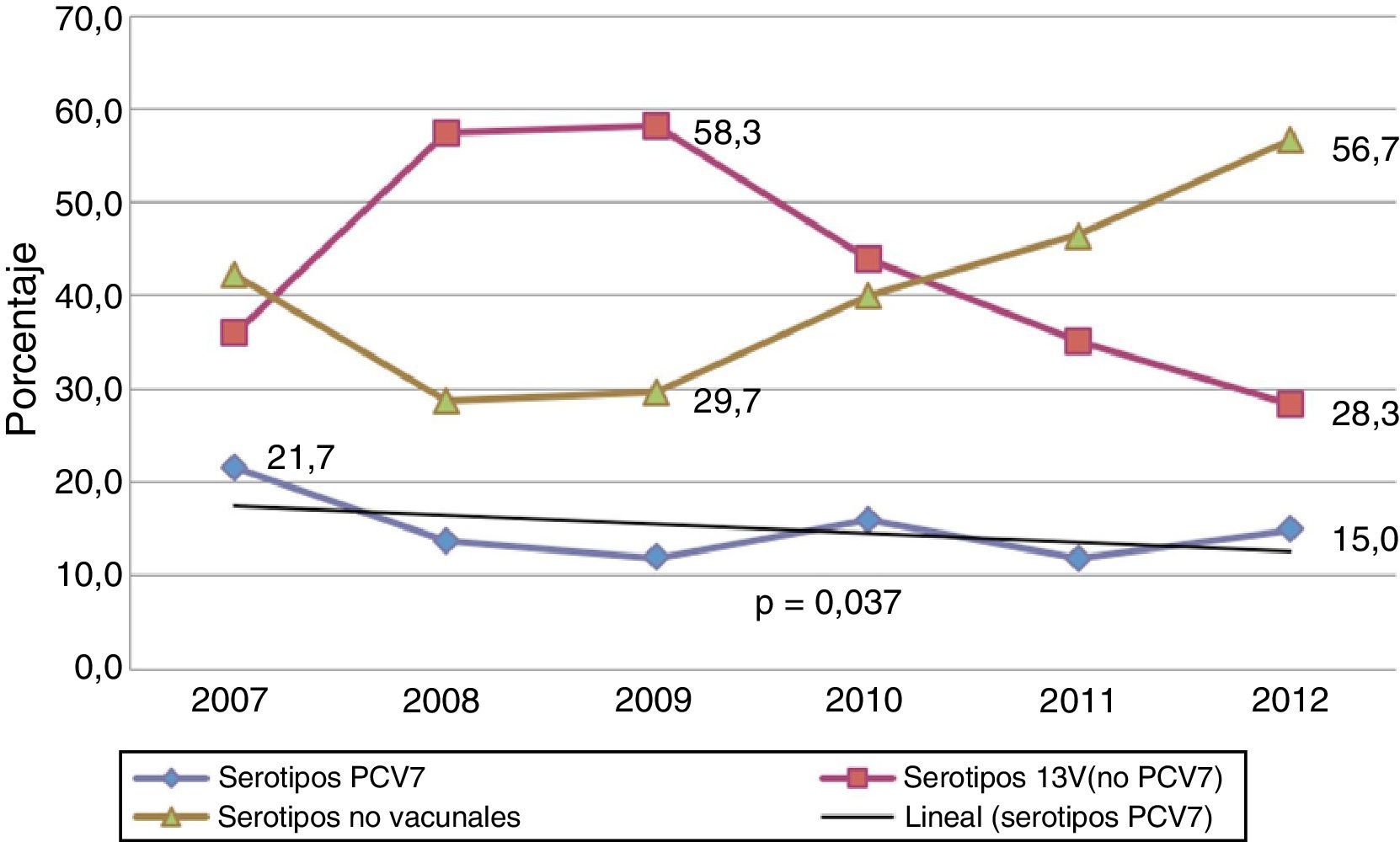
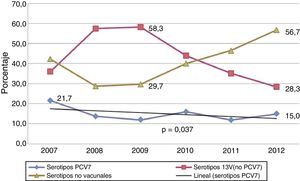
Durante los años de estudio la proporción de cepas serotipadas se incrementó progresivamente, pasando del 61% de 2007 (369 cepas serotipadas de 605 casos) al 74,5% en 2012 (293 cepas de 393 casos). De todos los aislamientos, el 15,2% correspondieron a serotipos incluidos en la vacuna PCV7, y el 60% están incluidos en la PCV13. Los serotipos PCV7 descendieron del 21,7 al 15% (p=0,037) en los 6años del estudio, mientras que los serotipos adicionales de la PCV13 (1, 3, 5, 6A, 7F y 19A), tras un ascenso durante los 3 primeros años, experimentaron una reducción significativa desde 2009 (58,3% vs 28,3%; p<0,001) (fig. 2). Los serotipos no vacunales muestran una tendencia opuesta a la de los serotipos adicionales de la PCV13 desde 2009 a 2012, incrementándose de forma significativa desde el 29,7 al 56,7% (p<0,001).
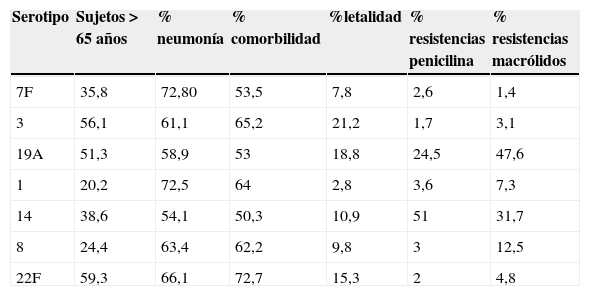
El serotipo 7F fue el más frecuente, con 232 aislamientos (12,5% de las cepas serotipadas), seguido del serotipo 3 (10,3%), el 19A (10,2%), el 1 (9,2%) y el 14 (7,1%). Las proporciones de casos por estos 5 serotipos descendieron a lo largo del periodo, con diferencias entre ellos; así, el serotipo7F experimentó un ascenso en los primeros años, con reducción acusada a partir de 2009 (test de tendencia lineal p=0,59), mientras que el serotipo14 mostró una tendencia opuesta, registrando un mayor descenso al inicio, para aumentar tras 2009 (test de tendencia lineal p=0,41). Los serotipos19A y 1 son los que experimentaron una disminución más pronunciada (test de tendencia lineal p<0,001 para ambos).
Estos serotipos fueron más frecuentes en los mayores de 65años, y menos frecuentes en el grupo de 5 a 9años, con la única excepción del serotipo1, que afectó mayoritariamente al grupo de edad de 10 a 44años (28,1%). Más de la mitad de los casos originados por estos serotipos se presentaron en forma de neumonía. El serotipo1 se presentó en el 9% de los casos como empiema pleural, y el serotipo3 fue el que tuvo la tasa de letalidad más elevada, con el 21,2% de defunciones (tabla 4).
Características de los serotipos predominantes
| Serotipo | Sujetos >65años | % neumonía | % comorbilidad | %letalidad | % resistencias penicilina | % resistencias macrólidos |
|---|---|---|---|---|---|---|
| 7F | 35,8 | 72,80 | 53,5 | 7,8 | 2,6 | 1,4 |
| 3 | 56,1 | 61,1 | 65,2 | 21,2 | 1,7 | 3,1 |
| 19A | 51,3 | 58,9 | 53 | 18,8 | 24,5 | 47,6 |
| 1 | 20,2 | 72,5 | 64 | 2,8 | 3,6 | 7,3 |
| 14 | 38,6 | 54,1 | 50,3 | 10,9 | 51 | 31,7 |
| 8 | 24,4 | 63,4 | 62,2 | 9,8 | 3 | 12,5 |
| 22F | 59,3 | 66,1 | 72,7 | 15,3 | 2 | 4,8 |
Se aislaron 31 serotipos no vacunales diferentes. Entre ellos, los más frecuentes fueron el serotipo8, que acumuló el 10,6%, y el 22F, que supuso el 7,6% de los mismos. El serotipo8 aumentó de forma significativa en 2012, pasando del 2,1% en 2007 al 7,2% en 2012 (p=0,007). El 42,7% de los casos por este serotipo afectaron a adultos entre 45 y 64años. Por lo que se refiere al serotipo 22F, este pasó de representar el 3,8% de los casos en 2009 al 6,8% en 2012 (p=0,13), y el 59,3% de los casos ocurrieron en mayores de 65años. La tasa de letalidad de estos 2 serotipos fue del 9,7 y del 15,2%, respectivamente. Ambos serotipos se presentaron principalmente en pacientes con alguna patología previa (62,2% en el 8 y 72,7% en el 22F).
Los menores de 5años acumularon un total de 340 casos, lo que supuso el 11,24% de ENI durante los años del estudio (tabla 1).
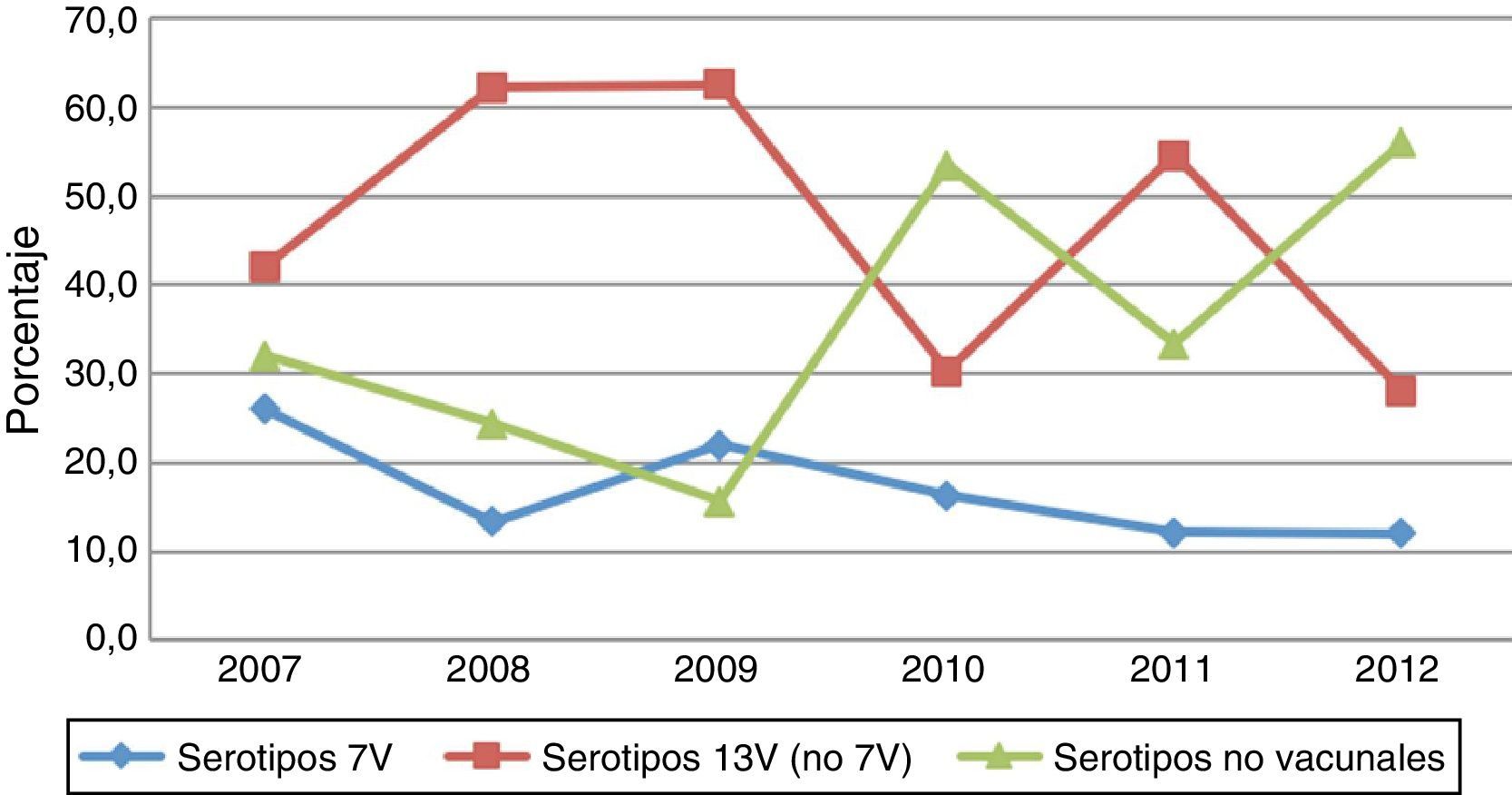
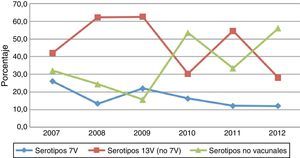
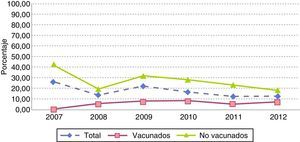
Los serotipos de la vacuna PCV7 en este grupo de edad presentaron cifras inferiores a las de los demás serotipos, con un descenso no significativo a lo largo del periodo: de 13 casos en 2007 (26%) a 3 en 2012 (12%) (p=0,27) (fig. 3). Aunque no se apreciaron diferencias significativas según el estado vacunal, el peso de estos serotipos fue superior en no vacunados, evolucionando desde el 41,9% en 2007 (13casos) al 18,2% en 2012 (2casos), mientras que en sujetos vacunados (con al menos una dosis de vacuna) representaron menos del 10% durante los 6años del estudio: únicamente 6 casos en el período de estudio, con 3 sujetos parcialmente vacunados con 1, 2 o 3 dosis de vacuna y 3 sujetos con 4 dosis de vacuna (1 con 4 dosis de PCV7 y 2 sujetos con pautas mixtas PCV7 y PCV13 o PCV10) (fig. 4).
De igual forma, el número de aislamientos por los serotipos adicionales 1, 3, 5, 6A, 7F y 19A contenidos en la PCV13 mostró un comportamiento descendente, pasando de 21 casos en 2007 (42%) a 8 en 2012 (32%) (p=0,56) (fig. 3); sin embargo, la evolución de estos serotipos fue diferente según el estado vacunal de los sujetos. Durante los primeros años del estudio la proporción de aislamientos en vacunados fue superior a la de los no vacunados, diferencia que se hizo más notoria en 2009 (84,6% vs 47,4%; p=0,07); a partir de 2010 esta tendencia se invirtió, observándose una reducción no significativa del 60,3% en vacunados entre 2010 y 2012 (36% vs 14.3%, p=0,28), mientras que los sujetos no vacunados experimentaron un incremento no significativo entre estos años (22,2% vs 54,5%; p=0,27).
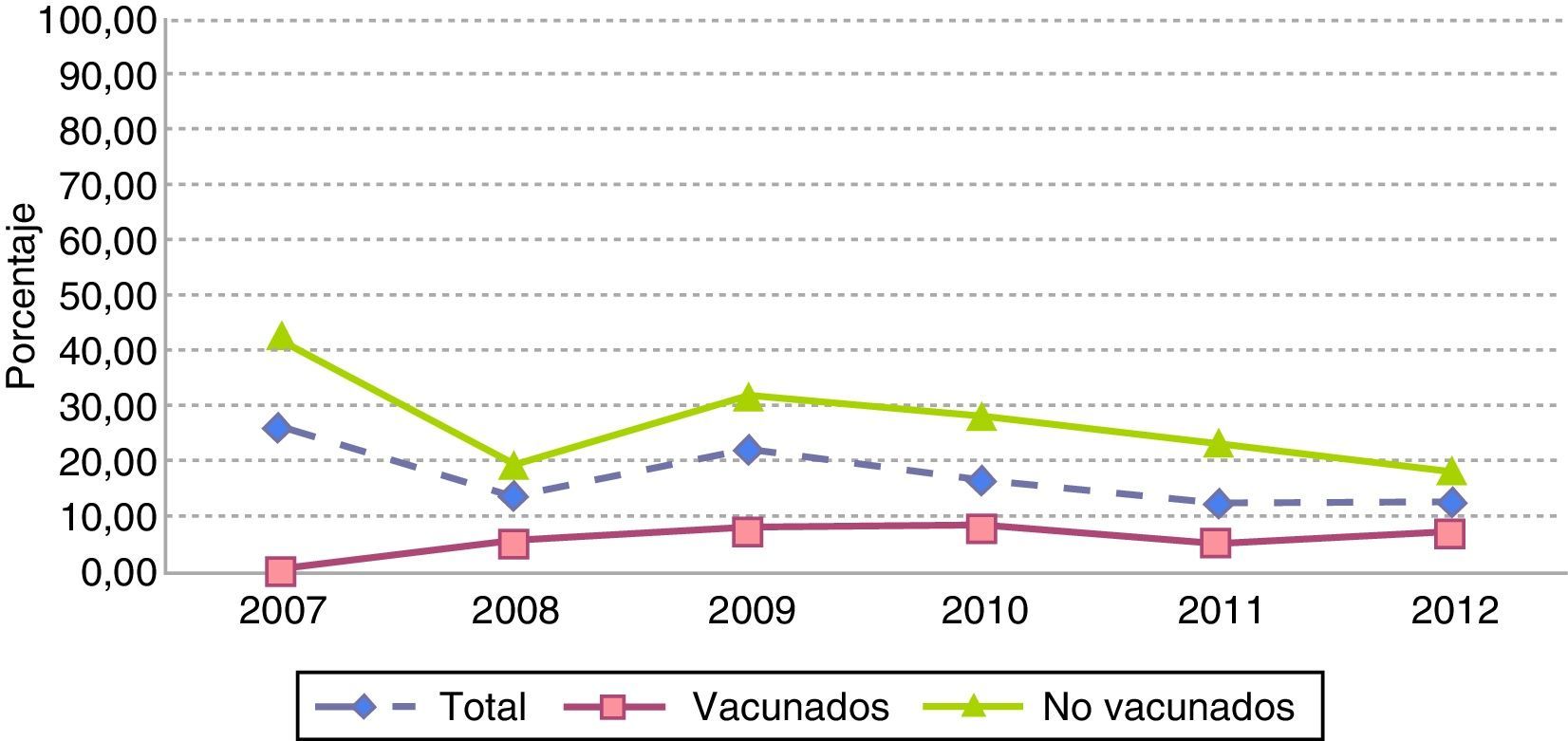
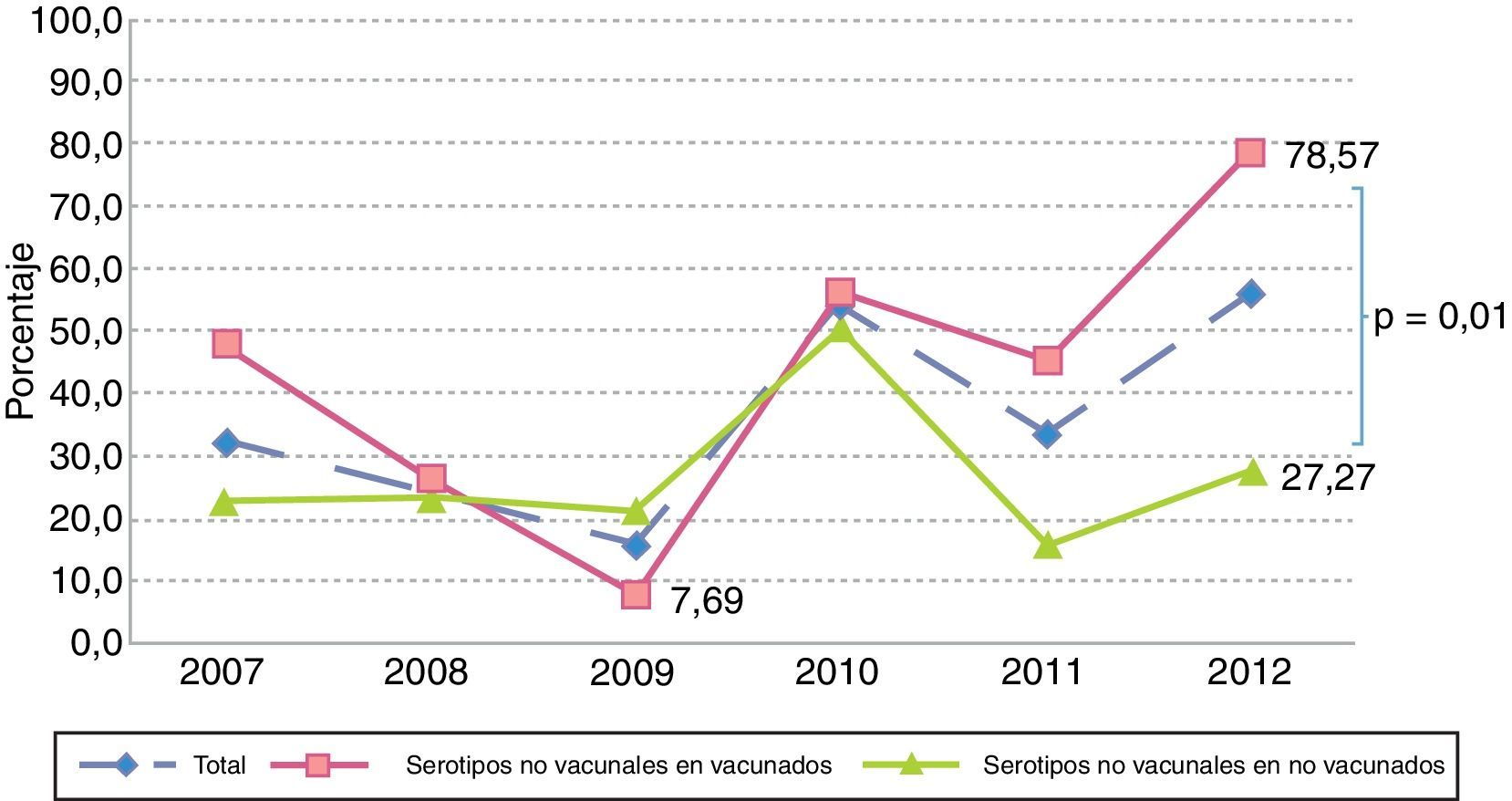
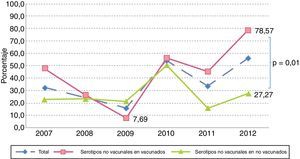
Simultáneamente a este proceso, pudimos observar que aunque no existieron variaciones en el número de aislamientos por serotipos no vacunales (16 en 2007, 14 en 2012), se apreció un incremento significativo de la proporción de casos por estos serotipos en vacunados entre 2009 y 2012 (7,7% vs 78,6%; p<0,001), mientras que en no vacunados permanecieron relativamente estables durante todo el periodo, divergiendo ambos grupos desde 2010, con diferencias significativas en 2012 (78,6% vs 27,2%, p=0,01) (fig. 5).
DiscusiónLos datos de nuestro estudio muestran la evolución de ENI en la Comunidad Valenciana 6años después de la introducción de la vacuna PCV7 y objetivan una disminución progresiva de la incidencia, de forma similar a lo referido en diferentes estudios3,4, cuantificando en un 40% esta reducción global durante el periodo de estudio.
Los datos de incidencia a nivel nacional muestran diferencias entre las comunidades autónomas. Así, en Castilla y León las tasas registradas durante el periodo 2007-2011 son inferiores a las nuestras y muestran tendencia ascendente hasta el año 2010, que alcanza los 6,6 casos, para caer en 2011 a 4,8 casos por 105 habitantes13. Por el contrario, en Cataluña entre 2007 y 2009 las tasas anuales superaron los 18 casos por 105 habitantes, con tasas muy superiores a las nuestras en los menores de 5años14.
A nivel internacional, según el European Centre for Disease Prevention and Control (ECDC) la incidencia de ENI global en Europa en 2010 fue de 5,2 casos por 105 habitantes, con amplia variabilidad entre los países, con 9,6 casos por 105 habitantes para los menores de 5años y 14,4 para los mayores de 65años15.
Probablemente, las diferencias encontradas entre todas las series se deban a diferencias en cuanto a estructura poblacional, sistemas de vigilancia empleados, coberturas vacunales alcanzadas y técnicas diagnósticas microbiológicas empleadas. A este respecto, cabe destacar que en la Comunidad Valenciana la exhaustividad y la precisión diagnóstica que proporcionan los sistemas AVE y RedMIVA en la vigilancia epidemiológica nos permiten tener datos objetivos de la incidencia de la ENI en nuestro entorno.
El descenso de las tasas, aunque es más notorio en los menores de 5años, es común a todos los grupos de edad, lo que sugiere el impacto de la protección inmunitaria de grupo que ofrece la vacunación16, tanto en niños como en adultos no vacunados, y que se explica porque al disminuir la colonización nasofaríngea en los sujetos vacunados se reduce la transmisión de los serotipos vacunales a la población17.
La neumonía es la forma clínica predominante en nuestra población, con tasas de incidencia en torno a 6 casos por 105 habitantes, con descenso progresivo desde el 2008. Estos datos difieren de las cifras de otros estudios realizados en nuestro entorno; así, en Andalucía las tasas entre 2007 y 2011 rondaron los 2 casos por 105, descendiendo a 1,8 por 105 en 201113, mientras que en Madrid, en 2011, los casos de enfermedad neumocócica que requirieron ingreso hospitalario mostraron tasas de neumonía más elevadas, con 26,1 casos por 105 habitantes18. La bacteriemia sin foco y la meningitis son las formas clínicas que siguen en frecuencia a la neumonía, apreciándose un descenso de las tasas por bacteriemia sin foco, mientras que la meningitis permanece estable. En otros estudios realizados, como el de Madrid, se reflejan tasas de 1,1 por 105 para septicemia neumocócica y 0,5 para meningitis.
La letalidad se mantiene en torno al 15% durante el periodo de estudio, siendo esta cifra algo mayor a las referidas en otras comunidades autónomas, con 13% en Andalucía entre 2007-2010, aunque en 2011 muestra un incremento de hasta el 20%13, y del 11,1% de letalidad media en Madrid para el periodo 2007-200918. Todos los estudios coinciden en que las tasas de letalidad más elevadas corresponden a los mayores de 65años, siendo las meningitis y las sepsis las que acumulan mayor proporción de fallecimientos. Los datos disponibles para el año 2011 en Andalucía muestran una letalidad por sepsis del 17,9%, del 18,4% para la meningitis y del 10% para la neumonía neumocócica. En nuestro estudio la letalidad por bacteriemia sin foco se encuentra en torno al 25-30% según años, y por meningitis alrededor del 15-20%, seguidas por la neumonía, con un 10-15% de letalidad.
La distribución por serotipos nos ha permitido comprobar un descenso de la proporción de casos originados por serotipos vacunales, mientras se incrementan de forma significativa los no vacunales. Este cambio en la distribución de serotipos se ha objetivado en numerosos estudios a nivel mundial, y en algunas zonas han originado un incremento posterior de ENI19,20, contrariamente a lo reflejado en nuestra serie. Este fenómeno de reemplazo ha sido interpretado como efecto de la introducción de la PCV7 en los calendarios de vacunación, y se ha reflejado en todos los grupos de edad. En Navarra se objetivó un descenso del 65% en las tasas de ENI por serotipos vacunales y un incremento del 40% en los serotipos no vacunales21. En otro estudio realizado a mayores de 65años durante el periodo 2007-2009 se comprobó una reducción del 59% en serotipos vacunales con respecto a 1999-2000 y un incremento de 55% en la proporción de los serotipos adicionales de la PCV1322. Sin embargo, existen autores que defienden que no se debe exclusivamente al efecto vacunal, sino que intervienen cambios cíclicos y naturales de los serotipos y otros factores, entre los que debemos mencionar la terapia antiinfecciosa y las resistencias antibióticas17.
En nuestra serie, en los menores de 5años, población diana de las vacunas conjugadas, los datos muestran que, efectivamente, los casos de ENI por serotipos PCV7, tras 12 años de inicio de la vacunación, son escasos, tanto en pacientes vacunados —demostrando una protección directa— como en no vacunados, por la protección de grupo, aunque estos últimos acumulan mayor proporción de casos.
En los primeros años del estudio, y de forma coincidente con las demás series17,23, los principales serotipos responsables de ENI en nuestro territorio fueron el 19A, el 7F y el 1, todos ellos serotipos incluidos en la PCV13. El serotipo 19A fue el principal responsable de enfermedad neumocócica en Estados Unidos durante el periodo post-PCV76, mientras que en España un estudio reciente ha mostrado un incremento del 504% de aislamientos por este serotipo en menores de 16años entre 2001-2005 y 2006-200924.
Tras la introducción de la PCV13 en el 2010, la proporción de casos por los serotipos adicionales de esta vacuna ha descendido considerablemente, mientras que se han incrementado otros serotipos no vacunales, sobre todo en sujetos vacunados, y entre los que destacamos el 8 y el 22F, cuyo incremento se ha objetivado en otros estudios realizados en la era post-PCV716,25,26.
En el estudio de Picazo et al.27 se ha apreciado un descenso de la incidencia global de ENI tras la introducción de la PCV13, sobre todo causado por el descenso de los serotipos 1, 19A y 5. Indican que no existe un temprano reemplazo de serotipos, como sí ocurrió con la introducción de la PCV7, ya que la incidencia de ENI causada por serotipos no vacunales se ha mantenido estable con aislamiento de 15 serogrupos diferentes en 34 casos.
Aunque parece precipitado extraer conclusiones, tras tan solo 2años de vacunación con PCV13 parece verosímil considerar que en los próximos años podríamos asistir a un nuevo reemplazo de serotipos motivado por la implantación de esta vacuna, de forma similar a lo ocurrido tras la introducción de la PCV7. Los sistemas de vigilancia resultan imprescindibles para poder identificar nuevos cambios en la epidemiología de la enfermedad que requieran optimizar las estrategias de control.
LimitacionesLa principal limitación de nuestro estudio radica en la falta de serotipificación de todas las cepas, por lo que no podemos calcular la incidencia de la enfermedad por serotipo. Además, la serotipificación se ha realizado sin aleatorización.
Al tratarse de una muestra relativamente pequeña, el tamaño alcanzado en algunas de las variables estudiadas resulta insuficiente, y puede ser el motivo de que ciertas comparaciones no resulten significativas y de que las distribuciones muestren grandes variaciones.
Añadido a esto, debemos destacar que, al tratarse de una vacuna no incluida en los calendarios de vacunación sistemática, carecemos de datos directos de cobertura vacunal en nuestro entorno, lo que nos impide valorar el impacto real que la vacunación ha podido ejercer en la población.
Por último, debemos mencionar que aunque el Registro Nominal de Vacunas permite incluir las vacunas administradas a nivel privado, no siempre se registran, lo que puede condicionar los resultados. Sin embargo, la encuesta epidemiológica recoge la información sobre el estado de vacunación que comunican los sujetos.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.