Dalbavancina (DBV) es un nuevo lipoglucopéptido con eficacia frente a grampositivos, cuyo uso está aprobado para el tratamiento de las infecciones de piel y partes blandas. Su farmacocinética lineal permite un amplio intervalo entre dosis. Constituye una prometedora alternativa como terapia antibiótica en pacientes con infección cardiovascular por cocos grampositivos.
Material y métodosEstudio retrospectivo de pacientes con infección cardiovascular (bacteriemia, infección de dispositivos de estimulación cardiaca o endocarditis infecciosa [EI]) que recibieron tratamiento con DBV en el Hospital Clínico San Carlos de Madrid durante 7 años (2016-2022). Se dividió a los pacientes en 2 grupos de estudio: 1) EI, y 2) bacteriemia. Se analizaron variables epidemiológicas, clínicas, microbiológicas y de tratamiento.
ResultadosUn total de 25 pacientes recibieron tratamiento con DBV por un episodio de infección cardiovascular. La EI fue la indicación más frecuente (68%), seguida de la bacteriemia (32%), con un predominio de varones en ambos grupos (64 vs. 62%) y una edad media de 67,7 y 57,5 años, respectivamente. El 100% de los aislamientos en hemocultivos fue por cocos grampositivos (Staphylococcus spp., Streptococcus spp. o Enterococcus spp.) en ambos grupos de estudio. Previamente a DBV, todos los pacientes recibieron antibioterapia parenteral tanto en el grupo de EI (media: 80 días) como en el de bacteriemia (media: 14,8 días). El motivo principal para la administración de DBV fue la continuación de tratamiento antibiótico intravenoso fuera del hospital tanto en el grupo de EI (n=15) como en el de bacteriemia (n=8). En todos los casos, DBV se utilizó como terapia de consolidación, en tratamiento semanal o quincenal. Se documentó curación clínica y microbiológica en el 84% de los casos (n=21), 76,4% en el grupo de EI y 100% en el de bacteriemia. No se documentó ningún efecto adverso asociado a la administración de DBV.
ConclusiónDBV es un antibiótico eficaz y seguro como terapia de consolidación en el tratamiento de la EI y de la bacteriemia producida por microorganismos grampositivos.
Dalbavancin (DBV), a novel lipoglycopeptide with activity against Gram-positive bacterial infections, is approved for the treatment of acute bacterial skin and skin structure infections. It has linear dose-related pharmacokinetics allowing a prolonged interval between doses. It would be a good option for the treatment of patients with Gram-positive cardiovascular infections.
Material and methodsRetrospective analysis of patients with cardiovascular infection (bacteremia, implantable electronic device infection and infective endocarditis [IE]) treated with DBV at Hospital Clínico San Carlos (Madrid) for 7 years (2016-2022). Patients were divided into 2 study groups: 1) IE, and 2) bacteremia. Epidemiological, clinical, microbiological and therapeutic data were analyzed.
ResultsA total of 25 patients were treated with DBV for cardiovascular infection. IE was the most common indication (68%), followed by bacteremia (32%) with male predominance in both groups (64 vs. 62%) and median age of 67,7 and 57,5 years, respectively. Hundred percent of blood cultures were positive to Gram-positive microorganisms (Staphylococcus spp., Streptococcus spp. or Enterococcus spp.) in both study groups. Previously to DBV, all patients received other antibiotic therapy, both in the group of IE (median: 80 days) as in bacteremia (14,8 days). The main reason for the administration of DBV was to continue intravenous antimicrobial therapy outside the hospital in both the EI group (n=15) and the bacteremia group (n=8). DBV was used as consolidation therapy in a once- or twice-weekly regimen. Microbiological and clinical successes were reached in 84% of cases (n=21), 76,4% in IE group and 100% in bacteremia group. No patient documented adverse effects during long-term DBV treatment.
ConclusionDBV is an effective and safety treatment as consolidation antibiotic therapy in IE and bacteremia produced by Gram-positive microorganisms.
La endocarditis infecciosa (EI) es una enfermedad grave que se asocia a una elevada morbimortalidad, siendo responsable en la actualidad de 65.000 muertes por año1. Su incidencia ha aumentado a lo largo del tiempo, así como la ocurrencia de cambios significativos en el perfil clínico y microbiológico de los episodios1–4. Con respecto a los microorganismos causantes de EI, los estafilococos constituyen el género más frecuentemente implicado y, en particular, Staphylococcus aureus es el microorganismo más frecuente en España. La piedra angular del tratamiento de la EI es la antibioterapia, la cual debe administrarse de forma intravenosa y durante un tiempo prolongado (4-6 semanas)5, siendo necesaria en ocasiones la intervención quirúrgica de recambio valvular, dada la agresividad de la enfermedad y las complicaciones de la misma.
Por otra parte, la bacteriemia causada por cocos grampositivos constituye una de las infecciones nosocomiales más frecuentes, incrementando la morbimortalidad de los pacientes hospitalizados entre un 12 y un 25%6.
Dalbavancina (DBV) es un nuevo antibiótico lipoglucopéptido aprobado por la agencia estadounidense Food and Drug Administration en 2014 y la Agencia Europea del Medicamento en 2015 para el tratamiento de las infecciones de piel y partes blandas (IPPB)7,8. Este antibiótico presenta eficacia probada in vitro frente a múltiples microorganismos grampositivos, incluyendo estafilococos resistentes a meticilina y cepas con sensibilidad intermedia a la vancomicina, estreptococos del grupo viridans, estreptococos beta-hemolíticos, Streptococcus pneumoniae, enterococos, así como cocos y bacilos grampositivos anaerobios. DBV presenta una concentración mínima inhibitoria de 0,06mg/L contra estafilococos coagulasa negativos y 16 veces menor contra estreptococos beta-hemolíticos que vancomicina9. DBV presenta una farmacocinética lineal en relación con la dosis administrada, con una semivida de eliminación de 346h, lo cual permite un amplio intervalo entre dosis, de hasta 2 semanas, dependiendo de la dosis administrada10,11. Constituye, por tanto, una prometedora alternativa como terapia de consolidación en pacientes con EI por cocos grampositivos en fase estable.
El objetivo del presente estudio es describir el perfil clínico y microbiológico de los pacientes que han recibido DBV como tratamiento de infección cardiovascular, sus resultados clínicos y su seguridad.
Material y métodosSe trata de un estudio retrospectivo, observacional y unicéntrico en el que se incluyeron aquellos pacientes mayores de 18 años del Hospital Clínico San Carlos de Madrid tratados con DBV entre el 1 de enero de 2016 y el 27 de septiembre de 2022, y que requirieron ingreso hospitalario. El Hospital Clínico San Carlos es un centro de tercer nivel de titularidad púbica administrado por el Servicio Madrileño de Salud. Es, además, centro de referencia para la formación sanitaria de la Universidad Complutense de Madrid.
De este grupo, se seleccionaron aquellos pacientes que recibieron tratamiento con al menos una dosis de DBV por un episodio documentado de infección cardiovascular.
Posteriormente, se procedió a dividir a los pacientes en 2 grandes grupos diagnósticos: 1) EI (válvula nativa, válvula protésica, asociada a dispositivo o prótesis endovascular), y 2) bacteriemia (primaria o asociada a catéter).
El diagnóstico de EI se realizó según los criterios de la Sociedad Europea de Cardiología de 20155, y el diagnóstico de EI asociada a dispositivo según los criterios del documento de consenso de la Asociación Europea del Ritmo Cardiaco de 202012. La infección de prótesis endovascular se definió con criterios clínicos, imagen diagnóstica radiológica compatible (TC) y aislamiento microbiológico en muestras de sangre y/o aspirado percutáneo o material protésico explantado13.
La bacteriemia se definió como la presencia de al menos 2 hemocultivos positivos para el mismo microorganismo en ausencia de EI, y la bacteriemia asociada a catéter cuando se documentó el mismo microorganismo en el cultivo de la punta de este6,14.
Las características epidemiológicas, clínicas y microbiológicas se recogieron a partir de la revisión de historias clínicas de los pacientes.
La curación clínica se definió como la ausencia de síntomas o signos de infección en probable relación con la enfermedad que llevó al tratamiento con DBV, y la curación microbiológica como la ausencia de crecimiento del mismo microorganismo en hemocultivos en los 6 meses posteriores al diagnóstico, una vez finalizado el tratamiento.
Se definió el fracaso terapéutico como la falta de respuesta a la antibioterapia administrada, bien por la persistencia de clínica asociada a EI (insuficiencia cardiaca, disfunción valvular y/o imagen de vegetación>10mm o presencia de embolismos sistémicos), bien por bacteriemia persistente a pesar de antibioterapia parenteral adecuada.
Se definió la reinfección como la presencia de un nuevo episodio de EI o bacteriemia causados por el mismo microorganismo que ocasionó el episodio inicial después de los 6 meses posteriores al diagnóstico.
El seguimiento clínico y microbiológico de los pacientes se realizó en el área de consultas externas de nuestro centro tras el alta hospitalaria, una vez finalizado el tratamiento antibiótico.
El estudio fue aprobado por el Comité Ético del Hospital Clínico San Carlos de Madrid (código: 23/057-E) y cumplió los preceptos éticos establecidos en la Declaración de Helsinki.
Análisis estadísticoLas variables continuas con distribución normal se describieron como media y desviación estándar (DE) o mediana y rango intercuartílico. Las variables categóricas se presentaron como número absoluto y porcentaje. El análisis se llevó a cabo mediante el programa estadístico SPSS® 23.0 (SPSS Inc., Chicago, IL, EE. UU.).
ResultadosDescripción de la poblaciónEntre 2016 y 2022, 59 pacientes de nuestro centro fueron tratados con DBV, en 25 (42,3%) de los cuales se documentó infección cardiovascular, constituyendo este nuestro grupo de estudio. En el resto de los casos (57,7%) la administración de DBV fue por: infección osteoarticular (osteomielitis, artritis séptica) (40,6%) y/o IPPB (17,1%).
El 64% fueron varones con una edad media de 64,4 años (rango: 40-89 años) y una media de índice de Charlson de 4,5 (rango: 0-14). El 44% eran portadores de prótesis endovascular (prótesis valvular cardiaca, marcapasos o endoprótesis vascular). La EI fue la indicación más frecuente (68%), seguida de la bacteriemia asociada a catéter (24%). El 100% de los aislamientos en hemocultivos fue por cocos grampositivos.
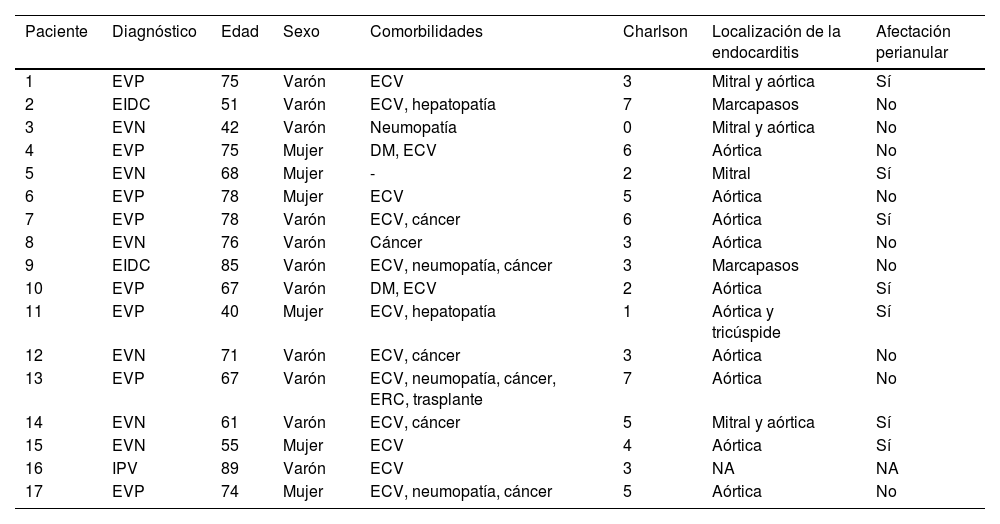
Pacientes con endocarditis infecciosaSe documentaron un total de 17 casos de EI, de los cuales 6 fueron sobre válvula nativa y 8 sobre válvula protésica. Se registraron 2 casos de EI asociada a dispositivo y una infección de prótesis endovascular. El 64,7% fueron varones y la edad media fue de 67,7 años (rango: 40-89 años; DE 14,32), siendo el 70% mayores de 65 años. Las comorbilidades más habituales fueron, por orden de frecuencia: enfermedad cardiovascular (82%), neoplasia de órgano sólido (41%), enfermedad respiratoria (23%) y diabetes mellitus (11,7%). La media del índice de Charlson fue de 3,8 (DE 1,97). Las principales características clínicas y epidemiológicas de los pacientes con EI tratados con DBV se muestran en la tabla 1.
Características clínicas y epidemiológicas de los pacientes con endocarditis infecciosa tratados con dalbavancina
| Paciente | Diagnóstico | Edad | Sexo | Comorbilidades | Charlson | Localización de la endocarditis | Afectación perianular |
|---|---|---|---|---|---|---|---|
| 1 | EVP | 75 | Varón | ECV | 3 | Mitral y aórtica | Sí |
| 2 | EIDC | 51 | Varón | ECV, hepatopatía | 7 | Marcapasos | No |
| 3 | EVN | 42 | Varón | Neumopatía | 0 | Mitral y aórtica | No |
| 4 | EVP | 75 | Mujer | DM, ECV | 6 | Aórtica | No |
| 5 | EVN | 68 | Mujer | - | 2 | Mitral | Sí |
| 6 | EVP | 78 | Mujer | ECV | 5 | Aórtica | No |
| 7 | EVP | 78 | Varón | ECV, cáncer | 6 | Aórtica | Sí |
| 8 | EVN | 76 | Varón | Cáncer | 3 | Aórtica | No |
| 9 | EIDC | 85 | Varón | ECV, neumopatía, cáncer | 3 | Marcapasos | No |
| 10 | EVP | 67 | Varón | DM, ECV | 2 | Aórtica | Sí |
| 11 | EVP | 40 | Mujer | ECV, hepatopatía | 1 | Aórtica y tricúspide | Sí |
| 12 | EVN | 71 | Varón | ECV, cáncer | 3 | Aórtica | No |
| 13 | EVP | 67 | Varón | ECV, neumopatía, cáncer, ERC, trasplante | 7 | Aórtica | No |
| 14 | EVN | 61 | Varón | ECV, cáncer | 5 | Mitral y aórtica | Sí |
| 15 | EVN | 55 | Mujer | ECV | 4 | Aórtica | Sí |
| 16 | IPV | 89 | Varón | ECV | 3 | NA | NA |
| 17 | EVP | 74 | Mujer | ECV, neumopatía, cáncer | 5 | Aórtica | No |
DM: diabetes mellitus; ECV: enfermedad cardiovascular; EIDC: endocarditis infecciosa asociada a dispositivo cardiaco; ERC: enfermedad renal crónica; EVN: endocarditis sobre válvula nativa; EVP: endocarditis sobre válvula protésica; IPV: infección de prótesis vascular; NA: no aplica.
Los microorganismos más frecuentes por orden de frecuencia dentro del grupo de EI fueron: Staphylococcus coagulasa negativos (35%), S. aureus sensibles a meticilina (17%), Enterococcus faecalis (17%) y estreptococos del grupo viridans (17%). En un caso se documentó bacteriemia por S. aureus resistente a meticilina.
Previamente a la administración de antibioterapia con DBV, todos los pacientes con EI recibieron tratamiento antibiótico parenteral solo o en combinación, con una duración media de 80 días (rango: 7-730 días; DE 164,62). Los antibióticos más frecuentemente utilizados fueron los beta-lactámicos, solos o en combinación (n=13), y la daptomicina, sola o en combinación (n=7). En 4 casos se asoció un aminoglucósido al tratamiento inicial con un beta-lactámico y en 2 casos se hizo terapia combinada con rifampicina.
La estancia media de ingreso hospitalario fue de 45 días (rango: 7-150 días; DE 34) para el grupo de EI. La cirugía de recambio valvular o extracción de dispositivo endovascular estuvo indicada en el 60% de los pacientes y fue realizada en el 48% de los casos. La estancia media hospitalaria en pacientes tratados quirúrgicamente fue de 35,4 días (rango: 7-91 días; DE 21,72).
Las dosis de DBV administradas fueron de: 500, 1.000 o 1.500mg, con una media de dosis de 3,47 (rango: 1-12 dosis; DE 3,23) y una duración total de 96 semanas (media 5,6; rango: 1-24 semanas; DE 5,57).
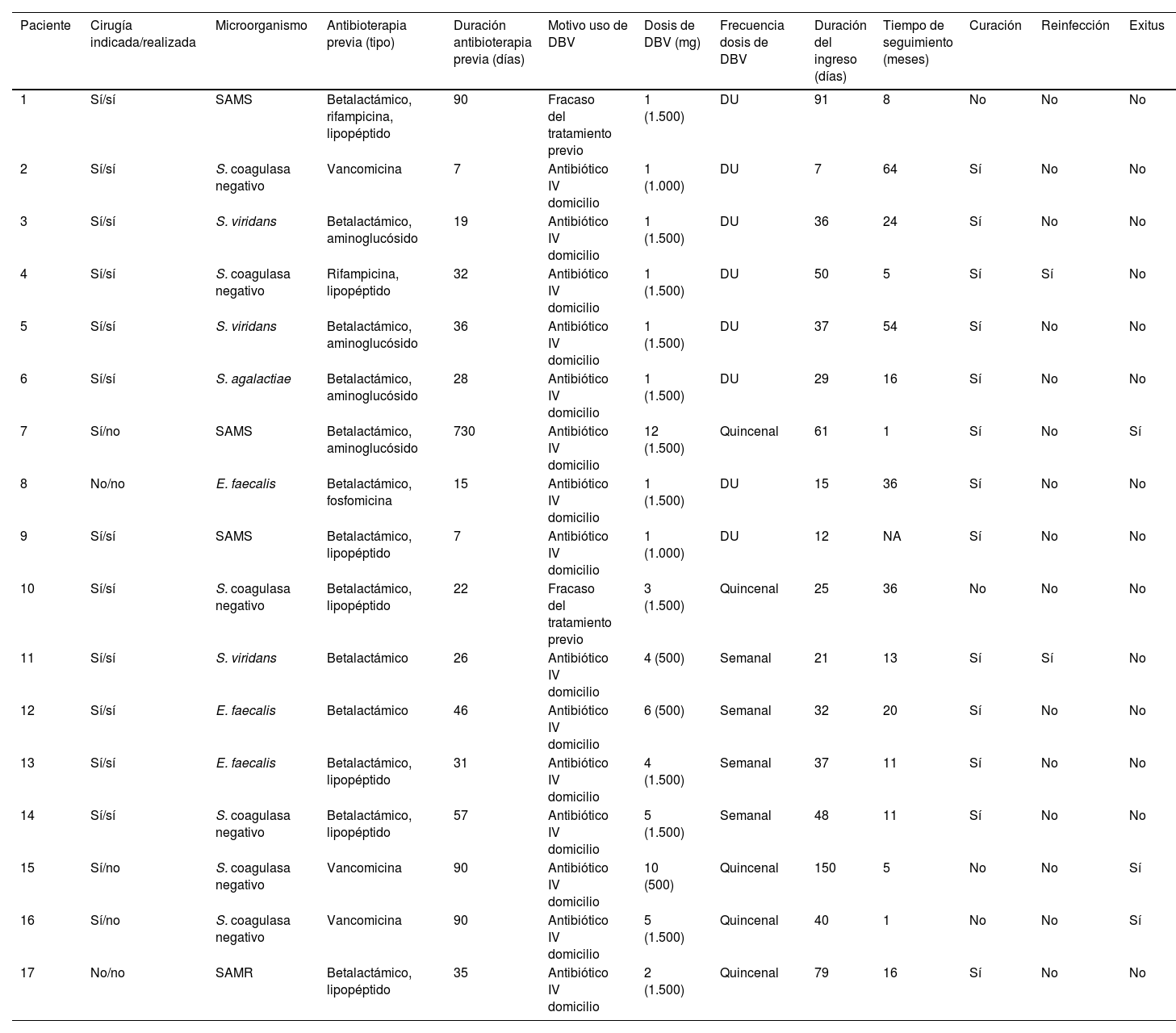
La duración de la antibioterapia con DBV, la dosis administrada y la periodicidad, así como la evolución clínica de los pacientes y el perfil microbiológico de los episodios de EI, se muestran en la tabla 2.
Tipo de tratamiento, evolución y perfil microbiológico de los pacientes con endocarditis infecciosa tratados con dalbavancina
| Paciente | Cirugía indicada/realizada | Microorganismo | Antibioterapia previa (tipo) | Duración antibioterapia previa (días) | Motivo uso de DBV | Dosis de DBV (mg) | Frecuencia dosis de DBV | Duración del ingreso (días) | Tiempo de seguimiento (meses) | Curación | Reinfección | Exitus |
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | Sí/sí | SAMS | Betalactámico, rifampicina, lipopéptido | 90 | Fracaso del tratamiento previo | 1 (1.500) | DU | 91 | 8 | No | No | No |
| 2 | Sí/sí | S. coagulasa negativo | Vancomicina | 7 | Antibiótico IV domicilio | 1 (1.000) | DU | 7 | 64 | Sí | No | No |
| 3 | Sí/sí | S. viridans | Betalactámico, aminoglucósido | 19 | Antibiótico IV domicilio | 1 (1.500) | DU | 36 | 24 | Sí | No | No |
| 4 | Sí/sí | S. coagulasa negativo | Rifampicina, lipopéptido | 32 | Antibiótico IV domicilio | 1 (1.500) | DU | 50 | 5 | Sí | Sí | No |
| 5 | Sí/sí | S. viridans | Betalactámico, aminoglucósido | 36 | Antibiótico IV domicilio | 1 (1.500) | DU | 37 | 54 | Sí | No | No |
| 6 | Sí/sí | S. agalactiae | Betalactámico, aminoglucósido | 28 | Antibiótico IV domicilio | 1 (1.500) | DU | 29 | 16 | Sí | No | No |
| 7 | Sí/no | SAMS | Betalactámico, aminoglucósido | 730 | Antibiótico IV domicilio | 12 (1.500) | Quincenal | 61 | 1 | Sí | No | Sí |
| 8 | No/no | E. faecalis | Betalactámico, fosfomicina | 15 | Antibiótico IV domicilio | 1 (1.500) | DU | 15 | 36 | Sí | No | No |
| 9 | Sí/sí | SAMS | Betalactámico, lipopéptido | 7 | Antibiótico IV domicilio | 1 (1.000) | DU | 12 | NA | Sí | No | No |
| 10 | Sí/sí | S. coagulasa negativo | Betalactámico, lipopéptido | 22 | Fracaso del tratamiento previo | 3 (1.500) | Quincenal | 25 | 36 | No | No | No |
| 11 | Sí/sí | S. viridans | Betalactámico | 26 | Antibiótico IV domicilio | 4 (500) | Semanal | 21 | 13 | Sí | Sí | No |
| 12 | Sí/sí | E. faecalis | Betalactámico | 46 | Antibiótico IV domicilio | 6 (500) | Semanal | 32 | 20 | Sí | No | No |
| 13 | Sí/sí | E. faecalis | Betalactámico, lipopéptido | 31 | Antibiótico IV domicilio | 4 (1.500) | Semanal | 37 | 11 | Sí | No | No |
| 14 | Sí/sí | S. coagulasa negativo | Betalactámico, lipopéptido | 57 | Antibiótico IV domicilio | 5 (1.500) | Semanal | 48 | 11 | Sí | No | No |
| 15 | Sí/no | S. coagulasa negativo | Vancomicina | 90 | Antibiótico IV domicilio | 10 (500) | Quincenal | 150 | 5 | No | No | Sí |
| 16 | Sí/no | S. coagulasa negativo | Vancomicina | 90 | Antibiótico IV domicilio | 5 (1.500) | Quincenal | 40 | 1 | No | No | Sí |
| 17 | No/no | SAMR | Betalactámico, lipopéptido | 35 | Antibiótico IV domicilio | 2 (1.500) | Quincenal | 79 | 16 | Sí | No | No |
DBV: dalbavancina; DU: dosis única; IV: intravenoso; NA: no aplica (seguimiento en otro centro); SAMR: Staphylococcus aureus resistente a meticilina; SAMS: Staphylococcus aureus sensible a meticilina.
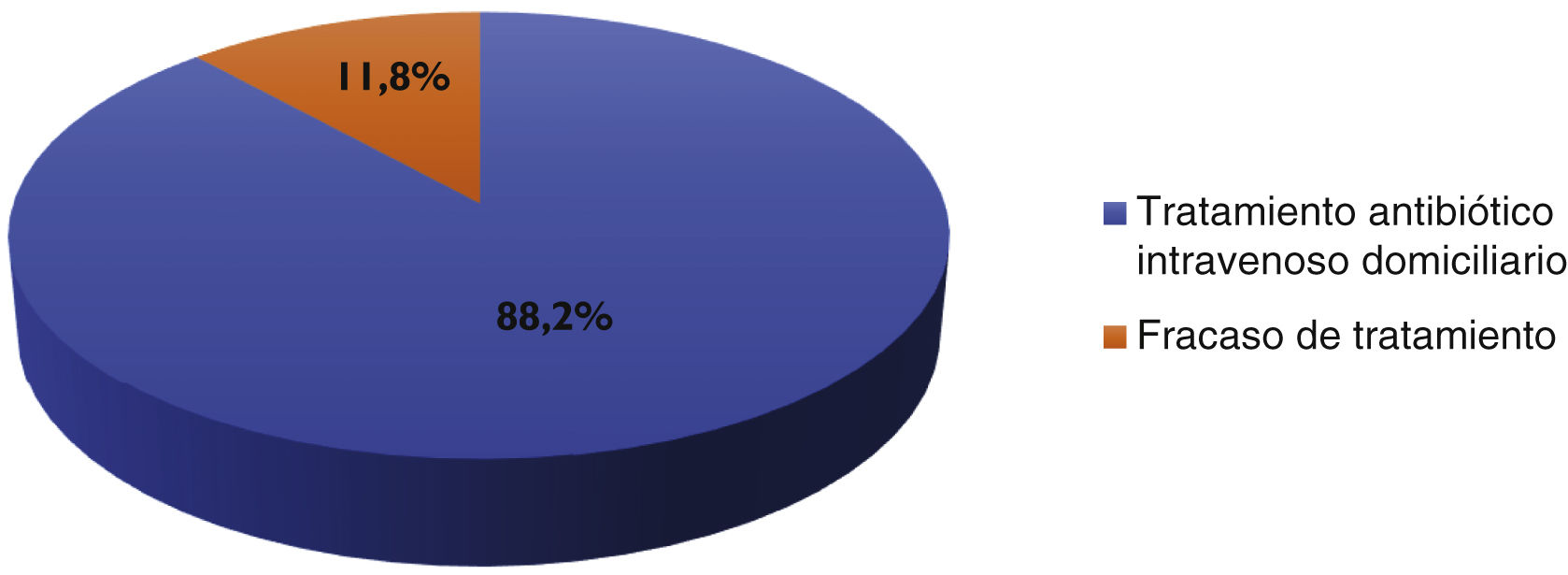
Los motivos para la administración de DBV en el grupo de EI fueron la continuación de tratamiento antibiótico intravenoso fuera del hospital (n=15) o el fracaso previo al tratamiento (n=2).
En todos los casos, DBV se administró el día del alta, bien como dosis única, bien como dosis inicial. Los resultados del motivo de uso de DBV se muestran en la fig. 1.
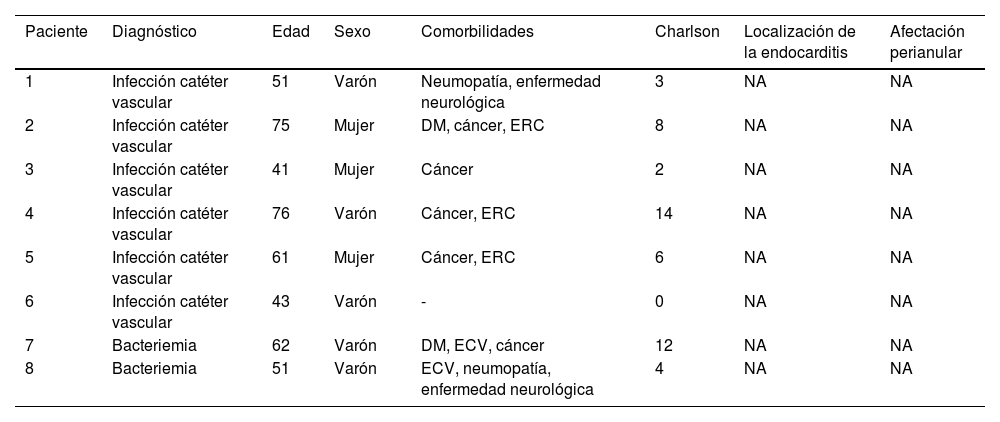
Pacientes con bacteriemiaDentro del grupo de pacientes con bacteriemia, se documentaron un total de 8 episodios, de los cuales 6 fueron bacteriemias asociadas a catéter y 2 bacteriemias primarias. El 62,5% fueron varones, con una edad media de 57,5 años (rango: 41-76 años; DE 12,48). Las comorbilidades más frecuentes fueron la neoplasia de órgano sólido (62%) y la enfermedad renal crónica (37,5%), con una media de índice de Charlson de 6,1 (DE 4,59). Las principales características clínicas y epidemiológicas de los pacientes con bacteriemia tratados con DBV se muestran en la tabla 3.
Características clínicas y epidemiológicas de los pacientes con bacteriemia tratados con dalbavancina
| Paciente | Diagnóstico | Edad | Sexo | Comorbilidades | Charlson | Localización de la endocarditis | Afectación perianular |
|---|---|---|---|---|---|---|---|
| 1 | Infección catéter vascular | 51 | Varón | Neumopatía, enfermedad neurológica | 3 | NA | NA |
| 2 | Infección catéter vascular | 75 | Mujer | DM, cáncer, ERC | 8 | NA | NA |
| 3 | Infección catéter vascular | 41 | Mujer | Cáncer | 2 | NA | NA |
| 4 | Infección catéter vascular | 76 | Varón | Cáncer, ERC | 14 | NA | NA |
| 5 | Infección catéter vascular | 61 | Mujer | Cáncer, ERC | 6 | NA | NA |
| 6 | Infección catéter vascular | 43 | Varón | - | 0 | NA | NA |
| 7 | Bacteriemia | 62 | Varón | DM, ECV, cáncer | 12 | NA | NA |
| 8 | Bacteriemia | 51 | Varón | ECV, neumopatía, enfermedad neurológica | 4 | NA | NA |
DM: diabetes mellitus; ECV: enfermedad cardiovascular; ERC: enfermedad renal crónica; NA: no aplica.
Los microorganismos más frecuentemente aislados fueron los Staphylococcus coagulasa negativos (62%), seguidos de S. aureus (25%). Se documentó una bacteriemia por S. aureus resistente a meticilina.
Previamente a la administración de antibioterapia con DBV, todos los pacientes con bacteriemia recibieron tratamiento antibiótico parenteral solo o en combinación, con una duración media de 14,8 días (rango: 5-35 días; DE 9,06). Los antibióticos más utilizados fueron los beta-lactámicos, solos o en combinación (n=7), y la daptomicina, sola o en combinación (n=6).
La estancia media de ingreso hospitalario fue de 22,6 días (rango: 7-41; DE 9,49) en el grupo de bacteriemias.
Las dosis de DBV administradas fueron de: 500, 1.000 o 1.500mg, con una media de dosis de 1,12 (rango: 1-2; DE 0,33) y una duración total de 16 semanas (media 2; rango: 1-4; DE 0,86).
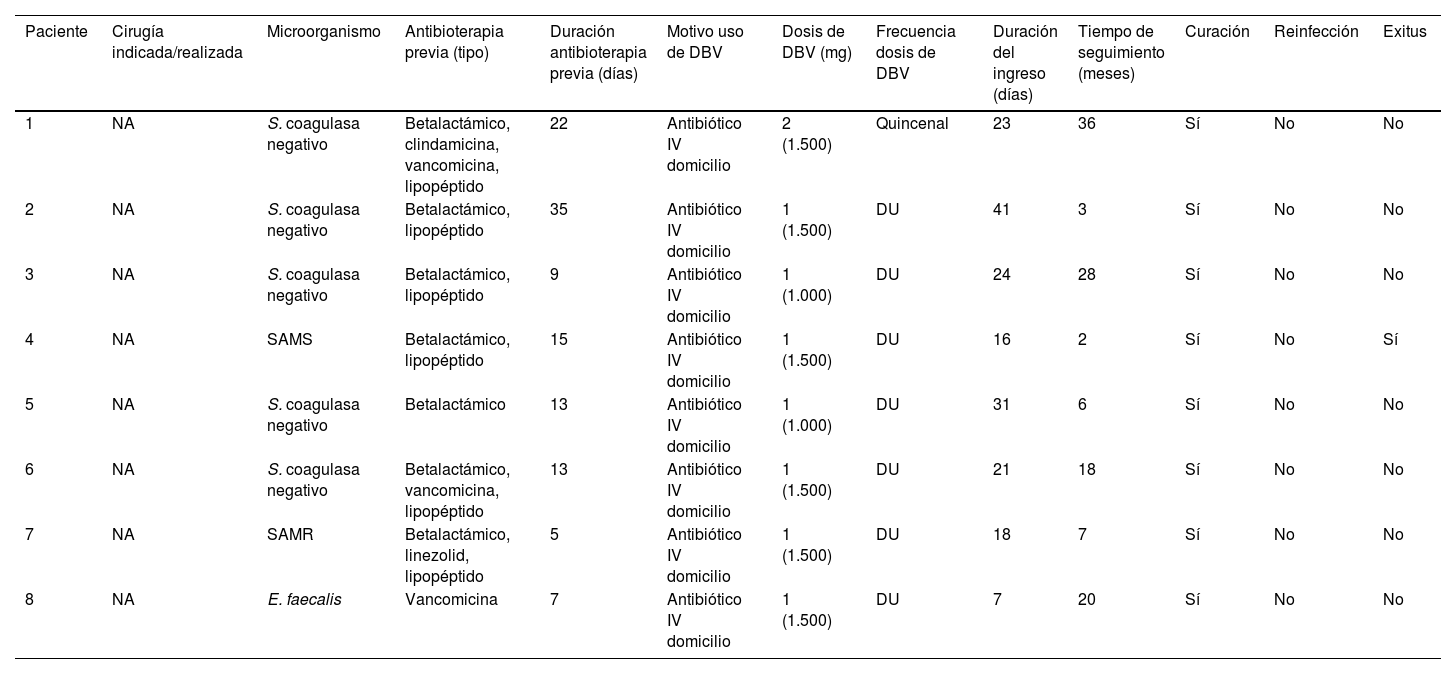
La duración de la antibioterapia con DBV, la dosis administrada y la periodicidad, así como la evolución clínica de los pacientes y el perfil microbiológico de los episodios de bacteriemia, se muestran en la tabla 4.
Tipo de tratamiento, evolución y perfil microbiológico de los pacientes con bacteriemia tratados con dalbavancina
| Paciente | Cirugía indicada/realizada | Microorganismo | Antibioterapia previa (tipo) | Duración antibioterapia previa (días) | Motivo uso de DBV | Dosis de DBV (mg) | Frecuencia dosis de DBV | Duración del ingreso (días) | Tiempo de seguimiento (meses) | Curación | Reinfección | Exitus |
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | NA | S. coagulasa negativo | Betalactámico, clindamicina, vancomicina, lipopéptido | 22 | Antibiótico IV domicilio | 2 (1.500) | Quincenal | 23 | 36 | Sí | No | No |
| 2 | NA | S. coagulasa negativo | Betalactámico, lipopéptido | 35 | Antibiótico IV domicilio | 1 (1.500) | DU | 41 | 3 | Sí | No | No |
| 3 | NA | S. coagulasa negativo | Betalactámico, lipopéptido | 9 | Antibiótico IV domicilio | 1 (1.000) | DU | 24 | 28 | Sí | No | No |
| 4 | NA | SAMS | Betalactámico, lipopéptido | 15 | Antibiótico IV domicilio | 1 (1.500) | DU | 16 | 2 | Sí | No | Sí |
| 5 | NA | S. coagulasa negativo | Betalactámico | 13 | Antibiótico IV domicilio | 1 (1.000) | DU | 31 | 6 | Sí | No | No |
| 6 | NA | S. coagulasa negativo | Betalactámico, vancomicina, lipopéptido | 13 | Antibiótico IV domicilio | 1 (1.500) | DU | 21 | 18 | Sí | No | No |
| 7 | NA | SAMR | Betalactámico, linezolid, lipopéptido | 5 | Antibiótico IV domicilio | 1 (1.500) | DU | 18 | 7 | Sí | No | No |
| 8 | NA | E. faecalis | Vancomicina | 7 | Antibiótico IV domicilio | 1 (1.500) | DU | 7 | 20 | Sí | No | No |
DBV: dalbavancina; DU: dosis única; IV: intravenoso; NA: no aplica; SAMR: Staphylococcus aureus resistente a meticilina; SAMS: Staphylococcus aureus sensible a meticilina.
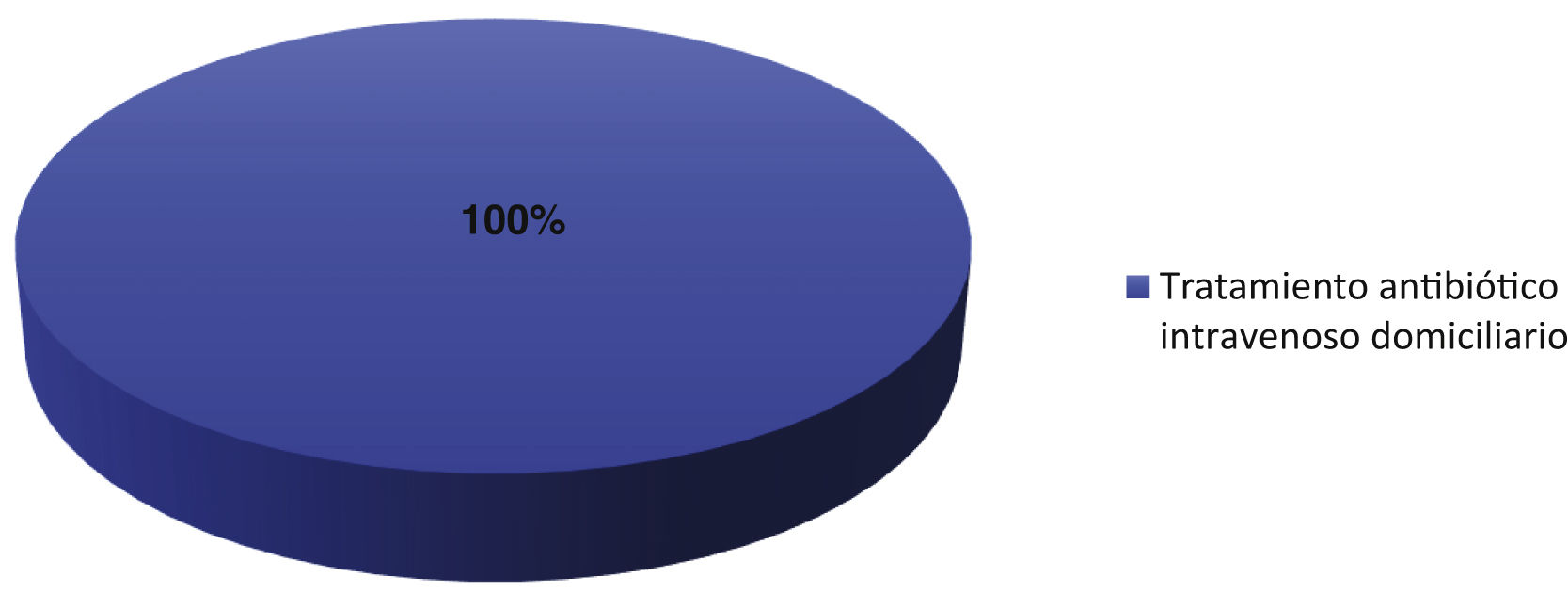
En el grupo de bacteriemias, DBV se administró con el objetivo de continuar el tratamiento antibiótico intravenoso fuera del hospital (n=8).
En todos los casos, DBV se administró el día del alta, bien como dosis única, bien como dosis inicial. Los resultados del motivo de uso de DBV se muestran en la fig. 2.
EfectividadSe documentó curación clínica y microbiológica en el 84% de los pacientes tratados con DBV (n=21), 76,4% en el grupo de EI (n=13) y 100% en el de bacteriemias (n=8). Se realizó un tiempo de seguimiento medio de 18,8 meses (rango: 1-64; DE 18,08) en el grupo de EI, y de 15 meses (rango: 2-36; DE 11,73) en el de bacteriemias.
En 4 pacientes se documentó fracaso al tratamiento con DBV. El primer caso era un varón de 82 años con EI de repetición sobre válvula protésica secundaria a bacteriemia persistente por S. aureus que requirió recambio valvular, asociándose DBV como intento de intensificación de la actividad microbicida, presentando un nuevo episodio de EI que requirió nuevamente recambio valvular y cambio de antibioterapia (ciprofloxacino) a largo plazo.
El segundo caso era un varón de 71 años con EI sobre prótesis valvular metálica y marcapasos secundaria a Staphylococcus coagulasa negativo que tuvo un embolismo sistémico, lo que obligó a recambio valvular, asociándose DBV como terapia de consolidación, pero desarrolló mediastinitis secundaria a infección de herida quirúrgica que requirió reintervención en un segundo tiempo para limpieza de foco quirúrgico. Se optó posteriormente por el cambio de antibioterapia (ciprofloxacino y rifampicina) de manera prolongada.
Los otros 2 casos (EI sobre válvula nativa e infección de prótesis endovascular) fueron pacientes con criterios de cirugía pero considerados no candidatos quirúrgicos por comorbilidades, que recibieron antibioterapia crónica con DBV como uso compasivo y que acabaron falleciendo.
En 2 pacientes hubo evidencia de reinfección tras tratamiento con DBV. El primer caso era una mujer de 81 años con EI protésica e infección de marcapasos secundarias a bacteriemia por Staphylococcus epidermidis de foco cutáneo. Se trató con DBV y rifampicina, alcanzándose la curación. Dieciocho meses después presentó un nuevo episodio de similares características secundario a bacteriemia por S. epidermidis con puerta de entrada cutánea, optándose por recambio valvular y de marcapasos y tratándose con daptomicina y rifampicina.
El segundo caso fue una mujer de 41 años con adicción a drogas por vía parenteral que experimentó un primer episodio de endocarditis por E. faecalis, optándose por la administración de DBV en régimen ambulatorio por falta de adherencia, alcanzándose la curación. Siete meses después ingresa por un nuevo episodio de EI, optándose por recambio valvular y tratamiento con ceftriaxona, perdiéndose el seguimiento tras solicitar el alta voluntaria.
En 2 pacientes con infección de catéter vascular hubo necesidad de administrar terapia antibiótica prolongada (>20 días) previamente al tratamiento con DBV, dado que se trataba de bacteriemias complicadas. El primer caso era un paciente con bacteriemia persistente a pesar de antibioterapia intravenosa (vancomicina/tigeciclina). En el segundo, la bacteriemia fue secundaria a una infección de herida quirúrgica que precisó manejo ambulatorio a través de la unidad de hospitalización domiciliaria con distintas pautas antibióticas (ertapenem/linezolid). Ambos pacientes alcanzaron la curación tras tratamiento con DBV.
Efectos adversosNo se documentó ningún efecto adverso asociado a la administración de DBV.
DiscusiónDBV es un antibiótico aprobado para el tratamiento de las IPPB en adultos y niños mayores de 3 meses7,8. Su utilización en otras indicaciones clínicas ha sido documentada en modelos animales15 y series de casos clínicos16–19.
Las infecciones cardiovasculares en general, y la EI en particular, son enfermedades que requieren de un tratamiento antibiótico de larga duración. Además, la proporción de pacientes que requieren cirugía como parte del tratamiento (bien para reemplazo valvular, bien para recambio del dispositivo de estimulación) suponen hasta un 50-60% de los casos de EI5,12. En la actualidad, los pacientes con EI son mayores en edad y reúnen múltiples comorbilidades, entre las que se encuentran la inmunosupresión, la diabetes mellitus, la presencia de valvulopatías o la necesidad de dispositivos de estimulación cardiaca. Son, además, enfermos más frágiles y con ingresos hospitalarios más prolongados que otros más jóvenes. Por consiguiente, la estancia media hospitalaria de estos pacientes ha aumentado, y con ella, las tasas de complicaciones médicas y de efectos adversos derivados de tratamientos antibióticos de larga duración20. Asimismo, la calidad de vida percibida por los pacientes y su capacidad funcional se ven disminuidas. En este contexto clínico y epidemiológico, nuevas moléculas con actividad antimicrobiana que aúnen a la vez una eficacia similar a los tratamientos actuales, bien toleradas y que permitan su administración fuera del ámbito hospitalario, podrían suponer una significativa disminución en el gasto asociado a la estancia hospitalaria, así como una disminución de los riesgos y complicaciones derivados de estancias prolongadas.
Las características farmacocinéticas y farmacodinámicas de DBV permiten su administración en dosis única semanal o cada 2 semanas sin perder por ello cobertura antibiótica, por lo que resulta una atractiva opción que facilita una adecuada adherencia y cumplimentación en terapias prolongadas administradas fuera del ámbito hospitalario. Además, la ausencia de interacción significativa de DBV con la actividad del citocromo P45021 reduce la posibilidad de interacciones farmacológicas en pacientes habitualmente polimedicados. La administración en dosis única de 1.500mg, o bien de 1.000mg seguidos de 500mg a la semana, es la recomendada en el tratamiento de IPPB. Sin embargo, en la infección cardiovascular su dosificación es más controvertida, al ser una terapia utilizada fuera de guía clínica22. Los problemas de adherencia terapéutica en la EI, especialmente en pacientes con adicción a drogas por vía parenteral o alcoholismo, es un problema añadido. Ajaka et al.19 describen la utilidad de DBV en este perfil de pacientes, concluyendo que puede tener un papel útil como terapia de rescate en el tratamiento de la EI y la bacteriemia en una población con barreras en el acceso al tratamiento estándar. La problemática social y la carencia de apoyo familiar o soporte doméstico son condicionantes demostrados para la falta de adherencia terapéutica. DBV podría jugar un papel útil en este sentido, asegurando la cumplimentación gracias a su cómoda posología.
Por otro lado, en comparación con otras opciones de tratamiento ambulatorio de la infección cardiovascular y de la EI en particular, DBV supone una opción terapéutica atractiva. En este sentido, existen otras moléculas de administración parenteral (oritavancina) cuya utilidad ha sido estudiada en el tratamiento de la EI en régimen ambulatorio23, pero cuyo papel aún está por determinar en cuanto a eficacia y seguridad en este tipo de infecciones. Además, son cada vez más numerosos los estudios que arrojan datos favorables sobre el tratamiento de la EI mediante antibioterapia oral en régimen ambulatorio20,24,25. Aunque se ofrecen resultados prometedores, dicha modalidad de terapia debe aplicarse por el momento en pacientes seleccionados, debiendo mantenerse los mismos estándares de seguimiento clínico que en la terapia hospitalaria convencional. No se trata solo de prescribir una terapia ambulatoria a largo plazo, sino de asegurar una adecuada adherencia y vigilancia clínica del paciente. DBV, al ser una molécula disponible únicamente para administración parenteral, permite no solo asegurar la cumplimentación, sino también garantizar la oportunidad de mantener un seguimiento clínico cada vez que el paciente acuda al entorno hospitalario a recibir su dosis semanal o quincenal.
En lo referente al tratamiento antibiótico de la bacteriemia, es interesante tener en cuenta que en adultos ha sido tradicionalmente tratada con antibioterapia intravenosa, siendo cada vez mayor la tendencia a la transición a un tratamiento antibiótico oral. En este sentido, un panel de expertos de la Infectious Diseases Society of America consideró adecuada la transición de la terapia parenteral a oral tanto en infecciones por gramnegativos como por grampositivos, cuando el foco de la infección estuviese controlado y el paciente estuviese clínicamente estable26. Sin embargo, en pacientes con bacteriemia por S. aureus, la mayoría consideraron mantener la antibioterapia intravenosa. DBV cumpliría este requisito permitiendo un tratamiento ambulatorio.
Nuestros resultados son acordes con la evidencia disponible en el uso de DBV en EI y bacteriemia, e indican que podría suponer una alternativa óptima y segura al tratamiento intrahospitalario en pacientes clínicamente estables que únicamente requieren continuar hospitalizados para la administración de antibioterapia y en los que se pueda garantizar un seguimiento extrahospitalario adecuado. En nuestro estudio, todos los pacientes habían recibido antibioterapia parenteral previa con distintas combinaciones de antibióticos, utilizándose DBV como terapia de consolidación cuando la infección estuvo controlada, tanto en el grupo de pacientes con EI como en el de bacteriemia. En esta población de alto riesgo, compleja y de difícil manejo, se obtuvieron tasas globales de curación superiores al 80% de los tratados. Estos resultados son similares a los de otras series publicadas hasta la fecha tanto en el grupo de EI16–19 como en el de bacteriemia27.
En nuestro trabajo cabe destacar la presencia de varios pacientes con EI que requirieron la administración de terapia antibiótica previa prolongada, encontrándonos rangos tan amplios como 7 a 730 días y dosis posteriores de DBV administradas también muy variables (entre una y 12 dosis). Este hecho puede explicarse porque se trataba de pacientes con un elevado riesgo quirúrgico en los que se optó por un tratamiento conservador con antibioterapia crónica a largo plazo para lograr la curación. El paso posterior a DBV se planteó como terapia antibiótica supresora al haberse agotado otras opciones de tratamiento intrahospitalario o evidenciarse progresión de la infección en pruebas de imagen (ecocardiograma transesofágico y PET/TC). En este sentido, existen varias publicaciones al respecto sobre el uso de DBV como terapia antibiótica supresora tanto en infección osteoarticular28–30 como en infección cardiovascular31. Estos casos justificarían la elevada media de días de tratamiento antibiótico previo en nuestra serie (80 días) con respecto a la media habitual de la EI.
Por otro lado, llama la atención que en el grupo de pacientes con bacteriemia de nuestra serie, principalmente por Staphylococcus coagulasa negativos y generalmente asociada a infección por catéter, se administra DBV tras un período de antibioterapia convencional previa prolongado (2 semanas). Esto obedece a 2 motivos: 1) se trataba de pacientes con bacteriemia persistente a pesar de la retirada del catéter, y 2) eran pacientes en los que había una imposibilidad de retirada del catéter al tratarse de un dispositivo permanente (Port-a-cath®, Hickman®), necesario para la administración de terapia oncológica o nutrición parenteral.
La ausencia de efectos adversos en nuestra serie es otro aspecto positivo a tener en cuenta. Otras opciones terapéuticas utilizadas habitualmente en los episodios de EI y/o bacteriemia por cocos grampositivos (vancomicina/linezolid) se asocian a efectos adversos significativos (nefrotoxicidad/alteraciones hematológicas)32 que limitan cada vez más su uso en población anciana, pluripatológica y polimedicada. Sería, además, un tratamiento coste-efectivo, que contribuiría a reducir los costes asociados a la hospitalización por este tipo de infecciones. A este respecto, los datos más recientes en relación con la estancia hospitalaria media actual de pacientes con EI en España, así como los costes asociados con la hospitalización, arrojan los siguientes resultados: la estancia media hospitalaria por la enfermedad en pacientes tratados quirúrgicamente es de 40,1 días, mientras que en pacientes tratados médicamente es de 23,1 días. Los costes medios de hospitalización por EI en la actualidad son de 12.537€ por paciente, pero existen enormes diferencias entre los pacientes que reciben cirugía (40.700€/paciente) y aquellos con tratamiento médico exclusivamente (9.257€/paciente)33–35. En este sentido, un estudio multicéntrico efectuado en distintos hospitales españoles calculó un ahorro de estancia hospitalaria para EI de 557 días y de 636 días para bacteriemia en aquellos pacientes tratados con DBV, concluyendo así ser un fármaco altamente coste-efectivo27. En nuestra serie, con una alta proporción de pacientes intervenidos quirúrgicamente, la estancia media se redujo en 4,7 días con respecto a la media (35,4 vs. 40,1 días). Si bien en nuestro estudio no se realiza un análisis directo de coste-efectividad, el tratamiento con DBV disminuiría los costes de ingreso hospitalario en este perfil de paciente de alta complejidad y con estancias hospitalarias prolongadas.
Nuestro estudio presenta las limitaciones inherentes a su diseño retrospectivo y a su reducido tamaño muestral, así como la ausencia de un grupo de comparación. Todos los pacientes recibieron DBV como tratamiento de consolidación tanto si se trataba de pacientes con EI como si el motivo de administración fue bacteriemia, por lo que no podemos ofrecer evidencia científica para la evaluación de su eficacia y seguridad como tratamiento de primera línea en la infección cardiovascular.
Por otra parte, dado que DBV pertenece al grupo de antibióticos de acción prolongada y que son moléculas relativamente nuevas, sus indicaciones en ficha técnica no suelen ser consistentes con su uso en la vida real. Ello condiciona una gran variedad de dosis de DBV (500, 1.000 o 1.500mg) y posología (semanal, quincenal), lo que dificulta la interpretación de los resultados. Son necesarios estudios farmacocinéticos para identificar la dosis más apropiada en terapias prolongadas.
Como fortalezas de nuestro trabajo cabe destacar los distintos tipos de infecciones cardiovasculares representados. A diferencia de otras series que evalúan únicamente el papel de DBV en EI17,19, en nuestro trabajo se presentan 2 grupos de pacientes diferenciados con infección cardiovascular: 1) pacientes con EI sobre válvula nativa, protésica o infección de dispositivos endovasculares, y 2) pacientes con bacteriemia asociada o no a catéter, lo que aporta aspectos novedosos a lo publicado hasta ahora en la literatura36,37, incluyendo además una alta proporción (48%) de pacientes sometidos a cirugía (n=12) en el grupo de EI.
Por último, hay que destacar el amplio período de estudio que incluye nuestra serie (7 años), superior a otras series retrospectivas de mayor tamaño, pero más recortadas en el tiempo, con períodos de estudio de 2 años16,27.
ConclusionesEn nuestro estudio de pacientes con infección cardiovascular, DBV se muestra como un fármaco eficaz como terapia antibiótica de consolidación tanto en pacientes con EI como en bacteriemia.
La ausencia de efectos adversos e interacciones posiciona a DBV como una terapia segura en pacientes pluripatológicos y polimedicados que padecen una infección cardiovascular.
Su administración en régimen ambulatorio puede contribuir al manejo terapéutico de los pacientes con EI y bacteriemia producida por microorganismos grampositivos.
FinanciaciónNinguna.
Conflicto de interesesNo existen conflictos de intereses.