Introducción
Quince años después del descubrimiento del agente responsable, la hepatitis crónica C aún constituye un importante problema sanitario, con considerables implicaciones médicas y sociales. No obstante, los avances en el conocimiento de la historia natural de la enfermedad y de sus mecanismos patogénicos, la incorporación de técnicas diagnósticas fiables y más accesibles y la introducción de nuevas modalidades terapéuticas permiten contemplar la enfermedad con más optimismo que en épocas todavía muy recientes.
Epidemiología actual de la infección por el VHC en la población general y en los pacientes infectados por el VIH
El virus de la hepatitis C (VHC) es un virus ARN que pertenece a la familia de los Flavivirus. Fue identificado por primera vez en 1989 y en la actualidad se conocen seis genotipos diferentes distribuidos geográficamente; en España predomina el genotipo 1b.
El VHC es responsable del 20% de las hepatitis agudas y más del 70% de las crónicas. La hepatopatía crónica por el VHC afecta del 1 al 3% de la población mundial, aproximadamente unos 170 millones de personas, lo cual constituye un problema sanitario de gran magnitud1. En nuestro medio alrededor del 2% de la población estaría infectada.
El VHC puede transmitirse por vía sexual, vertical (maternofetal) y percutánea tras exposición a sangre que sería la vía más eficaz. El virus de la inmunodeficiencia humana (VIH) presenta similares vías de contagio y esto condiciona que exista una alta tasa de prevalencia de coinfección VIH-VHC: oscilando entre el 15 y el 40% en función de la zona geográfica y hasta el 90% si nos fijamos en el subgrupo de pacientes con antecedentes de adicción a drogas por vía parenteral (ADVP) o hemofílicos2,3.
La hepatitis C es aproximadamente 10 veces más infectiva que el VIH tras la exposición percutánea accidental, observando la seroconversión en 15-30 casos por mil exposiciones4. La transfusión con sangre o derivados contaminados representó al inicio una importante vía de contagio que gracias a las medidas de cribado que actualmente se realizan en los bancos de sangre ha quedado eliminada5. La transmisión sexual (tanto homosexual como heterosexual) del VHC en las parejas estables es poco frecuente aunque parece que en los individuos VIH seropositivos es algo superior (3%)6. La transmisión maternofetal del VHC en las pacientes monoinfectadas es del 2-5%, mientras que entre las pacientes VIH seropositivas este porcentaje se eleva al 10-12%. Para algunos autores este incremento se relacionaría con el valor del ARN-VHC en suero y el consumo de drogas por vía intravenosa7,8.
Historia natural de la infección por el VHC
Historia natural de la infección por el VHC en la población general
La infección aguda por el VHC cursa de manera asintomática en el 70-80% de los casos; raramente se presenta de forma fulminante. Tras la infección aguda, aproximadamente el 20% de los pacientes son capaces de aclarar la viremia y por tanto curarse; el resto permanecerán con una infección crónica9. Se ha determinado que estos pacientes tras 20 años de evolución presentan una probabilidad del 5-25% de desarrollar una cirrosis10 y una vez establecida la cirrosis el riesgo anual de desarrollar insuficiencia hepática o carcinoma hepatocelular se estima del 2-4 y 1-7%, respectivamente11.
Historia natural de la infección por el VHC en la población VIH positiva. Interacciones VIH-VHC
Tras la aparición del tratamiento antirretroviral de gran actividad (TARGA) y el correcto control de la infección por el VIH, la hepatopatía crónica por el VHC y las complicaciones asociadas a dicha infección suponen una importante causa de morbimortalidad en la población VIH seropositiva12. Algunos autores han constatado que en el momento actual la enfermedad hepática terminal constituye la primera causa de ingreso hospitalario y muerte en estos pacientes13-15.
La historia natural de la infección por el VHC en el paciente infectado por el VIH difiere a la de la población general debido a las interacciones que se producen entre ambos virus, que a continuación se detallan y se resumen en la tabla 1.
Efecto del VIH sobre la infección por el VHC
En los pacientes seropositivos existe un mayor riesgo de cronificación de la infección por el VHC16,17; en esta población la tasa de aclaramiento de la hepatitis aguda por el VHC es del 5-10%. La coinfección, además, se asocia con títulos más elevados de ARN-VHC, sobre todo en pacientes con linfocitos CD4 bajos títulos de lo cual posiblemente refleja un déficit en el control de la replicación del VHC secundario a la inmunodeficiencia causada por el VIH; la implicación clínica que esto representa todavía se desconoce.
En la mayoría de los trabajos publicados se ha observado que en los pacientes seropositivos la progresión a cirrosis es más rápida presentándose a los 6-10 años tras la infección18,19 y que las tasas de desarrollo de insuficiencia hepática y carcinoma hepatocelular son más elevadas20-22.
La mayoría de autores sugieren que el tratamiento antirretroviral (TAR) tiene un impacto positivo sobre la infección por el VHC y el daño hepático asociado; de forma indirecta mejora el pronóstico de la enfermedad hepática reduciendo la replicación viral mediante la estimulación de la respuesta específica para el VHC23 y, por otro lado, se ha demostrado un efecto directo antifibrogénico de las terapias basadas en inhibidores de la proteasa24,25.
Efecto de la hepatitis C en la progresión del VIH
Existen datos discordantes en la literatura especializada en cuanto al efecto del VHC en la evolución de la infección crónica por el VIH. Mientras que algunos autores han valorado una menor tolerancia y eficacia del TAR en estos pacientes así como una mayor tasa de progresión a sida y muerte26,27, otros autores valoran que el impacto del VHC sería mínimo e irrelevante en el curso clínico de la infección VIH28,29.
La coinfección por el VHC se ha relacionado con el aumento de la toxicidad hepática asociada al TARGA30,31 y aunque se desconocen los mecanismos implicados exactos parecen estar involucrados: factores virales propios32, un descenso en el metabolismo, fenómenos de reconstitución inmunológica33 y un aumento de la disfunción mitocondrial34.
Diagnóstico de la infección por el VHC
Para el cribado es suficiente realizar una prueba de enzimoinmunoanálisis que detecta anticuerpos del VHC en sangre. Los pacientes que presentan un resultado positivo para los anticuerpos deberán confirmar este diagnóstico con la detección del ARN del VHC por una técnica de reacción en cadena de la polimerasa (PCR). El resultado positivo del ARN-VHC confirma una infección activa por dicho virus. No obstante, debido a la fluctuación de los niveles de ARN-VHC en sangre una determinación aislada de ARN-VHC negativa no es suficiente para descartar la infección crónica y se recomiendan como mínimo dos determinaciones con una diferencia de 6 meses para confirmar el aclaramiento del VHC.
Dada la alta tasa de prevalencia de coinfección, todos los pacientes infectados por el VIH deben ser valorados para descartar la existencia de una infección crónica por el VHC. En estos pacientes los títulos de anticuerpos anti-VHC pueden disminuir y hacerse indetectables, sobre todo en aquellos con CD4 más bajos35; así, ante un paciente con elevación crónica de transaminasas y anticuerpos negativos, se debe solicitar el ARN-VHC para descartar por completo la existencia de una hepatopatía crónica por el VHC.
Es útil conocer la cuantificación del ARN-VHC, tanto basal como a las pocas semanas de iniciar el tratamiento, ya que, al igual que el genotipo viral, su valor se ha relacionado con la respuesta final a la terapia; no así con la gravedad o progresión de la enfermedad36.
Biopsia hepática
La evaluación histológica mediante la biopsia hepática es la prueba que proporciona una mayor y mejor información de la actividad inflamatoria y la fibrosis hepática37. Su resultado nos ayuda en la toma de decisiones terapéuticas, permite realizar un pronóstico de la enfermedad y descartar otras causas de hepatopatía no relacionadas con el VHC (hepatopatías metabólicas o tóxicas, p. ej., por el alcohol); no obstante, no es una técnica disponible en todos los centros y es relativamente cara. Por estos motivos en la población infectada por el VIH que presenta una progresión más acelerada de la enfermedad hepática, las últimas recomendaciones del panel internacional de expertos en VIH-VHC aconseja ofrecer el tratamiento aún sin disponer del resultado histológico38.
Se considera que para realizar un correcto seguimiento de los pacientes infectados por el VHC que no se tratan, sería conveniente disponer de una biopsia hepática de control cada 3-5 años39.
Tratamiento de la infección por el VHC
Consideraciones generales
Los pacientes con hepatopatía crónica por el VHC deben ser aconsejados para prevenir la transmisión, controlar su función hepática, evitar tóxicos tales como el alcohol que pueden acelerar la evolución de su hepatopatía y, si es posible, recomendar el tratamiento.
Antes de iniciar ninguna terapia se debe realizar un cribado para descartar la existencia de otras infecciones hepáticas crónicas como el virus de la hepatitis B (VHB) o bien si han estado en contacto con el virus de la hepatitis A (VHA) y en caso de no presentar anticuerpos ser vacunados ya que el riesgo de hepatitis fulminante en los pacientes infectados por el VHC que se sobreinfectan por un VHA o VHB es mayor al de la población general40.
El objetivo principal del tratamiento es la erradicación del virus y por tanto la curación de la enfermedad. Se considera una respuesta correcta, respuesta virológica sostenida (RVS) si el ARN-VHC se mantiene negativo a los 6 meses de haber finalizado la terapia. Otro beneficio potencial de la terapia con interferón y ribavirina es la obtención de cierta mejoría histológica, con la consiguiente disminución del riesgo de evolución a insuficiencia hepática terminal y hepatocarcinoma, que se puede valorar incluso en aquellos pacientes que no consiguen negativizar el VHC41. Por último, en la población coinfectada es importante destacar que, al erradicar la infección por el VHC con el tratamiento, se consigue mejorar el control y el pronóstico de la infección por el VIH al aumentar la tolerancia a los antirretrovirales42.
Tratamiento de la infección por el VHC en la población general
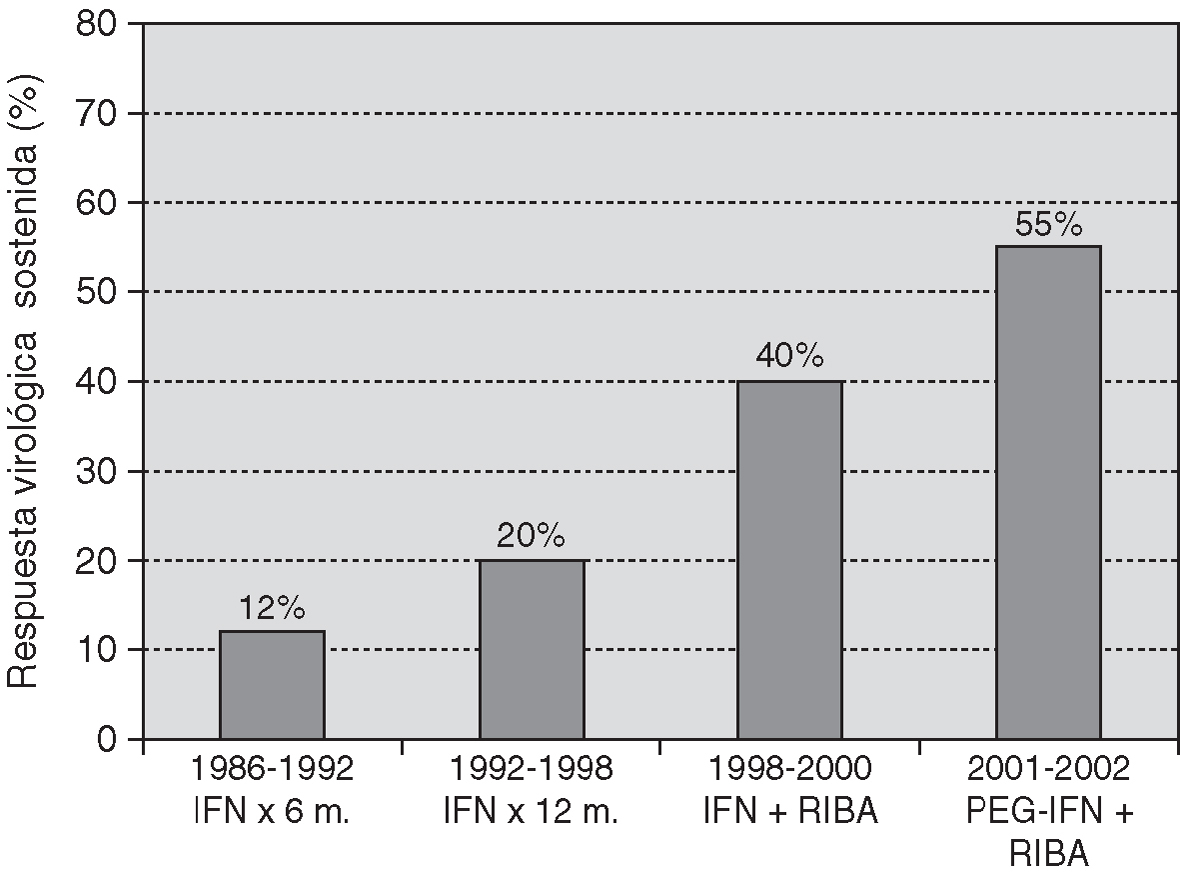
El tratamiento de la hepatitis crónica C se basó inicialmente en la administración de interferón durante un tiempo prolongado. La adición de ribavirina al interferón, a mediados de la década pasada, y, más recientemente, la introducción del interferón pegilado han determinado un aumento sustancial de la eficacia del tratamiento con relación a la monoterapìa con interferón. De hecho, la tasa de respuesta virológica sostenida que se obtiene con los tratamientos actuales es entre 3 y 5 veces superior a la que se obtenía hace tan sólo unos pocos años (fig. 1).
Figura 1. Eficacia del tratamiento de la hepatitis C en la población general, medida por la respuesta virológica sostenida, según el tratamiento empleado.
El interferón pegilado es una presentación farmacológica que se obtiene mediante la unión fisicoquímica de una molécula de interferón a recombinante a una o varias moléculas de polietilenglicol. La conjugación de proteínas con polietilenglicol es un método bien conocido para retrasar su aclaramiento, prolongar y mantener su actividad y, en consecuencia, mejorar su eficacia. En la actualidad se dispone de dos moléculas comercializadas de interferón pegilado; el interferón pegilado α -2a con un peso molecular de 40 kDa y el interferón pegilado α -2b, de 12 kDa.
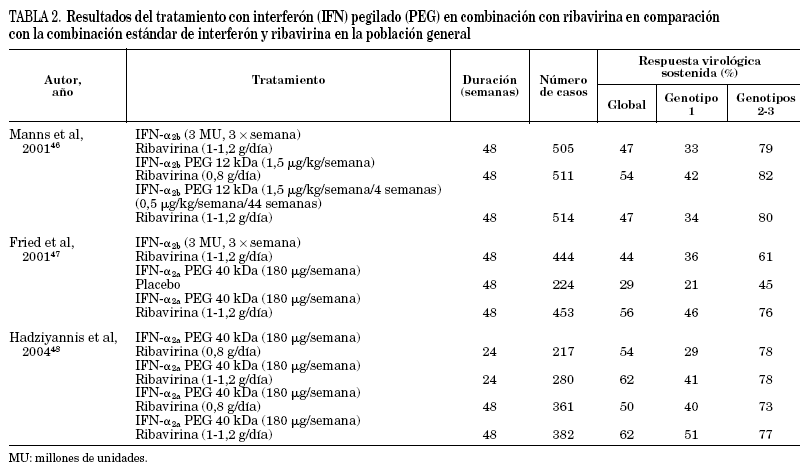
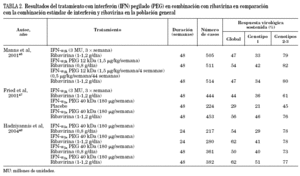
El conocimiento de que la adición de ribavirina mejoraba sustancialmente la eficacia del interferón estándar junto con los mejores resultados obtenidos con interferón pegilado, tanto a -2a como a -2b, administrado en monoterapia43-45 sugerían claramente la posibilidad de optimizar el tratamiento con la combinación de interferón pegilado y ribavirina. Hasta el momento se han publicado los resultados de dos amplios estudios diseñados para evaluar la eficacia y la seguridad de esta nueva combinación en comparación con el tratamiento combinado estándar46,47 y, muy recientemente, se han comunicado los resultados de un tercer estudio en el que se evaluaron cuatro pautas de tratamiento con interferón pegilado α -2a y ribavirina que diferían en la dosificación de la ribavirina y en la duración del tratamiento48. En la tabla 2 se resumen las principales características de estos tres estudios. Los resultados indican que el tratamiento combinado con ribavirina e interferón proporciona mejores resultados si se utiliza interferón pegilado. Uno de los estudios mostró que la combinación con ribavirina también se mostró más eficaz que la monoterapia con interferón pegilado47. El análisis de la posible influencia del genotipo del virus C en la respuesta al tratamiento confirmó que los genotipos 2 y 3 son mucho más sensibles que el genotipo 1, como ya se había observado al utilizar los tratamientos disponibles anteriormente. Es interesante subrayar que casi el 80% de los pacientes infectados con genotipos 2-3 y que más del 40% de los infectados con el genotipo 1 presentaron una respuesta virológica sostenida. Por su diseño específico, los resultados del estudio de Hadzyannis et al48 indican que la tasa de respuesta de los pacientes con genotipo 2-3 no aumenta si el tratamiento se mantiene durante 48 semanas ni si se utilizan dosis altas de ribavirina, mientras que en los pacientes infectados con genotipo 1 ocurre lo contrario. Otro estudio, en el que se administró tratamiento combinado con interferón pegilado α -2b y ribavirina durante 24 semanas ha mostrado que la tasa de respuesta es igualmente muy elevada en los pacientes infectados con genotipo 3 y cercana al 100% en los pacientes con genotipo 249. Estos datos indican que la determinación del genotipo es imprescindible para decidir cuál es la duración óptima del tratamiento.
Manns et al46 comprobaron que existía una relación inversa entre el peso del paciente y la eficacia del tratamiento. Puesto que los pacientes que en este estudio recibieron la dosis más alta de interferón pegilado habían sido tratados con una dosis fija de ribavirina de sólo 800 mg/día, se sospechó que los pacientes de más peso podrían haber recibido una cantidad subóptima de ribavirina. El análisis de este aspecto mostró la mayor efectividad del tratamiento en los pacientes que recibieron dosis más altas de ribavirina, superiores a 10,6 mg/kg/día.
La buena adherencia al tratamiento es un factor importante para mejorar los resultados del mismo. Recientemente se han comunicado los resultados de un subanálisis del estudio de McHutchison et al50 en el que se tuvo en cuenta el grado de adherencia al tratamiento. Para ello, los pacientes fueron separados en dos grupos según cumplieran o no el criterio de haber recibido al menos el 80% de las dosis de interferón y de ribavirina asignadas en el protocolo durante al menos el 80% de las 48 semanas de tratamiento previstas. Los resultados de este análisis muestran que la respuesta virológica sostenida fue claramente superior en los pacientes que recibieron un tratamiento más completo (63%) que en los que no lo recibieron (52%). En el subgrupo de pacientes que cumplieron los criterios señalados (80/80/80) y que además recibieron una dosis de ribavirina igual o superior a 10,6 mg/kg/día la tasa de respuesta virológica sostenida fue del 72% en la totalidad de los pacientes, del 63% en los pacientes infectados con genotipo 1 y del 94% en los infectados con genotipo 2 o 3. Estos datos indican claramente que el buen cumplimiento terapéutico es esencial para obtener los mejores resultados.
Tratamiento de la hepatitis crónica por VHC en pacientes coinfectados por el VIH
Los primeros ensayos de tratamiento para el VHC en los pacientes con infección crónica por el VIH se realizaron con interferón a en monoterapia. Se trata de estudios de series de casos con pocos pacientes llevados a cabo en la época previa al TARGA51-53. La tasa de respuesta sostenida virológica media obtenida de estas experiencias se sitúa alrededor del 15%.
Posteriormente se añadió a la terapia con interferón a la ribavirina. La experiencia con esta combinación en los pacientes coinfectados es aún escasa54-57 y los datos de eficacia global se sitúan alrededor del 22%, oscilando según los trabajos entre el 16 y el 40%.
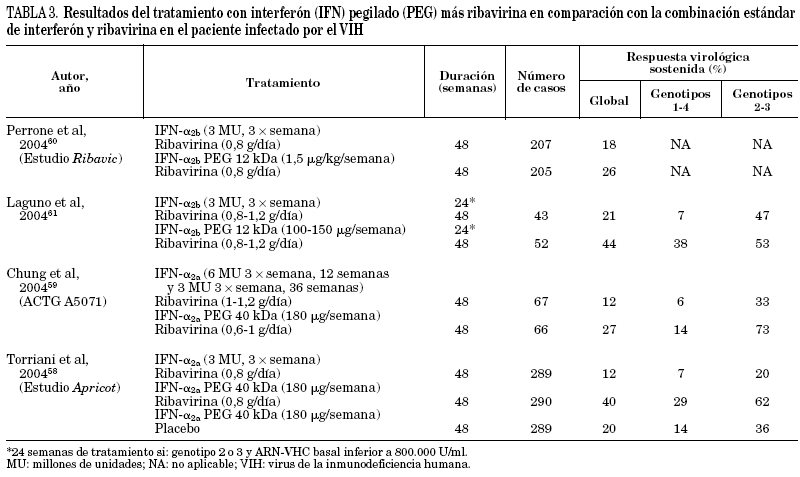
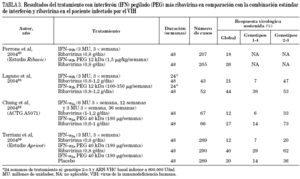
Recientemente se han comunicado varios estudios con un amplio número de pacientes incluidos, donde se evalúa la terapia combinada de interferón pegilado y ribavirina58-63. En la tabla 3 se recogen los resultados más destacables de los ensayos clínicos. Aunque existen diferencias en el diseño y en la población incluida en cada uno de ellos, todos concluyen que la respuesta es significativamente mayor en los pacientes tratados con interferón pegilado a y ribavirina (RVS: 27-44%) que en aquellos tratados con interferón a convencional y ribavirina (RVS: 12-21%).
En la actualidad, la duración del tratamiento anti-VHC en el paciente coinfectado es motivo de estudio y discusión. Algunos autores han valorado que el aclaramiento del VHC es más lento en los pacientes infectados por el VIH64 y otros destacan la existencia de una mayor tasa de recidiva del VHC en los pacientes con genotipo 2 y 3 tras haber respondido al final de 24 semanas de terapia62. A tenor de estos datos parece oportuno investigar la conveniencia de alargar la terapia anti-VHC en los pacientes coinfectados.
Indicación de tratamiento
Las indicaciones de tratamiento no están perfectamente delimitadas y todavía son objeto de debate en foros nacionales e internacionales. La Conferencia de Consenso promovida por la Asociación Europea para el Estudio del Hígado y que se desarrolló en París en 1999 propuso que todos los pacientes con hepatitis crónica C con transaminasas elevadas son candidatos a recibir tratamiento, en particular en los casos con fibrosis hepática y en ausencia de contraindicaciones mayores65. La presencia de cirrosis, clínicamente compensada, no contraindica el tratamiento, aunque las probabilidades de respuesta virológica sean menores. En términos parecidos se ha pronunciado la más reciente Conferencia de Consenso promovida por el National Institute of Health (NIH) de Estados Unidos, (junio 2002) que propone que, aunque todos los pacientes son candidatos en potencia, el tratamiento está recomendado en aquellos con mayor riesgo de progresar a la cirrosis y que en los pacientes con hepatitis leve la existencia de una relación favorable entre los riesgos y los beneficios del tratamiento está menos claramente demostrada, por lo que la decisión de tratar o no debe ser tomada a título individual en cada caso66.
En la población infectada por el VIH, además de cumplirse los mismos criterios de indicación de terapia que en los pacientes monoinfectados, se debe tener en cuenta que el paciente mantenga respecto a su infección crónica por el VIH una buena situación clínica sin evidencia de infecciones oportunistas activas, presente una carga viral indetectable o baja (< 30.000 copias/ml) y unos CD4 estables por encima de 250 cél./ml y se encuentre bajo TAR estable o sin necesidad del mismo. Los pacientes coinfectados presentan una peor tasa de respuesta al tratamiento con interferón y ribavirina, una mayor probabilidad de interrumpirlo y, posiblemente, de desarrollar efectos adversos al tratamiento anti-VHC; por lo tanto, la terapia debe ser indicada de forma individualizada teniendo en cuenta las ventajas e inconvenientes de iniciarla o diferirla. En este sentido deben tenerse presentes todos los factores asociados a una buena respuesta al tratamiento: los comunes a los de la población monoinfectada como son el sexo femenino, la edad inferior a 40 años, el genotipo VHC 2 o 3, la carga viral del VHC baja (ARN-VHC < 800.000 U/ml) y la no existencia de fibrosis o sólo a nivel portal y los factores que se relacionan al control del VIH como el valor de CD4 (> 500 cél./μl) y una carga viral del VIH baja (ARN-VIH < 10.000 copias/ml)53,54. Además debe valorarse la menor probabilidad de complicaciones graves en pacientes que no precisen TAR simultáneamente, el riesgo de desarrollar toxicidad o de presentar interacciones medicamentosas y, por último, la disponibilidad del paciente para realizar el tratamiento de forma adecuada.
Seguimiento y tolerancia
El manejo del paciente con hepatitis crónica C que recibe tratamiento con interferón y ribavirina es relativamente complejo. Es indispensable controlar de cerca al paciente, además de instruirlo acerca de cómo utilizar los fármacos e informarle de los posibles efectos de éstos. Los pacientes, que frecuentemente estaban asintomáticos y se encontraban bien antes del tratamiento, dejan de estarlo cuando lo inician.
Los pacientes deberán ser evaluados antes de iniciar el tratamiento, cada 2 semanas las primeras 4 semanas de tratamiento y, a ser posible, de forma mensual hasta finalizar el tratamiento. En las visitas de seguimiento es importante realizar una anamnesis dirigida hacia la aparición de efectos adversos, así como una analítica completa para descartar problemas hematológicos o bioquímicos. En los pacientes seropositivos se recomienda determinar el recuento de linfocitos CD4 y la viremia por VIH al mes de iniciar la terapia y cada 3 meses durante el resto del tratamiento.
La disponibilidad de métodos serológicos para investigar y cuantificar la presencia de ARN-VHC en el suero ha permitido estudiar la relación entre la respuesta virológica inicial y el resultado final del tratamiento. En varios estudios en los que se utilizó monoterapia con interferón convencional se puso en evidencia que la rapidez en la respuesta virológica estaba en relación directa con el resultado final del tratamiento. Es bien conocida que la ausencia de respuesta tras 24 semanas de tratamiento combinado con interferón estándar y ribavirina tiene un valor predictivo negativo del 100% en relación con la respuesta sostenida67; por lo tanto, se debe considerar la interrupción de la terapia en los pacientes que permanece et al47 ha mostrado que la respuesta virológica observada tras 12 semanas de tratamiento con interferón pegilado α -2a de 40 kDa y ribavirina tiene un alto valor predictivo de la repuesta final, ya que los pacientes que no han respondido en este período tienen muy pocas probabilidades de presentar una respuesta virológica sostenida si el tratamiento se prolonga hasta completar 48 semanas. Por el contrario, la probabilidad de respuesta sostenida en los pacientes con respuesta favorable en la semana 12 es muy alta, del 65%, y está relacionada con el cumplimiento terapéutico como previamente se ha comentado. Otro estudio reciente en el que se ha analizado específicamente el valor pronóstico del descenso de la concentración de ARN-VHC en el suero en distintos momentos del tratamiento ha confirmado que un descenso menor de dos logaritmos tras 12 semanas de tratamiento tiene un valor predictivo negativo para la respuesta sostenida del 100%68. Resultados similares se han obtenido en un estudio con población infectada por el VIH69. Esta información es útil para decidir precozmente respecto a la continuación o no del tratamiento; en esta decisión puede ser prudente considerar otras circunstancias individuales, como la tolerancia o el beneficio que puede esperarse de la continuación del tratamiento en los pacientes sin respuesta virológica inicial, en particular en los enfermos con fibrosis avanzada o con cirrosis.
Efectos adversos
Aparecen resumidos en la tabla 4. Son muy frecuentes, diversos y de intensidad variable, por lo que la tolerancia al tratamiento también es muy distinta de un paciente a otro70. La mayoría de los pacientes presentan una tolerancia intermedia, con diversas molestias que, en mayor o menor grado, pueden interferir en sus actividades habituales.
Muchos pacientes, en general al principio del tratamiento, presentan síntomas parecidos a los de la gripe horas después de la administración de interferón, que pueden aliviarse con paracetamol. También son frecuentes la astenia, la dificultad para concentrarse, el insomnio, la tendencia a la depresión, que pueden ser intensos y causan dificultades para el desarrollo de las actividades habituales del paciente. En algunos casos las alteraciones psicológicas o psicopatológicas pueden llegar a requerir atención psiquiátrica. El apoyo psicológico y el estímulo al paciente para que cumpla adecuadamente el tratamiento son a menudo factores importantes del éxito terapéutico.
El interferón puede ocasionar neutropenia y trombocitopenia y la ribavirina ocasiona anemia por exceso de hemólisis, lo que hace necesario la vigilancia regular del hemograma y el ajuste de las dosis de los medicamentos si fuera preciso. Las alteraciones de la función tiroidea son relativamente frecuentes, en forma de hipertiroidismo o, más comúnmente, hipotiroidismo; estos trastornos pueden ser permanentes y su detección puede obligar a considerar la interrupción del tratamiento. Otro efecto secundario frecuente y de base poco conocida es la tos seca, imitativa y por lo general leve que presentan los pacientes tratados con ribavirina. Asimismo, la ribavirina tiene un efecto teratógeno; este hecho, unido a que se desconocen todavía sus efectos sobre la espermatogénesis, hace que se aconseje a ambos sexos el empleo de métodos anticonceptivos eficaces durante el tratamiento con ribavirina y los 6 meses siguientes. Afortunadamente, los efectos adversos graves, como la depresión con tentativas de autólisis, los cuadros psicóticos graves o el desencadenamiento de alguna enfermedad autoinmune latente, como la diabetes mellitus, son excepcionales.
La aparición de efectos secundarios en los pacientes coinfectados es, al igual que en la población general, muy frecuente58-61. La mayoría de ellos son de fácil manejo clínico, aunque debemos tener presente que el 14-21% de los pacientes presentan efectos graves que conducen a la interrupción del tratamiento. En general, el espectro de efectos adversos descritos es similar al de los pacientes monoinfectados. Sin embargo, existen algunos efectos secundarios que podrían potenciarse con el VIH y el TAR; ejemplos de ello son la existencia de una mayor toxicidad a nivel del sistema nervioso central71 por el interferón o una mayor incidencia de anemia por la ribavirina72. Es frecuente observar la presencia de linfocitopenia con descenso significativo del valor absoluto de linfocitos CD4, aunque el valor relativo se mantiene estable58-61. Un efecto adverso importante, no comunicado hasta el momento durante el tratamiento de los pacientes monoinfectados por el VHC, es la aparición de acidosis láctica y/o pancreatitis73,74. Su incidencia es baja, pero presenta una alta tasa de mortalidad. La ribavirina es un inhibidor de la transcriptasa inversa análogo de nucleósido que puede tener un efecto inhibitorio sobre la gammapolimerasa mitocondrial, así como potenciar la acción intracelular de la didanosina lo cual daría lugar a la aparición de esta sintomatología. Estos hallazgos han conducido a que la Food and Drug Administration (FDA) recomiende evitar el uso de forma concomitante de didanosina y ribavirina.
Son varios los puntos pendientes de respuesta en el tratamiento del VHC: son necesarios estudios que definan mejor la eficacia, seguridad y pautas más efectivas, evaluar el beneficio de la terapia prolongada sobre la histología en los pacientes con hepatopatía avanzada o cirrosis que no han presentado respuesta virológica, investigar si las dosis y los tiempos de tratamiento óptimos de los fármacos anti-VHC deben ser iguales para todos los pacientes haciendo especial énfasis en los pacientes coinfectados por el VIH, definir si la eficacia y tolerancia del tratamiento es mejor cuando se trata secuencialmente la infección por VHC y la infección por VIH o cuando se trata de manera simultánea y, por último, investigar la eficacia y tolerancia en pacientes coinfectados con menos de 200 linfocitos CD4+ y en pacientes con cirrosis hepática descompensada.
Prevención de la infección por el VHC
Las personas ADVP que no están infectadas por el VHC deben ser animadas a abandonar el consumo de drogas y, si esto no es posible, que utilicen los servicios para un consumo seguro. El uso de preservativo para las relaciones sexuales es una medida eficaz para el control de la transmisión a este nivel. En la actualidad, no existen vacunas efectivas para prevenir el VHC.