La calidad de vida y la morbimortalidad en la acromegalia están relacionadas con el control bioquímico (IGF-1 normal para edad y sexo)1. El tratamiento de primera línea incluye la cirugía transesfenoidal y/o análogos de somatostatina (ASS) de primera generación, que actúan principalmente a través de la isoforma 2 del receptor de somatostatina (RSS). Estudios epidemiológicos y amplios registros nacionales2–5 indican que esta estrategia no supera el 50% de remisiones. La segunda línea incluye pegvisomant en monoterapia o asociado a ASS, que mejora el porcentaje de remisiones, pero supone una mayor complejidad terapéutica.
Los estudios pivotales de pasireótida6,7, un ASS con afinidad para varios RSS, sobre todo RSS5, evidencian superioridad frente a ASS de primera generación, lo cual nos permitiría controlar un mayor número de casos. En nuestra práctica clínica habitual, los pacientes con acromegalia mal controlados con ASS están en su gran mayoría en tratamiento con pegvisomant en monoterapia o combinado con ASS. Prácticamente no existen datos sobre la utilidad en la práctica clínica de pasireótida.
Presentamos 4 pacientes acromegálicos con control deficiente tras cirugía y ASS y/o pegvisomant, en los que pasireótida ha permitido controlar las concentraciones de IGF-1 y el tamaño de los restos tumorales.
Caso 1Mujer de 53 años que presenta diabetes mellitus bien controlada con hipoglucemiantes orales y acromegalia por un macroadenoma hipofisario isointenso en T2 de 2,5cm, con invasión del seno cavernoso derecho y cisterna supraselar, GH 6,9ng/ml e IGF-1 1.028ng/ml (límite superior de la normalidad [LSN] para edad y sexo 253ng/dl).
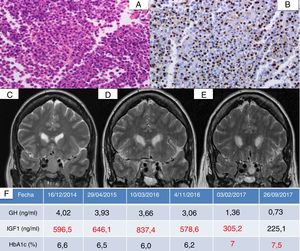
La resección transesfenoidal endoscópica fue incompleta. Se trataba de un adenoma escasamente granulado, con expresión intensa de GH. Tras cirugía requirió ASS a dosis máximas y se combinó posteriormente pegvisomant hasta 30mg/día, sin alcanzarse control de IGF-1 debido a una mala tolerancia a este último por mialgias. Fue reintervenida e irradiada a principio de 2016, tras lo cual el tamaño tumoral permaneció estable, 15×13mm, pero persistía IGF-1 elevado (578,6ng/dl) con buen control glucémico (HbA1c 6,2%). A finales de 2016 se inició pasireótida 40mg/mes, normalizando IGF-1 y con una reducción en el diámetro máximo tumoral del 45% a los 3 meses de tratamiento. Como efecto adverso, se constató un leve deterioro del control glucémico. En la figura 1 se muestra la anatomía patológica y la evolución radiológica y bioquímica.
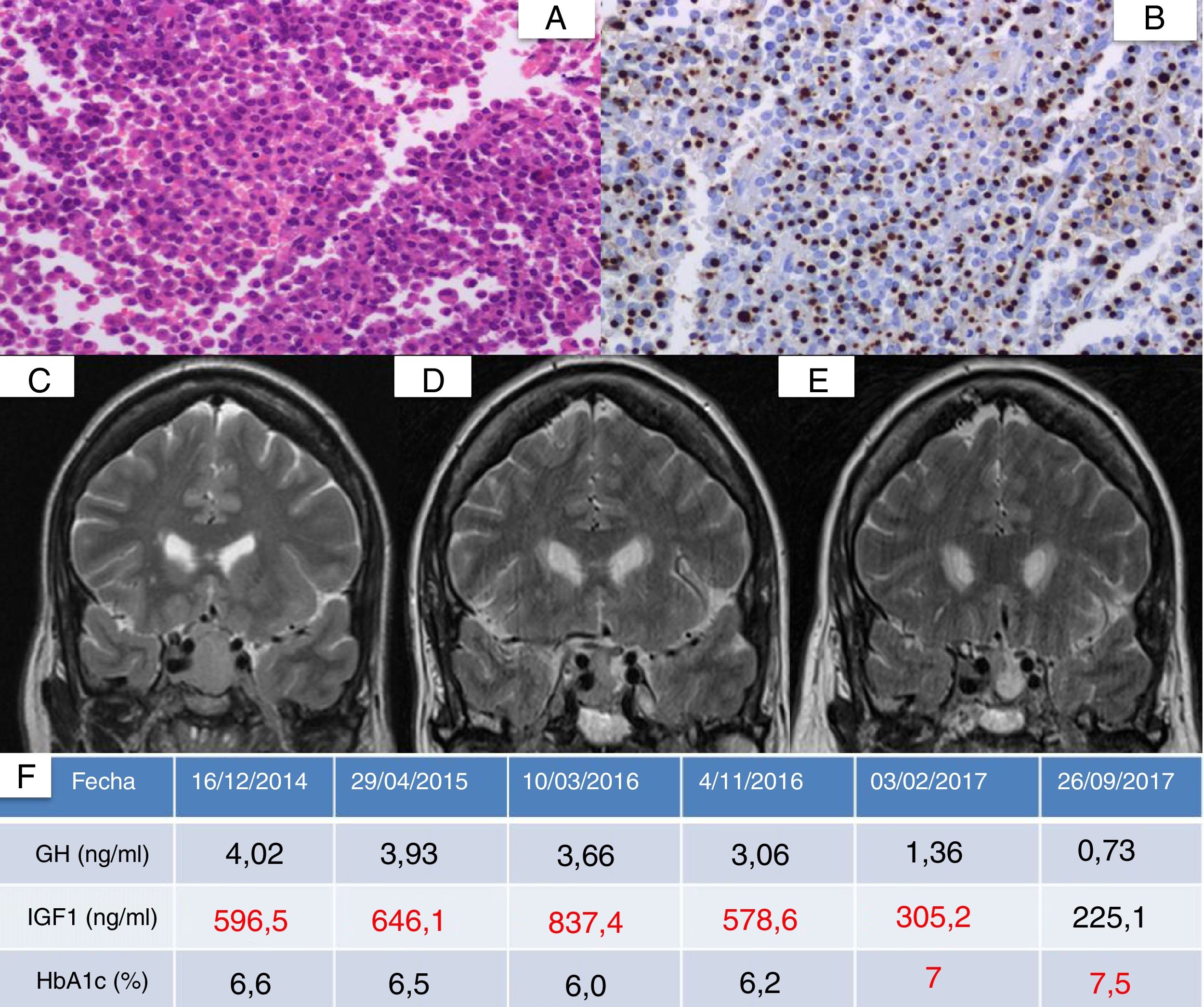
Anatomía patológica y evolución radiológica y bioquímica de un paciente con acromegalia (caso 1) tras inicio de pasireótida. A: parénquima hipofisario con alteración arquitectural y proliferación homogénea de células de mediano tamaño con núcleos redondos y citoplasmas eosinófilos poligonales (H&E, ×400). B: expresión en dot paranuclear de citoqueratina CAM5.2, compatible con patrón escasamente granulado (CAM5.2, ×400). C: resonancia de hipófisis prequirúrgica con adenoma hipofisario de 2,5cm isohipointenso en T2. D: resonancia previa al inicio de pasireótida. E: resonancia hipofisaria tras 3 meses de pasireótida. F: evolución de GH, IGF-1 y HbA1c. Valor de IGF-1 ajustado a edad y sexo: 93-253ng/ml.
Varón de 25 años con un macroadenoma hipofisario de 3,2cm, con invasión del seno cavernoso derecho, hipointenso en T2. Se realizó cirugía transesfenoidal endoscópica. La lesión correspondía a un adenoma escasamente granulado, con expresión intensa de GH. Persistió un resto en el seno cavernoso derecho de 8×11mm. Siguió tratamiento con ASS a dosis máximas y se combinó cabergolina (1,5mg/semana) y pegvisomant 35mg/día, sin alcanzarse un adecuado control bioquímico, IGF-1 en torno a 1,5-1,6 LSN. A finales de 2016 se suspendió cabergolina y ASS e inició pasireótida 40mg/mes, logrando el control bioquímico 3 meses después (IGF-1 279,7ng/ml).
Caso 3Mujer de 35 años con un macroadenoma invasivo de 2,4cm, hiperintenso en T2. Se practicó resección transesfenoidal endoscópica, persistiendo restos tumorales en el seno cavernoso izquierdo. La anatomía patológica reveló un adenoma escasamente granulado, intensamente inmunorreactivo para GH. Presentó resistencia a ASS, por lo que se cambió a pegvisomant 20mg/día, con control bioquímico óptimo los 8 años posteriores. Sin embargo, en 2016 se constató un aumento progresivo del resto tumoral en los 3 últimos años, que pasó de 16×12×11 a 20×13×13mm, por lo que se sustituyó pegvisomant por pasireótida 40mg/mes y se asoció radioterapia. A los 3 meses (45 días tras la radioterapia) se objetivó una reducción del resto tumoral superior al 50% (10×9×7mm) y la normalización de IGF-1.
Caso 4Mujer de 76 años, diagnosticada 20 años antes de macroadenoma hipofisario de 2cm, hiperintenso en T2. Recibió tratamiento quirúrgico incompleto al que se asoció ASS y radioterapia adyuvante por resistencia. Revisada la anatomía patológica, resultó ser un tumor escasamente granulado. Continuó en tratamiento con ASS como antiproliferativo con valores de IGF-1 discretamente elevados (1,3-1,4 LSN). A los 15 años se evidenció un aumento de las cifras de IGF-1 (1,6 LSN), persistiendo sin cambios significativos el resto tumoral (16×18×13mm), por lo que en 2011 fue incluida en el estudio PAOLA7 (pasireótida 40mg/mes). Desde entonces, mantiene IGF-1 normal y el tamaño tumoral se ha reducido un 35% en su diámetro máximo.
En nuestro trabajo, hemos descrito 4 pacientes acromegálicos con tumores agresivos, 3 irradiados, que no alcanzaron un control bioquímico correcto tras cirugía y ASS.
Todos ellos han sido tratados con éxito con pasireótida LAR. La indicación de tratamiento ha sido la ineficacia de pegvisomant en monoterapia o asociado a ASS, ya sea por no poder normalizar el IGF-1, por intolerancia a pegvisomant o por crecimiento tumoral. Los 4 casos normalizaron el IGF-1 y 3 redujeron el volumen tumoral. Es difícil cuantificar la influencia de la radioterapia en el caso 1, realizada 10 meses antes, y posiblemente no significativa en los otros 2 casos (20 años y 45 días antes del control radiológico). Excepto el empeoramiento del control glucémico en un caso, no se han presentado otros efectos adversos.
Esta resistencia al tratamiento de primera línea podría haber sido prevista con anterioridad. Es conocido que la invasión del seno cavernoso dificulta la extirpación tumoral completa. Por otro lado, la hiperintensidad en T2 y un patrón histológico escasamente granulado son factores que pronostican la resistencia a ASS de primera línea8. Nuestros 4 casos presentaban, al menos, 2 de estos 3 factores. Disponer de la expresión del RSS5 hubiera sido de gran valor para la elección de pasireótida en primera línea. Las guías actuales de tratamiento de la acromegalia postulan avanzar a la siguiente línea terapéutica tras constatar el fracaso de la previa. Creemos que la elección del tratamiento médico debería basarse en la predicción del éxito terapéutico. En ese sentido, ya se ha planteado la medicina personalizada y abandonar la clásica estrategia de ensayo-error9,10.
Hemos podido observar en un pequeño número de casos la eficacia de pasireótida como alternativa a la falta de respuesta a ASS de primera línea. Este fallo podría haber sido previsto si se hubiesen tenido en cuenta las características de estos tumores y se habrían evitado así costes añadidos y años de ineficacia terapéutica.